Ագրեգատային վիճակ

Ֆիզիկայում ագրեգատային վիճակը նյութի գոյության կայուն ձևերից է։ Առօրյա կյանքում հանդիպում են պինդ, հեղուկ, գազային վիճակները ու պլազման։ Հայտնի է շատ այլ ագրեգատային վիճակների գոյությունը, ինչպիսիք են ապակին կամ հեղուկ բյուրեղները։ Ագրեգատային վիճակներից շատերը գոյություն ունեն միայն էքստրեմալ պայմաններում։ Այդպիսի վիճակներից են Բոզե-Այնշտայնի կոնդենսատը, այլասերված նեյտրոնային գազը, քվարկ-գլյուոնային պլազման, որոնք առաջանում են համապատասխանաբար էքստրեմալ ցածր ջերմաստիճանների, մեծ խտության և բարձր էներգիաների դեպքում։ Որոշ ագրեգատային վիճակների գոյությունը կանխատեսված է տեսականորեն, սակայն առայժմ փորձնականորեն ապացուցված չէ։
Պատմականորեն ագրեգատային վիճակների բաժանումը կատարվել է ըստ նյութի որակական հատկությունների տարբերության։ Պինդ վիճակում նյութը պահպանում է ծավալը և ձևը, ընդ որում նյութի բաղկացուցիչ մասնիկները (ատոմներ, մոլեկուլներ կամ իոններ) դասավորված են իրար մոտ՝ ֆիքսված դիրքերում։ Հեղուկ վիճակում նյութը պահպանում է ծավալը, սակայն նյութի ձևը փոփոխվում է՝ կախված այն պարունակող անոթից։ Այս վիճակում մասնիկները կրկին իրար մոտ են դասավորված՝ ունենալով ազատ շարժման հնարավորություն։ Գազային վիճակում նյութի ինչպես ձևը, այնպես էլ ծավալը փոփոխվում են, «հարմարվելով» նյութը պարունակող անոթին։ Մասնիկները գազային վիճակում իրար մոտ չեն գտնվում և նրանց դիրքերը ֆիքսված չեն։ Պլազմայի դեպքում փոփոխելի են և՛ ծավալը, և՛ ձևը։ Պլազման, բացի չեզոք ատոմներից, բաղկացած է նաև զգալի քանակությամբ իոններից և էլեկտրոններից, որոնք ազատ շարժման մեջ են։
«Փուլ» տերմինը երբեմն կիրառվում է ագրեգատային վիճակի իմաստով, սակայն համակարգը կարող է պարունակել նույն ագրեգատային վիճակի մի քանի չմիախառնվող փուլեր։
Չորս հիմնարար վիճակները[խմբագրել | խմբագրել կոդը]
Պինդ մարմին[խմբագրել | խմբագրել կոդը]

Պինդ վիճակում նյութի բաղկացուցիչ մասնիկները (ատոմներ, մոլեկուլներ կամ իոններ) դասավորված են միմյանց մոտ։ Նրանց միջև գործող փոխազդեցության գումարային ուժերը ձգողական բնույթի են, և այնքան մեծ են, որ թույլ չեն տալիս մասնիկներին ազատ շարժվել, մասնիկները կատարում են միայն տատանողական շարժում հավասարակշռության դիրքերի շուրջը։ Դրա հետևանքով պինդ մարմինների ծավալն ու ձևը կայուն են և խիստ որոշակի։ Պինդ մարմինները կարող են փոխել իրենց ձևը միայն արտաքին ուժի ազդեցության դեպքում (ինչը տեղի է ունենում, օրինակ, երբ պինդ մարմինը կոտրվում է)։
Բյուրեղային պինդ մարմիններում մասնիկների (ատոմներ, մոլեկուլներ կամ իոններ) տեղակայման դիրքերը տարածական պարբերականություն ունեն, մասնիկների փոխադարձ դասավորությունը նման է տարածական կարգավորված ցանցի։ Գոյություն ունեն բյուրեղային կառուցվածքների բազմաթիվ տեսակներ, ընդ որում նույն նյութը տարբեր պայմաններում կարող է ունենալ տարբեր բյուրեղային կառուցվածքներ։ Օրինակ՝ երկաթի բյուրեղային կառուցվածքը 912 °C-ից ցածր ջերմաստիճաններում խորանարդակենտրոն է, իսկ 912—1394 °C ջերմաստիճանային տիրույթում՝ նիստակենտրոն։ Սառույցի համար հայտնի են տասնհինգ բյուրեղային կառուցվածքներ, որոնք առաջանում են տարբեր ջերմաստիճանների և ճնշումների դեպքում[1]։
Ապակին, կամ այլ ոչ բյուրեղային, ամորֆ պինդ մարմինները, որոնցում առկա չէ հեռակա կարգը, նկարագրվում են ստորև որպես նյութի ոչ դասական ագրեգատային վիճակներ
Պինդ մարմինները կարող են ձևափոխվել հեղուկի հալման հետևանքով, իսկ հեղուկները պինդ մարմնի՝ սառեցման։ Հնարավոր է նաև պինդ մարմնի անմիջապես անցումը գազային վիճակի, այդ պրոցեսը անվանվում է սուբլիմացիա։ Հակառակ պրոցեսը, երբ գազը անմիջապես վերածվում է պինդ մարմնի, կոչվում է դեսուբլիմացիա։
Հեղուկ[խմբագրել | խմբագրել կոդը]

Հեղուկ վիճակում նյութը գրեթե անսեղմելի է և ընդունում է իրեն պարունակող անոթի ձևը։ Հեղուկի ծավալը անփոփոխ է, եթե հաստատուն են ջերմաստիճանն ու ճնշումը։ Երբ պինդ մարմինը տաքացվում է մինչև իր հալման կետից բարձր ջերմաստիճաններ, այն վերածվում է հեղուկի (այն դեպքում, երբ ճնշումը բարձր է եռակի կետին համապատասխանող ճնշումից)։ Հեղուկի դեպքում միջմոլեկուլային (միջատոմական կամ միջիոնային) ուժերը նույնպես էական են, սակայն մոլեկուլները (ատոմները, իոնները) ունեն բավարար էներգիա միմյանց նկատմամբ շարժվելու համար, այսինքն հեղուկի կառուցվածքը «շարժուն» է։ Սա նշանակում է, որ հեղուկի ձևը փոխվում է՝ կախված այն պարունակող անոթից։ Նույն նյութի ծավալը հեղուկ վիճակում սովորաբար ավելի մեծ է, քան պինդ վիճակում, ամենահայտնի բացառությունը ջուրն է, -ն։ Ամենաբարձր ջերմաստիճանը, որում տրված հեղուկը կարող է գոյություն ունենալ, կոչվում է կրիտիկական ջերմաստիճան[2]։
Գազ[խմբագրել | խմբագրել կոդը]

Գազը սեղմելի հեղուկն է։ Գազը ոչ միայն ընդունում է իրեն պարունակող անոթի ձևը, այլ նաև ընդարձակվում է՝ ամբողջությամբ գրավելով անոթի ծավալը։
Գազերում մոլեկուլների կինետիկ էներգիաները բավականչափ մեծ են միջմոլեկուլային ուժերը անտեսելու համար (իդեալական գազի պարագայում նրանք համարվում են հավասար զրոյի), բացի դրանից հարևան մոլեկուլների միջև հեռավորությունները շատ անգամ ավելի են, քան մոլեկուլների չափերը։ Գազը որոշալի ձև կամ ծավալ չունի, գազի համար այս մեծությունները պայմանավորված են այն պարունակող անոթով։ Հեղուկը կարող է փոխակերպվել գազի հաստատուն ճնշման տակ մինչև եռման կետը տաքացնելու հետևանքով, կամ հաստատուն ջերմաստիճանի դեպքում՝ ճնշումը նվազեցնելու հետևանքով։
Կրիտիկական ջերմաստիճանից ցածր ջերմաստիճաններում գազը (կամ որ նույնն է՝ գոլորշին) կարող է հեղուկացվել միայն սեղմման հետևանքով՝ առանց սառեցնելու։ Գոլորշին կարող է հավասարակշռության մեջ լինել հեղուկի (կամ պինդ մարմնի) հետ, և այդ դեպքում նրա ճնշումը հավասար է հեղուկի (կամ պինդ մարմնի) հագեցած գոլորշու ճնշմանը։
Գերկրիտիկական հեղուկ է անվանվում այն գազը, որի ջերմաստիճանը և ճնշումը ավելի բարձր են կրիտիկական արժեքներից։ Այս դեպքում գազի և հեղուկի միջև տարբերությունը վերանում է։ Գերկրիտիկական հեղուկը ունի գազին բնորոշ հատկություններ, սակայն նրա մեծ խտության հետևանքով որոշ դեպքերում ի հայտ են գալիս լուծիչի հատկություններ, որոնք օգտակար կիրառությունների հիմք են հանդիսանում։ Օրինակ գերկրիտիկական կարբոնի երկօքսիդը օգտագործվում է կոֆեինի նկատմամբ գերկրիտիկական հեղուկ էքստրակցիա կիրառելիս՝ կոֆեինազերծված սուրճի արտադրության ժամանակ[3]։
Պլազմա[խմբագրել | խմբագրել կոդը]

Պլազման ևս չունի որոշակի ձև կամ ծավալ։ Սակայն ի տարբերություն գազերի, պլազման էլեկտրահաղորդիչ է, այն առաջացնում է մագնիսական դաշտեր և էլեկտրական հոսանքներ, «արձագանքում է» էլեկտրամագնիսական բնույթի ուժերին։ Պլազմայում դրականապես լիցքավորված միջուկները կարծես լողում են անարգել շարժվող ազատ էլեկտրոնների «ծովում»։ Ինչպես և մետաղների դեպքում, այս ազատ էլեկտրոնների «ծովը» էլեկտրականություն հաղորդելու հնարավորություն է տալիս։
Սովորաբար գազը փոխակերպվում է պլազմայի երկու ճանապարհներով․ կամ երկու կետերի միջև պոտենցիալների հսկայական տարբերություն կիրառելով, կամ հասցնելով գազը էքստրեմալ բարձր ջերմաստիճանների։ Ջերմաստիճանի բարձրացումը հնարավորություն է տալիս վալենտական էլեկտրոններին լքել ատոմները և դառնալ ազատ։ Այսպիսով առաջանում է մասնակի իոնացված պլազմա։ Սակայն ավելի բարձր ջերմաստիճանների դեպքում, ինչպիսիք առկա են աստղերում, ըստ էության բոլոր էլեկտրոնները ազատ են, և փաստորեն պլազման կազմված է ազատ էլեկտրոնների «ծովում» շարժվող միջուկներից։ Վերջինս անվանվում է լրիվ իոնացված պլազմա։
Չնայած պլազման Երկրի վրա նորմալ պայմաններում ազատ վիճակում գոյություն չունի, այն սովորաբար առաջանում է կայծակների, կայծային պարպումների ընթացքում, լյումինեսցենտային կամ նեոնային լամպերում և պլազմային հեռուստացույցներում։ Արևի պսակը, կրակի որոշ տեսակները, ինչպես նաև աստղերը պլազմային վիճակում գտնվող լուսարձակող նյութի լավ օրինակ են։
Փուլային անցումներ[խմբագրել | խմբագրել կոդը]

Նյութի վիճակը բնութագրվում է նաև փուլային անցումներով։ Փուլային անցումը ի հայտ է բերում նյութի կառուցվածքի փոփոխություն, որի հետևանքով կտրուկ փոխվում են նաև նյութի հատկությունները։ Նյութի առանձին վիճակը կարող է նկարագրվել որպես ջերմադինամիկական վիճակների մի ամբողջություն, որը փուլային անցման հետևանքով առանձնացված է մեկ այլ ամբողջությունից։ Այսպես օրինակ, կարելի է ասել, որ ջուրը ունի մի քանի պինդ վիճակ[4]։
Գերհաղորդականության առաջացումը նույնպես կապված է փուլային անցման հետ, այսպիսով առանձնացվում է նաև գերհաղորդիչ վիճակը։ Նմանապես ֆեռոմագնիսական վիճակը ևս առաջանում է փուլային անցման հետևանքով և ունի առանձնացող հատկություններ։ Երբ նյութի վիճակի փոփոխությունը տեղի է ունենում փուլ առ փուլ, միջանկյալ փուլերը կոչվում են մեզոփուլ։ Սրանց կիրառությունը կապված է հեղուկ բյուրեղային տեխնոլոգիաների ներմուծման հետ[5][6]։
Նյութի վիճակների ամբողջությունը կամ փուլը կարող է ձևափոխվել այլ փուլի կախված ճնշման և ջերմաստիճանային պայմանների փոփոխությունից։ Օրինակ՝ պինդ մարմինը ձևափոխվում է հեղուկի ջերմաստիճանի բարձրացման հետևանքով։ Բացարձակ զրոյի մոտակայքում ցանկացած նյութ գտնվելու է պինդ վիճակում։ Ջերմություն հաղորդելուն զուգընթաց պինդ նյութը կհալվի՝ վերածվելով հեղուկի, երբ ջերմաստիճանը հասնի հալման կետին, այնուհետև եռման կետում հեղուկը կգոլորշիանա, վերածվելով գազի, որից հետո, բավականաչափ էներգիա ձեռք բերելու դեպքում գազը կվերածվի պլազմայի, որտեղ բարձր էներգիաներով օժտված էլեկտրոնները առանձնացած են ատոմներից։
Մատերիայի այն ձևերը, որոնք կազմված չեն մոլեկուլներից և ղեկավարվում են տարաբնութ ուժերով կարող են նույնպես համարվել առանձին ագրեգատային վիճակներ։ Սրա օրինակներից են գերհոսելի հեղուկը (ֆերմիոնային կոնդենսատ) կամ քվարկ-գլյուոնային պլազման։
Ոչ դասական ագրեգատային վիճակներ[խմբագրել | խմբագրել կոդը]
Ապակի[խմբագրել | խմբագրել կոդը]
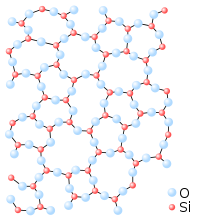 |
 | ||||
Նույն քիմիական բաղադրությամբ ապակու պատահական դասավորությամբ ցանցի (ձախ) և կարգավորված բյուրեղացանցի (աջ) սխեմատիկ պատկերներ։
| |||||
Ապակին ոչ բյուրեղային կամ ամորֆ պինդ մարմին է։ Այն պատրաստվում է տարբեր դասի նյութերից, ինչպիսիք են անօրգանական ցանցերը (օրինակ պատուհանի ապակին պատրաստված է սիլիկատից և որոշ հավելումներից), մետաղական համաձուլվածքները, իոնական մետաղները, ջրային լուծույթները, մոլեկուլային հեղուկները կամ պոլիմերները։ Ջերմադինամիկական տեսակետից ապակին իր բյուրեղային անալոգի նկատմամբ մետաստաբիլ վիճակում է, այնուամենայնիվ կոնվերսիայի գործակիցը գործնականում զրո է։
Անկարգավորվածության որոշակի աստիճանով բյուրեղներ[խմբագրել | խմբագրել կոդը]
Պլաստիկ բյուրեղը մոլեկուլային պինդ մարմին է, նրա կառուցվածքում առկա է պոզիցիոն հեռակա կարգը, սակայն մոլեկուլները պտտական ազատության աստիճան ունեն։ Օրիենտացիոն ապակում, ինչպես նաև սպինային ապակում այդ ազատության աստիճանը սառեցված է։
Հեղուկ բյուրեղներ[խմբագրել | խմբագրել կոդը]
Հեղուկ բյուրեղների հատկությունները միջանկյալ դիրք են գրավում շարժուն հեղուկների և կարգավորված պինդ մարմինների հատկությունների միջև։ Հիմնականում հեղուկ բյուրեղները կարող են հոսել հեղուկի պես, սակայն նրանք օժտված են հեռակա կարգով։ Ի տարբերություն հեղուկների, հեղուկ բյուրեղներում կան դոմեններ, որոնց ներսում մոլեկուլները շարժվում են մի որոշակի ուղղությամբ և չեն կարող ազատորեն պտտվել։ Հեղուկ բյուրեղները, այնպես ինչպես բյուրեղային պինդ մարմինները, արձագանքում են բևեռացած լույսին։
Մագնիսական կարգավորվածությամբ վիճակներ[խմբագրել | խմբագրել կոդը]
Անցումային մետաղների ատոմները հաճախ օժտված են մագնիսական մոմենտով, որը պայմանավորված է քիմիական կապ չստեղծող էլեկտրոնների սպինով։ Որոշ պինդ մարմիններում ատոմների մագնիսական մոմենտները ունեն տարբեր տիպերի կարգավորվածություն։ Ըստ այդ հատկության տարբերում են երեք տիպի նյութեր՝ ֆեռոմագնիսներ, հակաֆեռոմագնիսներ և ֆեռիմագնիսներ։
Ֆեռոմագնիսական նյութերում (օրինակ, երկաթում) դոմենի ներսի բոլոր ատոմների մագնիսական մոմենտները համուղղված են։ Եթե մագնիսական դոմենների գումարային մոմենտները նույնպես համուղղված են, ապա պինդ մարմինը մշտական մագնիս է, ընդ որում այն պահպանում է մագնիսական հատկությունները նույնիսկ էքստրեմալ մագնիսական դաշտի բացակայության դեպքում։ Մագնիսացումը անհետանում է միայն այն ժամանակ, երբ նյութը տաքացվում է մինչև Կյուրիի ջերմաստիճանը, որը մասնավորապես երկաթի համար 768 °C է։
Հակաֆեռոմագնիսական նյութերում կան երկու ատոմական համախմբեր, որոնց գումարային մագնիսական մոմենտները մեծությամբ հավասար և ճիշտ հակուղղված են, հետևաբար նրանք չեզոքացնում են միմյանց, այնպես որ մագնիսացումը զրո է։ Հակաֆեռոմագնիսի օրինակ է նիկել (II)-ի օքսիդը ()։
Ֆեռիմագնիսական նյութերում այդ ատոմական համախմբերի մագնիսական մոմենտները կրկին հակուղղված են, սակայն մեծությամբ հավասար չեն, ուստի նրանց փոխչեզոքացումը լիարժեք չէ և մագնիսացումը հավասար չէ զրոի։ Ֆեռիմագնիսի օրինակ է մագնետիտը (), որը բաղկացած է տարբեր մագնիսական մոմենտներ ունեցող և իոններից։
Քվանտային սպինային հեղուկը անկարգավորված վիճակ է փոխազդող սպիներով համակարգում, որը, ի տարբերություն մյուս անկարգավորված վիճակների, պահպանում է անկարգավորվածությունը նույնիսկ շատ ցածր ջերմաստիճանների պայմանում։ Ֆիզիկական իմաստով քվանտային սպինային հեղուկը հեղուկ չէ, այլ պինդ մարմին է, որի մագնիսական կարգավորվածությունը խախտված է։ «Հեղուկ» անվանումը կապված է կոնվենցիոնալ հեղուկում մոլեկուլային անկարգավորվածության անոլոգիայի հետ։ Քվանտային սպինային հեղուկում դոմենները փոխդասավորված են պատահականորեն, ի տարբերություն ֆեռոմագնիսների կան հակաֆեռոմագնիսների (որոնցում դոմենները դասավորված են համապատասխանաբար զուգհեռ և հակազուգահեռ)։ Պատահական փոխդասավորությունը իրականանում է, քանի որ երկրաչափաորեն ֆրուստրացված մագնիսական մոմենտները չեն կարող հավասարաչափ դասավորվել զուգահեռ կամ հակազուգահեռ։ Սառեցնելուց դոմենները պետք է «ընտրեն» կողմնորոշում, սակայն այն պատճառով, որ հնարավոր վիճակները էներգիապես համարժեք են, ընտրությունը կատարվում է պատահականորեն։ Որպես հետևություն, քվանտային սպինային հեղուկում չկա հեռակա մագնիսական կարգ, սակայն առկա է ուժեղ մոակա կարգ։
Վիճակներ, որոնցում առանձնացված են միկրոփուլերը[խմբագրել | խմբագրել կոդը]

Համապոլիմերներում կարող է տեղի ունենալ միկրոփուլերի բաժանում, որի արդյունքում գոյանում է պարբերական նանոկառուցվածքների բազմություն։ Պատկերի վրա դա ցուցադրված է ստիրոլ-բութադիեն-ստիրոլ համապոլիմերի բլոկի օրինակով։ Միկրոփուլերի առանձնացումը կարող է բացատրվել ձեթի և ջրի միջև փուլերի առանձնացման անալոգիայի օգնությամբ։ Քանի որ բլոկերի միջև քիմիական անհամապատասխանություն կա, տեղի է ունենում նմանատիպ փուլերի առանձնացում։ Սակայն բլոկերի միջև առկա կովալենտ կապի պատճառով փուլերը մակրոսկոպական մակարդակով չեն առանձնանում, ինչպես ձեթը և ջուրը, այլ դրա փոխարեն գոյանում են նանոմետրական մասշտաբի կառուցվածքներ։ Յուրաքանչյուր բլոկի հարաբերական երկրությունից և ընդհանուր պոլիմերային բլոկի տոպոլոգիայից ելնելով հնարավոր է ստանալ շատ մորֆոլոգիաներ, որոնցից յուրաքանչյուրը մի ագրեգատային վիճակում է։
Իոնական հեղուկներւմ նույնպես տեղի է ունենում միկրոփուլերի առանձնացում։ Անիոնները և կատիոնները կարող են անհամատեղելի լինել, և այդ դեպքում նրանք պետք է առանձնանան, սակայն դրան խոչընդոտում են էլեկտրական ձգողության ուժերը։ Այսպիսով, անիոնները և կատիոնները դիֆուզ շարժման մեջ են առանձնացված շերտերում, այլ ոչ թե ազատորեն, ինչպես համասեռ հեղուկում է[7]։
Ցածրջերմաստիճանային վիճակներ[խմբագրել | խմբագրել կոդը]
Գերհոսելի հեղուկ[խմբագրել | խմբագրել կոդը]

Բացարձակ զրոյին մոտ ջերմաստիճաններում որոշ հեղուկներ կատարում են երկրորդ սեռի փուլային անցում և անցնում գերհոսելի վիճակի։ Գերհոսելի հեղուկները բնութագրվում են զրոյական մածուցիկությամբ (կամ անվերջ հոսունությամբ, այսինքն հեղուկը հոսում է առանց շփման)։ Գերհոսունության երևույթը բացահայտվել է 1937 թվականին հելիումի համար, որը գտնվում է գերհոսելի վիճակում 2,17 Կ-ից ցածր ջերմաստիճաններում (λ կետ կոչվող 2,17 Կ ջերմաստիճանում տեղի է ունենում փուլացին անցումը)։ Գերհոսելի վիճակում գտնվող հեղուկը դուրս է «մագլցում» իրեն պարունակող անոթից[8]։ Գերհոսելի հեղուկը ունի անվերջ ջերմային հաղորդականություն, այնպես որ նրա մեջ չի կարող առաջանալ ջերմաստիճանային գրադիենտ։ Տեղակայելով գերհոսելի հեղուկը պտտվող տարայի մեջ կարելի է ստանալ քվանտային փոթորիկներ։
Համաձայն այս հատկությունները բացատրող տեսության, հելիում-4 իզոտոպները կազմում են Բոզե-Այնշտայնի կոնդենսատ գերհոսելի վիճակում։ Վերջերս գերհոսելի ֆերմիոնային կոնդենսատ ստացվել էր անգամ ավելի ցածր ջերմաստիճանում՝ հազվադեպ հելիում-3 և լիթիում-6 իզոտոպներով[9]։
Բոզե-Այնշտայնի կոնդենսատ[խմբագրել | խմբագրել կոդը]

1924 թվականին Ալբերտ Այնշտայնը և Շատենդրանաթ Բոզեն կանխատեսեցին այսպես կոչված Բոզե-Այնշտայնի կոնդենսատի գոյությունը։ Բոզե-Այնշտայնի կոնդենսատը հաճախ դիտարկվում է որպես նյութի հինգերորդ ագրեգատային վիճակ։ Կոնդենսատում նյութի բոլոր բաղկացուցիչ մասնիկները կազմում են մեկ քվանտային վիճակ, որը բնութագրվում է մեկ ընդհանուր ալիքային ֆունկցիայով։
Գազային վիճակում Բոզե-Այնշտայնի կոնդենսատը երկար ժամանակ փորձնականորեն չհաստատված տեսական վարկած էր։ 1995 թվականին ԱՄՆ-ում Էրիկ Կորնելի և Կարլ Վիմանի գլխավորած հետազոտական խումբին հաջողվեց առաջին անգամ փորձնականորեն ստանալ Բոզե-Այնշտայնի կոնդենսատը։ Կոնդենսատը ավելի «սառն է», քան պինդ մարմինը։ Այն առաջանում է, երբ ատոմները գտնվում են մոտ (կամ նույն) էներգիական մակարդակներում՝ բացարձակ զրոյին շատ մոտ ջերմաստիճաններում (−273.15 °C)։
Ֆերմիոնային կոնդենսատ[խմբագրել | խմբագրել կոդը]
Ֆերմիոնային կոնդենսատը նման է Բոզե-Այնշտայնի կոնդենսատին, սակայն բաղկացած է ֆերմիոններից։ Պաուլիի արգելման սկզբունքի համաձայն ֆերմիոնները չեն կարող գտնվել նույն քվանտային վիճակում, սակայն ֆերմիոնների զույգը դրսևորվում է որպես բոզոն, և այդպիսի մի քանի զույգերի մեկ քվանտային վիճակում գտնվելը հնարավոր է։
Ռիդբերգի մոլեկուլ[խմբագրել | խմբագրել կոդը]
Ռիդբերգի մատերիան խիստ ոչ իդեալական պլազմայի մետաստաբիլ վիճակներից է, այն առաջանում է գրգռված ատոմների կոնդենսացիայի ժամանակ։ Այդ ատոմները կարող են նաև բաժանվել էլեկտրոնների և իոնների որոշակի ջերմաստիճանի հասնելու դեպքում։ 2009 թվականի ապրիլին «Nature» ամսագրում հրապարակվեց տեղեկություն այն մասին, որ հնարավոր է այսպես կոչված Ռիդբերգի մոլեկուլի գոյությունը, այն ձորձնականորեն ստացվել էր Ռիդբերգի և հիմնական վիճակում գտնվող ատոմներից[10][11]։ Փորձը կատարվել էր ռուբիդիումի ուլտրասառը ատոմներով։
Քվանտային Հոլի վիճակ[խմբագրել | խմբագրել կոդը]
Քվանտային Հոլի վիճակում առաջանում է էլեկտրական հոսանքին ուղղահայաց ուղղությամբ քվանտացված լարում, պալմանավորված Հոլի էֆեկտով։ Քվանտային սպինային Հոլի վիճակը տեսականորեն կանխատեսված վիճակ է, որը հնարավորություն կտա նվազեցնելու էլեկտրոնային սարքերի էներգիական կորուստները և նրանց աշխատանքի արդյունքում անջատված ջերմությունը։
Ֆոտոնային մատերիա[խմբագրել | խմբագրել կոդը]
Ֆոտոնային մատերիայում ֆոտոնները փոխազդում են գազի հետ, զարգացնելով այնպիսի զանգված, որը թույլ է տալիս նրանց փոխազդել նաև միմյանց հետ, առաջացնելով անգամ ֆոտոնային մոլեկուլներ։ Սա հնարավոր չէ դատարկությունում շարժվող ֆոտոնների դեպքում, քանի որ նրանք չունեն դադարի զանգված և չեն կարող փոխազդել։
Դրոպլետոն[խմբագրել | խմբագրել կոդը]
Դրոպլետոնը էլեկտրոնների և խոռոչների համախումբ է, «քվանտային մրրիկ» բաղկացած էլեկտրոններից և խոռոչներից, որոնք հոսում են միմյանց շուրջ և դրսևորում են իրենց հեղուկի նման[12]։
Բարձրէներգիական վիճակներ[խմբագրել | խմբագրել կոդը]
Այլասերված նյութ[խմբագրել | խմբագրել կոդը]
Էքստրեմալ մեծ ճնշումների դեպքում, այնպես, ինչպես հանգած աստղերի միջուկներում, նյութը անցում է կատարում մի շարք էկզոտիկ, հիմնականում քվանտամեխանիկական էֆեկտներով պայմանավորված ագրեգատային վիճակների, որոնց ամբողջությունը անվանում են այլասերված նյութ։ Ֆիզիկայում «այլասերված» տերմինը վերաբերում է երկու վիճակների, որոնց էներգիաները նույնն են, և այդ իմաստով վիճակները կարող են փոխարինել միմյանց։ Համաձայն Պաուլիի արգելման սկզբունքի, այլասերված նյութում երկու ֆերմիոնային մասնիկների միևնույն էներգիական մակարդակում գտնվելը անհնար է։ Ի տարբերություն սովորական պլազմայի, այլասերված պլազման տաքացնելիս քիչ է ընդարձակվում, քանի որ անհետանում են իմպուլսային վիճակները։ Որպես սրա հետևանք՝ այլասերված աստղերը սեղմվում են, հասնելով շատ մեծ խտությունների։ Առավել մեծ զանգվածով օժտված այլասերված աստղերը ունեն փոքր չափեր, քանի որ գրավիտացիոն ուժը ավելի մեծ է, սակայն ճնշումը չի աճում նրան համեմատական։
Էլեկտրոնային այլասերված նյութը հայտնաբերվել է սպիտակ թզուկներում։ Այնտեղ էլեկտրոնները կապված են ատոմների հետ, սակայն հնարավորություն ունեն տեղափոխվելու հարևան ատոմի մեջ։ Նեյտրոնային այլասերված նյութը հայտնաբերվել է նեյտրոնային աստղերում։ Հսկայական գրավիտացիոն ճնշումը այնքան ուժեղ է սեղմում ատոմներին, որ էեկտրոնները ստիպված են վերամիավորվել պրոտոնների հետ հակադարձ β-տրոհման ճանապարհով, ինչը բերում է նեյտրոնների գերխիտ կոնգլոմերացիայի։ Սովորաբար միջուկից դուրս գտնվող ազատ նեյտրոնները տրոհվում են 15 րոպեյից քիչ պակաս կիսատրոհման պարբերությամբ, սակայն նեյտրոնային աստղերում տրոհման փոխարեն տեղի է ունենում հակադարձ տրոհում։ Սառը այլասերված նյութը առկա է նաև մոլորակներում, օրինակ՝ Յուպիտերում կամ անգամ ավելի մեծ զանգվածով օժտված շագանակագույն թզուկներում, որոնց կեղևը ենթադրաբար պարունակում է մետաղական ջրածին։ Այլասերման հետևանքով առավել մեծ զանգվածով շագանակագույն թզուկների չափսերը շատ մեծ չեն։ Մետաղներում էլեկտրոնները կարող են դիտարկվել որպես այլասերված գազ, որը շարժվում է չայլասերված դրական իոնների ցանցում։
Քվարկային նյութ[խմբագրել | խմբագրել կոդը]
Սովորական սառը նյութում քվարկերը հավաքված են ուժեղ փոխազդեցության ուժերով հադրոնների (օրինակ՝ պրոտոնների կամ նեյտրոնների) մեջ։ Կամայական հադրոն բաղկացած է 2–4 քվարկերից։ Քվարկային նյութը կամ քվանտային քրոմոդինամիկական նյութը փուլերի ամբողջություն է, որտեղ ուժեղ փոխազդեցության ուժերը հաղթահարված են և քվարկները ազատ շարժվելու հնարավորություն ունեն։ Քվարկային նյութը ի հայտ է գալիս էքստրեմալ մեծ խտությունների կամ ջերմաստիճանների դեպքում, և հայտնի չի այն լաբորատոր, ջերմային հավասարակշռության պայմաններում ստանալու որևէ միջոց։ Սովորական պայմաններում ստացված քվարկային նյութը անմիջապես ենթարկվում է ռադիոակտիվ տրոհման։
Տարօրինակ նյութը քվարկային նյութի տարատեսակ է, որը ենթադրաբար առկա է որոշ Օպենհեյմեր-Վոլկովի սահմանին մոտ նեյտրոնային աստղերում (մոտավորապես 2–3 արևի զանգվածին համարժեք), սակայն նրա գոյության ապացույցներ դեռևս չկան։ Տարօրինակ նյութում էներգիայի մի մասը համապատասխանում է տարօրինակ քվարկերին՝ d-քվարկերի ավելի ծանր անալոգներին։ Ենթադրվում է, որ տարօրինակ նյութը առաջանալուց հետո կարող է ստաբիլ լինել ցածր էներգիական վիճակներում։
Քվարկ-գլյուոնային պլազման շատ բարձր ջերմաստիճանային վիճակ է, որում քվարկները կրկին դառնում են անկախ և ազատորեն շարժվելու հնարավորություն են ստանում գլյուոնների՝ ներատոմական մասնիկների «ծովում», որոնք ցրում են քվարկների միջև գործող ուժեղ փոխազդեցության ուժերը։ Սա նման է պլազմայում էլեկտրոնների ատոմներից առանձնանալուն։ Այս վիճակը շատ հապճեպ ստացվում է արագացուցիչներում՝ էքստրեմալ բարձր էներգիաներով օժտված իոնների բախման ժամանակ, ինչը հնարավորություն է տալիս գիտնականներին ուսումնասիրել առանձին քվարկերի հատկությունները փորձնական ճանապարհով։ Քվարկ-գլյուոնային պլազման հայտնաբերվել է 2000 թվականին ՑԵՌՆ-ում։ Ի տարբերություն պլազմայի, որը դրսևորվում է գազի պես, քվարկ-գլյուոնային պլազմայի ներսում փոխազդեցությունները ուժեղ են, և այն առավել նման է հեղուկի։
Տեսականորեն ենթադրվում է, որ մեծ խտությունների և համեմատաբար ցածր ջերմաստիճանների դեպքում քվարկերը կարող են կազմել քվարկային հեղուկ, որի բնույթը դեռևս անհայտ է։ Քվարկային հեղուկը պետք է առաջացնի հստակ գունահամային արգելափակված վիճակ անգամ ավելի բարձր խտությունների դեպքում։ Գունավոր լիցքերի համար այսպիսի վիճակը գերհաղորդիչ է։ Ենթադրաբար այսպիսի վիճակներ կարող են առաջանալ նեյտրոնային աստղերում։
Գունավոր ապակու կոնդենսատ[խմբագրել | խմբագրել կոդը]
Գունավոր ապակու կոնդենսատը տեսականորեն պետք է գոյություն ունենա լույսի արագությանը մոտ արագություններով շարժվող ատոմական միջուկների ներսում։ Համաձայն Այնշտայնի հարաբերականության տեսության, բարձր էներգիաներով օժտված միջուկների չափերը պետք է փոքրանան, այսինքն միջուկները պետք է սեղմվեն շարժման ուղղությամբ։ Դրա արդյունքում միջուկի ներսում գտնվող գլյուոնները ստացիոնար դիտորդի համար կազմավորում են լույսի արագույանը մոտ արագությունով շարժվող «գլյուոնային պատ»։ Շատ բարձր էներգիաների դեպքում գլյուոնների խտությունը այդ պատի ներսում զգալիորեն աճում է։ Ի տարբերություն քվարկ-գլյուոնային պլազմայի, որը գոյանում է նման պատերի բախումների արձյունքում, գունավոր ապակու կոնդենսատը բնութագրում է հենց այդպիսի պատերը։ Այն մասնիկների ներքին հատկություն է և դիտվում է միայն շատ բարձր էներգիաների դեպքում, որոնք կարող են ստացվել RHIC-ում կամ ՑԵՌՆ-ում։
Շատ բարձր էներգիայով վիճակներ[խմբագրել | խմբագրել կոդը]
Տարատեսակ տեսություններ կանխատեսում են ագրեգատային նոր վիճակներ շատ բարձր էներգիաների դեպքում։ Համաձայն ներկայիս պատկերացումների՝ տիեզերքի բարիոնային ասիմետրիան ստեղծվել է գոյություն ունեցած մի անհայտ ագրեգատյին վիճակի հետևանքվ։ Լարերի տեսությունում Հագեդորնի ջերմաստիճանը կանխատեսված է գերլարերի համար մոտ Կ-ին, այդ ջերմաստիճանում հսկայական թվով գերլարեր են առաջանում։ Պլանկի ջերմաստիճանում Կ) գրավիտացիոն ուժը առանձին մասնիկների միջև դառնում է էական։ Որևէ գոյություն ունեցող տեսություն ի վիճակի չէ բացատրել այս վիճակները, նրանք նաև չեն կարող հաստատվել ոչ մի կանխատեսվող փորձով։ Այնուամենայնիվ այս վիճակները կարևոր նշանակություն ունեն կոսմոլոգիայում, քանի որ ենթադրվում է, որ Մեծ պայթյունի ընթացքում տիեզերքը անցել է այս վիճակներով։
Հարաբերականության ընդհանուր տեսության կողմից կանխատեսված գրավիտացիոն սինգուլյարությունը, որը առկա է սև խոռոչի կենտրոնում, չի հանդիսանում նյութի փուլ, այն ընդհանրապես նյութական օբյեկտ չէ, այլ տարածաժամանակային հատկություն է այդ դիրքում (չնայած դրա ստեղծմանը մասնակցել է նյութական զանգված-էներգիա)։ Սակայն բոլոր մասնիկների դիրքում տարածաժամանակային հատկություն լինելու փաստը վիճելի է[13]։
Այլ կանխատեսված վիճակներ[խմբագրել | խմբագրել կոդը]
Գերպինդ մարմին[խմբագրել | խմբագրել կոդը]
Գերպինդ մարմինը տարածական կարգավորվածությամբ օժտված նյութ է (պինդ մարմին է կամ բյուրեղ), որն ունի գերհոսելիության հատկություն։ Գերհոսելի հեղուկի նման, գերպինդ մարմինը առանց շփման շարժվելու հատկությամբ է օժտված, սակայն այն պահպանում է իր ձևը։ Չնայած նրան, որ գերպինդ մարմինը պինդ մարմին է, այն ցուցաբերում է բազմաթիվ հատկություններ, որոնք բնորոշ չեն պինդ մարմիններին։ Այսպիսով վիճարկվում է, որ գերպինդ մարմինը նյութի այլ վիճակ է[14]։
Լարացանցային հեղուկ[խմբագրել | խմբագրել կոդը]
Լարացանցային հեղուկում ատոմների դասավորությունը ստաբիլ չէ (այնպես, ինչպես հեղուկում), սակայն համաձայնեցված է ընդհանուր կառուցվածքը (այնպես, ինչպես պինդ մարմիններում)։ Պինդ մարմնում ատոմները դասավորվում են ցանցում այնպես, որ ցանկացած ատոմի սպինը հակառակ է ուղղված շրջապատող ատոմների սպիներին։ Իսկ լարացանցային հեղուկում ատոմների դասավորությունը պահանջում է, որ որոշ ատոմներ ունենան նույն սպինով հարևաններ։ Սա առաջացնում է հետաքրքիր հատկություններ, նաև հաստատում է տիեզերքի ֆունդամենտալ պայմաններին վերաբերող որոշ անսովոր գաղափարներ։
Գերապակի[խմբագրել | խմբագրել կոդը]
Գերապակին նյութի ագրեգատային վիճակ է, որը միևնույն ժամանակ բնութագրվում է գերհոսունությամբ և սառեցված ամորֆ կառուցվածքով։
Մութ մատերիա[խմբագրել | խմբագրել կոդը]
Չնայած մութ մատերիան ըստ հաշվարկների զբաղեցնում է ամբողջ տիեզերական նյութի զանգվածի 83 %-ը, նրա հատկությունների մեծամասնությունը մնում է չբացահայտված, քանի որ այն չի կլանում և չի արձակում էլեկտրամագնիսական ճառագայթում։ Այժմ գոյություն ունեն բազմաթիվ մրցակցող տեսություններ այն վերաբերյալ, թե ինչից է կառուցված մութ մատերիան[15][16]։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ M.A. Wahab (2005). Solid State Physics: Structure and Properties of Materials. Alpha Science. էջեր 1–3. ISBN 978-1-84265-218-3.
- ↑ F. White (2003). Fluid Mechanics. McGraw-Hill. էջ 4. ISBN 978-0-07-240217-9.
- ↑ G. Turrell (1997). Gas Dynamics: Theory and Applications. John Wiley & Sons. էջեր 3–5. ISBN 978-0-471-97573-1.
- ↑ M. Chaplin (2009 թ․ օգոստոսի 20). «Water phase Diagram». Water Structure and Science. Արխիվացված օրիգինալից 2016 թ․ մարտի 3-ին. Վերցված է 2010 թ․ փետրվարի 23-ին.
- ↑ D.L. Goodstein (1985). States of Matter. Dover Phoenix. ISBN 978-0-486-49506-4.
- ↑ A.P. Sutton (1993). Electronic Structure of Materials. Oxford Science Publications. էջեր 10–12. ISBN 978-0-19-851754-2.
- ↑ Álvarez, V.H.; Dosil, N.; Gonzalez-Cabaleiro, R.; Mattedi, S.; Martin-Pastor, M.; Iglesias, M. & Navaza, J.M.: Brønsted Ionic Liquids for Sustainable Processes: Synthesis and Physical Properties. Journal of Chemical & Engineering Data 55 (2010), Nr. 2, S. 625–632.
- ↑ J.R. Minkel (2009 թ․ փետրվարի 20). «Strange but True: Superfluid Helium Can Climb Walls». Scientific American. Արխիվացված օրիգինալից 2011 թ․ մարտի 19-ին. Վերցված է 2010 թ․ փետրվարի 23-ին.
- ↑ L. Valigra (2005 թ․ հունիսի 22). «MIT physicists create new form of matter». MIT News. Արխիվացված օրիգինալից 2013 թ․ դեկտեմբերի 11-ին. Վերցված է 2010 թ․ փետրվարի 23-ին.
- ↑ V. Bendkowsky; և այլք: (2009). «Observation of Ultralong-Range Rydberg Molecules». Nature. 458 (7241): 1005–1008. Bibcode:2009Natur.458.1005B. doi:10.1038/nature07945. PMID 19396141.
- ↑ V. Gill (2009 թ․ ապրիլի 23). «World First for Strange Molecule». BBC News. Արխիվացված օրիգինալից 2009 թ․ հուլիսի 1-ին. Վերցված է 2010 թ․ փետրվարի 23-ին.
- ↑ Luntz, Stephen (2014 թ․ հունվարի 3). «New State of Matter Discovered». IFLScience (անգլերեն). Արխիվացված օրիգինալից 2017 թ․ ապրիլի 16-ին. Վերցված է 2017 թ․ ապրիլի 16-ին.
- ↑ David Chalmers; David Manley; Ryan Wasserman (2009). Metametaphysics: New Essays on the Foundations of Ontology. Oxford University Press. էջեր 378–. ISBN 978-0-19-954604-6. Արխիվացված օրիգինալից 2014 թ․ սեպտեմբերի 17-ին.
- ↑ G. Murthy; և այլք: (1997). «Superfluids and Supersolids on Frustrated Two-Dimensional Lattices». Physical Review B. 55 (5): 3104. arXiv:cond-mat/9607217. Bibcode:1997PhRvB..55.3104M. doi:10.1103/PhysRevB.55.3104.
- ↑ Trimble, Virginia (1987). «Existence and nature of dark matter in the universe». Annual Review of Astronomy and Astrophysics. 25: 425–472. Bibcode:1987ARA&A..25..425T. doi:10.1146/annurev.aa.25.090187.002233.
- ↑ Hinshaw, Gary F. (2010 թ․ հունվարի 29). «What is the universe made of?». Universe 101. NASA website. Արխիվացված է օրիգինալից 2016 թ․ հուլիսի 26-ին. Վերցված է 2010 թ․ մարտի 17-ին.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- 2005-06-22, MIT News: MIT physicists create new form of matter․ Մեջբերում․ «They have become the first to create a new type of matter, a gas of atoms that shows high-temperature superfluidity.»
- 2003-10-10, Science Daily: Metallic Phase For Bosons Implies New State Of Matter
- 2004-01-15, ScienceDaily: Probable Discovery Of A New, Supersolid, Phase Of Matter․ Մեջբերում․ «...We apparently have observed, for the first time, a solid material with the characteristics of a superfluid...but because all its particles are in the identical quantum state, it remains a solid even though its component particles are continually flowing...»
- 2004-01-29, ScienceDaily: NIST/University Of Colorado Scientists Create New Form Of Matter: A Fermionic Condensate
- Short videos demonstrating of States of Matter, solids, liquids and gases by Prof. J M Murrell, University of Sussex
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ագրեգատային վիճակ» հոդվածին։ |
| ||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 58)։ |










