Թթուներ

Թթուներ, քիմիական միացություններ, էլեկտրոլիտներ, որոնք դիսոցվելիս առաջացնում են ջրածնի կատիոն (H+, Բրյոնսթեդի թթուներ) և թթվային մնացորդի անիոններ կամ միացություններ, որ կարող են ընդունել էլեկտրոնային զույգ կովալենտ կապի ձևավորմամբ (Լյուիսի թթուներ)[1]։ Մասնավորապես՝ թթուների բաղադրությունն արտահայտվում է հետևյալ ընդհանուր բանաձևերով. HnR որտեղ R-ը մնացորդ է, n-ը՝ ջրածնի ատոմների թիվը։ Թթվի բաղադրությունում առկա և մետաղի ատոմով (ատոմներով) տեղակալվելու ընդունակ ջրածնի ատոմների թիվը, որը բնորոշում է թթվի հիմնայնությունը, կարող է չհամընկնել թթվի բաղադրությունում առկա ջրածնի ատոմների ընդհանուր թվին։ Այսպես՝ ֆոսֆորային թթուն (H3PO3) ոչ թե եռահիմն է (ինչպես կարելի էր եզրակացնել այդ թթվի քիմիական բանաձևից), այլ՝ երկհիմն։ Պատճառն այն է, որ տվյալ թթվի բաղադրությունում առկա ջրածնի 3 ատոմից միայն երկուսը կարող է մետաղի ատոմներով տեղակալվել։ Ահա թե ինչու ֆոսֆորային թթվի առավել ճշգրիտ քիմիական բանաձևն է H2(HPO3)։
Կենցաղում ու տեխնիկայի ոլորտում թթու սովորաբար կոչվում են Բրյոնսթեդի թթուները, որոնք ջրային լուծույթներում առաջացնում են հիդրօքսոնիումի իոնի ավելցուկ՝ H3O+։ Այդ իոնների առկայությունը պայմանավորում է թթուների լուծույթները թթվային համը, հայտանյութերի գույնը փոխելու ունակությունը, իսկ բարձր խտության դեպքում՝ թթուների գրգռիչ հատկությունը։ Թթվի Ջրածնի ատոմներն ունակ են տեղակալվել մետաղների ատոմներով՝ առաջացնելով աղեր, որոնք պարունակում են մետաղների կատիոններ ու թթվային մնացորդի անիոններ։
Թթուների սահմանում[խմբագրել | խմբագրել կոդը]
Թթուների մասին պատկերացումների զարգացման պատմություն[խմբագրել | խմբագրել կոդը]

Թթուները՝ որպես քիմիական միացությունների դաս, որ օժտված են մի շարք մոտ հատկություններով, հայտնի են հին ժամանակներից։
1778 թվականին ֆրանսիացի քիմիկոս Անտուան Լավուազիեն ենթադրել է, որ թթվային հատկությունները պայմանավորված են նրանց կազմում թթվածնի առկայությամբ։ Այդ վարկածը եղել է անհիմն, քանի որ շատ թթուներ իրենց կազմում չունեն թթվածին, իսկ թթվածին պարունակող բազմաթիվ միացություններ չեն ցուցաբերում թթվային հատկություններ։ Այնուամենայնիվ, հենց այդ վարկածն է հիմք հանդիսացել անվանում տալու թթվածնին՝ որպես քիմիական տարրի[2]։ 1833 թվականին գերմանացի քիմիկոս Յուստուս Լիբիխը սահմանել է թթուն՝ որպես ջրածին պարունակող միացություն, որում ջրածինը կարող է տեղակալվել մետաղով[2]։
Թթուների ու հիմքերի ընդհանուր տեսության ստեղծման առաջին փորձը նախաձեռնել է շվեդ ֆիզիկաքիմիկոս Սվանտե Արենիուսը։ 1887 թվականին ձևակերպված նրա տեսության մեջ թթուն սահմանվում է որպես միացություն, որը դիսոցվում է ջրային լուծույթում՝ առաջացնելով H+ ջրածնի իոններ[2]։ Շուտով պարզվել է Արենիուսի տեսության սահմանափակ լինելը։ Նախ բացահայտվել է, որ անհնար է պատկերացնել չսոլվատացված Н+ կատիոնի գոյությունը լուծույթում, երկրորդ՝ Արենիուսի տեսությունը հաշվի չի առնում լուծիչի ազդեցությունը թթվահիմնային հավասարակշռության վրա, ի վերջո պարզվել է, որ տեսությունը կիրառելի չէ ոչ ջրային համակարգերի վերաբերյալ[3]։
Համաձայն Ֆրանկլինի սոլվենտային տեսության, որ ստեղծվել է 1924 թվականին, թթու կոչվել է այն նյութը, որը լուծվելիս ավելացրել է այն կատիոնների թիվը, որոնց ձևավորվում են լուծիչի դիսոցման ժամանակ։ Տվյալ տեսությունը կարևոր դեր է կատարել թթուների ոչ ջրային լուծույթների ուսումնասիրման համար։ Թթուների ու հիմքերի քիմիական տեսությունը ձևավորվել է Ա. Հանչի (1917-1927) աշխատանքներում։ Ըստ Հանչի՝ թթուներ կոչվում են ջրածնի այն միացությունները, որոնցում ջրածինը կարող է տեղակալվել մետաղով կամ ոչ մետաղական ռադիկալով՝ առաջացնելով աղ[2]։
1923 թվականին ստեղծվել են Բրյոնսթեդ-Լոուրիի ու Լյուիսի տեսությունները, որոնք լայնորեն կիրառվում են ներկայում[4]։
Թթուն Բրյոնսթեդ-Լոուրիի տեսությունում[խմբագրել | խմբագրել կոդը]

Թթուների ու հիմքերի պրոտոնային տեսությունում, որն միմյանցից անկախ ու գրեթե միաժամանակ առաջ են քաշել 1923 թվականին դանիացի գիտնական Յոհաննես Նիկոլաուս Բրյոնսթեդն ու անգլիացի գիտնական Թոմաս Մարտին Լոուրին (Լաուրի), թթու է կոչվում այն միացությունը կամ մոլեկուլային իոնը, որն ունակ է տալ պրոտոն քիմիական այլ միացության՝ հիմքի[5]։ Ըստ Բրյոնսթեդ-Լոուրիի տեսության՝ թթուների ու հիմքերի քիմիական փոխազդեցությանը միշտ մասնակցում են պրոտոնի դոնոր թթվածինը (Բրյոնսթեդի թթու) և նրա հետ զուգորդված հիմքը՝ ցանկացած միացություն, որն ունակ է իրեն միացնել պրոտոնը (Բրյոնսթեդի հիմք)։ Քանի որ հիմքը կարող է դիտարկվել որպես թթվից պրոտոն պոկելու արդյունք, թթվի էլեկտրական լիցքը միշտ մեկ միավոր պակաս է փոխադարձաբար նրա հետ զուգորդված հիմքի լիցքից։ Օրինակ՝ HCl թթվին համապատասխանում է նրա հետ զուգորդված հիմքը՝ Cl− քլորիդ-իոնը[2][6]։
Թթուն Լյուիսի տեսությունում[խմբագրել | խմբագրել կոդը]

Ըստ էլեկտրոնային տեսության, որն առաջարկվել է 1923 թվականին ամերիկացի ֆիզիկաքիմիկոս Գիլբերտ Նյուտոն Լյուիսի կողմից, թթուն նյութ է, որն ընդունում է էլեկտրոնային զույգ և ձևավորում կապ Լյուիսի հիմքի հետ այդ էլեկտրոնների զույգի հաշվին[7]։ Լյուիսի տեսությունում թթուներ կարող են լինել չլրացված ութէլեկտրոն մոլեկուլները թաղանթով (BF3, SO3), կոմպլեքս ձևավորող մետաղների մոլեկուլներ (Fe2+, Zn2+), անցումային տարրերի հալոգենիդներ (TiCl4), բևեռային երկակի կապերով մոլեկուլներ (SO2), կարբոկատիոններ։ Ի տարբերություն Բրյոնսթեդ-Լոուրիի տեսության՝ Լյուիսի տեսությունն ավելի ընդհանուր է և ընդգրկում է թթուների ավելի լայն շրջանակ[3][4]։
Վճռորոշ հատկությունը, որով պայմանավորված է Լյուիսի թթվի՝ Լյուիսի հիմքի հետ փոխազդելու ունակությունը, էներգետիկ համապատասխանությունն է էլեկտրոնային զույգն ընդունող ստորին ազատ մոլեկուլային օրբիտալի և վերին զբաղված մոլեկուլային օրբիտալի միջև, որի հետ գնում է այդ էլեկտրոնային զույգը։ Այդ ունակությունը հաշվի է առնվել Պիրսոնի կոշտ և փափուկ թթուների ու հիմքերի սկզբունքի (ԿՓԹՀ սկզբունք) շրջանակներում։ Տվյալ սկզբունքը սահմանում է, որ փափուկ թթուներն ավելի հակված են փոխազդելու փափուկ հիմքերի հետ, կոշտ թթուները՝ կոշտ հիմքերի։ Ընդ որում՝ կոշտ թթուներ ասելով նկատի են առնվում Լյուիսի թթուները, որոնք ունեն մեծ դրական լիցք, մեծ էլեկտրաբացասականություն և ցածր բևեռացվելիություն։ Փափուկ թթուները, ընդհակառակը, ունեն փոքր դրական լիցք, ցածր էլեկտրաբացասականություն և բարձր բևեռացվելիություն։ Քանի որ այդ հատկությունները փոխվում են սահուն կերպով, Լյուիսի թթուների շարքը միջանկյալ տեղ է զբաղեցնում կոշտ և փափուկ թթուների միջև[4]։ ԿՓԹՀ սկզբունքը չունի թթուների ուժեղության գնահատման քանակական չափանիշ, այդ պատճառով էլ այն չի կարող կիրառվել վերլուծական հաշվարկների համար[3]։
| Կոշտ թթուներ | Միջակա թթուներ | Փափուկ թթուներ |
|---|---|---|
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, |
| Կոշտ հիմքեր | Միջակա հիմքեր | Փափուկ հիմքեր |
| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, ալկեններ, C6H6, R3P, (RO)3P |
Թթուն Ուսանովիչի ընդհանուր տեսությունում[խմբագրել | խմբագրել կոդը]
1939 թվականին Միխայիլ Ուսանովիչը ձևակերպել է թթուների ու հիմքերի ընդհանուր տեսություն, որի համաձայն՝ թթու է այն մասնիկը, որը կարող է տալ կատիոններ, այդ թվում նաև պրոտոն, կամ միացնել անիոններ, այդ թվում նաև էլեկտրոն։ Այդպիսով՝ թթու հասկացությունը, ըստ Ուսանովիչի, ներառում է ինչպես Բրյոնսթեդի, այնպես էլ Լյուիսի թթուները, ինչպես նաև թթվեցուցիչները (օքսիդացնող)[3]։ Դրանից բացի, թթվայնության, ինչպես նաև հիմնայնության հասկացություններն Ուսանովիչի տեսությունում դիտարկվում են ոչ թե որպես նյութի ֆունկցիա, այլ դեր, որն այն կատարում է՝ կախված ռեակցիայի մյուս մասնակցից[9]։
Դասակարգում[խմբագրել | խմբագրել կոդը]

Լյուիսի և Բրյոնսթեդի թթուների բաժանվելուց բացի ընդունված է դրանք դասակարգել ըստ տարբեր հատկանիշների՝
- Ըստ ջրածնի թթվային ատոմների թվի[10].
- Ըստ ուժեղության՝
- ուժեղ – դիսոցվում են գրեթե ամբողջությամբ, դիսոցման հաստատուն՝ ավելի քան 1×10−3 (HNO3),
- թույլ – դիսոցման հաստատունը փոքր է 1×10−3 (քացախաթթու Kդ= 1,7×10−5)։
- Ըստ կայունության՝
- Ըստ քիմիական միացությունների դասերին պատկանելության՝
- Ըստ ցնդելիության՝
- Ըստ ջրում լուծելիության՝
- Ըստ մետաղի ատոմներ պարունակելու՝
Թթուների անվանումներ[խմբագրել | խմբագրել կոդը]
Ոչ օրգանական թթուներ[խմբագրել | խմբագրել կոդը]
Թթվածին պարունակող թթուների անվանումները բաղկացած են երկու մասից՝ բուն թթվի անունը (արտահայտված ածականով) և թթու բաղադրիչը (ծծմբական թթու, ֆոսֆորական թթու)։ Բուն թթվի անվանումը կազմվում է թթվակազմիչ տարրի հայերեն անվանմանը տարբեր ածանցների ավելացնելով.
- -ային (եթե տարրը գտնվում է օքսիդացման միակ կամ ամենաբարձր աստիճանում),
- օքսիդացման +5 միջանկյալ աստիճանը նշանակվում է -ական ածանցով (քլորական թթու՝ HClO3, բրոմական թթու՝ HBrO3, յոդական թթու՝ HIO3),
Եթե թթվակազմիչ տարրը երկու թթուներում էլ գտնվում է օքսիդացման նույն աստիճանում, բայց թթուները տարբերվում են «ջրի պարունակությամբ», ապա քիչ թթվածին պարունակող թթվի անվանն ավելացվում է մետա- նախածանցը, իսկ ավելի շատ թթվածին պարունակող թթվի անվանմանը՝ օրթո- նախածանցը, օրինակ՝ մետաֆոսֆորական թթու (HPO3) և օրթոֆոսֆորական թթու. (H3PO4)։
Մի քանի թթվակազմի տարրեր պարունակող թթվածնավոր թթուները կոչվում են իզոպոլիթթուներ։ Դրանք սովորաբար կոչվում են ավանդական անուններով (երկֆոսֆորական թթու H4P2O7, երկծծմբական թթու H2S2O7)։
Այն թթուները, որոնցում թթվածնի ատոմները տեղակալվել են ծծմբի ատոմներով, կոչվում են թիոթթուներ և ունեն համապատասխան թիո- նախածանցը (թիոֆոսֆորական թթու՝ H3PO3S)։ Եթե թթվի հիդրօքսիլ խմբերը կամ թթվածնի ատոմները տեղակալվել են հալոգենների ատոմներով կամ ամինախմբերով, ապա թթվի անվանն ավելացվում է նաև համապատասխան ածանցը (ամիդոֆոսֆորական թթու՝ H2PO3NH2),իսկ տեղակալված ծծմբական թթուներն ավանդաբար կոչվում են սուլֆոնական (քլորսուլֆոնական թթու՝ ClSO3H)։
Այն թթուները, որ ունեն -O-O- պերօքսիդային կամրջակ, վերաբերում են պերօքսիդային թթուներ և ունեն պերօքսիդ- մասնիկը (պերօքսիդմիածծմբական թթու՝ H2SO5) կամ գեր- նախածանցը (գերծծմբական թթու)[11]։
Օրգանական թթուներ[խմբագրել | խմբագրել կոդը]
Ավանդաբար պարզագույն կարբոնաթթուների համար առավել տարածված են առօրյա գործածական անունները, որոնց մի մասը ստեղծվել են դեռևս 18-րդ դարում (քացախաթթու, կարագաթթու, ադիպինաթթու, ֆթալաթթու)։ Ածխածնի ատոմների զույգ թվաքանակով բարձրագույն կարբոնաթթուները նույնպես ունեն առօրյա անվանումներ, սակայն այնքան նման են, որ դրանց օգտագործումը կարող է շփոթմունքի տեղիք տալ (կապրիլաթթու, կապրինաթթու)։
Կարբոնաթթուների սիստեմատիկ անվանումները կազմվում են թթվին համապատասխանող ալկանի անվանը-ական թթու վերջավորության ավելացնելով։ Երբեմն ավելի հեշտ է անվանումը կազմել -կարբոնաթթու մասնիկի ավելացմամբ, որը նշանակում է, որ միացության մեջ ջրածնի մեկ ատոմը տեղակալվել է կարբօքսիլային խմբով։ Այդպիսի մոտեցում կիրառվում է այն դեպքում, երբ կարբօքսիլային խումբը միացված է ցիկլային համակարգին (ցիկլոպրոպանկարբոնաթթու)։
Եթե կարբոնաթթուն պարունակում է պերօքսիդային կամրջակ, ապա այդպիսի թթուների անվանմանն ավելացվում են պերօքսի-, պեր- կամ գեր- մասնիկները (գերքացախաթթու, պերօքսիբենզոյաթթու)։
Ծծումբ պարունակող օրգանական թթուների նշանակման համար օգտագործվում են -սուլֆոնաթթու (RSO3H), -սուլֆինաթթու (RSO2H), -սուլֆենաթթու (RSOH) վերջավորությունները, որոնք նույնպես ավելացվում են RH ալկանի անվանը[12]։
| Բանաձև | Անվանումն ըստ IUPAC-ի | Առօրյա անվանում | Առօրյա անվան ծագում |
|---|---|---|---|
| НСООН | մեթանաթթու | մրջնաթթու | լատին․՝ formica — մրջյունի |
| СН3-СООН | էթանաթթու | քացախաթթու | լատին․՝ acetum — քացախ |
| СН3-СН2-СООН | պրոպանաթթու | պրոպիոնաթթու | հին հունարեն՝ proto + pion — առաջին + ճարպ |
| СН3-(СН2)2-СООН | բութանաթթու | կարագաթթու | լատին․՝ butyrum — յուղ |
| СН3-(СН2)3-СООН | պենտանաթթու | վալերիանաթթու | լատին․՝ Valeriána — վալերիան |
| СН3-(СН2)4-СООН | հեքսանաթթու | կապրոնաթթու | լատին․՝ caper — այծ |
| СН3-(СН2)5-СООН | հեպտանաթթու | էնանտաթթու | հին հունարեն՝ oenanthe — խաղողի ծաղիկ |
| СН3-(СН2)6-СООН | օկտանաթթու | կապրիլաթթու | լատին․՝ caper — այծ |
| СН3-(СН2)7-СООН | նոնանաթթու | պելարգոնաթթու | լատին․՝ Pelargonium — պելարգոն |
| СН3-(СН2)8-СООН | դեկանաթթու | կապրինաթթու | լատին․՝ caper — այծ |
| СН3-(СН2)9-СООН | ունդեկանաթթու | ունդեցիլանաթթու | |
| СН3-(СН2)10-СООН | դոդեկանաթթու | լաուրինաթթու | լատին․՝ Laurus — դափնի |
| СН3-(СН2)11-СООН | տրիդեկանաթթու | տրիդեցիլաթթու | |
| СН3-(СН2)12-СООН | տետրադեկանաթթու | միրիստինաթթու | լատին․՝ Myristica — մշկընկույզ, հին հունարեն՝ mύρων — ձիթապտղի յուղ |
| СН3-(СН2)13-СООН | պենտադեկանաթթու | պենտադեցիլաթթու | |
| СН3-(СН2)14-СООН | հեքսադեկանաթթու | պալմիտինաթթու | լատին․՝ palma — արմավենի |
| СН3-(СН2)15-СООН | հեպտադեկանաթթու | մարգարինաթթու | հին հունարեն՝ margaron — մարգարիտ |
| СН3-(СН2)16-СООН | օկտադեկանաթթու | ստեարինաթթու | հին հունարեն՝ stear — ճարպ |
| СН3-(СН2)17-СООН | նոնադեկանաթթու | նոնադեցիլաթթու | |
| С6Н5-СООН | բենզոլկարբոնաթթու | բենզոյաթթու | |
| СН2=СН-СООН | պրոպենաթթու | ակրիլաթթու | լատին․՝ acer + olere — սուր հոտ |
| СН≡С-СООН | պրոպինաթթու | ||
| СН3-С(СН3)2-СООН | 2,2-պիմեթիլպրոպանային | պիվալինաթթու | հապավում պինակոլին + վալերիանաթթու բառերից[Ն 1] |
Թթուների դիսոցում և ուժեղություն[խմբագրել | խմբագրել կոդը]
Թթուների ուժեղության քանակական բնութագիր[խմբագրել | խմբագրել կոդը]
Բրյոնսթեդ-Լոուրիի թթվահիմնային տեսությունը, որը թթուները դիտարկում է որպես պրոտոն տալու ունակ մասնիկ, հնարավորություն է տալիս քանակապես բնութագրել թթուների այդ հատկությունը՝ նրանց ուժեղությունը։ Թթվի ուժեղությունը բնութագրվում է ջրային լուծույթում թթվի դիսոցման ռեակցիայի հավասարակշռության հաստատունի օգնությամբ, որը կոչվում է նաև թթուների դիսոցման հաստատուն՝ Ka։ Որքան մեծ է Ka-ի արժեքը, այնքան մեծ է թթվի՝ պրոտոն տալու հատկությունը և այնքան ուժեղ է այն։ Թթվայնության հաստատունն արտահայտվում է նաև ավելի հարմար մեծությամբ՝ pKa, որը Ka-ի արժեքի բացասական լոգարիթմն է։ Օրինակ՝ պլավիկյան թթվի դիսոցման ու թթվայնության հաստատունի հավասարումը կարելի է գրել հետևյալ կերպ[15][16].
Բազմահիմն թթուների համար օգտագործում են դիսոցման հաստատունի մի քանի արժեքներ՝ Ka1, Ka2 և այլն, որոնք համապատասխանում են դիսոցման յուրաքանչյուր աստիճանին։ Օրինակ՝ ֆոսֆորական թթուն դիսոցվում է երեք աստիճանով[16].
| Թթու | Արժեք (m — n) | Ka |
|---|---|---|
| HClO | 0 | 10−8 |
| H3AsO3 | 0 | 10−10 |
| Н2SО3 | 1 | 10−2 |
| Н3РО4 | 1 | 10−2 |
| HNO3 | 2 | 101 |
| H2SO4 | 2 | 103 |
| HClO4 | 3 | 1010 |
Ընդունված է թթուները, ըստ ուժեղության, պայմանականորեն բաժանել հետևյալ խմբերի՝ շատ ուժեղ (pKa < 0), ուժեղ (0 < pKa < 4,5), միջին ուժեղության (4,5 < pKa < 9), թույլ (9 < pKa < 14), շատ թույլ (pKa > 14)[2]։
Թթուների ուժեղության մոտավոր գնահատման համար կիրառվում են Լայնուս Կարլ Փոլինգի էմպիրիկ կանոնները։ Այսպես, HnXOm տեսքով թթվածին պարունակող ոչ օրգանական թթուների համար հայտնի է էմպիրիկ կանոնը, ըստ որի՝ առաջին հաստատունի արժեքը կապված է (m — n) արժեքի հետ։ Եթե A=(m — n) = 0, ապա թթուն շատ թույլ է, եթե 1՝ թույլ, եթե 2՝ ուժեղ, իսկ եթե 3՝ շատ ուժեղ[17]։ Դրանից բացի, եթե այդպիսի թթուն գրել (HO)aXOb տեսքով, առաձնացնելով հիդրօքսիլային խմբերի մեջ մտնող թթվածնի ատոմները (նկատենք, որ b=m-n), ապա դիսոցման հաստատունի մեծությունն առաջին աստիճանում կարելի է գնահատել ըստ հետևյալ հավասարման.
այսինքն՝ առաջին դիսոցման հաստատունի արժեքը որոշվում է հիմնականում թթվածնի ոչ հիդրօքսիլային ատոմների b թվով։ Այդ կախվածությունը թթվածնի այդ ատոմների բացասական ինդուկտիվ էֆեկտի հետ կապում է O-H կապը, որի հաշվին հեշտանում է թթվածնի մոլեկուլից պրոտոնի պոկումը[18]։ Լ. Փոլինգին է վերագրվում նաև բազմահիմն թթուների թթվայնության հետ կապված էմպիրիկ կանոնը, ըստ որի՝ բազմահիմն թթուների դիսոցման pKa1, pKa2, pKa3 հաջորդական հաստատունները ունեն 1 ։ 10−5 : 10−10 հարաբերությունը։ Թթվայնության հաստատունի փոքրացումը կապված է ձևավորվող անիոնի լիցքի մեծացման հետ[18]։ Փոլինգի կանոնների համաձայն հաշվված pKa արժեքները տարբերվում են փորձարարականներից ընդամենը ±1[19]։ Թթուների ուժեղության մյուս բնութագրական հատկանիշը կարող է լինել α դիսոցման աստիճանը՝ իոնի դիսոցված թթվածնի մոլեկուլների թվի հարաբերությունը լուծույթում նրանց նախնական թվին։ Դիսոցման աստիճանն արտահայտվում է տոկոսներով կամ 0-1 անչափելի մեծության տեսքով[20].
| Թթվի բանաձև | pKa | Թթվի բանաձև | pKa |
|---|---|---|---|
| HClO4 | -5 ± 0,5 | H2PO4- | 7,20 |
| H2SO4 | -2,8 ± 0,5 | HClO | 7,25 |
| H3O+ | -1,74 | H3BO3 | 9,24 |
| HNO3 | -1,32 | NH4+ | 9,25 |
| (COOH)2 | 1,26 | HCN | 9,22 |
| H2SO3 | 1,92 | HCO3- | 10,33 |
| HSO4- | 1,96 | H2O2 | 11,62 |
| H3PO4 | 2,12 | HPO42- | 12,32 |
| HF | 3,14 | H2O | 15,74 |
| HNO2 | 3,35 | NH3 (ж.) | 33 |
| CH3COOH | 4,76 | H2 | 38,6 |
| H2S | 7,05 | СH4 | ~58 |
Լուծիչի ազդեցություն[խմբագրել | խմբագրել կոդը]
Թթուների հավասարեցում և տարբերակում[խմբագրել | խմբագրել կոդը]
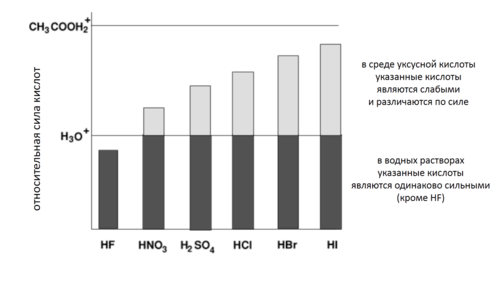
Թթվահիմնային հավասարակշռության վրա նշանակալի ազդեցություն է ունենում լուծիչը։ Մասնավորապես ջրային լուծիչների համար հայտնաբերվել է, որ թթվայնության pKa < 0 հաստատուն ունեցող բոլոր թթուներն ունեն նմանատիպ հատկություններ (օրինակ՝ լուծույթների pH)։ Դա բացատրվում է նրանով, որ այդպիսի թթուների համար հավասարակշռությունը գրեթե ամբողջովին տեղաշարժված է H3O+ հիդրոքսոնիումի իոնի ստեղծման ուղղությամբ, որը միակ թթուն է լուծույթում։ Ըստ էության, հիդրոքսոնիումի իոնը ամենաուժեղ թթուն է ջրային լուծույթներում, քանի որ ավելի ուժեղ բոլոր թթուներն ամբողջուվին վերածվում են այդ թթվի և դրանով իսկ հավասարվում իրենց ուժեղությամբ։ Օրինակ՝ pKa < 0 (HCl, HBr, H2SO4) բոլոր թթուներն ամբողջովին դիսոցվում են ջրային լուծույթներում։
Նմանատիպ իրավիճակ է նաև մյուս լուծիչների դեպքում. եթե «թթու-լուծիչ» համակարգում պրոտոնային թթվի pKa գերազանցում է պրոտոնացված լուծիչի (նրա զուգորդված թթվի) թթվայնությանը, ապա տեղի է ունենում պրոտոնների լիակատար տեղափոխում թթվից լուծիչին և լուծույթի միակ ու ամենաուժեղ թթուն դառնում են պրոտոնացված լուծիչի կատիոնները, ընդ որում՝ այդ դեպքում լուծույթի թթվայնությունը որոշվում է լուծիչին զուգորդված թթվի թթվայնությամբ։ Այդ երևույթը կոչվել է լուծիչի հավասարեցնող ազդեցություն[21]։ Նման կերպ pKa > 14 ունեցող շատ թույլ թթուները նույնպես ջրային լուծույթներում հավասարվում են ուժով[22][23]։
Պրոտոնացված CH3CO2+H2 քացախաթթվի թթվայնությունն նշանակալիորեն ավելի բարձր է, քան H3O+ պրոտոնացված ջրի թթվայնությունը, այդ պատճառով էլ քացախաթթվային լուծույթներում հավասարեցնող ազդեցությունը նկատվում է թթուների զգալիորեն ավելի ցածր pKa դեպքում։
Թթուները, որոնց pKa 0-ից 14 է, ջրում դիսոցվում են ոչ ամբողջությամբ. դրանց թթվային հատկությունները լուծույթում կախված են pKa-ի արժեքից։ Օրինակ՝ մոնոքլորքացախաթթուն և դիքլորքացախաթթու, որոնց pKa հավասար է 2,86 և 1,26 համապատասխանաբար, խիստ տարբերվում են դիսոցման աստիճանով (0,1 М լուծույթում առաջինը դիսոցվում է 11 %, երկրորդը՝ 52 %)[24]։ Դա կոչվում է լուծիչի տարբերակող ազդեցություն։ pKa-ի միջակայքը, որում թթուները տարբերակվում են ըստ ուժեղության, հավասար է լուծիչի ինքնապրոտոլիզի հաստատունի ցուցանիշին։ Տարբեր լուծիչների համար այդ միջակայքը տարբեր է (14 ջրի համար, 19՝ էթանոլի, 33՝ ամոնիակի և այլն), դրան համապատասխանաբար տարբեր են նաև դրանց տարբերակվող և հավասարեցվող թթուների հավաքածուները[25]։
Եթե լուծիչն ունի հիմնային հատկություններ, ապա դրանում բոլոր թթուները դառնում են ավելի ուժեղ և ավելի մեծ թվով թթուներ են հավասարվում ըստ ուժի (օրինակ՝ ամոնիակում քացախաթթուն դիսոցվում է ամբողջությամբ, իսկ ջրային լուծույթներում այն ունի միջին ուժեղություն)։ Եվ հակառակը, եթե լուծիչի հիմնային հատկությունները թուլանում են, ապա ուժեղ թթուները կարող են դառնալ թույլ, իսկ հավասարեցվող թթուների քանակը՝ պակասել[25]։ Օրինակ՝ քացախաթթուն ծառայում է որպես հավասարեցվող լուծիչ HClO4 թթվի, որը նրանում դիսոցվում է ամբողջությամբ, աղաթթվի (HCl) ու ծծմբական թթվի (H2SO4) համար, որոնք քացախաթթվում թույլ են[26]։
Դիէլեկտրական թափանցելիության ազդեցություն[խմբագրել | խմբագրել կոդը]
Թթուների դիսոցման վրա ուժեղ ազդեցություն է ունենում լուծիչի դիէլեկտրական թափանցելիությունը։ Այդ ազդեցությունը հհատկապես նկատելի է տարբեր լիցքային տիպերի երկու թթուների համեմատման դեպքում։ Չեզոք թթվի, օրինակ՝ ֆենոլ (C6H5OH), դիսոցման դեպքում լուծույթում ձևավորվում է երկու իոն։ Դրական լիցքավորված թթուները, օրինակ՝ (C2H5)NH+,դիսոցվում են դրական լիցքավորված մեկ իոնի ձևավորմամբ։ Այդպիսով՝ առաջին դեպքում ռեակցիայից հետո իոնների թիվը մեծանում է, իսկ երկրորդ դեպքում այդ թիվը չի փոխվում[27]։
Հետևաբար, բարձր դիէլեկտրական թափանցելիություն ունեցող (ավելի բևեռային) լուծիչներից փոքր դիէլեկտրական թափանցելիություն ունեցող լուծիչներին անցումը պետք է խիստ նվազեցնի չեզոք թթուների ուժեղությունը և համեմատաբար քիչ ազդեցություն ունենա լիցքավորված թթուների վրա։ Այսպես, ջրում ֆենոլը հինգ անգամ ավելի ուժեղ է եռաէթիլամինի իոնից, սակայն մեթանոլում ֆենոլը 2500 անգամ ավելի թույլ է այդ իոնից[27]։
Անիոնների յուրահատուկ սոլվատացիայի ազդեցություն[խմբագրել | խմբագրել կոդը]
Լուծիչը կարող է մեծացնել նյութերի թթվայնությունը՝ յուրահատուկ ձևով կայունացնելով անիոնները, որոնք առաջացել են դիսոցման արդյունքում։
Թթուների կառուցվածքի ազդեցությունը դրանց ուժի վրա[խմբագրել | խմբագրել կոդը]
Գոյություն ունեն մի քանի գործոններ, որոնք որոշում են օրգանական և ոչ օրգանական թթուների հարաբերական ուժեղությունը, և որոնք կապված են այս կամ այն թթվի կառուցվածքի հետ։ Հաճախ մի քանի գործոններ գործում են միաժամանակ, այդ պատճառով էլ դժվար է կանխատեսել դրանք գումարային ազդեցությունը։ Առավել նշանակալիների թվում կարելի է առանձնացնել հետևյալ գործոնները[28].
- Ինդուկտիվ էֆեկտ (դաշտի էֆեկտ), էլեկտրաբացասական տեղակալիչները, որոնք օժտված են բացասական ինդուկտիվ էֆեկտով (-I-էֆեկտ), ուժեղացնում են թթուները։ Օրինակ՝ O2NCH2COOH թթուն գրեթե 1000 անգամ ավելի ուժեղ է, քան CH3COOH քացախաթթուն (դրանց pKa հավասար են 1,68 և 4,76 համապատասխանաբար)։ Դրա պատճառը կայունացնող ազդեցությունն է, որ այդ տեղակալիչները գործում են ձևավորվող թթվային անիոնի բացասական լիցքի վրա։ Նույնիսկ այն դեպքում, երբ թթուն դրական է լիցքավորված, իսկ զուգորդված հիմքը լիցք չունի, էլեկտրաբացասական խմբերը բարձրացնում են նրա թթվայնությունը, քանի որ ապակայունացնում են թթվի մոլեկուլը՝ ավելացնելով դրական լիցքի մեծությունը։ Դոնորային տեղակալիչները, որոնք ունեն +I-էֆեկտ, ընդհակառակը, նվազեցնում են թթվի ուժեղությունը։ Ինդուկտիվ էֆեկտը նվազում է թթվային կենտրոնի ու նրա վրա ազդող տեղակալիչի միջև հեռավորության մեծացման դեպքում[4][28]։

- Մեզոմեր էֆեկտ (ռեզոնանսային էֆեկտ), եթե թթվի դիսոցման ժամանակ ձևավորվող անիոնում բացասական լիցքը բաշխված է մի քանի ատոմների միջև ռեզոնանսի երևույթի հաշվին, ապա այդպիսի անիոնը կայունանում է, միացության թթվայնությունը՝ ավելանում։ Այդ պատճառով կարբոնաթթուներն ավելի ուժեղ թթուներ են, քան նրանց համապատասխան թթուները (կարբօքսիլատ-իոնների բացասական լիցքավորումը բաշխված է թթվածնի երկու ատոմների միջև)։ Նման էֆեկտ իրականանում է նաև ֆենոլներում, որտեղ զուգորդված հիմքի բացասական լիցքավորման կայունացմանը մասնակցում է արոմատիկ համակարգը[4][28]։
- Կապը պարբերական համակարգում ատոմների տեղակայման հետ, որքան բարձր է այն տարրի էլեկտրաբացասականությունը, որի հետ կապված է թթվային ատոմը, այնքան ուժեղ է թթուն։ Այդ պատճառով էլ թթուն ուժեղանում է պարբերական համակարգում ձախից աջ շարժվելուն զուգընթաց։ Թթվայնությունն ուժեղանում է նաև խմբում վերևից ներքև անցնելիս, ինչը կապված է թթվաստեղծ ատոմի ռադիուսի մեծացման, և հետևաբար նրանում լիցքի փոքր խտության հետ, ինչն արդյունքում հանգեցնում է ավելի թեթև դիսոցման[28].
- Լյուիսի թթուների ուժեղության փոփոխության օրինաչափությունը նույնպես կապված է կենտրոնական տարրի՝ քիմիական տարրերի պարբերական համակարգում զբաղեցրած տեղի հետ։ Այսպես, Լյուիսի թթուներից առավե ուժեղ են այն մոլեկուլները, որոնց արտաքին էլեկտրոնային շերտի լրացման համար պակասում է միայն մեկ էլեկտրոնային զույգ։ Այդ պատճառով, օրինակ, գալիումի քլորիդը՝ GaCl3, ավելի ուժեղ թթու է, քան ցինկի քլորիդը՝ ZnCl2։ Հավասար պայմանների դեպքում պակաս ուժեղ է այն MXn թթուն, որի կենտրոնական ատոմը չափերով ավելի մեծ է, ինչը կապված է դրական լիցքավորված միջուկի ու էլեկտրոնային զույգի միջև փոխազդեցության թուլացմամբ[28]։
- Ստատիկ էֆեկտներ, համաչափ երկհիմային թթուների դեպքում դիսոցման հաստատունն առաջին աստիճանում երկու անգամ ավելի մեծ է սպասվող արժեքից, քանի որ թթվում առկա են երկու պրոտոններ, որոնք ունակ են իոնացման։ Միևնույն ժամանակ դիսոցման հաստատունը երկրորդ աստիճանում երկու անգամ փոքր է սպասվող արժեքից, քանի որ դիկարբոնային թթվի դիանիոնը կարող է միացնել պրոտոն երկու հավասար դրությամբ։ Այսպիսով՝ Ka1/Ka2 հարաբերությունը մոտավորապես հավասար է, ինչն իրականում դիտարկվում է միմյանցից հեռացած թթվային խմբերով դիկարբոնային թթուների դեպքում[28]։
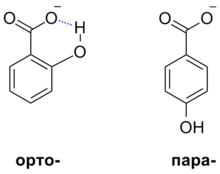
- Ջրածնային կապ, ներմոլեկուլային ջրածնային կապերը կարող են կայունացնող ազդեցություն ունենալ ձևավորվող անիոնների վրա և դրանով ուժեացնել համապատասխան թթուները։ Այսպես, օրթո-հիդրօքսիբենզոյական թթվի pKaկազմում է 2,98, իսկ պարա-հիդրօքսիբենզոյական թթվի համար՝ միայն 4,58, քանի որ առաջին միացության համար հնարավոր է ններմոլեկուլային ջրածնային կապի իրականացումը, իսկ երկրորդի համար՝ ոչ[28]։
- Տարածական էֆեկտներ, Բրյոնսթեդի թթուների համար տարածությունը հազվադեպ է խոչընդոտ հանդիսանում թթվահիմնային ռեակցիաներում, որովհետև պրոտոնը բավական փոքր է։ Տարածական էֆեկտներն ավելի նկատելի են Լյուիսի թթուների ու հիմքերի դեպքում։ Օրինակ՝ Լյուիսի ծավալային թթվի օգտագործման դեպքում Bt-Bu3 փոխազդեցության ուժը որոշվում է ոչ թե հիմքի ուժեղությամբ, նրա էլեկտրոնային զույգի տարածական մատչելիությամբ[28]։
- Հիբրիդացում, ալկիններն ու ցիանական թթուն (HCN) համեմատաբար ավելի ուժեղ թթուներ են, քան երկակի ու միակի կապերով անալոգները, որովհետև անիոնները sp-հիբրիդային ատոմի դեպքում ավելի կայուն են, քան sp2- կամ sp3-հիբրիդային ատոմի դեպքում[28]։
Համետի թթվայնության ֆունկցիա և սուպերթթուներ[խմբագրել | խմբագրել կոդը]
Շատ ուժեղ կամ կոնցենտրացված թթուների թթվահիմնային հատկությունների քանակական գնահատում հնարավոր չէ կատարել pH սանդղակի օգտագործմամբ, որովհետև ջրային լուծույթների համար այդ սանդղակը ներքևից սահմանափակված է pH = 0 արժեքով, որին համապատասխանում է H2SO4 ծծմբական թթվի 5 %-անոց լուծույթը։ Սակայն նման անհրաժեշտություն կա։ Տվյալ խնդրի լուծման համար 1932 թվականին Լուիս Համետը և Ա. Դեյրուպն առաջարկել են Համետի թթվայնության ֆունկցիան H0։ Այդ մոտեցման դեպքում շատ ուժեղ թթուների թթվահիմնային հավասարակշռությունը հետազոտվում է ջրից թույլ հիմքի առկայությամբ և չափվում է այդ հիմքի պրոտոնոցված ու չպրոտոնացված ձևերի խտությունների հարաբերությունը էլեկտրոնային սպեկրոսկոպիայի մեթոդով։ Դա հնարավորություն է տվել ավելացնել թթվայնության սանդղակը բացասական միջավայրում, ինչի շնորհիվ հնարավոր է դարձել ոչ օրգանական թթուների կոնցենտրացված լուծույթների թթվայնության գնահատումը[29]։
Համետի կողմից ներմուծված թթվայնության սանդղակը լայնորեն օգտագործվում է սուպերթթուների գնահատման համար, որոնց թթվայնությունն ավելի բարձր է, քան 100 %-անոց ծծմբական թթվի թթվայնությունը[30], որի դեպքում Համետի թթվայնության ֆունկցիան կազմում է H0 = −12։ Ինդիվիդուալ ոչ օրգանական միացությունների շարքում ուժեղ թթուներ են՝ HClO4 (H0 = −13), ClSO3H (H0 = −13,8) և FSO3H (H0 = −15,1)։ Հայտնի օրգանական թթուներից ամենաուժեղը տրիֆտորմեթանսուլֆաթթուն է CF3SO3H (H0 = −14,1)[29]։
Սուպերթթուների շարքին են պատկանում նաև Բրյոնսթեդի թթուների ու Լուիսի թթուների խառնուրդները, օրինակ՝ HF և SbF5 խառնուրդները տարբեր հարաբերակցությամբ (H0 < −30 1:1 հարաբերակցության դեպքում)։ Սուպերթթվի հայտնի օրինակ է օլեումը, որտեղ Լյուիսի թթվի դերը կատարում է SO3, որը ծծմբական թթվի հետ ռեակցիայի արդյունքում տալիս է H2S2O7 սուպերթթու (H0 = −14,5)[29]։
Ստացման եղանակներ[խմբագրել | խմբագրել կոդը]
Անթթվային թթուների զգալի մասը (ֆտորաջրական՝ HF, քլորաջրածնական՝ HCl, բրոմաջրածնակն՝ HBr, յոդաջրածնական՝ HJ, ծծմբաջրածնական՝ H2S, և այլ թթուներ) ստացվում են՝ համապատասխան գազային ջրածնային միացությունները ջրում լուծելով։ Այդ գազային ջրածնային միացությունների ստացման հիմնական եղանակններն են՝
- Ջրածնի և համապատասխան ոչ մետաղի անմիջական փոխազդեցությունը.
Համապատասխան աղի և այլ՝ ավելի ուժեղ թթվի փոխազդեցությունը.
- Թթուների ստացման լաբորատոր եղանակ.
- Թթուների ստացման արդյունաբերական եղանակ.
Թթվածնային թթուների ստացման հիմնական եղանակը՝ համապատասխան օքսիդի ու ջրի փոխազդեցությունն է, օրինակ.
Թթվածնային թթու է ստացվում նաև այդ թթվի աղի և այլ թթվի փոխազդեցությունից, եթե ստացվող թթուն, փոխազդող թթվի համեմատ՝ ցնդող է.
Որպես ռեակցիայի արգասիք՝ ջրում անլուծելի աղ կամ թթու է առաջանում.

Անթթվածնային թթուներին համապատասխանող գազեր կարելի է ստանալ և որոշ այլ փոխազդեցություններից։ Օրինակ՝ ավելի ակտիվ ոչ մետաղները դուրս են մղում պակաս ակտիվները համապատասխան թթուներից.
Ծծմբաջրածին՝ առաջանում ակտիվ մետաղների ու խիտ ծծմբական թթվի փոխազդեցությունից, օրինակ.
Թթվածնային թթուներ նույնպես կարելի է ստանալ որոշ այլ փոփազդեցություններից, օրինակ.
Քիմիական հատկությունները[խմբագրել | խմբագրել կոդը]

Թթուների քիմիական հատկությունները՝
- Թթուների փոխազդեցությունը հայտանյութերի հետ.
Բոլոր թթուների ջրային լուծույթները գունավորում են հայտանյութերը.
- լակմուսը (լ)՝ կարմիր,
- մեթիլօրանժը(մօ)՝ մուգ վարդագույն,
- իսկ ֆենոֆտալեինը(ֆֆ)՝ թթուներում չի գունավորվում։
Բոլոր թթուները դիսոցվելիս առաջացնում են ջրածին H+ կատիոններ (H3O)+ հիդրօքսոնիում իոններ, որոնք էլ պայմանավորում են թթուների մյուս ընդհանուր հատկությունները, օրինակ.
- HCl ↔ H+ + Cl-
- (HCl + H2O = (H3O) + +Cl-)
- Թթուների փոխազդեցությունը հիմքերի հետ.
Թթուներին առավել բնորոշ է հիմքերի (ինչպես ալկալիների, այնպես էլ՝ ջրում լուծվող) հետ փոխազդեցությունը՝ չեզոքացման ռեակցիան, որի հետևանքով աղ և ջուր են առաջանում (չլուծվող հիմքերի հետ փոխաղդեցության դեպքում նույնպես առաջանում են աղ և ջուր, եթե օգտագործվող թթուն լուծելի է[31]), օրինակ.
- Թթուներին փոխազդեցությունը հիմնային օքսիդների հետ.
Թթուներին նույնքան բնորոշ է հիմնային օքսիդների հետ փոխազդեցությունը, որը նույնպես հանգեցնում է աղի ու ջրի առաջացման, օրինակ.
- Թթուների փոխազգեցությունը մետաղների հետ.
Թթուների ու մետաղների փոխազդեցությունից աղ է առաջանում, և ջրածին է անջատվում։ Թթուների մեծ մասի լուծույթների հետ այդպես են փոխազգում այն մետաղները, որոնք մետաղների համեմատական ակտիվության շարքում ջրածնից առաջ(ձախ) են տեղադրված, օրինակ.
- Թթուների փոխազդեցությունն աղերի հետ.
- ա) անուծելի թթու.
- բ) թույլ (քիչ դիսոցվող) թթու.
- գ) անկայուն թթու.
- դ) անլուծելի աղ.
Անկայուն թթուները տաքացնելիս քայքայվում են, ընդ որում՝ սովորաբար առաջանում են ջուր և թթվին համապատասխանող անհիդրիդ, բայց կարող են և այլ արգասիքներ ստացվել, օրինակ.
Նշումներ[խմբագրել | խմբագրել կոդը]
- ↑ Պիվալինաթթուն կարող է ստացվել պինակոլինի օքսիդացմամբ և իզոմեր է վալերիանաթթվի հետ։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ «IUPAC Gold Book — Acid». Արխիվացված է օրիգինալից 2013 թ․ ապրիլի 17-ին. Վերցված է 2013 թ․ ապրիլի 15-ին.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 2. — С. 393—395. — ISBN 5-85270-039-8
- ↑ 3,0 3,1 3,2 3,3 Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. и др. Основы аналитической химии. Книга 1. Общие вопросы. Методы разделения / Под ред. Ю. А. Золотова. — 2-е изд., перераб. и доп. — М: Высшая школа, 1999. — С. 118. — ISBN 5-06-003558-1
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.
- ↑ «IUPAC Gold Book — Brønsted acid». Արխիվացված է օրիգինալից 2013 թ․ ապրիլի 17-ին. Վերցված է 2013 թ․ ապրիլի 15-ին.
- ↑ «IUPAC Gold Book — conjugate acid–base pair». Արխիվացված է օրիգինալից 2013 թ․ ապրիլի 17-ին. Վերցված է 2013 թ․ ապրիլի 15-ին.
- ↑ «IUPAC Gold Book — Lewis acid». Արխիվացված է օրիգինալից 2013 թ․ ապրիլի 17-ին. Վերցված է 2013 թ․ ապրիլի 15-ին.
- ↑ Золотов и др., 1999, էջ 152
- ↑ Кусаинова К. М. Нет ни кислот, ни оснований! Об одной полузабытой теории и её творце // Химия и жизнь. — 2004. — № 6. — С. 40—44.
- ↑ 10,0 10,1 Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. 8 класс. — 15-е изд. — М: Просвещение, 2011. — С. 101. — ISBN 978-5-09-025532-5
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л., Цветков А. А. Основы номенклатуры неорганических веществ / Под ред. Б. Д. Степина. — М: Химия, 1983. — С. 39—45.
- ↑ Кан Р., Дермер О. Введение в химическую номенклатуру = Introduction to Chemical Nomenclature / Пер. с англ. Н. Н. Щербиновской, под ред. В. М. Потапова и Р. А. Лидина. — М: Химия, 1983. — С. 131—134.
- ↑ Терней А. Современная органическая химия. Т. 2. — М: Мир, 1981. — С. 103.
- ↑ Senning A. Elsevier's Dictionary of Chemoetymology. The whies and whences of chemical nomenclature and terminology. — Elsevier, 2007. — 434 p. — ISBN 978-0-444-52239-9
- ↑ Золотов и др., 1999, էջ 121—122
- ↑ 16,0 16,1 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленинград: Химия, 1978. — С. 235.
- ↑ Химическая энциклопедия, 1992, т. 2, էջ 396
- ↑ 18,0 18,1 Дроздов А. А., Зломанов В. П. (1998). «Химия элементов главных групп периодической системы Д.И.Менделеева: галогены. 9. Свойства оксокислот хлора». Արխիվացված է օրիգինալից 2013 թ․ ապրիլի 19-ին. Վերցված է 2013 թ․ ապրիլի 17-ին.
- ↑ Шрайвер, Эткинс, 2004, էջ 244
- ↑ Химическая энциклопедия, 1992, т. 5, էջ 432
- ↑ «Levelling effect // IUPAC Glossary of terms used in physical organic chemistry. Pure & Appl. Chem., Vol. 51, p. 1768» (PDF). Արխիվացված է օրիգինալից (PDF) 2013 թ․ հոկտեմբերի 4-ին. Վերցված է 2018 թ․ նոյեմբերի 14-ին.
- ↑ Реутов и др., 2010, էջ 230—232
- ↑ Неорганическая химия / Под ред. Ю. Д. Третьякова. — М: Академия, 2004. — Т. 1. — С. 89—94. — ISBN 5-7695-1446-9
- ↑ Реутов и др., 2010, էջ 231
- ↑ 25,0 25,1 Золотов и др., 1999, էջ 123—125
- ↑ Танганов Б. Б. Химические методы анализа. — Улан-Удэ: Издательство ВСГТУ, 2005. — С. 8—14. — ISBN 5-89230-037-4
- ↑ 27,0 27,1 Реутов и др., 2010, էջ 233
- ↑ 28,0 28,1 28,2 28,3 28,4 28,5 28,6 28,7 28,8 Марч Дж. Органическая химия. Реакции, механизмы и структура. Т. 1 / Пер. с англ. З. Е. Самойловой, под ред. И. П. Белецкой. — М: Мир, 1987. — С. 340—346.
- ↑ 29,0 29,1 29,2 Штейнгарц В. Д. Суперкислоты // Соросовский образовательный журнал. — 1999. — № 3. — С. 82—87.
- ↑ «IUPAC Gold Book — superacid». Արխիվացված է օրիգինալից 2013 թ․ ապրիլի 28-ին. Վերցված է 2013 թ․ ապրիլի 23-ին.
- ↑ Мануйлов А. В., Родионов В. И. — Кислоты. Классификация кислот. Химические свойства. // Основы химии. Интернет-учебник.
Գրականություն[խմբագրել | խմբագրել կոդը]
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд. — М: Бином. Лаборатория знаний, 2010. — Т. 1. — 567 с. — ISBN 978-5-94774-613-6
- Шрайвер Д., Эткинс П. Неорганическая химия = Inorganic Chemistry / Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм, под ред. В. П. Зломанова. — М: Мир, 2004. — Т. 1. — 679 с. — ISBN 5-03-003628-8
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- Ամեն ինչ թթուների մասին
- Օրգանական և անօրգանական թթուներ
- Անթթվածնավոր և թթվածնավոր թթուներ, քիմիական ռեակցիաների տեսակները Արխիվացված 2013-09-16 Wayback Machine
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Թթուներ» հոդվածին։ |
| ||||||||||||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 4, էջ 185)։ |


![{\displaystyle K_{\mathrm {a} }={\frac {[{\mathsf {H_{3}O^{+}}}]\cdot [{\mathsf {F^{-}}}]}{[{\mathsf {HF}}]}}=6{,}61\cdot 10^{-4};}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b89f809ea632b8eabdbe7dfe29ecb4c6c84a8025)

![{\displaystyle {\mathsf {H_{3}PO_{4}+H_{2}O}}\rightleftharpoons {\mathsf {H_{2}PO_{4}^{-}+H_{3}O^{+}}};K_{\mathrm {a1} }={\frac {[{\mathsf {H_{2}PO_{4}^{-}}}]\cdot [{\mathsf {H_{3}O^{+}}}]}{[{\mathsf {H_{3}PO_{4}}}]}}=7{,}52\cdot 10^{-3};}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3933d55cf578bcf29c7ea10c64304e16dcacf270)
![{\displaystyle {\mathsf {H_{2}PO_{4}^{-}+H_{2}O}}\rightleftharpoons {\mathsf {HPO_{4}^{2-}+H_{3}O^{+}}};K_{\mathrm {a2} }={\frac {[{\mathsf {HPO_{4}^{2-}}}]\cdot [{\mathsf {H_{3}O^{+}}}]}{[{\mathsf {H_{2}PO_{4}^{-}}}]}}=6{,}31\cdot 10^{-8};}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7daa1e198ee16fcc7386f32cac56765547858eb6)
![{\displaystyle {\mathsf {HPO_{4}^{2-}+H_{2}O}}\rightleftharpoons {\mathsf {PO_{4}^{3-}+H_{3}O^{+}}};K_{\mathrm {a3} }={\frac {[{\mathsf {PO_{4}^{3-}}}]\cdot [{\mathsf {H_{3}O^{+}}}]}{[{\mathsf {HPO_{4}^{2-}}}]}}=1{,}26\cdot 10^{-12}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f607d39b742ab61cc22e9fe3c4ae31b7bea7a5a)

![{\displaystyle \alpha ={\frac {C_{\text{dis}}}{C_{0}}}={\frac {[{\mathsf {X^{-}}}]}{[{\mathsf {HX}}]+[{\mathsf {X^{-}}}]}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9b3da9542f921316247e2eb4ddbd3921805f767)































