Էթան
| Էթան | |
|---|---|
 | |
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Էթան |
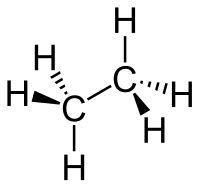
| Քիմիական բանաձև | C₂H₆ |
| Ռացիոնալ բանաձև | |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | գազային |
| Մոլային զանգված | 5,0E−26 կիլոգրամ[1] գ/մոլ |
| Իոնիզացման էներգիա | 1,8E−18 ջոուլ[2] կՋ/մոլ |
| Հալման ջերմաստիճան | −182,8 °C[2] °C |
| Եռման ջերմաստիճան | 184,6 K[3] և −88,6 °C[2] °C |
| Այրման ջերմաստիճան | 152 °C |
| Ինքնաբռնկման ջերմաստիճան | 472 °C |
| Գոյացան էնթալպիա | −83 820 ջոուլ մեկ մոլի համար[3] կՋ/մոլ |
| Քիմիական հատկություններ | |
| Կառուցվածք | |
| Բյուրեղային կառուցվածք | մոլեկուլային |
| Դիպոլ մոմենտ | 0 Կլ·մ[2] |
| Դասակարգում | |
| CAS համար | 74-84-0 |
| PubChem | 6324 |
| EINECS համար | 200-814-8 |
| SMILES | CC |
| ЕС | 200-814-8 |
| RTECS | KH3800000 |
| ChEBI | 6084 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Էթան (լատին․՝ Ethanum), (), օրգանական միացություն, ալկանների հոմոլոգիական շարքի երկրորդ անդամը։ Բնության մեջ հանդիպում է բնական գազի, նավթի և այլ նյութեր բաղադրության մեջ։ Մեթանի և պրոպանի համեմատ ավելի հրդեհավտանգ և պայթյունավտանգ է։ Ունի թմրացնող ազդեցություն, որը թուլացնում է արյան և ջրի լուծելիությունը։
Հատկություններ[խմբագրել | խմբագրել կոդը]
Ֆիզիկական հատկությունները[խմբագրել | խմբագրել կոդը]
Էթանը ստանդարտ պայմաններում անգույն, անհոտ, անհամ գազ է։ Մոլային զանգվածը՝ 30 գ/մոլ է։ Հեղուկանում է -182,81 °C-ում և անցնում է գազային վիճակի՝ -88,63 °C-ում։
Քիմիական հատկությունները[խմբագրել | խմբագրել կոդը]
Մոլեկուլային ֆորմուլն է (տարածականը՝ )։ Բնորոշ հատկությունն է հալոգենների հետ ընթացող ռեակցիան, որն ընթանում է ջրածնի տեղակալմամբ ազատ շղթայական ռադիկալային մեխանիզմով։ Էթանի ջերմային դեհիդրումից 550-650 °C ընկած հատվածում առաջանում է էթիլեն, իսկ 800 °C և ավելիի դեպքում՝ ացետիլեն (ստացվում է նաև բենզոլ )։ Անմիջական քլորացումից 300-450 °C ջերմաստիճաններում առաջանում է էթիլքլորիդ, նիտրացման ժամանակ՝ նիտրոէթան։
Ֆիզիոլոգիական ազդեցությունը[խմբագրել | խմբագրել կոդը]
Հանդիսանում է թույլ նարկոտիկ հատկություններով օժտված նյութ։
Ստացումը[խմբագրել | խմբագրել կոդը]
Արդյունաբերական ստացման եղանակներ[խմբագրել | խմբագրել կոդը]
Արդյունաբերությունում ստանում են նավթից և բնական գազից, որում ըստ ծավալի այն կազմում է 10%։
Լաբորատոր ստացման եղանակներ[խմբագրել | խմբագրել կոդը]
Լաբորատորիայում ստանում են մեթիլհալոգենիդներից Վյուրցի եղանակով, նատրիումի ացետատի էլեկտրոլիզից Կոլբեի ռեակցիայի միջոցով, էթիլբրոմիդից Գրինյարի ռեակցիայի միջոցով, էթիլենի հիդրումից(պալադիում կատալիզատորի միջոցով) կամ ացետիլենի հիդրումից(նիկել կատալիզատորի միջոցով)։
Կիրառումը[խմբագրել | խմբագրել կոդը]
Էթանը հիմնականում օգտագործում են էթիլենի ստացման համար։
Հետաքրքիր փաստեր[խմբագրել | խմբագրել կոդը]
Ենթադրվում է, որ Սատուրնի արբանյակ Տիտանի մակերեսային շերտերում ցածր ջերմաստիճանի պատճառով(-180 °C) գոյություն ունեն հեղուկ մեթան-էթանային խառնուրդի ամբողջ գետեր և լճեր։
Աղբյուրներ[խմբագրել | խմբագրել կոդը]
- Тутурин Н. Н., Этан // Энциклопедический словарь Брокгауза и Ефрона։ В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 ETHANE
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 3,0 3,1 3,2 3,3 Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics // J. Chem. Educ. — ACS, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Էթան» հոդվածին։ |
| ||||||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 4, էջ 7)։ |


