ԴՆԹ
| ԴՆԹ | |
|---|---|
 ԴՆԹ-ի կրկնակի պարույրի կառուցվածքի մի մասը | |
| Տեսակ | structural class of chemical entities? |
| Ենթադաս | Նուկլեինաթթուներ[1], կենսապոլիմերներ և biological macromolecule?[2] |
| Մասն է | Միտոքոնդրիումներ, Գենոմ, nucleosome?, DNA binding?[3], DNA metabolic process?[3], DNA catabolic process?[3], DNA biosynthetic process?[3], DNA transport?[3], DNA transmembrane transporter activity?[3], protein-DNA-RNA complex?[3], protein-DNA complex?[3], DNA import into cell involved in transformation?[4], catalytic activity, acting on DNA?[5] և Բջջակորիզ |
| Կազմված է | polynucleotide? և Նուկլեոտիդ[1] |
| Մասնագիտություն | genealogical DNA test? |
| MeSH | D13.444.308 |
| Foundational Model of Anatomy | 74412 |
Դեզօքսիռիբոնուկլեինաթթու (ԴՆԹ) (անգլ.՝ Deoxyribonucleic acid (DNA)) բոլոր կենդանի օրգանիզմների և որոշ վիրուսների զարգացման և կենսագործունեության գենետիկական հրահանգները պարունակող նուկլեինաթթու։ Վերջինները, սպիտակուցներն ու ածխաջրերը կյանքի համար անհրաժեշտ երեք կարևորագույն մակրոմոլեկուլներն են։ ԴՆԹ-ի մոլեկուլները սովորաբար կրկնակի պարույրներ են՝ կազմված երկու երկար կենսապոլիմերներից, որոնք էլ իրենց հերթին կազմված են նուկլեոտիդներից։ Յուրաքանչյուր նուկլեոտիդ կազմված է ազոտային հիմքից (գուանին (G, Գ), ադենին (A, Ա), թիմին (T, Թ) և ցիտոզին (C, Ց)), ածխաջրից (դեզօքսիռիբոզ) և ֆոսֆորական թթվի մնացորդներից։ ԴՆԹ-ի մոլեկուլների հիմնական դերը տեղեկատվության երկարատև պահպանումն է։ ԴՆԹ-ի այն հատվածները, որոնք ծածկագրում են սպիտակուցներ, կոչվում են գեներ, իսկ ԴՆԹ-ի չծածկագրող հատվածներն ունեն կառուցվածքային նշանակություն կամ մասնակցում են ծածկագրող հատվածների ակտիվության կարգավորմանը։
ԴՆԹ-ի երկու շղթաներն ընթանում են միմյանց հակառակ ուղղությամբ, որի պատճառով համարվում են հակազուգահեռ դասավորված։ ԴՆԹ-ի որևէ ծայրում շղթաներից մեկի 3′ ծայրն է, մյուսի՝ 5′ ծայրը։ Դեզօքսիռիբոզին միանում է 4 տեսակի ազոտային հիմքերից որևէ մեկը[6]։ Հենց այս 4 ազոտային հիմքերի հաջորդականությունն էլ ապահովում է ինֆորմացիայի գաղտնագրումը։ Ինֆորմացիան պահպանվում է գենետիկական ծածկագրի միջոցով, իսկ ծածկագիրը հետագայում փոխակերպվում է ամինաթթուների հաջորդականության։ ԴՆԹ-ի շղթաներից մեկի հիման վրա միաշղթա նուկլեինաթթվի՝ ՌՆԹ-ի սինթեզի պրոցեսն անվանվում է տրանսկրիպցիա, իսկ ի-ՌՆԹ-ի կաղապարի վրա ամինաթթուների հաջորդականության սինթեզը՝ տրանսլյացիա։
Բջիջների ներսում ԴՆԹ-ն փաթեթավորվում է քրոմոսոմների մեջ։ Բջջի բաժանման ժամանակ քրոմոսոմները կրկնապատկվում են ԴՆԹ-ի ռեպլիկացիայի (կրկնապատկման) ժամանակ։ Էուկարիոտ օրգանիզմների մոտ (կենդանիներ, բույսեր, սնկեր և նախակենդանիներ) ԴՆԹ-ի հիմնական մասը պահպանվում է կորիզում, իսկ որոշ մասը՝ օրգանոիդներում (միտոքոնդրիումներում կամ քլորոպլաստներում)[7]։ Պրոկարիոտների մոտ (բակտերիա և արքեա) ԴՆԹ-ն պահպանվում է միայն ցիտոպլազմայում։
Հետազոտման պատմություն[խմբագրել | խմբագրել կոդը]


ԴՆԹ-ն հայտնաբերվել է 1869 թվականին Ֆրիդրիխ Միշերի կողմից։ Սկզբում նա այն անվանել է նուկլեին, բայց հետագայում, երբ բացահայտում է այդ նյութի թթվային հատկությունները, վերանվանում է՝ նուկլեինաթթու[8]։ Նոր բացահայտված միացության կենսաբանական նշանակությունը դեռևս պարզ չէր, և այն պարզապես համարում էին օրգանիզմում ֆոսֆորի պահեստարան։ Ավելին, դեռ 20-րդ դարի սկզբում շատ կենսաբաններ համարում էին, որ ԴՆԹ-ն ոչ մի կապ չունի տեղեկատվության պահպանման և փոխանցման հետ։
Հետագայում ապացուցվեց, որ ոչ թե սպիտակուցներն են գենետիկական տեղեկատվությունը պահպանող մոլեկուլները, այլ ԴՆԹ-ն։ Այս փաստը ապացուցող առաջին փորձերը կատարեցին Էվերը, Կոլին Մաք-Լեոդը և Մաքլին Մաք-Կարտին 1944 թվականին։ Ամերիկացի գիտնականներ Ալֆրեդ Հերշիի և Մարտա Չեյզի փորձը՝ նշագրված իզոտոպներով, թույլ տվեց ապացուցել, որ վարակված բջիջներ է անցնում ֆագի միայն նուկլեինաթթուն, իսկ ֆագերի նոր սերունդներն ունենում են և՛ սպիտակուցներ, և՛ նուկլեինաթթուներ[9]։
Մինչ 20-րդ դարի 50-ական թվականները ԴՆԹ-ի ճշգրիտ կառուցվածքը մնում էր անհայտ։ Չնայած արդեն քիչ թե շատ հայտնի էր, որ ԴՆԹ-ն կազմված է մի քանի շղթաներից, շղթաների թիվը և դասավորությունը ոչ ոք չգիտեր։
ԴՆԹ-ի կրկնակի պարույրի կառուցվածքն առաջարկեցին Ֆրենսիս Կրիկն ու Ջեյմ Ուոթսոնը 1953 թվականին՝ հիմնվելով Մորիս Ուիլկինսի և Ռոզալինդ Ֆրանկլինի ստացած ռենտգենոկառուցվածքային տվյալների, ինչպես նաև «Չարգաֆի օրենքի» վրա[10]։ Ուոթսոնի և Կրիկի առաջարկված ԴՆԹ-ի մոդելը հետագայում ապացուցվեց, իսկ նրանց առաջարկը 1962 թվականին ստացավ Նոբելյան մրցանակ՝ ֆիզիոլոգիայի և բժշկության բնագավառում։ Նոբելյան մրցանակը ստացողների շարքում չկար Ռոզալինդ Ֆրանկլինը, քանի որ նա այդ ժամանակ մահացել էր քաղցկեղից (մրցանակը ետմահու չի շնորհվում)[11]։
Մոլեկուլի կառուցվածք[խմբագրել | խմբագրել կոդը]
Նուկլեոտիդներ[խմբագրել | խմբագրել կոդը]
Դեզօքսիռիբոնուկլեինաթթուն (ԴՆԹ) կենսապոլիմեր է, որի մոնոմերները նուկլեոտիդներն են[12][13]։
Յուրաքանչյուր նուկլեոտիդ կազմված է օրթոֆոսֆորական թթվի մնացորդից, որը միացած է դեզօքսիռիբոզին 5' դիրքում։ Վերջինիս 1' դիրքում միանում է 4 ազոտային հիմքերից որևէ մեկը գլիկոզիդային (C-N) կապի միջոցով։
Հենց նուկլեոտիդների կազմության մեջ մտնող ածխաջրի տեսակն էլ ԴՆԹ-ի և ՌՆԹ-ի միջև հիմնական տարբերություններից մեկն է (ՌՆԹ-ի կազմի մեջ մտնում է ռիբոզը)[14]։ Նուկլեոտիդի օրինակ է ադենոզինմոնոֆոսֆատը, որի ազոտային հիմքը ադենինն է։
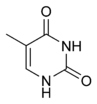
Տարբերում են ազոտային հիմքերի 2 հիմնական խումբ պուրինային (ադենին (A) և գուանին (G)) և պիրիմիդինային (ցիտոզին (C) և թիմին (T))[15]։
Բացառության կարգով, օրինակ բակտերիոֆագ PBS1-ի մոտ ԴՆԹ-ի կազմում հանդիպում է նաև 5-րդ տիպի ուրացիլ (U) ազոտային հիմքը։ Ուրացիլը կազմված է պիրիմիդինային օղակից և թիմինից տարբերվում է միայն օղակում մեթիլ խմբի բացակայությամբ։ Ուրացիլը հանդիպում է ՌՆԹ-ի կազմի մեջ և այնտեղ փոխարինում թիմինին[16]։
Հարկավոր է նշել, որ թիմինն ու ուրացիլը հանդիպում են ոչ միայն ԴՆԹ-ում և ՌՆԹ-ում համապատասխանաբար։ Պարզվել է, որ որոշ ՌՆԹ-ների սինթեզից հետո տեղի է ունենում ուրացիլների մասնակի մեթիլացում, որի պատճառով վերջիններս վերածվում են թիմինի։ Այս պրոցեսը տեղի է ունենում փ-ՌՆԹ-ի և ռ-ՌՆԹ-ի սինթեզի ժամանակ[17]։
Կրկնակի պարույր[խմբագրել | խմբագրել կոդը]

ԴՆԹ-ի պոլիմերը օժտված է բավականին բարդ կառույցով։ Նույն շղթայում նուկլեոտիդները միմյանց միացած են կովալենտ կապերի միջոցով՝ առաջացնելով պոլինուկլեոտիդային շղթաներ։ Գրեթե բոլոր դեպքերում 2 պոլինուկլեոտիդային շղթաները միմյանց միանում են ջրածնական կապերով՝ առաջացնելով կրկնակի պարույր. բացառություն են կազմում որոշ վիրուսներ, որոնց ԴՆԹ-ն միաշղթա է[10][14]։
Յուրաքանչյուր շղթայի հիմքը կազմված է միմյանց հաջորդող ֆոսֆատներից և ածխաջրերից[18]։ Միևնույն շղթայի նուկլեոտիդները միացած են ֆոսֆոեթերային կապերով, որոնք ձևավորվում են մի նուկլեոտիդի 3'-հիդօքսիլային (OH) և մյուս նուկլեոտիդի 5' ֆոսֆատային (5'—РО3) խմբերի միջև։ ԴՆԹ-ի շղթայի ասիմետրիկ ծայրերն անվանում են 3' (երեք պրիմ) և 5' (հինգ պրիմ)։ Մոլեկուլի բևեռականությունը մեծ նշանակություն ունի ԴՆԹ-ի սինթեզի ժամանակ։
ԴՆԹ-ի երկու շղթաները պարուրված են մեկը մյուսի հետ և այդպես պահպանվում է երկու շղթաների դեմ դիմաց գտնվող նուկլեոտիդների միջև առաջացող ջրածնական կապերի միջոցով։ Բնության մեջ ԴՆԹ-ի մոլեկուլը հիմնականում աջ պարուրված է։
Երկու շղթաներում 3' ծայրից 5' ծայր ուղղությունը միմյանց հակառակ դասավորված են (շղթաները միմյանց հակազուգահեռ են)։ Երկպարույրի լայնությունը 22 - 24 Å է կամ 2,2 - 2,4 նմ, յուրաքանչյուր նուկլեոտիդի երկարությունը՝ 3,3 Å (0,33 նմ)[19]։
Երկպարույրում տարբերում են փոքր (12 Å) և մեծ (22 Å) ակոսիկներ[20]։ Այն սպիտակուցները, որոնք միանում են երկշղթա ԴՆԹ-ի որոշակի հաջորդականություններին (օրինակ՝ տրանսկրիպցիայի ֆակտորները) շղթաների հետ փոխհարաբերության մեջ են մտնում մեծ ակոսիկի շրջանում, քանի որ այդտեղ նուկլեոտիդներն ավելի հասանելի են[21]։
Ազոտային հիմքերի միջև առաջացող կապեր[խմբագրել | խմբագրել կոդը]

|

|
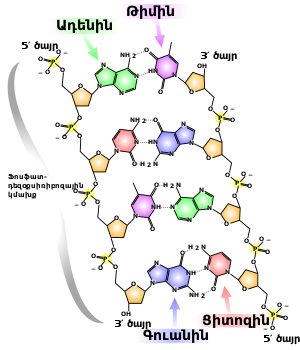
Մի շղթայում գտնվող նուկլեոտիդի ազոտային հիմքը միանում է դիմացի շղթայի որոշակի նուկլեոտիդի հետ։ Այսպիսի յուրահատուկ կապը անվանվում է կոմպլեմենտար, իսկ երևույթը՝ կոմպլեմենտարություն։ Պուրինները կոմպլեմենտար են պիրիմիդիններին (այսինքն՝ կարող են նրանց հետ առաջացնել ջրածնական կապեր)։ Ադենինը կապվում է թիմինի, իսկ ցիտոզինը՝ գուանինի հետ։ Շղթաները միացած են նաև հիդրոֆոբ և ստեքինգի կապերի միջոցով, որոնք կախված չեն նուկլեոտիդների հաջորդականությունից։
Շղթաների կոմպլեմենտարությունը նշանակում է, որ ինֆորմացիան, որն առկա է մի շղթայում, պարունակվում է նաև մյուսում։ Կոմպլեմենտար զույգերի միջև փոխհարաբերությունների յուրահատկությունն ու դարձելիությունը մեծ նշանակություն ունեն հատկապես ԴՆԹ-ի ռեպլիկացիայի և մյուս ֆունկցիաների իրականացման ժամանակ։
Քանի որ ջրածնական կապերը կովալենտ չեն, նրանք արագ խզվում և վերականգնվում են։ Երկու շղթաները կարող են առանձնանալ հատուկ ֆերմենտների (հելիկազ) կամ բարձր ջերմաստիճանի ազդեցությամբ[22]։ Տարբեր նուկլեոտիդային զույգեր առաջացնում են տարբեր քանակի ջրածնական կապեր։ AT զույգը կապված է երկու, իսկ GC զույգը՝ երեք ջրածնական կապերով. այս պատճառով GC զույգի անջատումն ավելի շատ էներգիա է պահանջում։
GC զույգերի պարունակության տոկոսը և ԴՆԹ-ի երկարությունը որոշում է շղթաների առանձնացման համար անհրաժեշտ էներգիան[23]։
ԴՆԹ-ի այն հատվածները, որոնց ֆունկցիայի պատճառով պետք է լինեն հեշտ խզվող, ինչպիսին օրինակ բակտերիալ պրոմոտորների TATA հաջորդականություններն են, պարունակում են մեծ քանակությամբ A և T։
Հիմքերի քիմիական ձևափոխություններ[խմբագրել | խմբագրել կոդը]
Քրոմատինի կառուցվածքը ազդում է գեների տրանսկրիպցիայի վրա. հետերոքրոմատինի հատվածները փոխում են իրենց ակտիվությունը ցիտոզինի մեթիլացման դեպքում։ Օրինակ՝ ցիտոզինի մեթիլացումից հետո 5-մեթիլցիտոզինի առաջացումը մեծ նշանակություն ունի X քրոմոսոմի ապաակտիվացման մեջ[24]։
Մեթիլացման միջին մակարդակը տարբեր կենդանի օրգանիզմների մոտ տարբեր է, օրինակ՝ Caenorhabditis elegans նեմատոդի մոտ մեթիլացում ընդհանրապես չի նկատվում, իսկ ողնաշարավորների մոտ հայտնաբերվել է մինչև 1% մեթիլացում[25]։
5-մեթիլցիտոզինը կարող է կորցնել ամինոխումբը (դեամինացում) և վերածվել թիմինի։ Դրա համար ցիտոզինի մեթիլացումը միաժամանակ նաև մուտացիաների թվի մեծացման աղբյուր է[26]։
Նուկլեոտիդների այլ ձևափոխությունների թվին են պատկանում ադենինի մեթիլացումը բակտերիաների մոտ և ուրացիլի գլիկոզիլացումը կինետոպլաստներում «J-հիմքերի» առաջացմամբ[27]։
ԴՆԹ-ի վնասվածքներ[խմբագրել | խմբագրել կոդը]

ԴՆԹ-ն կարող է վնասվել տարբեր մուտագենների ազդեցությամբ, որոնցից են օքսիդացնող և ալկիլացնող միացությունները, ինչպես նաև իոնացնող ճառագայթումը՝ ուլտրամանուշակագույն և ռենտգենյան ճառագայթումը։ ԴՆԹ-ի վնասման տեսակը կախված է մուտագենի տիպից։ Օրինակ՝ ուլտրամանուշակագույն ճառագայթումը ԴՆԹ-ն վնասում է դիմեր թիմինների առաջացմամբ, որոնք ի հայտ են գալիս հանդիպակաց հիմքերի միջև ձևավորվող կովալենտ կապերի արդյունքում[29]։
Ազատ ռադիկալները և ջրածնի պերօքսիդը, որոնք օքսիդանտներ են, առաջ են բերում ԴՆԹ-ի մի քանի տեսակի վնասվածքներ՝ հիմքերի հատկապես գուանոզինի ձևափոխություններ, ինչպես նաև ԴՆԹ-ում երկու շղթաների խզումներ[30]։ Որոշ տվյալների համաձայն մարդու յուրաքանչյուր բջջում ամեն օր օքսիդացնող միացությունների ազդեցությամբ վնասվում են շուրջ 500 նուկլեոտիդներ[31][32]։ Վնասվածքներից առավել վտանգավոր են երկու շղթաների խզումները, քանի որ դրանք դժվար են վերականգնվում ռեպարացիայի միջոցով և կարող են պատճառ հանդիսանալ քրոմոսոմի հատվածների կորստին՝ դելեցիայի և տրանսլոկացիայի։
Մուտագենների շատ մոլեկուլներ ներդրվում են (ինտերկալացվում) երկու շղթաների միջև։ Այս միացությունների մեծ մասն ունեն արոմատիկ օղակ։ Ինտերկալացվող միացությունները խախտում են կրկնակի պարույրը, խզում երկու շղթաների միջև գոյություն ունեցող կապերը։ Այս փոփոխություններն առաջ են բերում ԴՆԹ-ի տրանսկրիպցիայի և ռեպլիկացիայի խախտումներ և պատճառ հանդիսանում մուտացիաների։ Ինտերկալացվող միացությունները հաճախ կանցերոգեններ են, որոնցից ամենից հայտնի են բենզոպիրենը, ակրիդինը, աֆլատոքսինը և էտիդիումը[33][34][35]։ Այս միացություններն օգտագործվում են բժշկության մեջ՝ քիմիոթերապիայում քաղցկեղի արագ աճող բջիջների ճնշման համար[36]։
Գերպարուրվածություն[խմբագրել | խմբագրել կոդը]
Եթե բռնենք պարանի երկու ծայրերից և սկսենք ձգել տարբեր կողմեր, պարանը կկարճանա և պարանի վրա կառաջանա գերպարուրված հատված։ Հենց նույն կերպ էլ ԴՆԹ-ն կարող է գերպարուրված դառնալ։ Նորմալ պայմաններում ԴՆԹ-ի շղթայի 1 պտույտի երկարությունը 10,4 հիմք է, բայց գերպարուրված վիճակներում այդ թիվը կարող է ավելի փոքրանալ[37]։
Տարբերում են գերպարուրվածության երկու տեսակ՝ դրական՝ նորմալ պարույրների ուղղությամբ, որի դեպքում պարույրներն ավելի խիտ են դասավորված և բացասական, երբ պարույրները հակառակ են։ Բնության մեջ ԴՆԹ-ի մոլեկուլները հաճախ գտնվում են հակառակ գերպարուրված վիճակներում՝ ԴՆԹ-ի տրանսկրիպցիայի և ռեպլիկացիայի ժամանակ։ Տոպոիզոմերազները հատուկ ֆերմենտներն են, որոնք ուղղում են ԴՆԹ-ի այդպիսի գերպարուրված վիճակները[38]։

Քրոմոսոմի ծայրային կառույցներ[խմբագրել | խմբագրել կոդը]
Գծաձև քրոմոսոմների ծայրերում գտնվում են ԴՆԹ-ի հատուկ մասնագիտացած կառույցներ (թելոմերներ)։ Այդ հատվածների հիմնական նշանակությունը քրոմոսոմների ամբողջականության պահպանումն է[40], ԴՆԹ-ի ծայրերի պաշտպանումը էնդոնուկլեազների ազդեցությունից և ռեպարացիայի համակարգի ակտիվացման արգելակումը[41]։ Քանի որ սովորական ԴՆԹ պոլիմերազները չեն կարողանում կրկնապատկել քրոմոսոմների 3' ծայրերը դա իրականացնում են հատուկ ֆերմենտներ՝ թելոմերազներ։
Մարդու բջիջներում թելոմերները հաճախ ներկայացված են միաշղթա ԴՆԹ-ի հատվածներով, և կազմված են մի քանի հազար կրկնվող TTAGGG նուկլեոտիդային հաջորդականություններից[42]։ Այս հաջորդականությունները մեծ քանակով գուանինի պարունակության շնորհիվ կայունացնում են քրոմոսոմի ծայրային հատվածները՝ առաջացնելով G-կվադրուպլեքսներ կոչվող կառույցներ։ 4 գուանինային հիմքերը, որոնց բոլոր ատոմները գտնվում են նույն հարթության վրա, առաջացնում են թիթեղիկ, որը պահպանվում է հիմքերի միջև գոյություն ունեցող ջրածնական կապերի և նրանց կենտրոնում հելանտացվող մետաղի իոնի (հիմնականում կալիում) շնորհիվ։ Այս թիթեղիկները մետաղադրամների պես դասավորվում են մեկը մյուսի վրա[43]։
Քրոմոսոմների ծայրերին կարող են առաջանալ նաև այլ կառույցներ. հիմքերը կարող են դասավորվել մեկ շղթայով կամ էլ տարբեր զուգահեռ շղթաներով։ Թելոմերները առաջացնում են նաև հանգույցաձև կառույցներ, որոնք անվանվում են T-հանգույցներ կամ թելոմերային հանգույցներ[44]։ T-հանգույցի ծայրում միաշղթա թելոմերային ԴՆԹ-ն միանում է երկշղթա ԴՆԹ-ին՝ առաջացնելով եռաշղթա գոյացություններ, որոնք անվանվում են D-հանգույցներ (անգլ.՝ displacement loop)[43]։
Բակտերիալ և վիրուսային ԴՆԹ[խմբագրել | խմբագրել կոդը]
Պրոկարիոտ բջիջների մոտ երկպարույր ԴՆԹ-ն ունի ոչ թե սկիզբ և վերջ ունեցող գծային մոլեկուլների, այլ շրջանաձև մեկ մոլեկուլի տեսք, որի յուրաքանչյուր շղթաները վերջում 3', 5' ծայրերով միանում են իրար։ Այս երկու շղթաներն անվանվում են բակտերիալ քրոմոսոմներ կամ պլազմիդներ, որոնք տեղադրված չեն բջջակորիզում, այլ գտնվում են անմիջապես ցիտոպլազմայում։ Պրոկարիոտների ԴՆԹ-ի գերպարուրվածությունը շտկվում է տոպոիզոմերազի և գիրազի միջոցով։ Վիրուսները պարունակում են ԴՆԹ կամ ՌՆԹ, ըստ որի դասակարգվում են ԴՆԹ և ՌՆԹ վիրուսներ։ Ինչպես ՌՆԹ, այնպես էլ ԴՆԹ վիրուսների մոտ նուկլեինաթթուն պաշտպանված է սպիտակուցների մոլեկուլներով։
Կենսաբանական նշանակություն[խմբագրել | խմբագրել կոդը]
ԴՆԹ-ն գենետիկական ինֆորմացիայի կրողն է, որը ծածկագրված է նուկլեոտիդային հաջորդականության՝ գենետիկական ծածկագրի միջոցով։ ԴՆԹ-ի մոլեկուլի հետ է կապված կենդանի օրգանիզմների երկու կարևոր հատկություն՝ ժառանգականությունը և փոփոխականությունը։ ԴՆԹ-ի ռեպլիկացիայի ընթացքում առաջանում է մայրական շղթայի երկու կրկնօրինակ, որոնք ժառանգվում են դուստր բջիջների կողմից՝ բջջի բաժանման ժամանակ։ Այսպիսով, առաջացած երկու բջիջները մայրական բջջի գենետիկական կրկնօրինակներն են։
Գենետիկական ինֆորմացիան արտահայտվում է գեների էքսպրեսիայի ընթացքում տրանսկրիպցիայի և տրանսլյացիայի պրոցեսների ընթացքում։ Նուկլեոտիդների հաջորդականությունը «կոդավորում է» տարբեր տեսակի ՌՆԹ-ների մասին տեղեկատվություն՝
- ինֆորմացիոն կամ մատրիցային ՌՆԹ (ի-ՌՆԹ կամ մՌՆԹ) - պարունակում է տեղեկատվություն սպիտակուցում ամինաթթուների դասավորության մասին
- ռիբոսոմային ՌՆԹ (ռ-ՌՆԹ) - ռիբոսոմների հիմքն են հանդիսանում
- փոխադրող ՌՆԹ (փ-ՌՆԹ) - տեղափոխում է ամինաթթուները դեպի սպիտակուցների սինթեզի շրջան՝ ռիբոսոմի ակտիվ կենտրոն։
Գենոմի կառուցվածք[խմբագրել | խմբագրել կոդը]

Բնության մեջ հանդիպող ԴՆԹ-ների ճնշող մեծամասնությունը երկշղթա են և գծաձև (էուկարիոտներ, որոշ վիրուսներ և առանձին բակտերիաներ) կամ օղակաձև (պրոկարիոտներ, քլորոպաստներ և միտոքոնդրիումներ)։ Միաշղթա գծաձև ԴՆԹ են պարունակում որոշ վիրուսներ և բակտերիոֆագեր։ In vivo ԴՆԹ-ի մոլեկուլները գնտվում են փաթեթավորված և կոնդենսացված վիճակում[45]։ Էուկարիոտների բջջում ԴՆԹ-ն գտնվում է մեծ մասամբ կորիզում՝ քրոմոսոմների հավաքակազմի տեսքով։ Բակտերիալ ԴՆԹ հաճախ ներկայացված է մեկ օղակաձև ԴՆԹ-ի մոլեկուլով, որը տեղակայված է ցիտոպլազմայում և անվանվում է նուլեոտիդ[46]։
Գենոմի գենետիկական ինֆորմացիան կազմված է գեներից։ Գենը ժառանգական տեղեկատվության միավորն է, այն տրանսկրիպցվում է, ազդում է օրգանիզմի որևէ հատկանիշի վրա, պարունակում է տեղեկատվություն սպիտակուցի առաջնային կառուցվածքի մասին, ինչպես նաև կարգավորիչ հաջորդականություններ՝ պրոմոտորներ, էնհանսերներ, որոնք կարգավորում են ծածկագրող հատվածի էքսպրեսիան։
Շատ տեսակների մոտ գենոմի միայն շատ քիչ հատվածն է կոդավորում սպիտակուցներ։ Այսպես օրինակ, մարդու գենոմի միայն 1,5 %-ն է կազմված սպիտակուց ծածկագրող էկզոններից, իսկ 50 %-ից ավելին կազմված է չծածկագրող ԴՆԹ-ի կրկնվող հաջորդականություններից[47]։ Էուկարիոտների գենոմում մեծ քանակով չծածկագրող հաջորդականությունների առկայության և գենոմի հսկայական չափերի (համեմատած պրոկարիոտների հետ) պատճառը (C-արժեք) դեռևս չբացահայտված գիտական առեղծվածներից մեկն է[47]։ Գենոմում հայտնաբերված են նաև մեծ թվով վիրուսային հաջորդականություններ։
Գենոմի սպիտակուց չծածկագրող հաջորդականություններ[խմբագրել | խմբագրել կոդը]
Ներկայումս գոյություն ունեն շատ տվյալներ, որոնք կասկածի տակ են առնում ԴՆԹ-ի անպետք հատվածների («թափոնային ԴՆԹ» (անգլ.՝ junk DNA)) առկայության փաստը։
Թելոմերները և ցենտրոմերները պարունակում են քիչ թվով գեներ, սակայն նրանք մեծ նշանակություն ունեն գեների ակտիվության և կայունացման գործում[41][48]։ Հաճախ հանդիպում են նաև մարդու գենոմի չծածկագրող հաջորդականություններ՝ պսևդոգեներ, որոնք մուտացիայի արդյունքում ինակտիվացված գեներ են[49]։ Այդ հաջորդականություններն իրենցից ներկայացնում են «մոլեկուլային բրածոներ», չնայած դրանք կարող են հանդիսանալ նաև դուպլիկացիայի և դիվերգենցիայի սկզբնական նյութը[50]։
Օրգանիզմում սպիտակուցների բազմազանության մյուս աղբյուրը սփլայսինգի ժամանակ ինտրոնների օգտագործումն է որպես «կտրման և սոսնձման հատվածներ»[51]։
Հարկ է նշել, որ չծածկագրող հատվածները կարող են ինֆորմացիա պարունակել լրացուցիչ բջջային ՌՆԹ-ների մասին (օրինակ՝ կարճ կորիզային ՌՆԹ-ներ)[52]։
Մարդու տրանսկրիպցիայի՝ վերջերս կատարված հետազոտությունները ցույց են տվել, որ գենոմի միայն 10 %-ն է սկիզբ տալիս պոլիադելինացված ՌՆԹ-ներին[53], իսկ մկների մոտ այս թիվը 62 % է[54]։
Տրանսկրիպցիա և տրանսլյացիա[խմբագրել | խմբագրել կոդը]

ԴՆԹ-ում ծածկագրված գենետիկական տեղեկատվությունը պետք է ինչ-որ կերպ կարդացվի և արտահայտվի բջջի կազմության մեջ մտնող կենսապոլիմերների սինթեզով։ ԴՆԹ-ի շղթաների նուկլեոտիդների հաջորդականությունն ուղղակիորեն որոշում է ՌՆԹ-ում նուկլեոտիդների հաջորդականությունը։ Վերջինս «արտագրվում է» ԴՆԹ-ի կաղապարի հիման վրա՝ տրանսկրիպցիայի ընթացքում։ ի-ՌՆԹ-ի դեպքում նուկլեոտիդների հաջորդականությունը որոշում է ամինաթթուների հաջորդականությունը։ ԻՌՆԹ-ում հիմքերի և սպիտակուցում ամինաթթուների հաջորդականությունների միջև եղած փոխհարաբերությունը որոշվում է տրանսլյացիայի կանոններով, որոնք անվանվում են գենետիկական ծածկագիր։ Գենետիկական ծածկագիրը կազմված է 3 տառերից՝ կոդոններից, որոնք կազմված են 3 նուկլեոտիդից (օրինակ՝ ACU CAG UUU և այլն)։
Տրանսկրիպցիայի ժամանակ գենի նուկլեոտիդները արտագրվում են սինթեզվող ՌՆԹ-ի վրա ՌՆԹ պոլիմերազի միջոցով։ ԻՌՆԹ-ի դեպքում այս հաջորդականությունը կարդացվում է ռիբոսոմի միջոցով, որը կարդում է ծածկագիրը և ապահովում իՌՆԹ-ի և ամինաթթուներին միացած փՌՆԹ-ի միջև կապերի առաջացումը։ Եռանիշ կոդի ծածկագրման համար օգտագործվում են 4 տարբեր նուլկեոտիդներ, այսինքն՝ հնարավոր է 64 տարբեր զուգորդություններ (4³ կոմբինացիաներ)։ 64 կոդոններից 20-ը կոդավորվում է ամինաթթուների կողմից, որոնցից յուրաքանչյուրը կարող է ծածկագրվել մեկից ավելի անգամ։ ԻՌՆԹ-ի ծայրում գտնվող որոշ կոդոններ ցույց են տալիս սպիտակուցի ավարտը և անվանվում են «ստոպ կոդոններ»՝ UAA, UGA, UAG։
Ռեպլիկացիա[խմբագրել | խմբագրել կոդը]
Բջիջների բաժանումն անհրաժեշտ է միաբջիջ օրգանիզմների բազմացման և բազմաբջիջ օրգանիզմների աճման համար, բայց մինչ բջջի բաժանումը անհրաժեշտ է, որ կրկնապատկվի գենոմը, որպեսզի յուրաքանչյուր դուստր բջիջ պարունակի մայրական բջջին հատուկ գենետիկական ինֆորմացիան։ ԴՆԹ-ի կրկնապատկման մի քանի հնարավոր եղանակներից իրականանում է պոլիկոնսերվատիվ ուղին։ Երկու շղթաներն առանձնանում են և ապա յուրաքանչյուր շղթայի դիմաց ԴՆԹ պոլիմերազի օգնությամբ տեղի է ունենում կոմպլիմենտար շղթաների սինթեզը։ ԴՆԹ պոլիմերազը չի կարող ստեղծել նոր շղթա, այլ միայն երկարացնել արդեն գոյություն ունեցողները. այս պատճառով անհրաժեշտ են ԴՆԹ-ի կարճ հատվածներ (պրայմերներ), որոնք ամենասկզբում կմիանան շղթային, և ապա նոր ԴՆԹ պոլիմերազը կսկսի երկարացնել պոլինուկլեոտիդային շղթան։ Պրայմերների ստեղծումն իրականացվում է պրայմազա ֆերմենտի օգնությամբ։ ԴՆԹ պոլիմերազը շղթան կառուցում է միայն 5' --> 3' ուղղությամբ, այս պատճառով հակառակ շղթայի սինթեզի համար գործում են տարբեր մեխանիզմներ[55]։
Սպիտակուցների հետ փոխհարաբերություն[խմբագրել | խմբագրել կոդը]
ԴՆԹ-ի բոլոր ֆունկցիաները կապված են սպիտակուցների հետ փոխհարաբերություններից։ Այս փոխհարաբերւթյունները կարող են լինել ոչ յուրահատուկ, երբ սպիտակուցը միանում է ԴՆԹ-ի ցանկացած մոլեկուլին և յուրահատուկ՝ կախված որոշակի հաջորդականությունների առկայությունից։ Ֆերմենտները նույնպես կարող են փոխազդեցության մեջ մտնել ԴՆԹ-ի հետ. դրանցից առավել կարևոր են ՌՆԹ-պոլիմերազները, որոնք իրականացնում են ԴՆԹ-ի մատրիքսի հիման վրա ՌՆԹ-ի սինթեզը։
Կառուցվածքային և կարգավորիչ սպիտակուցներ[խմբագրել | խմբագրել կոդը]
ԴՆԹ-ի մոլեկուլը ոչ յուրահատուկ փոխհարաբերություններ է առաջացնում կառուցվածքային սպիտակուցների հետ։ Բջջում ԴՆԹ-ն կապված է այս սպիտակուցների հետ, որոնց միջոցով էլ փաթեթավորվում է և ձևավորում քրոմատինը։ Էուկարիոտների մոտ քրոմատինը ձևավորվում է հատուկ սպիտակուցների՝ հիստոնների մասնակցությամբ, պորկարիոտների ավելի թույլ փաթեթավորված քրոմատինը պարունակում է հիստոն հիշեցնող սպիտակուցներ[56][57]։
Հիստոններն առաջացնում են սկավառակաձև սպիտակուցային կառույց՝ նուկլեոսոմ, որոնց յուրաքանչյուրի շուրջը ԴՆԹ-ն կատարում է 2 պտույտ։ ԴՆԹ-ի և հիստոնների միջև ոչ յուրահատուկ փոխազդեցություններն առաջանում են իոնային կապերի շնորհիվ[58]։
Հիստոնների և ԴՆԹ-ի միջև փոխազդեցությունն ազդում է տարբեր տրանսկրիպցիոն ֆակտորների համար գեների հասանելիության վրա և փոփոխում տրանսկրիպցիայի արագությունը[59][60]։
Քրոմատինի մյուս ոչ յուրահատուկ սպիտակուցները (ոչ հիստոնային սպիտակուցներ) ունեն բարձր շարժունություն[61] և մասնակցում են քրոմատինի ավելի բարձր փաթեթավորման մակարդակների ստեղծմանը[62]։
Որոշ ոչ յուրահատուկ սպիտակուցների ֆունկցիան կապված է միաշղթա ԴՆԹ-ի կայունացման հետ։ Օրինակ՝ ռեպլիկացիոն A սպիտակուցը, առանց որի անհնար է ռեպլիկացիայի և ռեպարացիայի ընթացքը, քանի որ այն կայունացնում է միաշղթա ԴՆԹ-ն[63]։
Գոյություն ունեն նաև այնպիսի սպիտակուցներ, որոնք միանում են ԴՆԹ-ի միայն որոշակի հաջորդականություններին։ Այս սպիտակուցները առավելապես ունեն կարգավորիչ նշանակություն։ Առավել լավ ուսումնասիրված են տրանսկրիպցիոն ֆակտորները, որոնցից յուրաքանչյուրը ճանաչում է իր հաջորդականությունը պրոմոտորում և ճնշում կամ խթանում տրանսկրիպցիայի պրոցեսը[64]։
ԴՆԹ-ն ձևափոխող ֆերմենտներ[խմբագրել | խմբագրել կոդը]

Տոպոիզոմերազներ և հելիկազներ[խմբագրել | խմբագրել կոդը]
Բջջում ԴՆԹ-ն գտնվում է փաթեթավորված և գերպարուրված վիճակում։ Կենսագործունեության համար անհրաժեշտ պրոցեսների իրականացման համար ԴՆԹ-ն պետք է ապապարուրվի, որն էլ իրականանում է 2 ֆերմենտների՝ տոպոիզոմերազների և հելիկազների միջոցով։
Տոպոիզոմերազներն ունեն նուկլեազային և լիգազային ակտիվություն։ Նրանք փոփոխում են ԴՆԹ-ի գերպարուրված վիճակները՝ մեկ կամ երկու շղթայի խզման միջոցով[65]։
Տոպոիզոմերազներն անհրաժեշտ են շատ պրոցեսների այդ թվում ռեպլիկացիայի և տրանսկրիպցիայի համար։ Հելիկազները մոլեկուլային շարժիչներ համարվող սպիտակուցներ են։ Այս ֆերմենտներն օգտագործում են նուկլեոտիդֆոսֆատների և ավելի հաճախ ադենոզինեռֆոսֆատների (ԱԵՖ) քիմիական էներգիան և խզում ԴՆԹ-ի երկու շղթաների միջև գոյություն ունեցող ջրածնական կապերը[66]։
Նուկլեազներ և լիգազներ[խմբագրել | խմբագրել կոդը]
ԴՆԹ-ի ռեկոմբինացիայի կամ ռեպարացիայի պրոցեսներին մասնակցում են այնպիսի ֆերմենտներ, որոնք կարող են կտրել և ապա վերականգնել ԴՆԹ-ի շղթան։ ԴՆԹ-ն քայքայող ֆերմենտներն անվանվում են նուկլեազներ։ Տարբերում են 2 տեսակի նուկլեազներ՝ էկզոնուկլեազներ, որոնք հիդրոլիզում են ԴՆԹ-ի մոլեկուլի ծայրերին գտնվող նուլեոտիդները և էնդոնուկլեազներ, որոնք ԴՆԹ-ի շղթան խզում են միջին հատվածներում։ Լիգազները ԴՆԹ-ի շղթայի խզված տարբեր հատվածները միմյանց «սոսնձող» ֆերմենտներն են։
Պոլիմերազներ[խմբագրել | խմբագրել կոդը]
Պոլինուկլեոտիդային շղթան սինթեզող ֆերմենտներն անվանվում են պոլիմերազներ։ Այս ֆերմենտները նուկլեոտիդները միացնում են շղթային 3' ծայրի հիդրօքսիլ (OH) խմբին՝ 5' --> 3' ուղղությամբ[67]։ Տարբերում են մի քանի տեսակի պոլիմերազներ։ ԴՆԹ-ի ռեպլիկացիային մասնակցում է ԴՆԹ-կախյալ ԴՆԹ-պոլիմերազը։ Բացի նուկլեոտիդային շղթայի սինթեզից, շատ պոլիմերազներ ունեն նաև ռեպարացիոն հատկություններ և կարողանում են ուղղել սխալ ռեպլիկացված նուկլեոտիդները։ Օրգանիզմների մեծամասնության մոտ ԴՆԹ-պոլիմերազները գործում են ընդհանուր կոմպլեքսի՝ ռեպլիսոմայի տեսքով, որը պարունակում է բազմաթիվ լրացուցիչ ենթամիավորներ, ինչպիսին օրինակ հելիկազներն են[68]։ ՌՆԹ-կախյալ ԴՆԹ-պոլիմերազները պոլիմերազների հատուկ տեսակ են, որոնք ՌՆԹ-ի մատրիքսի վրա սինթեզում են ԴՆԹ։ Այս ֆերմենտը հանդիպում է հակառակ տրանսկրիպտող վիրուսների մոտ։ Այս ֆերմենտների դասին է պատկանում նաև թելոմերազը[69]։
Տրանսկրիպցիայի գործընթացն իրականանում է ԴՆԹ-կախյալ ՌՆԹ-պոլիմերազի միջոցով, որը ԴՆԹ-ի կաղապարի հիման վրա սինթեզում է ՌՆԹ[70]։
Գենետիկական ռեկոմբինացիա[խմբագրել | խմբագրել կոդը]

|

|

ԴՆԹ-ի երկպարույրը սովորաբար փոխհարաբերության մեջ չի մտնում ԴՆԹ-ի այլ հատվածների հետ. մարդու բջիջներում քրոմոսոմները ֆիզիկապես առանձնացված են մեկը մյուսից[72]։ Քրոմոսոմների այսպիսի մեկուսացումը կարևոր է ԴՆԹ-ի ֆունկցիոնալ ակտիվության պահպանման համար։ Քրոմոսոմների փոխհարաբերության հազվադեպ եղանակներից է կրոսինգովերը, որի ընթացքում տեղի է ունենում գենետիկական ռեկոմբինացիա։ Կրոսինգովերի ժամանակ տեղի է ունենում 2 ԴՆԹ-ի երկպարույրների խզում, մասերի փոխանակում և ապա վերամիավորում։
Ռեկոմբինացիան թույլ է տալիս փոխանակել գենետիկական տեղեկատվությունը և ստանալ գեների նոր համակցություններ, որը բարձրացնում է բնական ընտրության արդյունավետությունը և կարող է կարևոր դեր խաղալ նոր սպիտակուցների արագ էվոլյուցիայում[73]։ Գենետիկական ռեկոմբինացիան կարող է որոշակի դեր խաղալ նաև ԴՆԹ-ի ռեպարացիայում, հատկապես շղթայի կրկնակի խզումների հանդեպ բջջի պատասխանի իրականացման գործում[74]։
Կրոսինգովերի ամենատարածված եղանակը հանդիպում է հոմոլոգ քրոմոսոմների ռեկոմբինացիայում, երբ երկու հոմոլոգ քրոմոսոմներ փոխանակում են շատ նման հաջորդականություններ։ Ոչ հոմոլոգ քրոմոսոմների կրոսինգովերը, կարող է վնասել բջիջները, քանի որ դրա արդյունքում կարող են առաջանալ գենետիկական անոմալիաներ և քրոմոսոմների տրանսլոկացիաներ։ Ռեկոմբինացիայի գործընթացը կատալիզում են ռեկոմբինազ ֆերմենտները, որոնցից է օրինակ՝ RAD51-ը[75]։
Ռեկոմբինացիան սկսվում է ԴՆԹ-ի երկպարույրի կրկնակի խզմամբ, որն իրականացնում են էնդոնուկլեազները[76]։ Ռեկոմբինազն այնուհետև միացնում է երկու պարույրներն այնպես, որ առաջանում է խաչաձև մի կառույց, որն անվանում են Հոլիդեյի միացում (անգլ.՝ Holiday junction)։ Վերջում տեղի է ունենում Հոլիդեյի միացման վերադասավորություն, ԴՆԹ-ի երկպարույրների վերականգնում[77]։
Էվոլյուցիա[խմբագրել | խմբագրել կոդը]

ԴՆԹ-ն պարունակում է գենետիկական տեղեկատվություն, որը թույլ է տալիս կենդանի օրգանիզմներին աճել, բազմանալ և իրականացնել իրենց կենսագործունեությունը։ Չնայած այս ամենին, դեռևս պարզ չէ, թե ինչպես է կյանքի գոյության 4 միլիարդ տարիների ընթացքում ԴՆԹ-ն ձեռք բերել այս ֆունկցիան։ Ենթադրություններ կան, որ կյանքի ամենավաղ փուլերում, գենետիկական տեղեկատվության պահպանման համար օգտագործել են ՌՆԹ-ի մոլեկուլները[78][79]։ ՌՆԹ-ն առաջին բջիջների նյութափոխանակության գործում, հնարավոր է, ունեցել է կենտրոնական դեր, քանի որ այն կարող է պահպանել տեղեկատվությունը և միաժամանակ ցուցաբերել ֆերմենտատիվ ակտիվություն՝ հանդես գալով որպես ռիբոզիմ[80]։ Հենց այսպիսի ՌՆԹ կյանքն էլ, որտեղ ՌՆԹ-ն կարող էր օգտագործվել ինչպես ժառանգականության, այնպես էլ կատալիզի գործընթացներում, հնարավոր է, որ էվոլյուցիայի ընթացքում ազդել է 4 նուկլեոտիդներով գենետիկական ծածկագրի գաղտնագրման վրա[81]։ Նուկլեոտիդների թիվը չորսն է, քանի որ պետք է որ փոխզիջում առաջանար գաղտնագրող նուկլեոտիդների (որոնք 4-ն են) և ռիբոզիմների կատալիտիկ ակտիվություն ունեցող մյուս նուկլեոտիդների միջև[82]։
ՌՆԹ-ի աշխարհի կյանքի գոյության ուղղակի ապացույցներ գոյություն չունեն, քանի որ բրածո մնացորդների մեծամասնությունից ԴՆԹ-ի վերականգնումն անհնար է, և ոչ մի հնագույն գենետիկական համակարգ չի հասել մինչև մեր օրերը։ ԴՆԹ-ն շրջակա միջավայրում պահպանվում է միջինում 1 միլիոն տարի, որից հետո այն դեգրադացվում է՝ առաջացնելով կարճ հատվածներ։ ԴՆԹ-ի առանձնացումը և 250 միլիոն տարի առաջ աղի բյուրեղներում բակտերիալ սպորների 16S ռՌՆԹ-ի գեների որոշումը[83] գիտական լուրջ քննարկման աղբյուր է, որը, սակայն, շատ հակասական է[84][85]։
2011 թվականի օգոստոսի 8-ին ՆԱՍԱ-ի կողմից երկրի վրա ընկած երկնաքարերի ուսումնասիրության արդյունքում ենթադրվել է, որ ԴՆԹ-ի նուկլեոտիդները (ադենին, գուանին և նման օրգանական մոլեկուլներ), հնարավոր է, ունեցել են ոչ երկրային ծագում[86][87][88]։
Կիրառությունը տեխնոլոգիայում[խմբագրել | խմբագրել կոդը]
Գենետիկական ինժեներիա[խմբագրել | խմբագրել կոդը]

Տարբեր օրգանիզմների ԴՆԹ-ի առանձնացման և ձևափոխման համար մշակվել են տարբեր մեթոդներ։ ԴՆԹ-ի առանձնացման մեթոդներից է ֆենոլ-քլորոֆորմային էքստրակցիան, իսկ ձևափոխման մեթոդներից է ռեստրիկտազներով ճեղքումը կամ պոլիմերազային շղթայական ռեակցիան։ Ժամանակակից կենսաբանությունն ու կենսաքիմիան այս մեթոդներն ինստենսիվորեն կիրառում են ռեկոմբինանտային ԴՆԹ-ի տեխնոլոգիայում։ Ռեկոմբինանտային ԴՆԹ-ն մարդու կողմից ստեղծված ԴՆԹ-ի հաջորդականություն է, որը հավաքվել է ԴՆԹ-ի այլ հատվածներից։ Ռեկոմբինանտային ԴՆԹ-ն կարող են օրգանիզմ տեղափոխել պլազմիդների կամ վիրուսային վեկտորների օգնությամբ[89]։ Գենետիկորեն ձևափոխված օրգանիզմների արտադրությունը օգնում է ստեղծել այնպիսի արտադրանքներ, ինչպիսիք են ռեկոմբինանտային սպիտակուցները, որոնք կիրառվում են բժշկական հետազոտություններում[90] և գյուղատնտեսության մեջ[91][92]։
Դատաբժշկություն[խմբագրել | խմբագրել կոդը]

Դատաբժշկության մեջ ԴՆԹ-ն կիրառվում է դեպքի վայրում գտնված արյան, սերմնահեղուկի, մաշկի, թքի և մազի հետքերի մեջ պարունակվող ԴՆԹ-ի և մեղադրյալի ԴՆԹ-ի հետ համապատասխանության միջոցով մեղադրյալին նույնականացնելու նպատակով։ Այս երևույթը անվանվում է ԴՆԹ պրոֆիլացում, հաճախ նաև՝ գենետիկական դրոշմավորում։ ԴՆԹ պրոֆիլացման մեջ համեմատվում են ԴՆԹ-ի տարբեր կրկնվող հաջորդականություններ, ինչպիսիք են կարճ տանդեմային կրկնությունները (անգլ.՝ short tandem repeats) և մինիարբանյակները։ Այս մեթոդը ԴՆԹ-ի համապատասխանող հաջորդականությունները որոշելու համար սովորաբար չափազանց հավաստի է[93]։ Նույնականացումը կարող է բարդ լինել, եթե դեպքի վայրում հայտնաբերվել են մի քանի անձանց ԴՆԹ-ի հետքեր[94]։ ԴՆԹ պրոֆիլացումը զարգացրել է բրիտանացի գենետիկ Ալեք Ջեֆերեյսը 1984 թվականին և առաջին անգամ օգտագործվել դատաբժշկության մեջ՝ Էնդրբայի սպանությունների ժամանակ Քոլին Պիտչֆորքին մեղադրելու նպատակով[95]։
Դատաբժշկության զարգացումը և արյան, մաշկի, թքի ու մազերի հետքերով անձանց նույնականացումը թույլ է տվել վերանայել մի շարք դատական գործեր։ Կրկնակի մեղադրման օրենքի (անգլ.՝ Double jeopardy) վերացումը մի շարք երկրներում թույլ կտա վերանայել և վերաբացել մի շարք դատական գործեր, որոնց դատական գործընթացները ձախողվել են անբավարար փաստերի առկայության պատճառով։ Ծանր հանցագործություններում մեղադրվող անձանցից պահանջվում է ԴՆԹ-ի օրինակներ՝ նույնականացման համար[96]։ ԴՆԹ պրոֆիլացումն օգտագործվում է նաև մասսայական պատահարների զոհերին, ինչպես նաև ծանր պատահարների ժամանակ մարմնի կամ օրգանների հատվածները նույնականացնելու համար։

ԴՆԹ նանոտեխնոլոգիա[խմբագրել | խմբագրել կոդը]
ԴՆԹ նանոտեխնոլոգիան օգտագործում է ԴՆԹ-ի և այլ նուկլեինաթթուների յուրահատուկ մոլեկուլային ճանաչման մեխանիզմները՝ ինքնակազմավորվող օգտակար հատկանիշներով ԴՆԹ կոմպլեքսներ ստանալու համար[97]։ Այս դեպքում ԴՆԹ-ն օգտագործվում է որպես կառուցվածքային նյութ, այլ ոչ թե որպես կենսաբանական ինֆորմացիայի կրող։ Սրա միջոցով հաջողվել է ստեղծել երկչափ պարբերական ցանցեր, ինչպես նաև եռաչափ բազմանկյունի տեսք ունեցող կառույցներ[98]։ Նանոմեխանիկական սարքերը և ալգորիթմային ինքնակազմավորումը նույնպես ուսումնասիրվել է[99]։ Այս ԴՆԹ կառույցները օգտագործվել են այլ մոլեկուլների, օրինակ՝ ոսկու նանոմասնիկների և ստրեպտավիդինի դասավորությունը պարզելու նպատակով[100]։
Կենսինֆորմատիկա[խմբագրել | խմբագրել կոդը]
Կենսինֆորմատիկան ուսումնասիրում է կենսաբանական տեղեկատվության ձևափոխումը, հետազոտումը, ԴՆԹ-ի հաջորդականությունները։ ԴՆԹ-ի պահպանման, ուսումնասիրման համար հաջողությամբ օգտագործվել են համակարգչային գիտության, սարքերի ուսուցման, տվյալների շտերմարանների բնագավառների փորձը[101]։ Հաջորդականությունների փնտրման կամ համապատասխանող ալգորիթմների միջոցով իրականացվում է որոշակի հսկայական հաջորդականությունների շարքում նուկլեոտիդների փնտրում[102]։ ԴՆԹ-ի ուսումնասիրվող հաջորդականությունը կարող է համեմատվել ԴՆԹ-ի այլ հաջորդականության հետ՝ հոմոլոգ հատվածները և յուրահատուկ մուտացիաների տեղադրությունը պարզելու նպատակով։ Այս մեթոդները, հատկապես հաջորդականությունների դիրքի պարզումը, օգտագործվում են ֆիլոգենետիկ հարաբերությունները և սպիտակուցների ֆունկցիան պարզելու նպատակով[103]։ ԴՆԹ-ի այն հաջորդականությունները, որոնք կապված են որոշակի սպիտակուցների և ՌՆԹ-ներ գաղտնագրող գեների հետ կարող են նույնականացվել գեն փնտրող ալգորիթմների հետ, որը հետազոտողներին թույլ է տալիս որոշել որոշակի գենի արտադրանքի առկայությունը և նրանց դերը նույնիսկ օրգանիզմից դրանց մեկուսացնելուց առաջ[104]։ Ամբողջական գենոմները նույնպես կարող են համեմատվել, որը լույս է սփռում տվյալ օրգանիզմի էվոլյուցիոն պատմության վրա և թույլատրում էվոլյուցիոն գործընթացների մի ամբողջական համալիրի ուսումնասիրությունը։
Պատմություն և մարդաբանություն[խմբագրել | խմբագրել կոդը]

Քանի ԴՆԹ-ում ժամանակի ընթացքում կուտակվում են ժառանգվող մուտացիաներ, այն պարունակում է պատմական տեղեկատվություն և ԴՆԹ-ի հաջորդականություններն ուսումնասիրելիս գենետիկները կարող են եզրակացնել օրգանիզմների ֆիլոգենեզի՝ նրանց էվոլյուցիոն զարգացման մասին[105]։ Ֆիլոգենետիկայի այս ուղղությունն էվոլյուցիոն կենսաբանության կարևոր գործիքներից մեկն է։ Եթե համեմատվում են տեսակի ներսում ԴՆԹ-ի հաջորդականությունների փոփոխությունները, պոպուլյացիոն գենետիկները կարող են պարզել որոշակի պոպուլյացիաների պատմությունը։ Սա օգտագործվում է էկոլոգիական գենետիկայում և մարդաբանության մեջ։ Օրինակ, այս մեթոդով են նույնականացվել Իսրայելի տասը կորած տոհմերը[106][107]։
ԴՆԹ-ն օգտագործվել է նաև ժամանակակից ընտանիքների հարաբերություններն ուսումնասիրելու համար։ Այս կիրառությունը սերտորեն կապված է դատաբժշկության մեջ օգտագործվող համապատասխան մեթոդի հետ[108]։
Տեղեկատվության շտեմարան[խմբագրել | խմբագրել կոդը]
2013 թվականի հունվարին Nature ամսագրում տպագրված հոդվածում Եվրոպայի Կենսաինֆորմատիկայի ինստիտուտի և Ագիլենթ Թեքնոլոջիսի գիտնականները առաջարկում էին մեխանիզմ, որի օգնությամբ հնարավոր է ԴՆԹ-ն կիրառել որպես ինֆորմացիայի կրիչ։ Խումբը կարողացել է ԴՆԹ-ում գաղտնագրել 739 կբայթ տեղեկատվություն, սինթեզել ԴՆԹ-ի շղթան, ապա 100% ճշգրտությամբ այդ հաջորդականությունը ապագաղտնագրել իր սկզբնական ձևին։ Գաղտնագրված ինֆորմացիան կազմված էր տեքստից և ձայնային ֆայլերից։ Նմանատիպ ուսումնասիրություն է տպագրվել նաև Հարվարդի համալսարանի հետազոտողների կողմից 2012 թվականի օգոստոսին, որի ժամանակ 54 000 բառ պարունակող գիրքը գաղտնագրվել էր ԴՆԹ-ում[109][110]։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 G.P. Moss, P.A.S. Smith, Tavernier D. Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure: IUPAC Recommendations 1995 // Pure and Applied Chemistry — IUPAC, 1995. — Vol. 67, Iss. 8-9. — P. 1307—1375. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1351/PAC199567081307
- ↑ անատոմիայի հիմնարար մոդել
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Gene Ontology release 2019-11-16 — 2019.
- ↑ Gene Ontology release 2020-05-02 — 20200502 — 2020.
- ↑ Gene Ontology release 2022-07-01 — 2022-07-01 — 2022.
- ↑ «Մարդու զարգացման շնորհքը. ԴՆԹ». Վերցված է 2009 թ․ հունիսի 8-ին.
- ↑ Ռասել, Պիտեր (2001). iԾագումնաբանություն (անգլերեն). Նյու Յորք: Benjamin Cummings. ISBN 0-805-34553-1.
- ↑ Dahm R (2005). «Friedrich Miescher and the discovery of DNA». Dev Biol. 278 (2): 274–88. PMID 15680349.
- ↑ Hershey A, Chase M (1952). «Independent functions of viral protein and nucleic acid in growth of bacteriophage» (PDF). J Gen Physiol. 36 (1): 39–56. PMID 12981234.
- ↑ 10,0 10,1 Watson J, Crick F (1953). «Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid» (PDF). Nature. 171 (4356): 737–8. PMID 13054692.
- ↑ The Nobel Prize in Physiology or Medicine 1962 Nobelprize .org Accessed 22 Dec 06
- ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Butler, John M. (2001) Forensic DNA Typing «Elsevier». pp. 14 — 15. ISBN 978-0-12-147951-0
- ↑ 14,0 14,1 Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- ↑ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents IUPAC-IUB Commission on Biochemical Nomenclature (CBN) Accessed 03 Jan 2006
- ↑ Takahashi I, Marmur J. (1963). «Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis». Nature. 197: 794–5. PMID 13980287.
- ↑ Agris P (2004). «Decoding the genome: a modified view». Nucleic Acids Res. 32 (1): 223–38. PMID 14715921.
- ↑ Ghosh A, Bansal M (2003). «A glossary of DNA structures from A to Z». Acta Crystallogr D Biol Crystallogr. 59 (Pt 4): 620–6. PMID 12657780.
- ↑ Mandelkern M, Elias J, Eden D, Crothers D (1981). «The dimensions of DNA in solution». J Mol Biol. 152 (1): 153–61. PMID 7338906.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson R (1980). «Crystal structure analysis of a complete turn of B-DNA». Nature. 287 (5784): 755–8. PMID 7432492.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Pabo C, Sauer R. «Protein-DNA recognition». Annu Rev Biochem. 53: 293–321. PMID 6236744.
- ↑ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub H (2000). «Mechanical stability of single DNA molecules». Biophys J. 78 (4): 1997–2007. PMID 10733978.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Chalikian T, Völker J, Plum G, Breslauer K (1999). «A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques». Proc Natl Acad Sci U S A. 96 (14): 7853–8. PMID 10393911.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Klose R, Bird A (2006). «Genomic DNA methylation: the mark and its mediators». Trends Biochem Sci. 31 (2): 89–97. PMID 16403636.
- ↑ Bird A (2002). «DNA methylation patterns and epigenetic memory». Genes Dev. 16 (1): 6–21. PMID 11782440.
- ↑ Walsh C, Xu G. «Cytosine methylation and DNA repair». Curr Top Microbiol Immunol. 301: 283–315. PMID 16570853.
- ↑ Gommers-Ampt J, Van Leeuwen F, de Beer A, Vliegenthart J, Dizdaroglu M, Kowalak J, Crain P, Borst P (1993). «beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei». Cell. 75 (6): 1129–36. PMID 8261512.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ «PDB 1JDG». Արխիվացված է օրիգինալից 2008 թ․ սեպտեմբերի 22-ին. Վերցված է 2013 թ․ հոկտեմբերի 19-ին.
- ↑ Douki T, Reynaud-Angelin A, Cadet J, Sage E (2003). «Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation». Biochemistry. 42 (30): 9221–6. PMID 12885257.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget J, Ravanat J, Sauvaigo S (1999). «Hydroxyl radicals and DNA base damage». Mutat Res. 424 (1–2): 9–21. PMID 10064846.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Shigenaga M, Gimeno C, Ames B (1989). «Urinary 8-hydroxy-2′-deoxyguanosine as a biological marker of in vivo oxidative DNA damage». Proc Natl Acad Sci U S A. 86 (24): 9697–701. PMID 2602371. Արխիվացված է օրիգինալից 2008 թ․ մարտի 7-ին. Վերցված է 2013 թ․ հոկտեմբերի 20-ին.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Cathcart R, Schwiers E, Saul R, Ames B (1984). «Thymine glycol and thymidine glycol in human and rat urine: a possible assay for oxidative DNA damage» (PDF). Proc Natl Acad Sci U S A. 81 (18): 5633–7. PMID 6592579. Արխիվացված է օրիգինալից (PDF) 2008 թ․ հունիսի 25-ին. Վերցված է 2013 թ․ հոկտեմբերի 20-ին.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Ferguson L, Denny W (1991). «The genetic toxicology of acridines». Mutat Res. 258 (2): 123–60. PMID 1881402.
- ↑ Jeffrey A (1985). «DNA modification by chemical carcinogens». Pharmacol Ther. 28 (2): 237–72. PMID 3936066.
- ↑ Stephens T, Bunde C, Fillmore B (2000). «Mechanism of action in thalidomide teratogenesis». Biochem Pharmacol. 59 (12): 1489–99. PMID 10799645.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Braña M, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (2001). «Intercalators as anticancer drugs». Curr Pharm Des. 7 (17): 1745–80. PMID 11562309.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Benham C, Mielke S (2005). «DNA mechanics». Annu Rev Biomed Eng. 7: 21–53. PMID 16004565.
- ↑ Wang J (2002). «Cellular roles of DNA topoisomerases: a molecular perspective». Nat Rev Mol Cell Biol. 3 (6): 430–40. PMID 12042765.
- ↑ Created from NDB UD0017 Արխիվացված 2013-06-07 Wayback Machine
- ↑ Greider C, Blackburn E (1985). «Identification of a specific telomere terminal transferase activity in Tetrahymena extracts». Cell. 43 (2 Pt 1): 405–13. PMID 3907856.
- ↑ 41,0 41,1 Nugent C, Lundblad V (1998). «The telomerase reverse transcriptase: components and regulation». Genes Dev. 12 (8): 1073–85. PMID 9553037.
- ↑ Wright W, Tesmer V, Huffman K, Levene S, Shay J (1997). «Normal human chromosomes have long G-rich telomeric overhangs at one end». Genes Dev. 11 (21): 2801–9. PMID 9353250.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 43,0 43,1 Burge S, Parkinson G, Hazel P, Todd A, Neidle S (2006). «Quadruplex DNA: sequence, topology and structure». Nucleic Acids Res. 34 (19): 5402–15. PMID 17012276.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T (1999). «Mammalian telomeres end in a large duplex loop». Cell. 97 (4): 503–14. PMID 10338214.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Teif V.B. and Bohinc K. (2010). «Condensed DNA: condensing the concepts». Progress in Biophysics and Molecular Biology. doi:10.1016/j.pbiomolbio.2010.07.002.
- ↑ Thanbichler M, Wang S, Shapiro L (2005). «The bacterial nucleoid: a highly organized and dynamic structure». J Cell Biochem. 96 (3): 506–21. PMID 15988757.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 47,0 47,1 Wolfsberg T, McEntyre J, Schuler G (2001). «Guide to the draft human genome». Nature. 409 (6822): 824–6. PMID 11236998.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Pidoux A, Allshire R (2005). «The role of heterochromatin in centromere function» (PDF). Philos Trans R Soc Lond B Biol Sci. 360 (1455): 569–79. PMID 15905142.
- ↑ Harrison P, Hegyi H, Balasubramanian S, Luscombe N, Bertone P, Echols N, Johnson T, Gerstein M (2002). «Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22». Genome Res. 12 (2): 272–80. PMID 11827946.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Harrison P, Gerstein M (2002). «Studying genomes through the aeons: protein families, pseudogenes and proteome evolution». J Mol Biol. 318 (5): 1155–74. PMID 12083509.
- ↑ Soller M (2006). «Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22». Cell Mol Life Sci. 63 (7–9): 796–819. PMID 16465448.(չաշխատող հղում)
- ↑ Michalak P. (2006). «RNA world - the dark matter of evolutionary genomics». 19 (6): 1768–74. PMID 17040373.
{{cite journal}}: Cite journal requires|journal=(օգնություն) - ↑ Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S; և այլք: (2005). «RNA world - the dark matter of evolutionary genomics». 308: 1149–54. PMID 15790807. Արխիվացված է օրիգինալից 2010 թ․ հոկտեմբերի 1-ին. Վերցված է 2013 թ․ հոկտեմբերի 20-ին.
{{cite journal}}: Cite journal requires|journal=(օգնություն); Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Mattick JS (2004). «RNA regulation: a new genetics?». Nat Rev Genet. 5: 316–323. PMID 15131654.
- ↑ Albà M (2001). «Replicative DNA polymerases». Genome Biol. 2 (1): REVIEWS3002. PMID 11178285.
- ↑ Sandman K, Pereira S, Reeve J (1998). «Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome». Cell Mol Life Sci. 54 (12): 1350–64. PMID 9893710.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Dame RT (2005). «The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin». Mol. Microbiol. 56 (4): 858–70. PMID 15853876.
- ↑ Luger K, Mäder A, Richmond R, Sargent D, Richmond T (1997). «Crystal structure of the nucleosome core particle at 2.8 A resolution». Nature. 389 (6648): 251–60. PMID 9305837.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Jenuwein T, Allis C (2001). «Translating the histone code». Science. 293 (5532): 1074–80. PMID 11498575.
- ↑ Ito T. «Nucleosome assembly and remodelling». Curr Top Microbiol Immunol. 274: 1–22. PMID 12596902.
- ↑ Thomas J (2001). «HMG1 and 2: architectural DNA-binding proteins». Biochem Soc Trans. 29 (Pt 4): 395–401. PMID 11497996.
- ↑ Grosschedl R, Giese K, Pagel J (1994). «HMG domain proteins: architectural elements in the assembly of nucleoprotein structures». Trends Genet. 10 (3): 94–100. PMID 8178371.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Iftode C, Daniely Y, Borowiec J (1999). «Replication protein A (RPA): the eukaryotic SSB». Crit Rev Biochem Mol Biol. 34 (3): 141–80. PMID 10473346.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Myers L, Kornberg R. «Mediator of transcriptional regulation». Annu Rev Biochem. 69: 729–49. PMID 10966474.
- ↑ Schoeffler A, Berger J (2005). «Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism». Biochem Soc Trans. 33 (Pt 6): 1465–70. PMID 16246147.
- ↑ Tuteja N, Tuteja R (2004). «Unraveling DNA helicases. Motif, structure, mechanism and function». Eur J Biochem. 271 (10): 1849–63. PMID 15128295.
- ↑ Joyce C, Steitz T (1995). «Polymerase structures and function: variations on a theme?». J Bacteriol. 177 (22): 6321–9. PMID 7592405.
- ↑ Johnson A, O'Donnell M. «Cellular DNA replicases: components and dynamics at the replication fork». Annu Rev Biochem. 74: 283–315. PMID 15952889.
- ↑ Tarrago-Litvak L, Andréola M, Nevinsky G, Sarih-Cottin L, Litvak S (1994). «The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention». FASEB J. 8 (8): 497–503. PMID 7514143.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Martinez E (2002). «Multi-protein complexes in eukaryotic gene transcription». Plant Mol Biol. 50 (6): 925–47. PMID 12516863.
- ↑ Created from PDB 1M6G
- ↑ Cremer T, Cremer C (2001). «Chromosome territories, nuclear architecture and gene regulation in mammalian cells». Nature Reviews Genetics. 2 (4): 292–301. doi:10.1038/35066075. PMID 11283701.
- ↑ Pál C, Papp B, Lercher M (2006). «An integrated view of protein evolution». Nature Reviews Genetics. 7 (5): 337–48. doi:10.1038/nrg1838. PMID 16619049.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ O'Driscoll M, Jeggo P (2006). «The role of double-strand break repair – insights from human genetics». Nature Reviews Genetics. 7 (1): 45–54. doi:10.1038/nrg1746. PMID 16369571.
- ↑ Vispé S, Defais M (1997). «Mammalian Rad51 protein: a RecA homologue with pleiotropic functions». Biochimie. 79 (9–10): 587–92. doi:10.1016/S0300-9084(97)82007-X. PMID 9466696.
- ↑ Neale MJ, Keeney S (2006). «Clarifying the mechanics of DNA strand exchange in meiotic recombination». Nature. 442 (7099): 153–8. Bibcode:2006Natur.442..153N. doi:10.1038/nature04885. PMID 16838012.
- ↑ Dickman M, Ingleston S, Sedelnikova S, Rafferty J, Lloyd R, Grasby J, Hornby D (2002). «The RuvABC resolvasome». Eur J Biochem. 269 (22): 5492–501. doi:10.1046/j.1432-1033.2002.03250.x. PMID 12423347.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Joyce G (2002). «The antiquity of RNA-based evolution». Nature. 418 (6894): 214–21. Bibcode:2002Natur.418..214J. doi:10.1038/418214a. PMID 12110897.
- ↑ Orgel L (2004). «Prebiotic chemistry and the origin of the RNA world». Crit Rev Biochem Mol Biol. 39 (2): 99–123. doi:10.1080/10409230490460765. PMID 15217990.
- ↑ Davenport R (2001). «Ribozymes. Making copies in the RNA world». Science. 292 (5520): 1278. doi:10.1126/science.292.5520.1278a. PMID 11360970.
- ↑ Szathmáry E (1992). «What is the optimum size for the genetic alphabet?». Proc Natl Acad Sci USA. 89 (7): 2614–8. Bibcode:1992PNAS...89.2614S. doi:10.1073/pnas.89.7.2614. PMC 48712. PMID 1372984.
- ↑ Szathmáry E (1992). «What is the optimum size for the genetic alphabet?» (PDF). Proc Natl Acad Sci U S A. 89 (7): 2614–8. PMID 1372984. Արխիվացված է օրիգինալից (PDF) 2008 թ․ հունիսի 25-ին. Վերցված է 2014 թ․ նոյեմբերի 29-ին.
- ↑ Vreeland R, Rosenzweig W, Powers D (2000). «Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal». Nature. 407 (6806): 897–900. PMID 11057666.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Hebsgaard M, Phillips M, Willerslev E (2005). «Geologically ancient DNA: fact or artefact?». Trends Microbiol. 13 (5): 212–20. PMID 15866038.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Nickle D, Learn G, Rain M, Mullins J, Mittler J (2002). «Curiously modern DNA for a "250 million-year-old" bacterium». J Mol Evol. 54 (1): 134–7. PMID 11734907.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Callahan, M.P.; Smith, K.E.; Cleaves, H.J.; Ruzica, J.; Stern, J.C.; Glavin, D.P.; House, C.H.; Dworkin, J.P. (2011 թ․ օգոստոսի 11). «Carbonaceous meteorites contain a wide range of extraterrestrial nucleobases». PNAS. doi:10.1073/pnas.1106493108. Արխիվացված է օրիգինալից 2011 թ․ սեպտեմբերի 18-ին. Վերցված է 2011 թ․ օգոստոսի 15-ին.
- ↑ Steigerwald, John (2011 թ․ օգոստոսի 8). «NASA Researchers: DNA Building Blocks Can Be Made in Space». ՆԱՍԱ. Արխիվացված է օրիգինալից 2020 թ․ ապրիլի 26-ին. Վերցված է 2011 թ․ օգոստոսի 10-ին.
- ↑ ScienceDaily Staff (2011 թ․ օգոստոսի 9). «DNA Building Blocks Can Be Made in Space, NASA Evidence Suggests». ScienceDaily. Վերցված է 2011 թ․ օգոստոսի 9-ին.
- ↑ Goff SP, Berg P; Berg (1976). «Construction of hybrid viruses containing SV40 and lambda phage DNA segments and their propagation in cultured monkey cells». Cell. 9 (4 PT 2): 695–705. doi:10.1016/0092-8674(76)90133-1. PMID 189942.
- ↑ Houdebine L (2007). «Transgenic animal models in biomedical research». Methods Mol Biol. 360: 163–202. doi:10.1385/1-59745-165-7:163. ISBN 1-59745-165-7. PMID 17172731.
- ↑ Daniell H, Dhingra A; Dhingra (2002). «Multigene engineering: dawn of an exciting new era in biotechnology». Current Opinion in Biotechnology. 13 (2): 136–41. doi:10.1016/S0958-1669(02)00297-5. PMC 3481857. PMID 11950565.
- ↑ Job D (2002). «Plant biotechnology in agriculture». Biochimie. 84 (11): 1105–10. doi:10.1016/S0300-9084(02)00013-5. PMID 12595138.
- ↑ Collins A, Morton N; Morton (1994). «Likelihood ratios for DNA identification». Proc Natl Acad Sci USA. 91 (13): 6007–11. Bibcode:1994PNAS...91.6007C. doi:10.1073/pnas.91.13.6007. PMC 44126. PMID 8016106.
- ↑ Weir B, Triggs C, Starling L, Stowell L, Walsh K, Buckleton J; Triggs; Starling; Stowell; Walsh; Buckleton (1997). «Interpreting DNA mixtures». J Forensic Sci. 42 (2): 213–22. PMID 9068179.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Colin Pitchfork — first murder conviction on DNA evidence also clears the prime suspect Forensic Science Service Accessed 23 December 2006
- ↑ «DNA Identification in Mass Fatality Incidents». National Institute of Justice. 2006 թ․ սեպտեմբեր. Արխիվացված է օրիգինալից 2006 թ․ նոյեմբերի 12-ին. Վերցված է 2014 թ․ նոյեմբերի 29-ին.
- ↑ Rothemund PW (2006). «Folding DNA to create nanoscale shapes and patterns». Nature. 440 (7082): 297–302. Bibcode:2006Natur.440..297R. doi:10.1038/nature04586. PMID 16541064.
- ↑ Andersen ES, Dong M, Nielsen MM; Dong; Nielsen; Jahn; Subramani; Mamdouh; Golas; Sander; Stark; Oliveira; Pedersen; Birkedal; Besenbacher; Gothelf; Kjems (2009). «Self-assembly of a nanoscale DNA box with a controllable lid». Nature. 459 (7243): 73–6. Bibcode:2009Natur.459...73A. doi:10.1038/nature07971. PMID 19424153.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Ishitsuka Y, Ha T; Ha (2009). «DNA nanotechnology: a nanomachine goes live». Nat Nanotechnol. 4 (5): 281–2. Bibcode:2009NatNa...4..281I. doi:10.1038/nnano.2009.101. PMID 19421208.
- ↑ Aldaye FA, Palmer AL, Sleiman HF; Palmer; Sleiman (2008). «Assembling materials with DNA as the guide». Science. 321 (5897): 1795–9. Bibcode:2008Sci...321.1795A. doi:10.1126/science.1154533. PMID 18818351.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Baldi, Pierre; Brunak, Soren (2001). Bioinformatics: The Machine Learning Approach. MIT Press. ISBN 978-0-262-02506-5. OCLC 45951728.
- ↑ Gusfield, Dan. Algorithms on Strings, Trees, and Sequences: Computer Science and Computational Biology. Cambridge University Press, 15 January 1997. ISBN 978-0-521-58519-4.
- ↑ Sjölander K (2004). «Phylogenomic inference of protein molecular function: advances and challenges». Bioinformatics. 20 (2): 170–9. doi:10.1093/bioinformatics/bth021. PMID 14734307.
- ↑ Mount DM (2004). Bioinformatics: Sequence and Genome Analysis (2 ed.). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 0-87969-712-1. OCLC 55106399.
- ↑ Wray G; Martindale, Mark Q. (2002). «Dating branches on the Tree of Life using DNA». Genome Biol. 3 (1): reviews0001.1–reviews0001.7. doi:10.1046/j.1525-142X.1999.99010.x. PMC 150454. PMID 11806830.
- ↑ Lost Tribes of Israel, NOVA, PBS airdate: 22 February 2000. Transcript available from PBS.org. Retrieved 4 March 2006.
- ↑ Kleiman, Yaakov. "The Cohanim/DNA Connection: The fascinating story of how DNA studies confirm an ancient biblical tradition". Արխիվացված 2016-04-25 Wayback Machine aish.com (13 January 2000). Retrieved 4 March 2006.
- ↑ Bhattacharya, Shaoni. "Killer convicted thanks to relative's DNA". Արխիվացված 2007-02-12 Wayback Machine newscientist.com (20 April 2004). Retrieved 22 December 06.
- ↑ Goldman, Nick; Bertone, Paul; Chen, Siyuan; Dessimoz, Christophe; LeProust, Emily M.; Sipos, Botond; Birney, Ewan (2013 թ․ հունվարի 23). «Towards practical, high-capacity, low-maintenance information storage in synthesized DNA». Nature. 494 (7435): 77–80. Bibcode:2013Natur.494...77G. doi:10.1038/nature11875. PMC 3672958. PMID 23354052.
- ↑ Naik, Gautam (2013 թ․ հունվարի 24). «Storing Digital Data in DNA». Wall Street Journal. Վերցված է 2013 թ․ հունվարի 24-ին.
Տես նաև[խմբագրել | խմբագրել կոդը]
| ||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի՝ 2013 թվականի 45 շաբաթվա հոդված։ |
|
|
Այս հոդվածը ներառված է Հայերեն Վիքիպեդիայի ընտրյալ հոդվածների ցանկում |
|
|
Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի՝ 2014 թվականի Տարվա հոդված |