Պրիոններ
| Պրիոններ | |
|---|---|
 Կրեյտցֆելդ–Յակոբի հիվանդությամբ հիվանդի ուղեղի ցանկացած հյուսվածքի հիստոլոգիական պատրաստուկ | |
| Տեսակ | սպիտակուցների խումբ կամ դաս |
| Հետևանք | transmissible spongiform encephalopathy? |
| Հայտնաբերող | Stanley B. Prusiner? |
| ՀՄԴ-9 | 046 |
| ՀՄԴ-10 | A81 |
Պրիոններ (անգլ.՝ prion՝ protein՝ «սպիտակուց» և infection՝ «վարակ», բառը առաջարկվել է 1982 թվականին Սթենլի Պրուզիների կողմից[1]), ախտածինների հատուկ դաս, որոնք կազմված են անոմալ երրորդային կառուցվածքով սպիտակուցներից և չեն պարունակում նուկլեինաթթուներ։ Այս դրույթն ընկած է պրիոնային տեսության հիմքում[2]։
Պրիոններն ունակ են ավելացնել իրենց քանակը՝ օգտագործելով կենդանի բջիջների ֆունկցիաները (այդ առումով պրիոնները նման են վիրուսներին)։ Պրիոնը՝ անոմալ եռաչափ (երրորդային) կառուցվածքով սպիտակուց է, որը ունակ է կատալիզել իրեն հոմոլոգ նորմալ բջջային սպիտակուցի տարածական փոխակերպումը և այն դարձնել իր նման (պրիոն)։ Որպես կանոն, սպիտակուցի՝ պրիոնային վիճակի անցումն ուղեկցվում է իր α-շղթայի β-թերթ փոխակերպմամբ։ Այդպիսի անցման հետևանքով առաջացած պրիոնները իրենց հերթին կարող են վերափոխել նոր սպիտակուցների մոլեկուլներ․ շղթայական ռեակցիայի արդյունքում առաջանում են հսկայական քանակությամբ սխալ պարուրված մոլեկուլներ[3]։ Պրիոնները մինչ այժմ հայտնի միակ ախտածիններն են, որոնց բազմացումը կատարվում է առանց նուկլեինաթթվի մասնակցության։ Պրիոնները «կենդանի» ընդունելու հարցը մինչ քննարկումների առարկա է[4]։
Բոլոր հայտնի պրիոնները առաջ են բերում ամիլոիդների ձևավորում. ամիլոիդները սպիտակուցային նյութեր են, որոնք միացնում են խիտ փաթեթավորված β-թերթերը։ Ամիլոիդները ֆիբրիլներ են, որոնք աճում են ծայրերում, իսկ ֆիբրիլների քանդվելը բերում է չորս աճող ծայրերի առաջացմանը։ Պրիոնային հիվանդության ինկուբացիոն շրջանի արագությունը որոշվում է պրիոնների քանակի էքսպոնենցիալ աճով, իսկ այն, իր հերթին, կապված է գծային աճի արագությունից և ագրեգատների (ֆիբրիլներ) հատվածավորումից[5]։ Պրիոնի բազմացման համար անհրաժեշտ է սկզբնական նորմալ դասավորված պրիոնային սպիտակուցի առկայությունը․ օրգանիզմները որոնց մոտ բացակայում է պրիոնային սպիտակուցի նորմալ ձևը, չեն տառապում պրիոնային հիվանդություններով։
Սպիտակուցի պրիոնային ձևը չափազանց կայուն է և կուտակվում է վարակված հյուսվածքում, առաջ բերելով վնասումը, և վերջում՝ մահը[6]։ Պրիոնային ձևի կայունությունը նշանակում է, որ պրիոնները կայուն են քիմիական և ֆիզիկական ազդակների կողմից առաջ բերվող բնափոխման նկատմամբ, այդ պատճառով այս մասնիկների ոչնչացումը կամ պահպանումը դժվար գործ է։ Պրիոնները գոյություն ունեն մի քանի ձևերով՝ շտամներով, որոնցից յուրաքանչյուրը ունի թեթևակի տարբերվող կառուցվածք։
Պրիոնները տարբեր կաթնասունների մոտ առաջ են բերում սպունգային շարժահաղորդ էնցեֆալոպատիաներ (ՍՇԷ), այդ թվում նաև խոշոր եղջերավոր անասունների սպունգային էնցեֆալիտ («կովի կատաղություն»)։ Մարդու մոտ պրիոնները առաջ են բերում Կրեյտցֆելդ-Յակոբի հիվանդությունը, Կրեյտցֆելդ-Յակոբի հիվանդության տեսակ՝ Յակոբը (vCJD), Հերստման-Շտրաուսլեր-Շեյնկերի ախտանիշը, ընտանեկան մահացու անքնությունը և կուրու[7] հիվանդությունները։ Բոլոր հայտնի պրիոնային հիվանդությունները վարակում են գլխուղեղը և նյարդային այլ օրգանները, ներկա պահին անբուժելի են և մահացու[8]։
Կաթնասունների բոլոր հայտնի պրիոնային հիվանդությունները կապված են PrP սպիտակուցի հետ։ Նրա նորմալ երրորդային կառուցվածքով ձևը կոչվում է PrPC (անգլ.՝ common՝ հասարակ կամ cellular՝ բջջային), իսկ վարակիչ, անոմալ ձևը կոչվում է PrPSc (անգլ.՝ scrapie՝ սկրեյպի ոչխար, բնության կողմից առաջացացրած պրիոնային հիվանդությունը)[9][10] կամ PrPTSE (անգլ.՝ Transmissible Spongiform Encephalopathies)[11]:
Պրիոններ ձևավորող սպիտակուցներ հայտնաբերվել են որոշ սնկերի մոտ[12]։ Սնկերի պրիոնների մեծամասնությունը չեն ազդում կենսունակության վրա, բայց մինչ այժմ պրիոնների դերը տեր սնկի համար և էվոլյուցիայի մեջ քննարկվում է[13]։ Սնկերի պրիոնների բազմացման գործընթացի ուսումնասիրությունը օգնել է կաթնասունների մոտ տեղի ունեցող նույնատիպ գործընթացը լավ հասկանալու համար։
Պատմություն[խմբագրել | խմբագրել կոդը]
Պրիոնային հիվանդությունների նկարագրություն[խմբագրել | խմբագրել կոդը]

Առաջին հայտնաբերված սպունգային տրանսմիսիոն էնցեֆալիտը՝ ոչխարների քոսն է՝ սրեյպին։ Հիվանդության առաջին դեպքերը գրանցվել են Մեծ Բրիտանիայում՝ 1700-ական թվականներին։ Հիվանդության ժամանակ ոչխարները տառապում են սուր քորից, որի հետևանքով կենդանին ստիպված էր անընդհատ քսմսվել (անգլ.՝ scrape) ծառերին։ Այստեղից էլ առաջացել է հիվանդության անվանումը։ Բացի այդ, ոչխարները քայլելիս ցավեր էին ունենում և ուժեղ նոպաներ։ Բոլոր այս ախտանիշները խոսում են գլխուղեղի վնասվածքի մասին. այս տարօրինակ հիվանդությունը գիտնականներին տարակուսանքի մեջ էր գցում։ Ավելի ուշ, 1967 թվականին, Չանդլերը (անգլ.՝ Chandler) հաստատեց, որ սկրեյպիով կարող են վարակվել նաև մկները, ինչը, անկասկած առաջընթաց էր այդ հիվանդության ուսումնասիրման մեջ[14]։
20-րդ դարում նկարագրվել են նաև մարդու հիվանդություններ հարուցող պրիոններ։ 1920-ական թվականներին Հանս Գերհարդ Կրեյցֆելդտը և Ալֆոնս Մարիա Յակոբը ուսումնասիրում էին մարդու նյարդային համակարգի նոր, անբուժելի հիվանդություն, որի գլխավոր ախտանիշը գլխուղեղում բծերի առաջացումն էր։ Արդյունքում այս հիվանդությունը անվանվեց ի պատիվ նրանց[14]։
1957 թվականին Կարլտոն Գայդուշեկը և Վինսենտ Զիգասը նկարագրեցին նեյրոլոգիական սինդրոմ, որը տարածվախ էր ֆորե ազգի մոտ, որոնք բնակվում էին Պապուայի բարձրավանդակում՝ Նոր Գվիենայում։ Այս հիվանդությունը բնորոշվում էր դողերոցքով, ատակսիայով և վաղ փուլերում՝ ատետոիդային շարժմամբ։ Այս ախտանիշներին հետագայում միացան նաև թուլությունը, դեմենցիան, հիվանդությունը անպայման ավարտվում էր մահով[14]։ Ֆորեների լեզվով այս հիվանդությունը կոչվում է կուրու, որը թարգմանաբար նշանակում է «դող»․ այս անվամբ այդ հիվանդությունը հայտնի է նաև այժմ։ Պարզվեց, կուրույի տարածման պատճառը ֆորեների մոտ ծիսական կանիբալիզմն էր։ Ազգային ծեսերի ժամանակ նրանք ուտում էին մահացած ցեղակիցների օրգանները։ Ուղեղը այդ դեպքում ուտում էին երեխաները, քանզի համարվում էր, դրանից երեխաների մոտ «խելքը շատանում է»։ Հիվանդության ինկուբացիոն շրջանը կարող է տևել մինչև 50 տարի, սակայն աղջիկների մոտ, հատկապես որոնք վարակվում էին կուրույով, այն կարող է կազմել չորս տարուց էլ քիչ[14]։ 1976 թվականին Կարլտոն Գայդուշեկը կուրու հիվանդության հայտնաբերման համար ֆիզիոլոգիայի և բժշկության բնագավառում արժանացել է Նոբելյան մրցանակի[15]։
Պրիոնների մասին կարծիքների զարգացումը[խմբագրել | խմբագրել կոդը]

1960-ական թվականներին Լոնդոնում երկու հետազոտողներ, ռադիոկենսաբան Տիկվահ Ալպերը (անգլ.՝ Tikvah Alper) և մաթեմատիկ Ջոն Սթենլի Գրիֆիտը առաջ քաշեցին հիպոթեզ, որ որոշ սպունգային տրանսմասիվային էնցեֆալոպատիաներ հարուցվում են պաթոգեններով, որոնք կազմված են միայն սպիտակուցներից[16][17]։ Ալպերը և Գրիֆիտը այդ կերպ փորձում էին բացատրել այն փաստը, որ գաղտնի ինֆեկցիոն ագենտը, որը առաջ է բերում Կրեյտցֆելդտ-Յակոբի հիվանդությունը, շատ կայուն է իոնիզացնող ճառագայթման նկատմամբ։ Ռադիացիայի չափաբաժինը, որը անհրաժեշտ է ինֆեկցիոն ագենտների կեսի ոչնչացման համար, կախված է նրանց չափերից․ որքան փոքր է այդպիսի մարմինը, այնքան փոքր է նրանում վարակված մասնիկ ընկնելու հավանականությունը։ Այդպես էլ հաստատվեց, որ պրիոնը շատ փոքր է վիրուս լինելու համար։
Ֆրենսիս Կրիկը թեև պաշտպանում էր այն տեսակետը, որ ինֆորմացիայի փոխանցումը սպիտակուցից սպիտակուց, կամ սպիտակուցից ԴՆԹ կամ ՌՆԹ անհնար է, նա նշեց, որ Գրիֆտի հիպոթեզը պարունակում էր վերջինիս վերաբերյալ հակասություններ (սակայն հենց Գրիֆտը իր հիպոթեզը այդ տեսանկյունից չէր դիտում)[18]։ Ավելի ուշ նա ձևավորեց իր մշակված հիպոթեզը հաշվի առնելով հակադարձ տրանսկրիպցիան, որը բացահայտվել էր 1970 թվականին Դեյվիդ Բալտիմորի և Հոուարդ Թեմինի կողմից։
1982 թվականին Սթենլի Պրուզիները Սան Ֆրանցիսկոյի Կալիֆորնիական համալսարանից հաղորդեց, որ իր խումբը առանձնացրել է հիպոտետիկ ինֆեկցիոն ագենտ (պրիոն) և որ այն կազմված է հիմնականում սպիտակուցներից (թեև նրնաք այդ սպիտակուցը առանձնացրել էին Պրուզիների հաղորդագրությունից երկու տարի անց)[19]։ Պրուզիները պրիոնների բնագավառում կատարած աշխատանքների համար 1997 թվականին ստացել է Նոբելյան մրցանակ ֆիզիոլոգիայի և բժշկության բնագավառում[1]։
Կառուցվածք[խմբագրել | խմբագրել կոդը]
Իզոկառուցվածք[խմբագրել | խմբագրել կոդը]

Պրիոնի սպիտակուցը (PrP) կարելի է հայտնաբերել առողջ մարդկանց և կենդանիների ամբողջ օրգանիզմում։ Վարակված հյուսվածքներում կա անոմալ կառուցվածք ունեցող PrP, որը կայուն է պրոտեազների նկատմամբ (ֆերմենտներ, որոնք հիդրոլիզում են սպիտակուցները)։ Ինչպես նշվեց վերևում, նորմալ ձևը կոչվում է PrPC, իսկ ախտածինը՝ PrPSc[20]: Որոշակի պայմաններում հնարավոր է in vitro ստանալ շատ թե քիչ կառուցվածքայնորեն նման PrP-ների իզոֆորմներ, որոնք ընդունակ են վարակել առողջ օրգանիզմները, թեպետև ավելի քիչ արդյունավետությամբ, քան հիվանդ օրգանիզմից առանձնացվածները[21]։
PrPC[խմբագրել | խմբագրել կոդը]
PrPC-ն կաթնասունների նորմալ թաղանթային սպիտակուց է, որը մարդու մոտ գաղտնագրվում է PRNP գենով։ Մարդու PRNP-ի ի-ՌՆԹ-ն կոդավորում է 253 ամինաթթվային մնացորդով (ա․ մ․) մի պոլիպեպտիդ, որը հասունացման ժամանակ կարճանում է բջջային ֆերմենտների միջոցով։ PrP-ի հասուն ձևը կազմված է 208 ամինաթթվային մնացորդներից և ունի 35-36 զ․ա․մ․ զանգված[22]։ Բացի օրգանական պրոտեոլիզից, PrP-ն ենթարկվում է նաև այլ հետտրանսլյացիոն ձևափոխությունների՝ N-գլիկոլիզացման՝ Asn-181 և Asn-197-ի միջոցով, Ser-230-ին գլիկոզիլֆոսֆատիդիլինոզիտոլի միացում և Cys-179 ու Cys-214 միջև դիսուլֆադային կապի առաջացում[23]։ Հետտրանսլյացիոն ձևափոխությանը մասնակցող ամինաթթվային մնացորդները, կաթնասունների մոտ բարձրակոնսերվատիվ են[24]։
PrP-ի տարածական կառուցվածքի մեջ առանձնացնում են չներկառուցված N-ծայրային հատված (մարդու մոտ 23-125 ա․ մ․) և գլոբուլային դոմեն (126-231 ա․ մ․), որը կազմված է երեք α-պարույրներից և երկշղթա հակազուգահեռ β-թերթից[25][26]։
Ըստ թաղանթի տարբերում են պրիոնների մի քանի տոպոլոգիական ձևեր՝ երկու տրանսմեմբրանային և մեկը՝ մեմբրանին միացած գլիկոլիպիդային խարիսխ[27]։
PrPC-ի ձևավորումը տեղի է ունենում Էնդոպլազմային ցանցում, հետագա հասունացումը՝ Գոլջիի համակարգում, որտեղից այն թաղանթային ներառուկների միջոցով հասնում է պլազմային թաղանթին։ Դրանից հետո այն էնդոսոմի քայքայվելուց հետո ամրանում է թաղանթի վրա կամ էլ ենթարկվում է էնդոցիտոզի և քայքայվում է լիզոսոմներում[28]։
Ի տարբերություն սպիտակուցների նորմալ լուծելի ձևերի, պրիոնները նստեցվում են գերարագ ցենտրիֆուգման միջոցով, որը համարվում է պրիոնների առկայության հայտնաբերման ստանդարտ եղանակ[9]։ PrPC-ն պղնձի երկվալենտ կատիոնի նկատմամբ ունի մեծ խնամակցություն[29]։ Այս փաստի իմաստը անհասկանալի է, բայց, հնարավոր է, դա որևէ կապ ունի նրա կառուցվածքի և կատարած ֆունկցիաների հետ։ Կան տվյալներ, որ PrP-ն կարևոր դեր է խաղում բջիջների ամրացման, ներբջջային ազդանշանների փոխանցման մեջ, կարող է մասնակցել գլխուղեղի բջիջների հաղորդակցմանը[30]։ Բայցևայնպես, պրիոնների ֆունկցիաները ամբողջությամբ չեն ուսումնասիրվել։
PrPSc[խմբագրել | խմբագրել կոդը]
PrP-ի վարակունակ PrPSc իզոձևը ընդունակ է PrPC-ի նորմալ սպիտակուցը վերածել վարակիչ իզոձևի՝ փոխելով նրա տարածական կառուցվածքը (երորդային կառուցվածքը)․ դա իր հերթին, փոխում է այլ սպիտակուցների հետ PrP-ի փոխազդեցությունը։ Թեպետ PrPSc ստույգ կառուցվածքը հայտնի չէ, հաստատված է, որ նրա մեջ α-պարույրները գերակշռում են β-թերթերին[31]։ Այսպիսի ոչ նորմալ իզոկառուցվածքները միավորվում են բարձրակառուցվածքային ամիլոիդնային թելերի մեջ, որոնք, կուտակվելով, ձևավորում են բուշտեր։ Անհայտ է, իզոկառուցվածքները բջջի վնասվածքի պատճառ են, թե ընդամենը ախտաբանական պրոցեսի կողմնակի հետևանք[32]։ Յուրաքանչյուր թելի ծայրը ծառայում է որպես բռնկիչ, որին կարող են միանալ ազատ սպիտակուցային մոլեկուլներ, որի հետևանքով ֆիբրիլը մեծանում է։ Մեծ մասամբ կարող են միանալ միայն PrP մոլեկուլները, որոնք ճանաչվում են PrPSc-ի առաջնային կառուցվածքին (այդ պատճառով պրիոնների փոխանցումը տեսակային է)[9]։ Սակայն, հնարավոր են նաև պրիոնների միջտեսակային փոխանցման օրինակներ[33]։
Պրիոնների բազմացման մեխանիզմը[խմբագրել | խմբագրել կոդը]


Առաջին հիպոթեզը, որը բացատրում էր պրիոնների բազմացումը առանց այլ մոլեկուլների մասնակցության, մասնավորապես առանց նուկլեինաթթուների, հետերոդիմերային մոդելն էր[34]։ Համաձայն այդ հիպոթեզի, PrPSc-ի մեկ մոլեկուլը միանում է PrPC-ի մեկ մոլեկուլին և կատալիզում է նրա պրիոնային ձևին անցումը։ PrPSc-ի երկու մոլեկուլներ դրանից հետո տարանջատվում են և շարունակում են այլ PrPC-ները վեր ածել PrPSc-ների։ Սակայն պրիոնների բազմացման մոդելը (ռեպլիկացիա) կարելի է բացատրում է ոչ միայն բուն բազմացումը, բայց և այն, թե ինչու է պրիոնների սպոնտան առաջացումը այդքան հազվագյուտ երևույթ։ Մանֆրեդ Էյգենը (լատին․՝ Manfred Eigen) ցույց տվեց, որ հետերոդիմերային մոդելը պահանջում է, որ PrPSc-ն լինի ֆանտաստիկ կատալիզատոր․ այն պետք է մեծացնի սպիտակուցի փոխակերպան հաճախությունը պրիոնային ձևի մոտ 1015 անգամ[35]։ Այդպիսի խնդիր չի առաջանում, եթե ընդունենք, որ PrPSc-ն գոյություն ունի միայն ագրեգատիվ (օրինակ ամիլոիդային) ձևով, որտեղ կոոպերատիվությունը հանդես է գալիս որպես պատնեշ՝ պրիոնային ձևի սպոնտան անցման համար։ Որպես հավելում, չնայած ծախսված ուժերին, PrPSc-ի մոնոմերի անջատումը դեռևս չի հաջողվել։
Ալտերնատիվ ֆիբրիլային մոդելը ենթադրում է, որ PrPSc-ն գոյություն ունի միայն ֆիբրիլների տեսքով, ընդ որում ֆիբրիլի ծայրերը կապվում են PrPC-ի հետ, որտեղ այն վեր է ածվում PrPSc-ի։ Եթե դա միայն այդպես լիներ, ապա պրիոնների քանակը կաճեր գծային կարգով։ Սակայն պրիոնային հիվանդության զարգացման դեպքում նկատվում է PrPSc-ի քանակի էքսպոտենցիալ աճ և ընդհանուր ինֆեկցիոն մասնիկների կոնցետրացիայի աճ[36][37][38]։ Դա կարելի է բացատրել, եթե հաշվի առնենք ֆիբրիլի քանդվելը[39]։ Օրգանիզմում ֆիբրիլների կտրատումը տեղի է ունենում շապերոն սպիտակուցների միջոցով, որոնք սովորաբար բջջին օգնում են մաքրվել ագրեգատիվ սպիտակուցներից[40]։
Պրիոնների ինֆեկցիոն մասնիկների էքսպոտենցիալ աճի արագությունը զգալի կերպով որոշվում է PrPSc-ի կոնցետրացիայի քառակուսի արմատով[5]։ Ինկուբատորային շրջանի տևողությունը որոշվում է էքսպոտենցիալ աճով, և այդ փաստը ապացուցվում է տրանսգենային մկների վրա կատարված in vivo ուսումնասիրություններով[5]։ Այդպիսի արմատային կախում նկատվում է նաև տարատեսակ in vitro ամիլոդային սպիտակուցներում[41]։
Պրիոնների ռեպլիկացիայի մեխանիզմի ուսումնասիրումը կարևոր դեր ունի դեղերի պատրաստման համար։ Քանի որ պրիոնային հիվանդությունների ինկուբացիոն շրջանը ծայրահեղ երկար է, արդյունավետ դեղանյութին ընդհանրապես անհրաժեշտ չէ ոչնչացնել բոլոր պրիոնները, բավական է ընդամենը իջեցնել նրանց էքսպոտենցիալ աճի արագությունը։ Մոդելավորումը ցույց է տալիս, որ ամենաէֆեկտիվ պատրաստուկը կլիներ այն, որը կկապվեր ֆիբրիլների ծայրերի հետ և կսահմանափակեր նրանց աճը[42]։
PrP-ի ֆունկցիաներ[խմբագրել | խմբագրել կոդը]
Նեյրոդեգեներացիայի, որը առաջանում է պրիոնների կողմից, բացատրություններից մեկը կարող է լինել PrP-ի ֆունկցիայի խախտումը։ Սակայն այդ սպիտակուցի նորմալ ֆունկցիաները վատ են ուսումնասիրված։ in vitro տվյալները ցույց են տալիս բազմաթիվ դերեր, իսկ մկների վրա կատարած փորձերը, այդ գենի նկատմամբ նոկաուտայինները, տվել են հարաբերականորեն քիչ ինֆորմացիա, քանի որ այդ կենդանիների մոտ նկատվում է նորմայից շատ քիչ շեղումներ։ Վերջին ուսումնասիրությունները, որոնք կատարվել են մկների վրա, ցույց են տվել, որ ծայրային նյարդերում PrP-ի քայքայումը ակտիվացնում է նրանց միելինային թաղանթի վերականգնումը Շվանի բջիջներով և որ PrP-ի բացակայությունը տանում է նյարդերի դեմիլենիզացիային[43]։
2005 թվականին առաջ է քաշվել ենթադրություն, որ նորմայում PrP-ն դեր է խաղում երկարաժամկետ հիշողության պահպանման համար[44]։ Բացի այդ, մկների մոտ, որոնք զրկված են Prnp գենից, նկատվում է հիպոկամպային երկարաժամկետ պոտենցիացիայի փոփոխություն[45][46]։
2006 թվականին Ուայտհեդ կենսաբուժական ուսումնասիրությունների համալսարանի գիտնականները ցույց են տվել, որ Prnp գենի էքսպրեսիան հեմոպոետիկ ցողունային բջիջներում անհրաժեշտ է ոսկրածուծի ինքնակարգավորման համար։ Հետազոտության մեջ պարզվել է, երկարակյաց հեմոպոետիկ ցողունային բջիջները բջջաթաղանթի վրա կրում են PrP, իսկ ցողունային բջիջներով արյունաստեղծ հյուսվածքները, որոնք զրկված են PrP-ից, զգայուն են բջջային հյուծման նկատմամբ[47]։
Հիպոթեզներ պրիոնների բաղադրության մասին[խմբագրել | խմբագրել կոդը]
Համաձայն առավել հնացած տեսակետի, պրիոնները իրենցից ներկայացնում են բացառապես սպիտակուցային ինֆեկցիոն ագենտներ[12]։ Սակայն այս հիպոթզի («մաքուր սպիտակուցային» հիպոթեզ) մոտ կան թերություններ, ինչի հետ կապված հայտնվեցին նաև այլընտրանքային կարծիքներ պրիոնների գոյության մասին։ Բոլոր թվարկված հիպոթեզները քննարկվում են ներքևում։
«Մաքուր սպիտակուցային» հիպոթեզ[խմբագրել | խմբագրել կոդը]
Մինչ պրիոնների հայտնաբերումը համարվում էր, որ բոլոր ինֆեկցիոն ագենտները բազմացման համար օգտագործում են միայն նուկլեինաթթուները։ «Մաքուր սպիտակուցային» հիպոթեզը վկայում է, որ սպիտակուցային կառույցը կարող է բազմանալ առանց նուկլեինաթթուների մասնակցության։ Սկզբում համարում էին, որ այս հիպոթեզը հակասում է մոլեկուլային կենսաբանության կենտրոնական դոգմային, ըստ որի նուկլեինաթթուները ծառայում են ժառանգական նյութի փոխանցման միակ եղանակ, սակայն ներկա պահին համարվում է, որ թեպետ պրիոնները ունակ են ինֆորմացիան փոխանցել առանց նուկլեինաթթուների, նրանք ունակ չեն ինֆորմացիան փոխանցել նուկլեինաթթուներին։
Վկայություններ, որոնք ծոսում են «մաքուր սպիտակուցային» հիպոթեզի օգտին[48]․
- պրիոնային հիվանդությունները չեն կարողացել կապել ոչ վիրուսների, ոչ բակտերիաների, ոչ սնկային հարուցիչների հետ, սակայն Saccharomyces cerevisiae խմորասնկերի մոտ հայտնի են ոչ լետալ պրիոններ, օրինակ Sup35p
- պրիոնների ինֆեկցիոն հատկությունները, ինչպես հայտնի են, կապված չեն նուկլեինաթթուների հետ․ պրիոնները կայուն են նուկլեազների և ուլտրամանուշակագույն ճառագայթման նկատմամբ, որոնք մահացու ազդեցություն ունեն նուկլեինաթթուների վրա,
- պրիոնները չեն առաջացնում իմունային պատասխան
- օրգանիզմների մոտ, որոնք վարակվում են այլ տեսակի օրգանիզմի կողմից, չի հայտնաբերվել PrPSc՝ դոնորի պրիոնի ամինաթթվային հաջորդականությամբ,
- PrP գենի մուտացիայով ընտանիքներում առակ են պրիոնային հիվանդությունների ժառանգականություն։ Այդ գենի մուտացիայով մկների մոտ նույնպես զարգանում է պրիոնային հիվանդություններ, չնայած խնամակալման խիստ պայմաններին, որոնք բացառում են արտաքինից վարակման աղբյուրները,
- կենդանիները, որոնք չունեն PrPC սպիտակուցը, չեն վարակվում պրիոնային հիվանդություններով։
Մուլտիկոմպոննետային հիպոթեզ[խմբագրել | խմբագրել կոդը]
in vitro եղանակով աճեցված բջիջների պրիոններրի ցածր ախտածնությունը տարավ մուլտիկոմպոննետային հիպոթեզի առաջացմանը, որը վկայում է, որ ինֆեկցիոն պրիոնի առաջացման համար անհրաժեշտ են այլ մոլեկուլ-կոֆակտորներ[49]։
2007 թվականին կենսաքիմիկ Սուրաչայ Սուպատոֆոնեն (Surachai Supattapone) և Դարտմունտի քոլեջի կոլեգաները PrPC-ից ստացան մաքուր ինֆեկցիոն պրիոններ, որոնք պարունակում էին լիպիդներ սպիտակուցների հետ և սինթետիկ պոլիանինային մոլեկուլներ[50]։ Նրանք ցույց տվեցին նաև, որ պոլիանինային մոլեկուլները, որոնք անհրաժեշտ են պրիոնների ձևավորման համար, օժտված էր PrP-ի նկատմամբ մեծ խնամակցության և նրա հետ կազմավորում էր համալիրներ։ Դա նրանց թույլ տվեց ենթադրել, որ ինֆեկցիոն պրիոնի կազմի մեջ մտնում են ոչ միայն սպիտակուց, այլև օրգանիզմի այլ մոլեկուլներ, այդ թվում սպիտակուցներ և պոլիանինային մոլեկուլներ[51]։
2010 թվականին Մա Ցզյանը (Jiyan Ma) Օհայո նահանգի համալսարանի կոլեգաների հետ ստացան ռեկոմբինատային PrP պարունակող բակտերիալ բջիջների կողմից սինթեզված ինֆեկցիոն պրիոններ, ֆոսֆոլիպիդ POPG և ՌՆԹ, ինչը նույնպես հաստատում է մուլտիկոմպոնենտային հիպոթեզը[52]։ Մնացած հետազոտություններում մեկ ռեկոմբինատային PrP-ից հաջողվեց ստանալ թույլ պրիոններ[53][54]։
2012 թվականին Supattapone-ը և կոլեգաները որպես էնդոգեն կոֆակտոր առանձնացրել են ֆոսֆատիդիլէթանոլամին լիպիդը, որը կարող է կատալիզել տարատեսակ շտամների ռեկեմբինանտ պրիոնների մեծ քանակներ՝ առանց որևէ այլ մոլեկուլի մասնակցության[55]։ Նրանք հաղորդել են նաև, որ այդ կոֆակտորը անհրաժեշտ է ինֆեկցիոն PrPSc-ի կոնֆորմացիայի պահպանման համար, ինչպես նաև ինֆեկցիոն պրիոնների շտամային հատկանիշների բացահայտման համար[56]։
Վիրուսային հիպոթեզ[խմբագրել | խմբագրել կոդը]
«Մաքուր սպիտակուցային» հիպոթեզը կրիտիկայի ենթարկվեց այն մարդկանց կողմից, ովքեր կարծում են, որ պրիոնային հիվանդությունների պարզ բացատրությունը կայանում է նրանց վիրուսային բնույթի մեջ[57]։ Ավելի քան տասի տար Եյլի համալսարանի նեյրոհիստոլոգ Լաուրա Մանուելիդսը (անգլ.՝ Laura Manuelidis) փորձում էր ապացուցել, որ պրիոնային հիվանդությունները հարուցվում են անհայտ դանդաղ վիրուսների կողմիից։ 2007 թվականի հունվարին նա և իր կոլեգանը հայտնեցին, որ վարակված սկրեյպիի կուլտուրայի բջիջների 10 %-ի մոտ հայտնաբերել են վիրուսներ[58][59]։
Վիրուսային հիպոթեզը պնդում է, որ սպունգային տրանսմիսիոն էնցեֆալոպատիան հարուցվում են ռեպլիկացիայի ունակ ինֆորմացիոն մոլեկուլների կողմից (ամենայն հավանականությամբ, նուկլեինաթթուների կողմից), որոնք կապվում են PrP-ների հետ։ ՍՏԷ-ի դեպքում հայտնի են շտամներ, այդ թվում սկրեյպիի և խոշոր եղջերավոր անասունների էնցեֆալոպատիայի դեպքում, որոնք բնորոշվում են սպեցիֆիկ կենսաբանական հատկություններով, ինչը, վիրուսային վարկածի կողմնակիցների կարծիքով, չի բացատրվում «մաքուր սպիտակուցային» հիպոթեզով։
Արգումենտներ, որոնք խոսում են վիրուսային հիպոթեզի օգտին[48]․
- վարիացիան շտամների միջև․ պրիոնները տարբերվում են ինֆեկտիվությամբ, ինկուբացիոն շրջանով, ախտանիշներով և հիվանդության զարգացման արագությամբ, ինչը հիշեցնում է տարբերությունը վիրուսների միջև, հատկապես ՌՆԹ պարունակող վիրուսներին (վիրուսներ, որոնք որպես ժառանգական միակ նյութ պարունակում են ՌՆԹ ),
- պրիոնային հիվանդությունների երկարաժամկետ ինկուբացիոն շրջանը և ախտանիշների արագ զարգացումը հիշեցնում է լենտավիրուսային ինֆեկցիան։ Օրինակ այդ կերպ ընթանում է ՄԻԱՎ-դրդվող ՁԻԱՀ-ը,
- Որոշ բջիջներում, որոնք վարակված են սկրեյպիով և Կրեյտցֆելդտ-Յակոբի հիվանդությամբ, հայտնաբերվել են վիրուսանման մասնիկներ, որոնք կազմված չեն PrP-ից[59]։
Խոշոր եղջերավոր անասունների էնցեֆալոպատիայի[60] և մաքրված կոմպոնենտներով կատարված քիմիական ռեակցիների վերջերս կատարված հետազոտությունները[50] հստակորեն վկայում են ընդդեմ այդ հիվանդությունների վիրուսային բնության դեմ։ Բացի այդ, վիրուսային հիպոթեզի դեմ խոսում է նաև Jiyan Ma-ի վերոհիշյալ աշխատությունը[52]։
Պրիոնային հիվանդություններ[խմբագրել | խմբագրել կոդը]
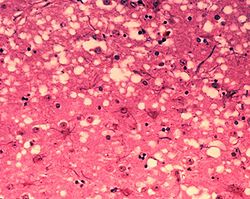
| Վարակվող կենդանիներ | Հիվանդություն |
|---|---|
| Ոչխարներ, Այծեր | սկրեյպի[61] |
| Կովեր | Խոշոր եղջերավոր անասունների սպունգային էնցեֆալոպատիա (ԽԵԱՍԷ), կամ կովերի կատաղություն[61] |
| Կզաքիսներ[61] | Կզաքիսների տրանսմասիվային էնցեֆալոպատիա (TME) |
| սպիտակապոչ եղջերու, եղջերու, որմզդեղն, ջորի[61] | Քրոնիկական թուլություն (CWD) |
| Կատուներ[61] | Կատվազգիների սպունգային էնցեֆալոպատիա (FSE) |
| Օրիքս, մեծ կուդու[61] | Արևադարձային սմբակավորների սպունգային էնցեֆալոպատիա (EUE) |
| Ջայլամ[62] | Սպունգային էնցեֆալոպատիա (փոխանցման դեպքեր չեն գրանցվել) |
| Մարդ | Կրեյտցֆելդտ-Յակոբի հիվանդություն (CJD)[61] |
| Կրեյտցֆելդտ-Յակոբի յատրոգենային հիվանդություն (iCJD) | |
| Կրեյտցֆելդտ-Յակոբի հիվանդության ձև (vCJD) | |
| Կրեյտցֆելդտ-Յակոբի ժառանգական հիվանդություն(fCJD) | |
| Կրեյտցֆելդտ-Յակոբի սպորադիկ հիվանդություն (sCJD) | |
| Հերստման-Շտրաուսլեր- Շեյնկերի սինդրոմ (GSS)[61] | |
| Ընտանեկան մահացու անքնություն (FFI)[63] | |
| Կուրու[61] |
Պրիոնները հարուցում են նեյրոդեգեներատիվ հիվանդություններ, քանի որ ձևավորում են կենտրոնական նյարդային համակարգի արտաբջջային կուտակումներ և ձևավորում են ամիլոիդային բշտիկներ, որոնք քանդում են հյուսվածքների նորմալ կառուցվածքը։ Քայքայումը բնորոշվում է «անցքերի» առաջացմամբ և հյուսվածքը ընդունում է սպունգանման կառուցվածք՝ նեյրոններում ներառուկների առաջացման պատճառով[64]։ Այդ ընթացքում նկատվող այլ հիստոլոգիական փոփոխություններն են՝ աստրոգլիոզը (իրար մոտ գտնվող նեյրոնների քայքայման հետևանքով աստրոցիտների քանակի ավելացում) և բորբոքային ռեակցիաների բացակայություն[65]։ Թեպետ բնական հիվանդությունների ինկուբացիոն շրջանը, որպես կանոն, տանում է ուղեղի վնասման և օրգանիզմի մահվան[66]։ Այդ ընթացքում առաջացող նեյրոդեգեներատիվ ախտանիշները կարող են լինել կոնվուլսիան, դեմենցիան, ատաքսիան (հավասարակշռված շարժումների խախտում), վարքային և անձնական փոփոխություններ։
Բոլոր հայտնի պրիոնային հիվանդությունները, որոնք միավորվում են սպունգային տրանսմիսիոն էնցեֆալոպատիան (ՍՏԷ) անվան տակ, անբուժելի են և մահացու[67]։ Մկների համար պատրաստվել է հատուկ վակցինա, հնարավոր է, դա կօգնի նաև մարդու համար վակցինաների հայտնագորխման համար[68]։ Բացի այդ, 2006 թվականին գիտնականները հայտարարեցին, որ գենային ինժեներիայի մեթոդների միջոցով ստացվել է կով, որը զրկված էր պրիոնային գենի առաջացնելու ունակությամբ, տեսականաորեն նա ունի ՍՏԷ-ի նկատմամբ իմունիտետ[69]։ Այս հետևությունը հիմնված են ուսումնասիրությունների վրա, որ մկները, որոնք զրկված են պրիոնային սպիտակուցի նորմալ ձևիվ, կայունություն են ցուցաբերել սկրեյպիի նկատմամբ[70]։
Պրիոնները վարակում են բազմատեսակ կաթնասուններ, և PrP սպիտակուցը չափազանց նման են բոլոր կաթնասունների մոտ[71]։ PrP-ի ոչ մեծ տարբերրությունների պատճառով պրիոնային հիվանդության միջտեսակային տեղափոխումը տարօրինակ երևույթ է։ Սակայն պրիոնային հիվանդության մարդկային ձևը (Կրեյցֆելդտ-Յակոբի հիվանդություն) հարուցվում է պրիոնի կողմից, որը սովորաբար վարակում է կովերին և առաջ է բերում խոշոր եղջերավոր անասունների էնցեֆալոպատիա, որը փոխանցվում է վարակված մսով[72]։
Առաջացման ուղիներ[խմբագրել | խմբագրել կոդը]
Համարվում է, որ պրիոնային հիվանդությունները կարող են ձեռք բերվել 3 ուղով՝ ուղղակի վարակման դեպքում, ժառանգաբար կամ հանկարծակի (սպոնտան)[73]։ Որոշ դեպքերում հիվանդության զարգացման համար անհրաժեշտ է այս գործոնների կոմբինացիան[74]։ Օրինակ, սկրեյպի զարգացման համար անհրաժեշտ է ինչպես վարակում, այնպես էլ գենոտիպով կապված զգայություն[75]։ Մեծ մասամբ պրիոնային հիվանդությունները առաջանում են սպոնտան՝ անհայտ պատճառներով։ Ժառանգական հիվանդությունների թվին դասվում են ընդհանուր դեպքերի 15 %-ը[76]։ Վերջապես, ամենաքիչ դեպքերը կազմում են շրջակա միջավայրից առաջացած հիվանդությունները, այսինքն նրանք, որոնք ունեն մարդածին բնություն և ծագում են պրիոնային վարակի հետևանքով[11]։
Սպոնտանային առաջացում[խմբագրել | խմբագրել կոդը]
Սպոնտային պրիոնային հիվանդությունը առաջանում է պոպուլյացիայի պատահական առանձնյակի մոտ։ Այդպիսին է, օրինակ, Կրեյտցֆելդտ-Յակոբի հիվանդության դասական տեսակը։ Կա պրիոնային հիվանդությունների սպոնտան առաջացման երկու հիմնական եղանակ։ Համաձայն նրանցից առաջինի սպոնտանային փոփոխությունները տեղի են ունենում ուղեղի նորմալ սպիտակուցներում, այսինքն առաջանում է հետտրանսլյացիոն ձևափոխության դեպքում[11]։ Ալտերնատիվ հիպոթեզը վկայում է, որ օրգանիզմի մեկ կամ մի քանի բջիջներ որևէ պահի դադարեցնում են սոմատիկ մուտացիաները (այսինքն ինֆորմացիա չեն փոխանցում) և սկսում են արտադրել դեֆեկտային սպիտակուց PrPSc-ը[77]։ Ինչպես էլ որ լինի, պրիոնային հիվանդությունների առաջացման կոնկրետ մեխանիզմն անհայտ է[11]։
Ժառանգականություն[խմբագրել | խմբագրել կոդը]

Հայտնաբերվել է գեն, որը կոդավորում է PrP սպիտակուցը՝ PRNP-ն[78], գտնվում է 20-րդ քրոմոսոմում։ Բոլոր ժառանգական պրիոնային հիվանդությունները կապված են այդ գենի մուտացիայի հետ։ Առանձնացվել են այս գենի մի շարք տարբեր մուտացիաներ (մոտ 30[11]), և այդ ընթացքում առաջացած մուտանտ սպիտակուցները առավել հակված են աննորմալ (պրիոնային) ձևին անցնելուն[75]։ Բոլոր այդպիսի մուտացիաները ժառանգվում են աուտոսոմ-դոմինանտ կերպով[11]։ Այս բացահայտումը անցք բացեց պրիոնների տեսության մեջ, համաձայն որի, պրիոնները կարող են պրիոնային ձևի վերածել միայն միանման ամինաթթվային կազմով միանման սպիտակուցներին։ Մուտացիները կարող են տեղի ունենալ ամբողջ գենի սահմանում։ Որոշ մուտացիաներ բերում են PrP սպիտակուցի N-ծայրի օկտապեպտիդային կրկնությունների քանդմանը։ Այլ հիվանդությունները, որոնք տանում են պրիոնային ժառանգական հիվանդության, կարող են տեղի ունենալ 102, 117 և 198 (Գերստման-Շտրաուսլեր-Շեյկերի սինդրոմ), 178, 200, 210 և 232 (Կրեյտցֆելդտ-Յակոբի հիվանդություն) և 178 (ընտանեկան մահացու անքնություն) դիրքերում։
Վարակում[խմբագրել | խմբագրել կոդը]
Ժամանակակից ուսումնասիրությունների տվյալներով, պրիոնային հիվանդությունների ջեռք բերման հիմնական ուղին վարակված մսի ուտելն է։ Համարվում է, որ պրիոնները կարող են մնալ մահացած կենդանիների մնացորդների շրջակայքում, ինչպես նաև մեզում, թքում և մարմնի այլ հեղուկներում և հյուսվածքներում։ Դրա պատճառով պրիոնային հիվանդությունը կարող է օրգանիզմ անցնել չվարակազերծված վիրահատական գործիքների միջոցով։ Նրանք կարող են մնալ նաև հողում՝ կավի և այլ հողային հանքային նյութերի հետ կապման շնորհիվ[79]։
Կալիֆորնիական համալսարանի մի խումբ հետազոտողներ՝ նոբելյան մրցանակակիր Սթենլի Պրուզների գլխավորությամբ ապացուցեցին, որ պրիոնային հիվանդությունները կարող են առաջանալ նաև գոմաղբի պրիոններից[80]։ Քանի որ գոմաղբ կա գրեթե բոլոր ջրամբարներում և արոտավայրերում, դա հնարավորություն է տալիս պրիոնային հիվանդությունների լայն տարածմանը։ 2011 թվականին հաղորդվեց մի պրիոնի հայտնաբերման մասին, որը տարածվում է աերոզոլի մասնիկների միջոցով (այսինքն օդակաթիլային ճանապարհով)[81]։ 2011 թվականին հրապարակվել է նաև նախնական ապացույց այն մասին, որ պրիոնները կարող են փոխանցել մեզից ստացած մարդու մենոպաուզային գոնադոտրոպինը, որը օգտագործվում է անպտղության բուժման համար[82]։
Մանրէազերծում[խմբագրել | խմբագրել կոդը]
Ինֆեկցիոն ագենտների բազմացումը, որոնք պարունակում են նուկլեինաթթուներ, կապված է նուկլեինաթթուներից։ Սակայն պրիոնները իրենց քանակը ավելացնում են՝ փոխելով սպիտակուցի նորմալ ձևը պրիոնայինի։ Այդ պատճառով պրիոնի դեմ ստերիլիզացիան պետք է միացնի նրանց դենատուրացիան այն աստիճանի, որում նրանք չեն կարողանա փոխել այլ սպիտակուցների կոնֆորմացիան։ Պրիոնները մեխամասամբ դիմացկուն են պրոտեազների, բարձր ջերմաստիճանի, ճառագայթման և ֆորմալինի նկատմամբ[83], սակայն այս միջոցները իջեցնում են նրանց էֆեկտիվությունը։ Պրիոնների դեմ էֆեկտիվ դեզինֆեկցիան պետք է ներառի պրիոնների հիդրոլիզ կամ նրանց երրորդային կառուցվածքի վնասում/քայքայում։ Դրան կարելի է հասնել նատրիումի հիդրօքսիդով, քլորակիրով և այլ ուժեղ օքսիդիչներով մշակելու դեպքում[84]։ 18 րոպե 134 °C-ոց գոլործային ավտոկլավը չի կարող ապաակտիվացնել պրիոնը[85][86]։ Պրիոնների վերացման և դենատուրացիայի համար ներկա ժամանակներում ուսումնասիրվում է օզոնային մանրէազերծումը[87]։ Ամբողջությամբ դենատուրացված պրիոնի ռենատուրացիան մինչ էֆեկտիվ վիծակի չի գրանցվել, սակայն մասնակի դենատուրացիա կատարած պրիոնների դեպքեր գրանցվել են[88]։
Պրիոնները և ծանր մետաղները[խմբագրել | խմբագրել կոդը]
Համաձայն վերջերս կատարված ուսումնասիրությունների, ուղեղում ծանր մետաղների փոխանակության խանգարումը կարևոր դեր է խաղում նեյրոտոքսիա մեջ, որը կապված է PrPSc-ի հետ, թեպետ մինչ այսօր ունեցած տվյալների միջոցով դժվար է բացատրել այդ մեխանիզմը։ Կա հիպոթեզ, որը ազդեցությունը բացատրում է նրանով, որ PrPC-ն որոշակի դեր է խաղում ծանր մետաղների նյութափոխանակության մեջ, և այդ սպիտակուցի ագրեգացիայի հետևանքով նրա խանգարումը ֆիբրիլներում առաջ է բերում ուղեղի ծանր մետաղների նյութափոխանակության դիսբալանս։ Համաձայն այլ տեսակետի, PrPSc-ի տոքսիկությունը ավելանում է PrPC-կախյալ մետաղների ագրեգատի միացման հետևանքով, ինչը տանում է PrPSc-ի համալիրների առաջացմանը, որոնք ունեն օքսիդավերականգնիչ ակտիվություն։ Որոշ PrPC-մետաղ կոմպլեքսների ֆիզիոլոգիական նշանակությունը հայտնի է, իսկ մյուսների նծանակությունը՝ ոչ[89]։
Պոտենցիալ բուժում և ախտորոշում[խմբագրել | խմբագրել կոդը]
Շնորհիվ համակարգչային մոդելավորման գիտնականներին հաջողվել է գտնել միացություններ, որոնք կարող են ծառայել որպես դեղորայք պրիոնային հիվանդությունների համար։ Օրինակ, մեկ միացությունը կարող է միանալ PrPC-ի հետ և կայունացնել նրա կառուցվածքը, իջեցնելով վտանգավոր PrPSc-ների քանակը[90]։
Վերջերս նկարագրվել են հակապրիոնային հակամարմիններ, որոնք ունակ են անցնել արյունաուղեղային պատնեշի միջով և գործել պրիոննների ցիտոզոլում[91]։
Վերջին տասնամյակներում հաջողություններ են գրանցվել մսում պրիոնների ինֆեկտիվության նվազման մեջ՝ գերբարձր ճնշման շնորհիվ[92]։
2011 թվականին հայտնաբերվել է, որ պրիոնները կարող են քայքայվել քարաքոսերի կողմից[93][94]։
Մեծ պրակտիկ նշանակություն ունի պրիոնային հիվանդությունների դիագնոստիկայի խնդիրը, մասնավորապես, խոշոր եղջերավոր անասունների սպունգային էնցեֆալոպատիան և Կրեյցֆելդտ-Յակոբի հիվանդությունները։ Նրանց ինկուբացիոն շրջանը կազմում է մեկ ամսից մինչև տասնյակ տարիներ, որոնց ընթացքում մարդը չի զգում որևէ նախանշաններ, նույնիսկ եթե ուղեղային նորմալ PrPC սպիտակուցների փոխակերպումը պրիոնայինի արդեն սկսվել է։ Ներկա պահին գրեթե գոյություն չունի PrPSc-ի հայտնաբերման միջոց, բացի մահից հետո ուղեղի նաեյրոպաթոլոգիական և իմունոհիստոքիմիական հետազոտություններից հետո։ Պրիոնային հիվանդությունների բնորոշ գիծը համարվում է PrP սպիտակուցի կուտակումը PrPSc ձևով, սակայն մարմնից հեշտ ստացվող հեղուկներում, ինչպիսին են արյունը և մեզը, այն պարունակվում է շատ քիչ կոնցետրացիայով։ Հետազոտողները փորձում էին մշակել PrPSc-ի մասնաբաժնի չափման մեթոդ, սակայն այժմ առաջվա պես չկան բոլորի կողմից ընդունված մեթեդներ։
2010 թվականին Նյու-Յորքի հետազոտողների խումբը նկարագրեց PrPSc-ի հայտնաբերման միջոց նույնիսկ այն ժամանակ, երբ նրա քանակը ուղեղում կազմում է 10−11։ Այս եղանակը համադրում է նոր սարքավորումների, որոնք կոչվում են Surround Optical Fiber Immunoassay (SOFIA) («Հարակից հյուսվածքների օպտիկական իմունոլոգիական անալիզ») միջոցով կատարվող ամպլիֆիկացիան և PrPSc-ի դեմ որոշ հատուկ սպեցիֆիկ հակամարմինները։ Բոլոր PrPSc-ների ամպլիֆիկացիայի միջոցով կոնսետրատցիան մեծացնելուց հետո, նմուշը նշվում է սպեցիֆիկ հակամարմիններով ֆլուորեսցենտրիկ ներկերով և վերջում տեղադրվում է միկրոկապիլար անոթի մեջ։ Հետո այդ անոթը տեղադրվում է հատուկ սարքի մեջ այնպես, որ այն ամբողջությամբ շրջապատվում է օպտիկական հյուսվածքներով և ամբողջ լույսը, որը մղվում է դեպի անոթ, կլանում է ներկանյութի կողմից, որը նախնական գրգռվել էր լազերային լույսով։ Այս տեխնիկան թույլ է տալիս հայտնաբերել PrPSc-ն նույնիսկ սպիտակուցների պրիոններ անցման նախնական փուլերում, ինչը, առաջին հերթին իջեցնում է վտանգը, իսկ երկրորդ հերթին արագացնում է գործընթացը։ Այս մեթոդով գիտնականները ուսումնասիրել են առաջին հայացքից առողջ թվացող ոչխարներին, որոնք իրականում վարակված էին սկրեյպիով։ Երբ հիվանդությունը դարձավ բացահայտ, հետազոտվեցին նաև նրանց ուղեղները։ Այդ կերպ, հետազոտողները հնարավորություն ստացան համեմատել ոչ ինֆեկցիոն և գաղտնի հիվանդ օրգանիզմների արյան և ուղեղային հյուսվածքի անալիզները։ Արդյունքները ցույց տվեցին, որ վերոհիշյալ տեխնիկան թույլ է տալիս օրգանիզմում հայտնաբերել PrPSc-ն առաջին ախտանիշներից բավական շուտ[95][96]։
Հակապրիոնային ակտիվություն հայտնաբերվել է աստեմիզոլի մոտ[97]։
Սնկերի պրիոններ[խմբագրել | խմբագրել կոդը]
| [PSI+] պրիոնների ձևավորումը չեղյալ է համարում կարմիր պիգմենտի ձևավորումը, որը առաջանում է ade1 գենի մուտացիայի հետևանքով (ներքևից), ինչի հետևանքով խմորասնկերի գաղութը սպիտակում է (վերևից)։ |
Սպիտակուցներ, որոնք ժառանգաբար կարող են փոխանցել իրենց կոնֆորմացիան, այսինքն ոչ մենդելյան օրինաչափություններով Ռիդ Ուիքերի կողմից 1990-ականների սկզբին հայտնաբերվել են Saccharomyces cerevisiae խմորասնկերի մոտ։ Կաթնասունների պրիոնների հետ նմանության պատճառով սպիտակուցների կոնֆորմացիայի այդպիսի ալտերնատիվ ժառանգվող տարրերը կոչվեցին խմորասնեկրի պրիոններ։ Ավելի ուշ պրիոններ հայտնաբերվել են Podospora anserina սնկերի մոտ։
Ուայտհեդի համալսարանի խումբը Սյուզան Լինդկվիստի (անգլ.՝ Susan Lindquist) գլխավորությամբ ցույց է տվել, որ սնկերի որոշ պրիոններ կապված չեն որևէ հիվանդության հետ, այլ կարող են օգտակար դեր խաղալ։ Սակայն NIH-ի հետազոտողները արգումենտ են ներկայացրել ի օգուտ նրա, որ սնկերի պրիոնները կարող են իջեցնել բջջի կենսունակությունը[98]։ Այդ պատճառով այն հարցը, թե համարվում են սնկերի պրիոնները հիվանդածին ագենտներ թե նրանք ինչ-որ օգտակար դեր են խաղում, մնում է անպատասխան[99]։
2012 թվականի դրությամբ հայտնի է սնկերի 11-12 պրիոններ՝ յոթը Saccharomyces cerevisiae-ի (Sup35, Rnq1, Ure2, Swi1, Mot3, Cyc8, Sfp1, Mca1', վակուոլային պրոտեազ B и Mod5) մոտ և մեկը Podospora anserina-ի (НЕТ-s, МАР-կինազ) մոտ։
Նրանցից առավել ուսումնասիրված է տրանսլյացիայի տերմինացիայի գործոն Sup35-ը (հոմոլոգ eRF3)։ Բջիջներում, որոնցում առկա է Sup35 պրիոնային ձևը, կոչվում են [PSI+] բջիջներ։ Այդպիսի բջիջները ունենում են փոփոխված ֆիզիոլոգիական վիճակ և որոշ գեների էքսպրեսիայի փոփոխված մակարդակ, ինչը թույլ է տալիս առաջ քաշել մի հիպոթեզ, ըստ որի դրոժների մոտ պրիոնների ձևավորումը կարող է հարմարողական դեր խաղալ[100]։
Mca1 պրիոնի հայտնաբերման մասին հոդվածը հետագայում չեղյալ համարվեց, քանի որ փորձի արդյունքները վերարտադրել չհաջողվեց[101]։ Նշանակալից է, որ սնկերի պրիոնների մեծամասնությունը հիմնված է գլուտամին/ասպարգին-առատ պտուըտների վրա, բացառություն համարվում են Mod5 և HET-s:
Ինչպես նշվեց վերևում, սնկերի պրիոնները, ի տարբերություն կաթնասունների պրիոնների, փոխանցվում են հաջորդ սերնդին։ Այլ կերպ ասած, սնկերի մոտ առկա է պրիոնային (սպիտակուցային) ժառանգականության մեխանիզմ, որը կարող է ծառայել որպես ցիտոպլազմային ժառանգականության վառ օրինակ[12]։
| Սնկերի պրիոններ | |||||
|---|---|---|---|---|---|
| Սպիտակուց | Տեր | Նորմալ ֆունկցիա | Պրիոնային ձև | Պրիոնային ֆենոտիպ | Հայտնաբերման թվական |
| Ure2p | Saccharomyces cerevisiae | Ազոտի յուրացման կատալիզատոր | [URE3] | Կարող է յուրացնել ուրեդոսուկցինատը որպես ազոտի աղբյուր[12] | 1994 |
| Sup35p | S. cerevisiae | Տրանսլյացիայի տերմինացիայի գործոն | [PSI+] | Ստոպ-կոդոնների կարդալու հաճախականության բարձրացում | 1994 |
| HET-S | Podospora anserina | Ցիտոպլազմային անկախության գործոն[12] | [Het-s] | Միայն համադրելի շտամների միջև հետերոկարիոնի ձևավորում | 1997 |
| Վակուոլային պրոտեազ B | S. cerevisiae | մեյոզի խանգարում, բջջի կյանքի երկարության նվազում | [β] | Սովի պայմաններում բջջային սպիտակուցների քայքայման խանգարում | 2003 |
| MAP-կինազներ | Podospora anserina | Պիգմենտացիայի ուժեղացում, դանդաղ աճ | [C] | 2006 | |
| Rnq1p | S. cerevisiae | Գործոն, որը ուժեղացնում է պրիոնների ձևավորումը | [RNQ+], [PIN+] | Նպաստում է այլ սպիտակուցների ագրեգացիային | |
| Mca1* | S. cerevisiae | Խմորասնկերի ենթդրյալ կասպազա | [MCA+] | Անհայտ է | 2008 |
| Swi1 | S. cerevisiae | Քրոմատինի կոնֆորմացիայի փոփոխություն | [SWI+] | Ածխածնի որոշ աղբյուրների մոտ վատ աճ | 2008 |
| Սուս8 | S. cerevisiae | Ռեպրեսորների տրանսկրիպցիա | [OCT+] | Բազմաթիվ գեների տրանսկրիպցիայի դեռեպրեսիա | 2009 |
| Mot3 | S. cerevisiae | Կորիզային տրանսկրիպցիոն գործոն | [MOT3+] | Անաերոբ գեների տրանսկրիպցիոն դեռեպրեսիա | 2009 |
| Sfp1[102] | S. cerevisiae | Տրանսկրիպցիայի ենթադրյալ կարգավորում | [ISP+] | Անտիսուպրեսիա | 2010 |
| Mod5[103] | Saccharomyces cerevisiae | [MOD+] | 2012 | ||
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 «Stanley B. Prusiner - Autobiography». NobelPrize.org. Արխիվացված օրիգինալից 2013 թ․ հունիսի 14-ին. Վերցված է 2013 թ․ հունիսի 18-ին.
- ↑ Somerville RA. (2002). «TSE agent strains and PrP: reconciling structure and function». Trends in Biochemical Sciences. 27 (12): 606–612. PMID 12468229., однако насчёт состава прионов есть и другие точки зрения, см. Гипотезы о составе прионов
- ↑ Aguzzi A (2008). «Unraveling prion strains with cell biology and organic chemistry». Proceedings of the National Academy of Sciences of the United States of America. 105 (1): 11–2. Bibcode:2008PNAS..105...11A. doi:10.1073/pnas.0710824105. PMC 2224168. PMID 18172195.
- ↑ «Are viruses alive? What about prions?».
- ↑ 5,0 5,1 5,2 Masel J, Jansen VAA, Nowak MA (1999 թ․ մարտ). «Quantifying the kinetic parameters of prion replication» (PDF). Biophysical Chemistry. 77 (2–3): 139–152. doi:10.1016/S0301-4622(99)00016-2. PMID 10326247.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Christopher M. Dobson (2001 թ․ փետրվար). «The structural basis of protein folding and its links with human disease» (PDF). Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1406): 133–45. doi:10.1098/rstb.2000.0758. PMC 1088418. PMID 11260793. Վերցված է 2011 թ․ նոյեմբերի 9-ին.
- ↑ CDC - Prion Diseases
- ↑ Prusiner SB (1998). «Prions». Proceedings of the National Academy of Sciences of the United States of America. 95 (23): 13363–83. Bibcode:1998PNAS...9513363P. doi:10.1073/pnas.95.23.13363. PMC 33918. PMID 9811807.
- ↑ 9,0 9,1 9,2 Krull, Ira S.; Brian K. Nunnally (2004). Prions and mad cow disease. New York, N.Y: Marcel Dekker. էջ 6. ISBN 0-8247-4083-1.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM Vol. 457։
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 Diseases (Transmissible Spongiform Encephalopathies)(չաշխատող հղում)
- ↑ 12,0 12,1 12,2 12,3 12,4 Инге-Вечтомов, 2010, էջ 298
- ↑ Lindquist S, Krobitsch S, Li L, Sondheimer N (2001 թ․ փետրվար). «Investigating protein conformation-based inheritance and disease in yeast». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1406): 169–76. doi:10.1098/rstb.2000.0762. PMC 1088422. PMID 11260797. Վերցված է 2011 թ․ նոյեմբերի 9-ին.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 14,0 14,1 14,2 14,3 «History of prions» (PDF). Արխիվացված է օրիգինալից (PDF) 2013 թ․ ապրիլի 18-ին. Վերցված է 2015 թ․ օգոստոսի 24-ին.
- ↑ «The Nobel Prize in Physiology or Medicine 1976» (անգլերեն). Нобелевский фонд. Արխիվացված օրիգինալից 2012 թ․ հոկտեմբերի 15-ին. Վերցված է 2013 թ․ հունիսի 19-ին.
- ↑ Alper T, Cramp WA, Haig DA, Clarke MC (1967 թ․ մայիս). «Does the agent of scrapie replicate without nucleic acid?». Nature. 214 (5090): 764–6. Bibcode:1967Natur.214..764A. doi:10.1038/214764a0. PMID 4963878.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Griffith JS (1967 թ․ սեպտեմբեր). «Self-replication and scrapie». Nature. 215 (5105): 1043–4. Bibcode:1967Natur.215.1043G. doi:10.1038/2151043a0. PMID 4964084.
- ↑ Crick F (1970 թ․ օգոստոս). «Central dogma of molecular biology». Nature. 227 (5258): 561–3. Bibcode:1970Natur.227..561C. doi:10.1038/227561a0. PMID 4913914.
- ↑ Taubes, Gary (1986 թ․ դեկտեմբեր). «The game of name is fame. But is it science?». Discover. 7 (12): 28–41.
- ↑ Priola SA, Chesebro B, Caughey B (2003). «Biomedicine. A view from the top-prion diseases from 10,000 feet». Science. 300 (5621): 917–9. doi:10.1126/science.1085920. PMID 12738843.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Barria MA, Mukherjee A, Gonzalez-Romero D, Morales R, Soto C. De novo generation of infectious prions in vitro produces a new disease phenotype. // PLoS Pathog.. — 2009. — В. 5(5). —
- ↑ Yusa S., Oliveira-Martins J. B., Sugita-Konishi Y., Kikuchi Y. Cellular prion protein: from physiology to pathology // Viruses. — 2012. — В. 11. — Т. 4. — С. 3109-3131. — — PMID 23202518.
- ↑ «PrP в базе данных UniProt». Արխիվացված օրիգինալից 2013 թ․ հուլիսի 2-ին. Վերցված է 2013 թ․ հունիսի 25-ին.
- ↑ van Rheede T., Smolenaars M. M., Madsen O., de Jong W. W. Molecular evolution of the mammalian prion protein // Mol Biol Evol. — 2003. — В. 1. — Т. 20. — С. 111-121. — PMID 12519913.
- ↑ Riek R., Hornemann S., Wider G., Billeter M., Glockshuber R., Wüthrich K. NMR structure of the mouse prion protein domain PrP(121-231) // Nature. — 1996. — В. 6587. — Т. 382. — С. 180-182. — PMID 8700211.
- ↑ Ronga L., Tizzano B., Palladino P., Ragone R., Urso E., Maffia M., Ruvo M., Benedetti E., Rossi F. The prion protein: Structural features and related toxic peptides // Chem Biol Drug Des. — 2006. — В. 3. — Т. 68. — С. 139-147. — PMID 17062011.
- ↑ Hegde RS, Mastrianni JA, Scott MR; և այլք: (1998). «A transmembrane form of the prion protein in neurodegenerative disease». Science. 279 (5352): 827–34. Bibcode:1998Sci...279..827H. doi:10.1126/science.279.5352.827. PMID 9452375.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Liberski PP, Brown DR, Sikorska B, Caughey B, Brown P. Cell death and autophagy in prion diseases (transmissible spongiform encephalopathies). // Folia Neuropathol.. — 2008. — № 46(1). — P. 1-25.
- ↑ Brown DR, Qin K, Herms JW; և այլք: (1997). «The cellular prion protein binds copper in vivo». Nature. 390 (6661): 684–7. Bibcode:1997Natur.390..684B. doi:10.1038/37783. PMID 9414160.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Málaga-Trillo E, Solis GP, Schrock Y; և այլք: (2009 թ․ մարտ). Weissmann, Charles (ed.). «Regulation of embryonic cell adhesion by the prion protein». PLoS Biology. 7 (3): e55. doi:10.1371/journal.pbio.1000055. PMC 2653553. PMID 19278297. Վերցված է 2010 թ․ փետրվարի 28-ին.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Pan KM, Baldwin M, Nguyen J; և այլք: (1993 թ․ դեկտեմբեր). «Conversion of alpha-helices into beta-sheets features in the formation of the scrapie prion proteins». Proceedings of the National Academy of Sciences of the United States of America. 90 (23): 10962–6. Bibcode:1993PNAS...9010962P. doi:10.1073/pnas.90.23.10962. PMC 47901. PMID 7902575.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Baker, Harry F., and Rosalind M. Ridley, eds. Prion diseases. Totowa, N.J: Humana, 1996
- ↑ Grassmann A, Wolf H, Hofmann J, Graham J, Vorberg I. Cellular aspects of prion replication in vitro. // Viruses.. — 2013. — В. 5(1). — С. 374-405. —
- ↑ Cohen FE, Pan KM, Huang Z, Baldwin M, Fletterick RJ, Prusiner SB (1994). «Structural clues to prion replication». Science. 265 (5178): 530–531. Bibcode:1994Sci...264..530C. doi:10.1126/science.7909169. PMID 7909169.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Eigen M (1996). «Prionics or the kinetic basis of prion diseases». Biophysical Chemistry. 63 (1): A1–18. doi:10.1016/S0301-4622(96)02250-8. PMID 8981746.
- ↑ Bolton DC, Rudelli RD, Currie JR, Bendheim PE (1991). «Copurification of sp33-37 and scrapie agent from hamster brain prior to detectable histopathology and clinical-disease». Journal of General Virology. 72 (12): 2905–2913. doi:10.1099/0022-1317-72-12-2905. PMID 1684986.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Jendroska K, Heinzel FP, Torchia M, Stowring L, Kretzschmar HA, Kon A, Stern A, Prusiner SB, DeArmond SJ (1991). «Proteinase-resistant prion protein accumulation in syrian-hamster brain correlates with regional pathology and scrapie infectivity». Neurology. 41 (9): 1482–1490. PMID 1679911.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)(չաշխատող հղում) - ↑ Beekes M, Baldauf E, Diringer H (1996). «Sequential appearance and accumulation of pathognomonic markers in the central nervous system of hamsters orally infected with scrapie». Journal of General Virology. 77 (8): 1925–1934. doi:10.1099/0022-1317-77-8-1925. PMID 8760444.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Bamborough P, Wille H, Telling GC, Yehiely F, Prusiner SB, Cohen FE (1996). «Prion protein structure and scrapie replication: theoretical, spectroscopic, and genetic investigations». Cold Spring Harbor Symposium on Quantitative Biology. 61: 495–509. doi:10.1101/SQB.1996.061.01.050. PMID 9246476.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Winkler J, Tyedmers J, Bukau B, Mogk A. Chaperone networks in protein disaggregation and prion propagation. // J Struct Biol.. — 2012. — В. 179(2). — С. 152-60.. —
- ↑ Knowles TPJ, Waudby CA, Devlin GL, Cohen SIA, Aguzzi A, Vendruscolo M, Terentjev EM, Welland ME, Dobson CM (2009). «An Analytical Solution to the Kinetics of Breakable Filament Assembly». Science. 326 (5959): 1533–1537. Bibcode:2009Sci...326.1533K. doi:10.1126/science.1178250. PMID 20007899.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Masel J, Jansen VAA (2000). «Designing drugs to stop the formation of prions and other amyloids». Biophysical Chemistry. 88 (1–3): 47–59. doi:10.1016/S0301-4622(00)00197-6. PMID 11152275.
- ↑ Abbott A. (2010 թ․ հունվարի 24). «Healthy prions protect nerves». Nature. doi:10.1038/news.2010.29.
- ↑ Shorter J, Lindquist S (2005 թ․ հունիս). «Prions as adaptive conduits of memory and inheritance». Nature Reviews. Genetics. 6 (6): 435–50. doi:10.1038/nrg1616. PMID 15931169.
- ↑ Maglio LE, Perez MF, Martins VR, Brentani RR, Ramirez OA (2004). «Hippocampal synaptic plasticity in mice devoid of cellular prion protein». Brain Research. Molecular Brain Research. 131 (1–2): 58–64. doi:10.1016/j.molbrainres.2004.08.004. PMID 15530652.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Caiati MD, Safiulina VF, Fattorini G, Sivakumaran S, Legname G, Cherubini E. (2013). «PrPC Controls via Protein Kinase A the Direction of Synaptic Plasticity in the Immature Hippocampus». The Journal of Neuroscience. 33 (7): 2973–83. doi:10.1523/JNEUROSCI.4149-12.2013. PMID 23407955.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Zhang CC, Steele AD, Lindquist S, Lodish HF (2006). «Prion protein is expressed on long-term repopulating hematopoietic stem cells and is important for their self-renewal». Proceedings of the National Academy of Sciences of the United States of America. 103 (7): 2184–9. Bibcode:2006PNAS..103.2184Z. doi:10.1073/pnas.0510577103. PMC 1413720. PMID 16467153.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 48,0 48,1 Baker & Ridley (1996). Prion Disease. New Jersey: Humana Press. ISBN 0-89603-342-2.
- ↑ Supattapone (2010). «What makes a prion infectious?». Science. 327 (5969): 1091–2. doi:10.1126/science.1187790. PMID 20185716.
- ↑ 50,0 50,1 Deleault NR, Harris BT, Rees JR, Supattapone S (2007). «Formation of native prions from minimal components in vitro». Proceedings of the National Academy of Sciences of the United States of America. 104 (23): 9741–6. Bibcode:2007PNAS..104.9741D. doi:10.1073/pnas.0702662104. PMC 1887554. PMID 17535913.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Geoghegan JC, Valdes PA, Orem NR; և այլք: (2007). «Selective incorporation of polyanionic molecules into hamster prions». The Journal of Biological Chemistry. 282 (50): 36341–53. doi:10.1074/jbc.M704447200. PMC 3091164. PMID 17940287.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 52,0 52,1 Wang F, Wang X, Yuan CG, Ma J (2010). «Generating a prion with bacterially expressed recombinant prion protein». Science. 327 (5969): 1132–5. Bibcode:2010Sci...327.1132W. doi:10.1126/science.1183748. PMC 2893558. PMID 20110469.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Legname G, Baskakov IV, Nguyen HO; և այլք: (2004). «Synthetic mammalian prions». Science. 305 (5684): 673–6. Bibcode:2004Sci...305..673L. doi:10.1126/science.1100195. PMID 15286374.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Makarava N, Kovacs GG, Bocharova O; և այլք: (2010). «Recombinant prion protein induces a new transmissible prion disease in wild-type animals». Acta Neuropathologica. 119 (2): 177–87. doi:10.1007/s00401-009-0633-x. PMC 2808531. PMID 20052481.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Deleault NR, Piro JR, Walsh DJ; և այլք: (2012 թ․ մայիս). «Isolation of phosphatidylethanolamine as a solitary cofactor for prion formation in the absence of nucleic acids». Proc. Natl. Acad. Sci. U.S.A. 109 (22): 8546–51. doi:10.1073/pnas.1204498109. PMID 22586108.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Deleault NR, Walsh DJ, Piro JR; և այլք: (2012 թ․ հուլիս). «Cofactor molecules maintain infectious conformation and restrict strain properties in purified prions». Proc. Natl. Acad. Sci. U.S.A. 109 (28): E1938–46. doi:10.1073/pnas.1206999109. PMID 22711839.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Manuelidis L (2007 թ․ մարտ). «A 25 nm virion is the likely cause of transmissible spongiform encephalopathies». Journal of Cellular Biochemistry. 100 (4): 897–915. doi:10.1002/jcb.21090. PMID 17044041.
- ↑ «Pathogenic Virus Found in Mad Cow Cells». Yale. 2007 թ․ փետրվարի 2. Արխիվացված է օրիգինալից 2012 թ․ մայիսի 3-ին. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ 59,0 59,1 Manuelidis L, Yu ZX, Barquero N, Banquero N, Mullins B (2007). «Cells infected with scrapie and Creutzfeldt-Jakob disease agents produce intracellular 25-nm virus-like particles». Proceedings of the National Academy of Sciences of the United States of America. 104 (6): 1965–70. Bibcode:2007PNAS..104.1965M. doi:10.1073/pnas.0610999104. PMC 1794316. PMID 17267596.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Castilla J, Saá P, Hetz C, Soto C (2005). «In vitro generation of infectious scrapie prions». Cell. 121 (2): 195–206. doi:10.1016/j.cell.2005.02.011. PMID 15851027.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 61,0 61,1 61,2 61,3 61,4 61,5 61,6 61,7 61,8 «90. Prions». ICTVdB Index of Viruses. U.S. National Institutes of Health website. 2002 թ․ փետրվարի 14. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ Hussein MF, Al-Mufarrej SI (2004). «Prion Diseases: A Review; II. Prion Diseases in Man and Animals» (PDF). Scientific Journal of King Faisal University (Basic and Applied Sciences). 5 (2): 139. Արխիվացված է օրիգինալից (PDF) 2011 թ․ մայիսի 10-ին. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ «BSE proteins may cause fatal insomnia». BBC News. 1999 թ․ մայիսի 28. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ Robbins SL, Cotran RS, Kumar V, Collins T, ed. (1999). Robbins pathologic basis of disease. Philadelphia: Saunders. ISBN 0-7216-7335-X.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: editors list (link) - ↑ Belay ED (1999). «Transmissible spongiform encephalopathies in humans». Annual Review of Microbiology. 53: 283–314. doi:10.1146/annurev.micro.53.1.283. PMID 10547693.
- ↑ «Prion Diseases». US Centers for Disease Control. 2006 թ․ հունվարի 26. Արխիվացված օրիգինալից 2013 թ․ հունիսի 15-ին. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ Gilch S, Winklhofer KF, Groschup MH; և այլք: (2001 թ․ օգոստոս). «Intracellular re-routing of prion protein prevents propagation of PrP(Sc) and delays onset of prion disease». The EMBO Journal. 20 (15): 3957–66. doi:10.1093/emboj/20.15.3957. PMC 149175. PMID 11483499.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ New York University Medical Center and School of Medicine (2005 թ․ մայիսի 14). «Active Vaccine Prevents Mice From Developing Prion Disease». Science Daily. Արխիվացված օրիգինալից 2013 թ․ հունիսի 15-ին. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ Weiss, Rick (2007 թ․ հունվարի 1). «Scientists Announce Mad Cow Breakthrough». The Washington Post. Վերցված է 2010 թ․ փետրվարի 28-ին. «Scientists said yesterday that they have used genetic engineering techniques to produce the first cattle that may be biologically incapable of getting mad cow disease.»
- ↑ Büeler H, Aguzzi A, Sailer A; և այլք: (1993). «Mice devoid of PrP are resistant to scrapie». Cell. 73 (7): 1339–47. doi:10.1016/0092-8674(93)90360-3. PMID 8100741.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Collinge J (2001). «Prion diseases of humans and animals: their causes and molecular basis». Annual Review of Neuroscience. 24: 519–50. doi:10.1146/annurev.neuro.24.1.519. PMID 11283320.
- ↑ Ironside JW (2006). «Variant Creutzfeldt-Jakob disease: risk of transmission by blood transfusion and blood therapies». Haemophilia : the Official Journal of the World Federation of Hemophilia. 12 Suppl 1: 8–15, discussion 26–8. doi:10.1111/j.1365-2516.2006.01195.x. PMID 16445812.
- ↑ Groschup MH, Kretzschmar HA, eds. (2001). «Prion Diseases Diagnosis and Pathogeneis». Archives of Virology. New York: Springer. Suppl 16.
{{cite journal}}:|author=has generic name (օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Geissen M, Krasemann S, Matschke J, Glatzel M (2007). «Understanding the natural variability of prion diseases». Vaccine. 25 (30): 5631–6. doi:10.1016/j.vaccine.2007.02.041. PMID 17391814.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 75,0 75,1 Goldmann W (2008). «PrP genetics in ruminant transmissible spongiform encephalopathies». Veterinary Research. 39 (4): 30. doi:10.1051/vetres:2008010. PMID 18284908.
- ↑ Clinic: Prion disease
- ↑ Clinic: Sporadic Prion Disease
- ↑ Oesch B, Westaway D, Wälchli M; և այլք: (1985). «A cellular gene encodes scrapie PrP 27–30 protein». Cell. 40 (4): 735–46. doi:10.1016/0092-8674(85)90333-2. PMID 2859120.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Johnson CJ, Pedersen JA, Chappell RJ, McKenzie D, Aiken JM (2007). «Oral transmissibility of prion disease is enhanced by binding to soil particles». PLoS Pathogens. 3 (7): e93. doi:10.1371/journal.ppat.0030093. PMC 1904474. PMID 17616973.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Tamgüney, Gültekin; Miller, Michael W., Wolfe, Lisa L., Sirochman, Tracey M., Glidden, David V., Palmer, Christina, Lemus, Azucena, DeArmond, Stephen J., Prusiner, Stanley B. (2009 թ․ սեպտեմբերի 9). «Asymptomatic deer excrete infectious prions in faeces». Nature. 461 (7263): 529–532. Bibcode:2009Natur.461..529T. doi:10.1038/nature08289. PMC 3186440. PMID 19741608.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ MacKenzie, Debora (2011 թ․ հունվարի 13). «Prion disease can spread through air». New Scientist. New Science Publications. Health. OCLC 60637733. Վերցված է 2011 թ․ ապրիլի 3-ին.
- ↑ Dorsselaer, Alain Van; Carapito, Christine; Delalande, François; և այլք: (2011 թ․ փետրվարի 10). Darlix, Jean-Luc (ed.). «Detection of Prion Protein in Urine-Derived Injectable Fertility Products by a Targeted Proteomic Approach». PLoS One. Vol. 6, no. 3. Public Library of Science (published 2011 թ․ մարտի 23). էջ e17815. doi:10.1371/journal.pone.0017815. ISSN 1932-6203. OCLC 70662135. PMC 3063168. PMID 21448279. Վերցված է 2011 թ․ ապրիլի 3-ին.
{{cite news}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Qin K, O'Donnell M, Zhao RY (2006 թ․ օգոստոս). «Doppel: more rival than double to prion». Neuroscience. 141 (1): 1–8. doi:10.1016/j.neuroscience.2006.04.057. PMID 16781817.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Race RE, Raymond GJ (2004). «Inactivation of transmissible spongiform encephalopathy (prion) agents by environ LpH». Journal of Virology. 78 (4): 2164–5. doi:10.1128/JVI.78.4.2164-2165.2004. PMC 369477. PMID 14747583.
- ↑ Collins SJ, Lawson VA, Masters CL (2004). «Transmissible spongiform encephalopathies». Lancet. 363 (9402): 51–61. doi:10.1016/S0140-6736(03)15171-9. PMID 14723996.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Brown P, Rau EH, Johnson BK, Bacote AE, Gibbs CJ, Gajdusek DC (2000). «New studies on the heat resistance of hamster-adapted scrapie agent: threshold survival after ashing at 600 degrees C suggests an inorganic template of replication». Proceedings of the National Academy of Sciences of the United States of America. 97 (7): 3418–21. Bibcode:2000PNAS...97.3418B. doi:10.1073/pnas.050566797. PMC 16254. PMID 10716712.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ «Ozone Sterilization». UK Health Protection Agency. 2005 թ․ ապրիլի 14. Արխիվացված է օրիգինալից 2008 թ․ մայիսի 22-ին. Վերցված է 2010 թ․ փետրվարի 28-ին.
- ↑ Weissmann C, Enari M, Klöhn PC, Rossi D, Flechsig E (2002). «Transmission of prions». Proceedings of the National Academy of Sciences of the United States of America. 99 Suppl 4 (90004): 16378–83. Bibcode:2002PNAS...9916378W. doi:10.1073/pnas.172403799. PMC 139897. PMID 12181490.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Singh N; և այլք: (2010). «Prion Protein and Metal Interaction: Physiological and Pathological Implications». The Prion Protein. Savanna Press. ISBN 978-0-9543335-2-2.
{{cite book}}: Explicit use of et al. in:|author=(օգնություն) - ↑ Kuwata K, Nishida N, Matsumoto T; և այլք: (2007). «Hot spots in prion protein for pathogenic conversion». Proceedings of the National Academy of Sciences of the United States of America. 104 (29): 11921–6. Bibcode:2007PNAS..10411921K. doi:10.1073/pnas.0702671104. PMC 1924567. PMID 17616582.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Daryl Rhys Jones, William Alexander Taylor, Clive Bate, Monique David, Mourad Tayebi A Camelid Anti-PrP Antibody Abrogates PrPSc Replication in Prion-Permissive Neuroblastoma Cell Lines // PLoS ONE. — 2010. — № 5(3). —
- ↑ Brown, P. Ultra-high-pressure inactivation of prion infectivity in processed meat: A practical method to prevent human infection // Proceedings of the National Academy of Sciences. — 2003. — № 100(10). — P. 6093-6097. —
- ↑ Johnson, Christopher; Bennett; Biro; Duque-Velasquez; Rodriguez; Bessen; Rocke; Bartz; James P. Bennett, Steven M. Biro, Juan Camilo Duque-Velasquez, Cynthia M. Rodriguez, Richard A. Bessen, Tonie E. Rocke (17th). Bartz, Jason C (ed.). «Degradation of the Disease-Associated Prion Protein by a Serine Protease from Lichens». PLoS ONE. 6 (5): 9836. Bibcode:2011PLoSO...6E9836J. doi:10.1371/journal.pone.0019836.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Yam, Philip. «Natural Born Prion Killers: Lichens Degrade "Mad Cow" Related Brain Pathogen». Scientific American. Արխիվացված օրիգինալից 2013 թ․ հունիսի 19-ին. Վերցված է 2013 թ․ հունիսի 18-ին.
- ↑ «Detecting Prions in Blood» (PDF). Microbiology Today: 195. 2010 թ․ օգոստոս. Արխիվացված է օրիգինալից (PDF) 2011 թ․ հոկտեմբերի 1-ին. Վերցված է 2011 թ․ օգոստոսի 21-ին.
- ↑ «SOFIA: An Assay Platform for Ultrasensitive Detection of PrPSc in Brain and Blood» (PDF). SUNY Downstate Medical Center. Արխիվացված է օրիգինալից (PDF) 2011 թ․ նոյեմբերի 9-ին. Վերցված է 2011 թ․ օգոստոսի 19-ին.
- ↑ Scripps Research Institute Scientists Identify First Potentially Effective Therapy for Human Prion Disease; Unique drug screening approach for prion diseases identifies tacrolimus and astemizole as antiprion agents / PNAS April 23, 2013 vol. 110 no. 17
- ↑ Dong J, Bloom JD, Goncharov V; և այլք: (2007). «Probing the role of PrP repeats in conformational conversion and amyloid assembly of chimeric yeast prions». The Journal of Biological Chemistry. 282 (47): 34204–12. doi:10.1074/jbc.M704952200. PMC 2262835. PMID 17893150.
{{cite journal}}: Explicit use of et al. in:|author=(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Halfmann R, Alberti S, Lindquist S (2010). «Prions, protein homeostasis, and phenotypic diversity». Trends in Cell Biology. 20 (3): 125–33. doi:10.1016/j.tcb.2009.12.003. PMC 2846750. PMID 20071174.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Galkin AP, Mironova LN, Zhuravleva GA, Inge-Vechtomov SG. (2006). «Yeast prions, mammalian amyloidoses, and the problem of proteomic networks». Genetica. 42 (11): 1558. PMID 17163073.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Nemecek, J; Nakayashiki, T, Wickner, RB (2011 թ․ հունիս). «Retraction for Nemecek et al.: A prion of yeast metacaspase homolog (Mca1p) detected by a genetic screen». Proceedings of the National Academy of Sciences of the United States of America. 108 (24): 10022. doi:10.1073/pnas.1107490108. PMC 3116407. PMID 21628591.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Rogoza T, Goginashvili A, Rodionova S, Ivanov M, Viktorovskaya O, Rubel A, Volkov K, Mironova L. (2010). «Non-Mendelian determinant [ISP+] in yeast is a nuclear-residing prion form of the global transcriptional regulator Sfp1.». Proc. Natl. Acad. Sci. U.S.A. 107 (23): 10573–7. doi:10.1073/pnas.1005949107. PMC 2890785. PMID 20498075.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Genjiro Suzuki, Naoyuki Shimazu, Motomasa Tanaka (2012). «A Yeast Prion, Mod5, Promotes Acquired Drug Resistance and Cell Survival Under Environmental Stress». Science. 336 (6079): 355–359. doi:10.1126/science.1219491.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)
Գրականություն[խմբագրել | խմբագրել կոդը]
- И. С. Шкундина, М. Д. Тер-Аванесян. Прионы. Успехи биологической химии, т. 46, 2006 Արխիվացված 2013-09-21 Wayback Machine (обзор)
- Григорьев В. Б. Прионные болезни человека и животных // Вопросы вирусологии. — 2004. — Т. 49. — № 5. — С. 4-12.
- Покровский В. И., Киселёв О. И., Черкасский Б. Л. Прионы и прионные болезни. — РАМН, 2004. — 384 с. — ISBN 5-7901-0038-4
- S. B. Prusiner. Prion biology and diseases. — New York: Cold Spring Harbor, 1999. — ISBN 0-87969-547-1
- Инге-Вечтомов С. Г. Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — 718 с. — ISBN 987-5-94869-105-3
- Список русскоязычной литературы по теме «Прионы и прионные болезни» Արխիվացված 2014-07-12 Wayback Machine
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
Անգլերեն լեզվով[խմբագրել | խմբագրել կոդը]
- Mad Cow Disease Արխիվացված 2020-10-27 Wayback Machine Կովերի կատաղության մասին ինֆորմացիա, Center for Global Food Issues.
- Madcowering Արխիվացված 2008-07-06 Wayback Machine A BSE-TSE blog.
- The Pathological Protein - Mad Cow, Chronic Wasting, and Other Deadly Prion Diseases Արխիվացված 2009-06-15 Wayback Machine (2003, updated online 2005). Philip Yam, Scientific American magazine writer and News Editor.
- Прионные заболевания Արխիվացված 2006-04-28 Wayback Machine (2003). Dr. Sean Heaphy, Leicester University.
- Prion Diseases and the BSE Crisis (1997). Stanley Prusiner–ի՝ պրիոնների հայտնաբերողի հոդվածը, Science magazine–ից.
- Britannica Nobel: Прион, 1997
- ICTVdb 90.001.0.01. Mammalian Prions
- Կովերի կատաղության մասին կայք՝ Mad Cow Disease
- News & Views on Mad Cow Disease, Mad Deer Disease, Chronic Wasting Disease, and Bovine Spongiform Encephalopathy Արխիվացված 2006-09-14 Wayback Machine
- Biography of Dr Prusiner
- Science Daily Պրիոնային հիվանդությունների դեմ վակցինայի հոդված
- Science Daily article on transmission of prions through soil
- Դիտարկում պրիոնների մասին Science Creative Quarterly–ից
- Prion disease animation
Ռուսաց լեզվով[խմբագրել | խմբագրել կոդը]
- Պրիոններ՝ ինֆեկցիոն հիվանդությունների հարուցիչների նոր դաս Արխիվացված 2009-06-16 Wayback Machine, В. А. Зуев, НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Москва // АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N10, стр. 33-38.
- Պրիոնային հիվանդությունների պաթոգենեզը(չաշխատող հղում)
- Պրիոններ Արխիվացված 2013-09-21 Wayback Machine // Успехи биологической химии, т. 46, 2006, с. 3-423
- Ս․ Շնոլ, Պրիոնների սպիտակուցներ (видеолекция) // Univertv.ru и МГУ, 27.02.2009
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի օրվա հոդված: |

