ՌՆԹ

Ռիբոնուկլեինաթթու, (ՌՆԹ), բոլոր կենդանի օրգանիզմներում պարունակվող երեք հիմնական մակրոմոլեկուլներից մեկը (մյուս երկուսը ԴՆԹ-ն և սպիտակուցներն են)։ Այնպես, ինչպես ԴՆԹ-ն, ՌՆԹ-ն նույնպես կազմված է նուկլեոտիդների շղթայից[1]։ Յուրաքանչյուր նուկլեոտիդ կազմված է ազոտային հիմքից, միաշաքարից (ռիբոզ) և ֆոսֆատային խմբից։ Նուկլեոտիդների հաջորդականության շնորհիվ ՌՆԹ-ն կարողանում է գաղտնագրել գենետիկական ինֆորմացիան։ Բոլոր բջջային օրգանիզմներն օգտագործում են իՌՆԹ-ն՝ սպիտակուցների սինթեզը ծրագրավորելու համար։
Բջջային ՌՆԹ-ն առաջանում է տրանսկրիպցիայի արդյունքում, որը ԴՆԹ-ի կաղապարի հիման վրա իրականացվող ՌՆԹ-ի ֆերմենտատիվ սինթեզն է։ Այս գործընթացն իրականանում է հատուկ ֆերմենտների՝ ՌՆԹ-պոլիմերազների միջոցով։ Տրանսկրիպցիայի արդյունքում առաջացած ՌՆԹ-ները հետագայում մասնակցում են սպիտակուցի կենսասինթեզին, որն իրականացնում են ռիբոսոմները։ Տրանսկրիպցիայից հետո մյուս ՌՆԹ-ները ենթարկվում են քիմիական ձևափոխությունների և կախված ՌՆԹ-ի տեսակից՝ առաջացնում երկրորդային և երրորդային կառուցվածքներ։
Միաշղթա ՌՆԹ-ները բնութագրվում են տարածական կառուցվածքներով, որտեղ շղթայի նույն նուկլեոտիդային հաջորդականությունները կապված են միմյանց հետ։ Որոշ բարձրակառուցվածքային ՌՆԹ-ներ, օրինակ՝ փՌՆԹ-ները, մասնակցում են սպիտակուցի կենսասինթեզին, ծառայում են կոդոնների ճանաչմանը և համապատասխան ամինաթթվի տեղափոխմանը սպիտակուցի սինթեզի վայր, իսկ ռՌՆԹ-ները կազմում են ռիբոսոմի հիմնական կառուցվածքային միավորը։
ՌՆԹ-ի ֆունկցիաները չեն սահմանափակվում միայն տրանսլյացիայում ունեցած նրանց դերով։ Փոքր կորիզային ՌՆԹ-ները, օրինակ, մասնակցում են էուկարիոտների իՌՆԹ-ների սփլայսինգին։
ՌՆԹ-ները մտնում են նաև որոշ ֆերմենտների կազմի մեջ (օրինակ՝ թելոմերազներ). որոշ ՌՆԹ-ների մոտ նկատվել է սեփական ֆերմենտատիվ ակտիվություն։
Մի շարք վիրուսների գենոմը կազմված է ՌՆԹ-ից, որը նրանց մոտ ունի այն նշանակությունը, ինչ բարձրակարգ օրգանիզմների մոտ ԴՆԹ-ն։ ՌՆԹ-ի ֆունկցիայի այսպիսի բազմազանության պատճառով ենթադրվում է, որ նախաբջջային առաջին կրկնապատկման ունակ մոլեկուլները եղել են ՌՆԹ-ները։
Ուսումնասիրման պատմություն[խմբագրել | խմբագրել կոդը]

Նուկլեինաթթուները հայտնաբերել է շվեյցարացի գիտնական Յոհան Միշերը 1868 թվականին։ Միշերն այս միացություններն անվանել է նուկլեին, քանի որ դրանք առանձնացվել էին կորիզից (լատին․՝ nucleus)[2]։ Հետագայում պարզվեց, որ նախակորիզավոր բջիջները նույնպես պարունակում են նուկլեինաթթուներ։ ՌՆԹ-ի դերը սպիտակուցների սինթեզում առաջարկվել է 1939 թվականին Տորբյորն Օսկար Կասպերսոնի, Ժան Բրաչետի և Ջեք Շուլցի աշխատանքներում[3]։
Ջերարդ Միարբաքսն առանձնացրել է առաջին ՌՆԹ-ն, որը կոդավորում էր ճագարի հեմոգլոբինը և ցույց է տվել, որ երբ այն մտցվում է օոցիտի մեջ, բջջում սկսվում է սինթեզվել հեմոգլոբին[4]։
1956-1957 թվականներին աշխատանքներ են տարվել բջջի ՌՆԹ-ի կառուցվածքը պարզելու ուղղությամբ։ Պարզվել է, որ բջջում ՌՆԹ-ի հիմնական մասը ռիբոսոմային է (ռ-ՌՆԹ)[5]։
Սևերո Օչոան 1959 թվականին ստացել է բժշկության Նոբելյան մրցանակ՝ ՌՆԹ-ի սինթեզի մեխանիզմը պարզելու համար[6]։ Հետագայում ցույց է տրվել, որ Օչաոյի կողմից հայտնաբերված ֆերմենտը մասնակցում է ՌՆԹ-ի դեգրադացիային, այլ ոչ թե սինթեզին։ 1956 թվականին Ալեքս Ռիչը և Դեյվիդ Դևիեսը հիբրիդիզացրեցին ՌՆԹ-ի երկու առանձին պարույրները՝ ստանալով ՌՆԹ-ի առաջին բյուրեղը, որի կառուցվածքը հնարավոր է պարզել ռենտգենյան բյուրեղագրությամբ[7]։
Խմորասնկերից մեկի՝ (S. cerevisiae) փՌՆԹ-ի 77 նուկլեոտիդների հաջորդականությունը պարզվել է 1965 թվականին Ռոբերտ Հոլեյի լաբորատորիայում, որի համար վերջինս 1968 թվականին ստացել է բժշկության Նոբելյան մրցանակ[8]։ 1967 թվականին Կարլ Վյոզեն ենթադրեց, որ ՌՆԹ-ն օժտված է նաև կատալիտիկ հատկություններով։ Նա առաջադրեց այսպես կոչված ՌՆԹ աշխարհի վարկածը, ըստ որի՝ պորտոօրգանիզմների ՌՆԹ-ն ծառայել է ինչպես տեղեկատվության պահպանման համար (այժմյան օրգանիզմների մոտ այդ դերը կատարում է ԴՆԹ-ի մոլեկուլը), այնպես էլ ունեցել է կատալիտիկ ակտիվություն (ներկայումս այս ֆունկցիան կատարում են հիմնականում սպիտակուցները)[9][10]։

Վաղ 1970-ականներին հայտնաբերվեցին ռետրովիրուսները և հակառակ տրանսկրիպտազը, ցույց տրվեց, որ ֆերմենտները կարող են ՌՆԹ-ի կաղապարի վրա սինթեզել ԴՆԹ։ Այս աշխատանքի համար 1975 թվականին Դեյվիդ Բալտիմորը, Ռենատո Դուլվեկոն և Հովարդ Թեմինը ստացան Նոբելյան մրցանակ։ 1976 թվականին Ուոլտեր Ֆիրզը և իր աշխատակիցները պարզեցին առաջին ՌՆԹ վիրուսի՝ բակտերիոֆագ MS2-ի գենոմի նուկլեոտիդների հաջորդականությունը[11]։ 1977 թվականին կաթնասունների վիրուսներում և բջիջների գեներում բացահայտվեցին ինտրոնները և ՌՆԹ-ի սփլայսինգը, որի համար Ֆիլիպ Շարփը և Ռիչարդ Ռոբերտսը ստացան Նոբելյան մրցանակ։ Վաղ 1980-ականներին հայտնաբերվեցին առաջին ռիբոզիմները, որի համար 1989 թվականին Թոմաս Սեչը և Սիդնի Էլթմենը ստացան Նոբելյան մրցանակ։ 1990 թվականին հայտնաբերվեց, որ Petunia բույսի գենոմում օտար գեների ներմուծումը բերում է բույսերի համապատասխան գեների ճնշմանը՝ լռեցմանը (սայլեսինգ), որն այժմ հայտնի է ՌՆԹ ինտերֆերենցիա անվանումով[12][13]։
Միաժամանակ ցույց տրվեց, որ մոտ 22 հիմքից կազմված ՌՆԹ-ները, որոնք ներկայումս անվանվում են միկրոՌՆԹ-ներ, կարևոր դեր ունեն C. elegans նեմատոդների օնտոգենեզում[14]։ ՌՆԹ ինտերֆերենցիայի ուսումնասիրության համար Էնդրյու Ֆայերը և Քրեյգ Մելլոն ստացան Նոբելյան մրցանակ, նույն տարում Նոբելյան մրցանակ ստացան նաև Ռոջեր Քորնբերգը՝ ՌՆԹ-ի տրանսկրիպցիայի հետազոտությունների համար։ Գեները կարգավորող ՌՆԹ-ների հայտնաբերումը խթանեց ՌՆԹ-ից կազմված դեղամիջոցների պատրաստումը (օրինակ՝ փիՌՆԹ-ներ), որոնք կարող են լռեցնել, արգելակել որոշակի գեներ[15]։
Քիմիական կառուցվածք և մոնոմերների ձևափոխություններ[խմբագրել | խմբագրել կոդը]

ՌՆԹ-ի նուկլեոտիդները կազմված են մոնոշաքար ռիբոզից, որին 1' դիրքում միանում է ադենին, գուանին, ցիտոզին կամ ուրացիլ[16] հիմքերից մեկը։ Ֆոսֆատային խումբը ռիբոզները միացնում է շղթայի մեջ՝ առաջացնելով կապ ռիբոզներից մեկի 3' դիրքի ածխածնի ատոմի և մյուսի 5'-ի ածխածինների միջև։ Ֆոսֆատային խմբերը ֆիզիոլոգիական pH-ում բացասական լիցքավորված են, դրա համար ՌՆԹ-ն պոլիանիոն է։ Ջրածնային կապեր են առաջանում ադենինի և ուրացիլի, գուանինի և ուրացիլի ու ցիտոզինի և գուանինի միջև[17]։ Այլ հարաբերություններ նույնպես հնարավոր են, օրինակ՝ մի խումբ ադենինների միացումը միմյանց[18] կամ ԳՆՌԱ քառօղակը, որում առկա են գուանին-ադենին զույգեր[17]։ ՌՆԹ-ն տրանսկրիպցվում է որպես 4 հիմքերի պոլիմերային մոլեկուլ, բայց հասուն ՌՆԹ-ներում կան շատ ձևափոխված հիմքեր և մոնոսախարիդներ[19]։ ՌՆԹ-ում հաշվվում են մոտ 100 տարբեր տեսակի ձևափոխված նուկլեոտիդներ, որոնցից 2'-O-մետալռիբոզը՝ մոնոշաքարի, իսկ փսևդոուրինը՝ ազոտային հիմքի ամենից հաճախ հանդիպող ձևափոխությունն է[20]։
ՌՆԹ-ի տարբերակից կառուցվածքային հատկանիշներից մեկը 2' դիրքում հիդրօքսիլ խմբի առկայությունն է ռիբոզ շաքարում։ Այս ֆունկցիոնալ խմբի առկայությունը ստիպում է, որ պարույրը ստանա А ձևի կառուցվածք[21]՝ չնայած շատ հազվադեպ այն կարող է ընդունել նաև B ձև, ինչպես ԴՆԹ-ում է[22]։ A տեսակի երկրաչափական ձևն առաջացնում է խորը և նեղ մեծ ակոսներ և մակերեսային և լայն փոքր ակոսներ[23]։ 2'-հիդրօքսիլ խմբի առկայությունը կարող է նաև ՌՆԹ-ի կոնֆորմացիոն ավելի ճկուն հատվածներում բերել հարող ֆոսֆոդիէթերային կապի խզմանը և հիմնական շղթային միացմանը[24]։
ՌՆԹ-ի հասունացման ընթացքում ՌՆԹ-ի կազմի մեջ մտնող շաքարները և հիմքերը կարող են ձևափոխվել՝ առաջացնելով ձևափոխված հիմքեր։ Փսևդոուրիդինի (Ψ) ուրացիլի և ռիբոզի կապը C-N չէ, այլ՝ C-C. այս նուկլեոտիդը ՌՆԹ-ի մոլեկուլում հանդիպում է տարբեր դիրքերում։ Մասնավորապես, փսևդոուրիդինը կարևոր է փՌՆԹ ֆունկցիոնալ ակտիվության համար[25]։ Հաջորդ կարևոր ձևափոխված հիմքը հիպոքսանտինն է՝ դեամինացված գուանինը, որի նուկլեոզիդը կրում է ինոզին (I) անվանումը։ Ինոզինը կարևոր դեր ունի գենետիկական կոդի ընդհանրության ֆունկցիայի ապահովման մեջ[26]։

Կան 100-ից ավելի բնական ձևափոխված նուկլեոզիդներ[27]։ Ամենամեծ կառուցվածքային բազմազանությունը փՌՆԹ-ում է[28], իսկ ռՌՆԹ-ում ամենից տարածված են փսևդոուրինը և 2'-O-մեթիլռիբոզով նուկլեոզիդները[29]։ Շատ այլ ձևափոխությունների դերը դեռևս ամբողջությամբ պարզ չէ, սակայն ռիբոսոսմային ՌՆԹ-ի շատ հետտրանսկրիպցիոն ձևափոխություններ գտնվում են կարևոր ֆունկցիոնալ հատվածներում[30]
Միաշղթա ՌՆԹ-ների ֆունկցիոնալ ձևը, ինչպես սպիտակուցներում, սովորաբար ունի երրորդային կառուցվածք։ Երրորդային կառուցվածքն ապահովվում է երկրորդական կառուցվածքային տարրերի, օրինակ՝ մոլեկուլում ջրածնային կապերի առաջացմամբ։ Սա թույլ է տալիս երրորդային կառուցվածքում տարբերել դոմեններ, ինչպիսիք են օրինակ ամրակային օղակները, արտափքումներ, ներքին օղակներ[31]։ Քանի որ ՌՆԹ-ն լիցքավորված է, անհրաժեշտ են մետաղի իոններ, օրինակ՝ Mg2+, շատ երկրորդային և երրորդային կառուցվածքներ կայունացնելու համար[32]։ ՌՆԹ-ի բնական էնանտիոմերը D-ՌՆԹ-ն է, կազմված D-ռիբոնուկլեոտիդներից։ Քիրալության բոլոր կենտրոնները գտնվում են D-ռիբոզում։ L-ռիբոզի կամ ավելի շատ L-ռիբոնուկլեոտիդների միջոցով հնարավոր է սինթեզել L-ՌՆԹ-ն։ L-ՌՆԹ-ն ավելի կայուն է ՌՆազների դեգրադացիայի հանդեպ[33]։
Ինչպես մյուս կառուցվածքային կենսապոլիմերների դեպքում հնարավոր է պարզել ՌՆԹ-ի պարուրված մոլեկուլի տոպոլոգիան։ Սա սովորաբար իրականացվում է միջշղթայական կապերի դասավորության որոշմամբ, որն անվանվում է ցիկլերի տոպոլոգիա։
Համեմատություն ԴՆԹ-ի հետ[խմբագրել | խմբագրել կոդը]

ՌՆԹ-ի և ԴՆԹ-ի միջև գոյություն ունի 3 հիմնական տարբերություն.
- ԴՆԹ-ն պարունակում է դեզօքսիռիբոզ, իսկ ՌՆԹ-ն՝ ռիբոզ[34], որն ունի լրացուցիչ հիդրօքսիլ խումբ։ Այս խումբը մեծացնում է մոլեկուլի հիդրոլիզի հավանականությունը, այսինքն՝ նվազեցնում ՌՆԹ-ի մոլեկուլի կայունությունը։
- Ադենինին կոմպլեմենտար նուկլեոտիդը ոչ թե թիմինն է, ինչպես ՌՆԹ-ում, այլ ուրացիլը, որը թիմինի չմեթիլացված ձևն է[35]։
- ԴՆԹ-ն երկպարույր է, որը կազմված է առանձին երկու մոլեկուլներից։ ՌՆԹ-ի մոլեկուլները հիմնականում ավելի կարճ են[36] և միաշղթա[37]։ ՌՆԹ-ի որոշ մոլեկուլներ կարող են առաջացնել կրկնակի պարույրներ, ինչպես օրինակ փՌՆԹ-ում է։
Սպիտակուց չգաղտնագրող սպիտակուցների՝ փՌՆԹ-ի, ռՌՆԹ-ի, մՌՆԹ-ի, մկՌՆԹ-ի և այլ չգաղտնագրող ՌՆԹ-ների կառուցվածքային անալիզը ցույց է տվել, որ վերջիններս կազմված են կարճ, միմյանց հետ կապված շղթաներից, որոնք պարուրվելով և միանալով առաջացնում են սպիտակուցների երրորդային կառուցվածքներին նման կառույցներ[38]։ Սրա հետևանքով ՌՆԹ-ն կարող է կատալիզել տարբեր քիմիական ռեակցիաներ, օրինակ՝ ռիբոսոմի պեպտիդ-տրանսֆերազային կենտրոնն ամբողջությամբ կազմված է ՌՆԹ-ից և մասնակցում է սպիտակուցների պեպտիդային կապերի առաջացմանը[39][40][41]։ Օրինակ՝ ռիբոսոմի կառուցվածքի բացահայտումը ցույց տվեց, որ ակտիվ կենտրոնն ամբողջությամբ կազմված է ՌՆԹ-ներից[42]։
ՌՆԹ-ի սինթեզ[խմբագրել | խմբագրել կոդը]
Կենդանի բջիջներում ՌՆԹ-ի սինթեզն իրականացվում է հատուկ ֆերմենտի՝ ՌՆԹ-պոլիմերազի միջոցով։ Էուկարիոտների մոտ ՌՆԹ-ի տարբեր տեսակները սինթեզվում են տարբեր կերպ՝ հատուկ մասնագիտացված ՌՆԹ-պոլմերազներով։ ՌՆԹ-ի սինթեզի համար կաղապար կարող է ծառայել ինչպես ՌՆԹ-ն, այնպես էլ՝ ԴՆԹ-ն։ Օրինակ՝ որոշ պոլիովիրուսների՝ ՌՆԹ-ից բաղկացած գենետիկական նյութի կրկնապատկման համար օգտագործվում է ՌՆԹ-կախյալ ՌՆԹ-պոլիմերազան[43]։ ՌՆԹ-կախյալ ՌՆԹ սինթեզը տեղի է ունենում ինչպես վիրուսներում, այնպես էլ բջջային օրգանիզմներում ՌՆԹ ինտերֆերենցիայի ընթացքում[44]։
Ե՛վ ԴՆԹ-կախյալ ՌՆԹ-պոլիմերազները, և՛ ՌՆԹ-կախյալ ՌՆԹ-պոլիմերազները միանում են պրոմոտորային հաջորդականությանը։ Մատրիքսի մոլեկուլի երկրորդային կառուցվածքը ճեղքվում է հելիկազային ակտիվություն ունեցող պոլիմերազների միջոցով, որը սուբստրատի վրա շարժվում է 3'-5' ուղղությամբ և միաժամանակ սինթեզում ՌՆԹ 5' → 3' ուղղությամբ։ Սկզբնական մոլեկուլի վրա գտնվող տերմինատորը որոշում է տրանսկրիպցիայի ավարտը[45]։ ՌՆԹ-ի շատ մոլեկուլներ սինթեզվում են իրենց նախնական ձևերով, որոնք հետագայում ենթարկվում են խմբագրումների. ՌՆԹ-սպիտակուցային համակարգերի միջոցով հեռացվում են անպետք հատվածները[46]։
Օրինակ՝ աղիքային ցուպիկի մոտ մեկ օպերոնի սահմաններում տեղակայված ռՌՆԹ-ի գեները (rrnB-ում դասավորման հաջորդականությունն այսպիսին է. 16S - tRNAGlu 2 - 23S-5S) ճանաչվում են մեկ երկար մոլեկուլի ձևով, որը հետագայում ենթարկվում է ճեղքման մի քանի հատվածներից, սկզբում՝ նախաՌՆԹ-ի և ապա՝ ռՌՆԹ-ի հասուն մոլեկուլների տեսքով[47]։ ՌՆԹ-ի նուկլեոտիդների հաջորդականության փոփոխությունը ՌՆԹ-ի սինթեզից հետո անվանվում է ՌՆԹ-ի խմբագրում կամ պրոցեսինգ։
Տրանսկրիպցիայի ավարտից հետո ՌՆԹ-ն հաճախ ենթարկվում է տարբեր ձևափոխությունների, որոնք անմիջականորեն կախված են տվյալ մոլեկուլի կատարած ֆունկցիայից։ Էուկարիոտների մոտ ՌՆԹ-ի մոլեկուլի հասունացումը հաճախ ընդգրկում է սփլայսինգը, որի ընթացքում ռիբոպրոտեիդների (սփլայսոսոմներ) միջոցով հեռացվում են չկոդավորող հատվածները (ինտրոնները)։ Այնուհետև նախա-մՌՆԹ-ի 5' ծայրին ավելացվում է հատուկ ձևափոխված նուկլեոտիդ (կեպ), իսկ 3' ծայրին՝ մի քանի ադենիններ՝ այսպես կոչված պոլի-A պոչը[46]։
ՌՆԹ-ի տեսակներ[խմբագրել | խմբագրել կոդը]

ՄՌՆԹ-ն կամ իՌՆԹ-ն ԴՆԹ-ում գաղտնագրված ինֆորմացիայի՝ դեպի ռիբոսոմներ փոխադրման ժամանակ ծառայում է որպես միջնորդ։ իՌՆԹ-ում գաղտնագրված հաջորդականությունը որոշում է սինթեզվող սպիտակուցի պոլիպետիդային շղթայի ամինաթթվային հաջորդականությունը[48]։ ՌՆԹ-ների ճնշող մեծամասնությունը սպիտակուց չի կոդավորում։ Այս չգաղտնագրող ՌՆԹ-ները կարող են տրանսկրիպցվել տարբեր գեների հետ (օրինակ՝ ռՌՆԹ) կամ լինել պատահական ինտրոններ[49]։ Դասական, մանրամասն հետազոտված չկոդավորող ՌՆԹ-ի տեսակները, փոխադրող ՌՆԹ-ներն են (փՌՆԹ) և ռՌՆԹ-ները, որոնք մասնակցում են տրանսլյացիային[50]։ Գոյություն ունեն նաև ՌՆԹ-ի դասեր, որոնք ապահովում են գեների կարգավորումը, ռՌՆԹ-ի պրոցեսինգը և այլն։ Բացի այդ, կան նաև այնպիսի ՌՆԹ-ի տեսակներ, որոնք ունեն ֆերմենտատիվ ակտիվություն (օրինակ՝ ՌՆԹ-ի մոլեկուլների ճեղքումը և սոսնձումը[51]): Էնզիմ անվան նմանությամբ ՌՆԹ-ի կատալիտիկ ակտիվություն ցուցաբերող մոլեկուլներն անվանվում են ռիբոզիմներ։
Մասնակցությունը տրանսլյացիային[խմբագրել | խմբագրել կոդը]
Սպիտակուցի ամինաթթվային հաջորդականության մասին տեղեկատվությունը գտնվում է իՌՆԹ-ում։ Երեք նուկլեոտիդների հաջորդականությունը համապատասխանում է ամինաթթուներից մեկին։ Էուկարիոտների բջիջներում նախա-իՌՆԹ-ն կամ պրե-իՌՆԹ-ն ենթարկվում է պրոցեսինգի, որի հետևանքում ձևավորվում է հասուն իՌՆԹ-ն։ Պրոցեսինգը ներառում է սպիտակուց չկոդավորող հատվածների՝ ինտրոնների հեռացումը։ Այնուհետև իՌՆԹ-ն դուրս է բերվում բջջակորիզից դեպից ցիտոպլազմա, որտեղ վերջինիս միանում են ռիբոսոմները և սկսում սպիտակուցի կենսասինթեզը՝ տրանսլյացիան՝ փՌՆԹ-ին միացած ամինաթթուների մասնակցությամբ։
Նախակորիզավոր բջիջներում (բակտերիաներ և արքեաներ) ռիբոսոմները կարող են միանալ իՌՆԹ-ին անմիջապես տրանսկրիպցիայից հետո։ Էուկարիոտների և պրոկարիոտների մոտ իՌՆԹ-ի կյանքի ցիկլն ավարտվում է ռիբոնուկլեազների միջոցով, որոնք ճեղքում են իՌՆԹ-ի մոլեկուլները[48]։
Փոխադրող ՌՆԹ (փՌՆԹ) կարճ՝ մոտ 80 նուկլեոտիդներից բաղկացած երրորդային կառուցվածք ունեցող մոլեկուլներ են։ փՌՆԹ-ները սինթեզի վայր են տեղափոխում յուրահատուկ ամինաթթուներ։ Յուրաքանչյուր փՌՆԹ ունի ամինաթթվին միանալու և հակակոդոնի տեղամաս։
Ռիբոսոմային ՌՆԹ-ն (ռՌՆԹ) ռիբոսոմի կատալիտիկ կառուցվածքային մասն է։ Էուկարիոտների ռիբոսոմները պարունակում են 4 տեսակի ռՌՆԹ 18S, 5.8S, 28S և 5S։ 4 տեսակի ռՌՆԹ-ներից երեքը սինթեզվում են կորիզակում։ Ցիտոպլազմայում ռիբոսոմային ՌՆԹ-ները միանում են ռիբոսոմային սպիտակուցների հետ և առաջացնում նուկլեոպրոտեիններ՝ ռիբոսոմ[48]։ Ռիբոսոմները միանում են մՌՆԹ-ի հետ և սինթեզում սպիտակուցներ։ ռՌՆԹ-ն կազմում է էուկարիոտներիում հանդիպող ՌՆԹ-ի ընդհանուր քանակի 80%-ը[52]։
Շատ բակտերիաներում և պլաստիդներում հայտնաբերվել է ՌՆԹ-ի յուրահատուկ տեսակ, որը փոխարինում է էուկարիոտների փՌՆԹ-ն և մՌՆԹ-ն (փմՌՆԹ)։ Առանց ստոպ կոդոնի՝ դեֆեկտային ՌՆԹ-ների վրա ռիբոսոմի կանգի ժամանակ փմՌՆԹ-ին միանում է ոչ մեծ մի պեպտիդ, որը սպիտակուցի մոլեկուլն ուղղորդում է դեպի դեգրադացիա[53]։
Գեների ակտիվության կարգավորում[խմբագրել | խմբագրել կոդը]
Կենդանի բջիջներում հայտնաբերված են մի քանի տեսակի ՌՆԹ-ներ, որոնք կարող են նվազեցնել գեների էքսպրեսիան։ ՄիկրոՌՆԹ-ները, որոնք ունեն 21-22 նուկլեոտիդ երկարություն, հայտնաբերվել են էուկարիոտների մոտ։ Սրանք ՌՆԹ ինտերֆերենցիայի մեխանիզմների միջոցով ազդում են գեների ակտիվության վրա։ ՄիկրոՌՆԹ-ֆերմենտ համակարգերը կարող են մեթիլացնել ԴՆԹ-ի նուկլեոտիդները` սրանով նորից նվազեցնելով գեների ակտիվությունը։ ԻՌՆԹ-ի կարգավորման այլ մեխանիզմների դեպքում կոմպլեմենտար միկրոՌՆԹ-ն դեգրադացվում է[54]։
Սակայն կան նաև այնպիսի միՌՆԹ-ներ, որոնք ոչ թե նվազեցնում, այլ բարձրացնում են գեների էքսպրեսիան[55]։ Կարճ ինտերֆերացնող ՌՆԹ-ներն ունեն 20-25 նուկլեոտիդ երկարություն և հաճախ ձևավորվում են վիրուսային ՌՆԹ-ի ճեղքման հետևանքով։ Կան նաև էնդոգենային բջջային կիՌՆԹ-ներ[56]։
Կարճ ինտերֆերացնող ՌՆԹ-ները նույնպես ազդում են ՌՆԹ-ինտերֆերացիոն համակարգի միջոցով և նման են միկրոՌՆԹ-ներին[57]։ Կենդանիների մոտ հայտնաբերվել են այսպես կոչված piՌՆԹ-ները, որոնք սեռական բջիջներում գործում են տրանսպոզոնների դեմ և մասնակցում են գամետների ձևավորմանը[58][59]։
ՌՆԹ-ի պրոցեսինգ[խմբագրել | խմբագրել կոդը]

ՌՆԹ-ի շատ մոլեկուլներ մասնակցում են այլ ՌՆԹ-ի մոլեկուլների ձևափոխմանը։ Ինտրոնները կտրտվում են նախա-մՌՆԹ սփլայսոսոմների միջոցով, որոնք, բացի սպիտակուցներից, պարունակում են նաև մանր կորիզային ՌՆԹ[50]։ Բացի այդ, ինտրոնները կարող են կատալիզել սեփական մոլեկուլի ճեղքումը[60]։ Տրանսկրիպցիայի արդյունքում սինթեզված ՌՆԹ-ն նույնպես կարող է ենթարկվել քիմիական ձևափոխությունների։ Էուկարիոտների մոտ ՌՆԹ-ի նուկլեոտիդների քիմիական ձևափոխությունները, այդ նուկլեոտիդների մեթիլացումը իրականացնում են մանր կորիզային ՌՆԹ-ները (60-300 նուկլեոտիդ)[61]։ ՌՆԹ-ի այս տեսակը կենտրոնացած է կորիզակում և Կախալի մարմնիկներում[49]։ Ռիբոսոմային և փոխադրող ՌՆԹ-ները պարունակում են շատ նմանատիպ ձևափոխություններ, որոնց տեղադրությունը շատ հաճախ պահպանվել է էվոլյուցիայի ընթացքում[62][63]։ Գիդային ՌՆԹ-ներն իրականացնում են կինետոպլաստում ՌՆԹ-ի խմբագրման պրոցեսը։ ՌՆԹ-ն կարող է նաև մեթիլացվել[64][65]։
ՌՆԹ-ից բաղկացած գենոմներ[խմբագրել | խմբագրել կոդը]

Ինչպես ԴՆԹ-ն, այնպես էլ ՌՆԹ-ն կարող է ինֆորմացիա կրել կենսաբանական գործընթացների մասին։ ՌՆԹ-ն՝ որպես գենոմ, կարող է օգտագործվել վիրուսների և վիրուսանման մասնիկների կողմից։
Վիրոիդներն ախտածինների մեկ այլ խումբ են, որոնք կազմված են, սակայն, միայն ՌՆԹ-ից, չեն կոդավորում սպիտակուց և կրկնապատկվում են միայն տեր բույսի բջջի պոլիմերազների միջոցով[66]։
Հակառակ տրանսկրիպցիա[խմբագրել | խմբագրել կոդը]
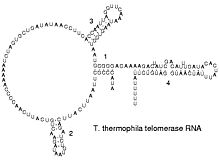
Հակառակ տրանսկրիպտող վիրուսներն իրենց գենոմը կրկնապատկում են սեփական ՌՆԹ-ն ԴՆԹ-ի տրանսկրիպտելու հաշվին։ Այս ԴՆԹ-ի կրկնօրինակները այնուհետև նորից տրանսկրիպտվում են ՌՆԹ-ի մոլեկուլների։ Ռետրոտրանսպոզոնները նույնպես տարածվում են հակառակ տրանսկրիպցիայի հաշվին[67]։ Թելոմերազը նույնպես գործում է նույն մեխանիզմով. այն պարունակում է ՌՆԹ, որը որպես կաղապար է օգտագործվում էուկարիոտ բջիջների քրոմոսոմների ծայրային հատվածների կառուցման համար[68]։
Երկշղթա ՌՆԹ[խմբագրել | խմբագրել կոդը]
Երկշղթա ՌՆԹ-ն երկու կոմպլեմետար շղթաներից կազմված ՌՆԹ-ի մոլեկուլ է, որն իր տարածական կառուցվածքով շատ նման է ԴՆԹ-ին։ Երկշղթա ՌՆԹ-ից են կազմված որոշ վիրուսների գենոմները (երկշղթա ՌՆԹ վիրուսներ, անգլ.՝ ds RNA)[69][70][71][72]։
Ռետրովիրուսներ և ռետրոտրասպոզոններ[խմբագրել | խմբագրել կոդը]
Այլ տեսակի վիրուսների մոտ ՌՆԹ գենոմն առկա է միայն կյանքի որոշակի ցիկլի ընթացքում։ Այսպես կոչվող ռետրովիրուսների վիրիոնները պարունակում են միայն ՌՆԹ-ի մոլեկուլներ, որոնք տիրոջ բջիջներ թափանցելուց հետո ծառայում են որպես մատրիքս՝ ԴՆԹ-ի օրինակների սինթեզի համար։ Իր հերթին, ԴՆԹ-ի մատրիքսից կարդացվում է ՌՆԹ գենոմը։ Բացի վիրուսներից հակառակ տրանսկրիպցիան կիրառում են նաև գենոմի շարժուն տարրերի մի դաս՝ ռետրոտրասպոզոնները[73]։
Օղակաձև ՌՆԹ[խմբագրել | խմբագրել կոդը]
Վերջերս հայտնաբերվել են միաշղթա կովալենտ կերպով փակված օղակաձև ՌՆԹ-ներ, որոնք լայնորեն էքպրեսվում են կենդանիների և բույսերի թագավորություններում։ Մինչ օրս օղակաձև ՌՆԹ-ների դերը պարզ չէ, չնայած որ ցույց են տրվել մի շարք փոխազդեցություններ միկրոՌՆԹ-ների հետ։
ՌՆԹ աշխարհի վարկած[խմբագրել | խմբագրել կոդը]
ՌՆԹ-ի մոլեկուլը միաժամանակ կարող է կրել տեղեկատվություն և ծառայել որպես քիմիական ռեակցիաների կատալիզատոր։ Այս հատկությունը թույլ է տալիս առաջ քաշել մի տեսություն, ըստ որի՝ ՌՆԹ-ն երկրի վրա կյանքի զարգացման պատմության ընթացքում եղել է այն առաջնային բարդ պոլիմերը, որը ծագել է նախակենսաբանական գործընթացների ժամանակ։ Այս տեսությունն անվանվել է ՌՆԹ աշխարհի վարկած[74][75]։ Այս տեսության համաձայն՝ էվոլյուցիայի առաջին փուլերի ընթացքում ավտոկատալիզել է այլ ՌՆԹ-ի, ապա ԴՆԹ-ի մոլեկուլներին։ Էվոլյուցիայի հաջորդ փուլի ընթացքում տեղեկատվության կրողներ են դարձել ավելի կայուն մոլեկուլները՝ ԴՆԹ-ները։ ՌՆԹ-ի մատրիքսի վրա նախառիբոսոմների միջոցով սպիտակուցների սինթեզն ընդարձակել է կենսաբանական համակարգերի ընդունակությունները և սպիտակուցները հետզհետե ֆունկցիոնալ առումով սկսել են փոխարինել ՌՆԹ-ի մոլեկուլներին։
Այս տեսությունների հիման վրա ենթադրվում է, որ ժամանակակից բջիջների սպիտակուցների կենսասինթեզում մասնակցող ՌՆԹ-ի շատ տեսակներ, հատկապես՝ ռՌՆԹ-ն և փՌՆԹ-ն ՌՆԹ աշխարհի մնացորդային ձևերն են։
2015 թվականի մարտին արտաքին տիեզերական պայմաններում արհեստական սինթեզի ճանապարհով լաբորատորիայում սինթեզվել են ՌՆԹ-ի և ԴՆԹ-ի բարդ նուկլեոտիդներ, այդ թվում՝ ուրացիլը, ցիստեինը և թիմինը։ Սինթեզում կիրառել են պիրիմիդին, որը երկնաքարերում շատ տարածված օրգանական միացություն է։ Պիրիմիդինը, ինչպես պոլիցիկլիկ արոմատիկ ածխաջրածինները, տիեզերքում ամենատարածված ածխածնով հարուստ միացություններից է, որը ենթադրաբար ձևավորվել է կարմիր հսկաներում կամ տիեզերական փոշում ու գազային ամպերում[76]։
Տես նաև[խմբագրել | խմբագրել կոդը]
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ «ՌՆԹ-ի բացատրություն (անգլերեն)». Արխիվացված է օրիգինալից 2010 թ․ հունվարի 4-ին. Վերցված է 2009 թ. հունիսի 7-ին.
- ↑ Dahm R (2005). «Friedrich Miescher and the discovery of DNA». Developmental Biology. 278 (2): 274–88. PMID 15680349.
- ↑ Nierhaus KH, Wilson DN. Protein Synthesis and Ribosome Structure. — Wiley-VCH, 2004. — С. 3. — ISBN 3-527-30638-2
- ↑ Carlier M (июнь 2003). «L'ADN, cette «simple» molécule». Esprit libre. Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 23-ին. Վերցված է ???-ին.
- ↑ А. С. Спирин. Биоорганическая химия. — М.: Высшая школа, 1986. — С. 10.
- ↑ Ochoa S. (1959). «Enzymatic synthesis of ribonucleic acid» (PDF). Nobel Lecture. Արխիվացված (PDF) օրիգինալից 2011 թ․ օգոստոսի 23-ին. Վերցված է ???-ին.
- ↑ Rich A; Davies, D (1956). «A New Two-Stranded Helical Structure: Polyadenylic Acid and Polyuridylic Acid». Journal of the American Chemical Society. 78 (14): 3548–3549. doi:10.1021/ja01595a086.
- ↑ Holley RW et al. Structure of a ribonucleic acid // Science. — 1965. — Vol. 147. — № 1664. — P. 1462–65. —
- ↑ Szathmáry E. The origin of the genetic code: amino acids as cofactors in an RNA world // Trends Genet.. — 1999. — Vol. 15. — № 6. — P. 223–9. —
- ↑ Siebert S (2006). «Common sequence structure properties and stable regions in RNA secondary structures» (PDF). Dissertation, Albert-Ludwigs-Universität, Freiburg im Breisgau. էջ 1. Արխիվացված է օրիգինալից (PDF) 2012 թ․ մարտի 9-ին. Վերցված է 2016 թ․ փետրվարի 5-ին.
- ↑ Fiers W, և այլք: (1976). «Complete nucleotide-sequence of bacteriophage MS2-RNA: primary and secondary structure of replicase gene». Nature. 260 (5551): 500–7. Bibcode:1976Natur.260..500F. doi:10.1038/260500a0. PMID 1264203.
- ↑ Napoli C; Lemieux C; Jorgensen R (1990). «Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans». Plant Cell. 2 (4): 279–89. doi:10.1105/tpc.2.4.279. PMC 159885. PMID 12354959.
- ↑ Dafny-Yelin M; Chung SM; Frankman EL; Tzfira T (2007 թ․ դեկտեմբեր). «pSAT RNA interference vectors: a modular series for multiple gene down-regulation in plants». Plant Physiol. 145 (4): 1272–81. doi:10.1104/pp.107.106062. PMC 2151715. PMID 17766396.
- ↑ Ruvkun G. Glimpses of a tiny RNA world // Science. — 2001. — Vol. 294. — № 5543. — P. 797–99. —
- ↑ Fichou Y; Férec C (2006). «The potential of oligonucleotides for therapeutic applications». Trends in Biotechnology. 24 (12): 563–70. doi:10.1016/j.tibtech.2006.10.003. PMID 17045686.
- ↑ Jankowski JAZ; Polak JM (1996). Clinical gene analysis and manipulation: Tools, techniques and troubleshooting. Cambridge University Press. էջ 14. ISBN 0-521-47896-0. OCLC 33838261.
- ↑ 17,0 17,1 Lee JC; Gutell RR (2004). «Diversity of base-pair conformations and their occurrence in rRNA structure and RNA structural motifs». J. Mol. Biol. 344 (5): 1225–49. doi:10.1016/j.jmb.2004.09.072. PMID 15561141.
- ↑ Barciszewski J; Frederic B; Clark C (1999). RNA biochemistry and biotechnology. Springer. էջեր 73–87. ISBN 0-7923-5862-7. OCLC 52403776.
- ↑ Jankowski JAZ, Polak JM (1996). Clinical gene analysis and manipulation: tools, techniques and troubleshooting. Cambridge University Press. էջ 14. ISBN 0521478960.
- ↑ Kiss T (2001). «Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs». The EMBO Journal. 20: 3617–22. doi:10.1093/emboj/20.14.3617.
- ↑ Salazar M; Fedoroff OY; Miller JM; Ribeiro NS; Reid BR (1992). «The DNA strand in DNAoRNA hybrid duplexes is neither B-form nor A-form in solution». Biochemistry. 32 (16): 4207–15. doi:10.1021/bi00067a007. PMID 7682844.
- ↑ Sedova A; Banavali NK (2016). «RNA approaches the B-form in stacked single strand dinucleotide contexts». Biopolymers. 105 (2): 65–82. doi:10.1002/bip.22750. PMID 26443416.
- ↑ Hermann T; Patel DJ (2000). «RNA bulges as architectural and recognition motifs». Structure. 8 (3): R47–R54. doi:10.1016/S0969-2126(00)00110-6. PMID 10745015.
- ↑ Mikkola S; Stenman E; Nurmi K; Yousefi-Salakdeh E; Strömberg R; Lönnberg H (1999). «The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group». Perkin transactions 2 (8): 1619–26. doi:10.1039/a903691a.
- ↑ Yu Q; Morrow CD (2001). «Identification of critical elements in the tRNA acceptor stem and TΨC loop necessary for human immunodeficiency virus type 1 infectivity». J Virol. 75 (10): 4902–6. doi:10.1128/JVI.75.10.4902-4906.2001. PMC 114245. PMID 11312362.
- ↑ Elliott MS; Trewyn RW (1983). «Inosine biosynthesis in transfer RNA by an enzymatic insertion of hypoxanthine». J. Biol. Chem. 259 (4): 2407–10. PMID 6365911.
- ↑ Cantara, WA; Crain, PF; Rozenski, J; McCloskey, JA; Harris, KA; Zhang, X; Vendeix, FA; Fabris, D; Agris, PF (2011 թ․ հունվար). «The RNA Modification Database, RNAMDB: 2011 update». Nucleic Acids Research. 39 (Database issue): D195–201. doi:10.1093/nar/gkq1028. PMC 3013656. PMID 21071406.
- ↑ Söll D; RajBhandary U (1995). TRNA: Structure, biosynthesis, and function. ASM Press. էջ 165. ISBN 1-55581-073-X. OCLC 183036381 30663724.
{{cite book}}: Check|oclc=value (օգնություն) - ↑ Kiss T (2001). «Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs». The EMBO Journal. 20 (14): 3617–22. doi:10.1093/emboj/20.14.3617. PMC 125535. PMID 11447102.
- ↑ King TH; Liu B; McCully RR; Fournier MJ (2002). «Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center». Molecular Cell. 11 (2): 425–35. doi:10.1016/S1097-2765(03)00040-6. PMID 12620230.
- ↑ Mathews DH; Disney MD; Childs JL; Schroeder SJ; Zuker M; Turner DH (2004). «Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure». Proc. Natl. Acad. Sci. USA. 101 (19): 7287–92. Bibcode:2004PNAS..101.7287M. doi:10.1073/pnas.0401799101. PMC 409911. PMID 15123812.
- ↑ Tan ZJ; Chen SJ (2008). «Salt dependence of nucleic acid hairpin stability». Biophys. J. 95 (2): 738–52. Bibcode:2008BpJ....95..738T. doi:10.1529/biophysj.108.131524. PMC 2440479. PMID 18424500.
- ↑ Vater A; Klussmann S (January 2015). «Turning mirror-image oligonucleotides into drugs: the evolution of Spiegelmer therapeutics». Drug Discovery Today. 20 (1): 147–155. doi:10.1016/j.drudis.2014.09.004. PMID 25236655.
- ↑ R.N. Shukla. Analysis of Chromosomes. ISBN 9789384568177.(չաշխատող հղում)
- ↑ Berg JM; Tymoczko JL; Stryer L (2002). Biochemistry (5th ed.). WH Freeman and Company. էջեր 118–19, 781–808. ISBN 0-7167-4684-0. OCLC 179705944 48055706 59502128.
{{cite book}}: Check|oclc=value (օգնություն) - ↑ «Nucleotides and Nucleic Acids» (PDF). Լոս Անջելեսի կալիֆոռնյան համալսարան. Արխիվացված է օրիգինալից (PDF) 2015 թ․ սեպտեմբերի 23-ին. Վերցված է 2016 թ․ փետրվարի 4-ին.
- ↑ «RNA: The Versatile Molecule». Յուտայի համալսարան. 2015.
- ↑ I. Tinoco; C. Bustamante (1999). «How RNA folds». J. Mol. Biol. 293 (2): 271–281. doi:10.1006/jmbi.1999.3001. PMID 10550208.
{{cite journal}}: Invalid|name-list-style=yes(օգնություն)CS1 սպաս․ postscript (link) - ↑ Higgs PG (2000). «RNA secondary structure: physical and computational aspects». Quarterly Reviews of Biophysics. 33 (3): 199–253. doi:10.1017/S0033583500003620. PMID 11191843.
- ↑ Higgs PG (2000). «RNA secondary structure: physical and computational aspects». Quarterly Reviews of Biophysics. 33: 199–253. doi:10.1017/S0033583500003620.
- ↑ Nissen P, Hansen J, Ban N, Moore PB, Steitz TA (2000). «The structural basis of ribosome activity in peptide bond synthesis». Science. 289 (5481): 920–30. doi:10.1126/science.289.5481.920.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Nissen P; Hansen J; Ban N; Moore PB; Steitz TA (2000). «The structural basis of ribosome activity in peptide bond synthesis». Science. 289 (5481): 920–30. Bibcode:2000Sci...289..920N. doi:10.1126/science.289.5481.920. PMID 10937990.
- ↑ Jeffrey L Hansen, Alexander M Long, Steve C Schultz (1997). «Structure of the RNA-dependent RNA polymerase of poliovirus». Structure. 5 (8): 1109–22. doi:10.1016/S0969-2126(97)00261-X.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Ahlquist P (2002). «RNA-Dependent RNA Polymerases, Viruses, and RNA Silencing». Science. 296 (5571): 1270–73. doi:10.1126/science.1069132.
- ↑ Nudler E; Gottesman ME (2002). «Transcription termination and anti-termination in E. coli». Genes to Cells. 7 (8): 755–68. doi:10.1046/j.1365-2443.2002.00563.x. PMID 12167155.
- ↑ 46,0 46,1 Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. էջեր 302–303. ISBN 0-8153-3218-1.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Wagner R., Theissen G., Zacharias (1993). Regulation of Ribosomal RNA synthesis and Control of ribosome Formation in E.coli. էջեր 119–129.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 48,0 48,1 48,2 Cooper GC, Hausman RE (2004). The Cell: A Molecular Approach (3rd edition ed.). Sinauer. էջեր 261–76, 297, 339–44. ISBN 0-87893-214-3.
{{cite book}}:|edition=has extra text (օգնություն) - ↑ 49,0 49,1 Wirta W (2006). Mining the transcriptome – methods and applications (PDF). ISBN 91-7178-436-5.
- ↑ 50,0 50,1 Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5th edition ed.). WH Freeman and Company. էջեր 118–19, 781–808. ISBN 0-7167-4684-0.
{{cite book}}:|edition=has extra text (օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Rossi JJ (2004). «Ribozyme diagnostics comes of age». Chemistry & Biology. 11 (7): 894–95. doi:10.1016/j.chembiol.2004.07.002.
- ↑ Kampers T, Friedhoff P, Biernat J, Mandelkow E-M, Mandelkow E (1996). «RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments». FEBS Letters. 399: 98–100, 344–49. PMID 8985176.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Gueneau de Novoa P, Williams KP (2004). «The tmRNA website: reductive evolution of tmRNA in plastids and other endosymbionts». Nucleic Acids Res. 32 (Database issue): D104-8. doi:10.1093/nar/gkh102. PMID 14681369.
- ↑ Matzke MA, Matzke AJM (2004). «Planting the seeds of a new paradigm». PLoS Biology. 2 (5): e133. doi:10.1371/journal.pbio.0020133. PMID 15138502.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Check E (2007). «RNA interference: hitting the on switch». Nature. 448 (7156): 855–58. doi:10.1038/448855a. PMID 17713502.
- ↑ Vazquez F, Vaucheret H, Rajagopalan R, Lepers C, Gasciolli V, Mallory AC, Hilbert J, Bartel DP, Crété P (2004). «Endogenous trans-acting siRNAs regulate the accumulation of Arabidopsis mRNAs». Molecular Cell. 16 (1): 69–79. doi:10.1016/j.molcel.2004.09.028. PMID 15469823.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Doran G (2007). «RNAi – Is one suffix sufficient?». Journal of RNAi and Gene Silencing. 3 (1): 217–19. Արխիվացված է օրիգինալից 2007 թ․ հուլիսի 16-ին. Վերցված է 2014 թ․ հուլիսի 17-ին.
- ↑ name=fruitfly_piRNA>Horwich MD, Li C Matranga C, Vagin V, Farley G, Wang P, Zamore PD (2007). «The Drosophila RNA methyltransferase, DmHen1, modifies germline piRNAs and single-stranded siRNAs in RISC». Current Biology. 17: 1265–72. doi:10.1016/j.cub.2007.06.030. PMID 17604629.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Girard A, Sachidanandam R, Hannon GJ, Carmell MA (2006). «A germline-specific class of small RNAs binds mammalian Piwi proteins». Nature. 442: 199–202. doi:10.1038/nature04917. PMID 16751776.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Steitz TA, Steitz JA (1993). «A general two-metal-ion mechanism for catalytic RNA». Proc. Natl. Acad. Sci. U.S.A. 90 (14): 6498–502. doi:10.1073/pnas.90.14.6498. PMID 8341661.
- ↑ Wirta W (2006). Mining the transcriptome – methods and applications. Stockholm: School of Biotechnology, Royal Institute of Technology. ISBN 91-7178-436-5. OCLC 185406288.
- ↑ Covello PS, Gray MW (1989). «RNA editing in plant mitochondria». Nature. 341: 662–66. doi:10.1038/341662a0. PMID 2552326.
- ↑ Omer AD, Ziesche S, Decatur WA, Fournier MJ, Dennis PP (2003). «RNA-modifying machines in archaea». Molecular Microbiology. 48 (3): 617–29. doi:10.1046/j.1365-2958.2003.03483.x. PMID 12694609.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Cavaillé J; Nicoloso M; Bachellerie JP (1996). «Targeted ribose methylation of RNA in vivo directed by tailored antisense RNA guides». Nature. 383 (6602): 732–5. Bibcode:1996Natur.383..732C. doi:10.1038/383732a0. PMID 8878486.
- ↑ Kiss-László Z; Henry Y; Bachellerie JP; Caizergues-Ferrer M; Kiss T (1996). «Site-specific ribose methylation of preribosomal RNA: a novel function for small nucleolar RNAs». Cell. 85 (7): 1077–88. doi:10.1016/S0092-8674(00)81308-2. PMID 8674114.
- ↑ Daròs JA, Elena SF, Flores R (2006). «Viroids: an Ariadne's thread into the RNA labyrinth». EMBO Rep. 7 (6): 593–8. doi:10.1038/sj.embor.7400706. PMC 1479586. PMID 16741503.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Kalendar R, Vicient CM, Peleg O, Anamthawat-Jonsson K, Bolshoy A, Schulman AH (2004). «Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes». Genetics. 166 (3): 1437–50. doi:10.1534/genetics.166.3.1437. PMC 1470764. PMID 15082561.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Podlevsky JD, Bley CJ, Omana RV, Qi X, Chen JJ (2008). «The telomerase database». Nucleic Acids Res. 36 (Database issue): D339–43. doi:10.1093/nar/gkm700. PMC 2238860. PMID 18073191.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Blevins T; և այլք: (2006). «Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing». Nucleic Acids Res. 34 (21): 6233–46. doi:10.1093/nar/gkl886. PMC 1669714. PMID 17090584.
{{cite journal}}:|first10=missing|last10=(օգնություն);|first11=missing|last11=(օգնություն); Unknown parameter|author-separator=ignored (օգնություն) - ↑ Jana S, Chakraborty C, Nandi S, Deb JK (2004). «RNA interference: potential therapeutic targets». Appl. Microbiol. Biotechnol. 65 (6): 649–57. doi:10.1007/s00253-004-1732-1. PMID 15372214.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Schultz U, Kaspers B, Staeheli P (2004). «The interferon system of non-mammalian vertebrates». Dev. Comp. Immunol. 28 (5): 499–508. doi:10.1016/j.dci.2003.09.009. PMID 15062646.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Whitehead, Kathryn A.; Dahlman, James E.; Langer, Robert S.; Anderson, Daniel G. (2011). «Silencing or stimulation? siRNA delivery and the immune system». Annual Review of Chemical and Biomolecular Engineering. 2: 77–96. doi:10.1146/annurev-chembioeng-061010-114133. ISSN 1947-5438. PMID 22432611.
- ↑ Kalendar R, Vicient CM, Peleg O, Anamthawat-Jonsson K, Bolshoy A, Schulman AH (2004). «Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes». Genetics. 166 (3): D339. doi:10.1534/genetics.166.3.1437. PMID 15082561.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Gilbert, Walter (1986 թ․ փետրվար). «The RNA World». Նեյչր. 319: 618. doi:10.1038/319618a0.
- ↑ Woese, Carl (1968 թ․ հունվար). The Genetic Code. Harper & Row. ISBN 978-0060471767.
- ↑ Marlaire, Ruth (2015 թ․ մարտի 3). «NASA Ames Reproduces the Building Blocks of Life in Laboratory». NASA. Արխիվացված է օրիգինալից 2015 թ․ մարտի 5-ին. Վերցված է 2015 թ․ մարտի 5-ին.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- ՌՆԹ աշխարհի վեբկայք, հղումների շտեմարան, պարունակում է կառուցվածքներ, հաջորդականություններ, գործիքնեեր, ամսագրեր։ (անգլ.)
- Նուկլեինաթթուների շտեմարան, ԴՆԹ-ի, ՌՆԹ-ի և նրանց կոմպլեքսների պատկերներ։ (անգլ.)
- Աննա Մարի Պիլի դասընթացը ՌՆԹ-ի կառուցվածքի, ֆունկցիայի և ճանաչման մասին (անգլ.)
| ||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «ՌՆԹ» հոդվածին։ |
| ||||||||||||||||
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի՝ 2017 թվականի հոկտեմբերի 29-ի օրվա հոդված: |
|
|
Այս հոդվածը ներառված է Հայերեն Վիքիպեդիայի լավ հոդվածների ցանկում |
|
|
Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի՝ 2017 թվականի Տարվա հոդված |


