Քաղցկեղածնություն
Քաղցկեղածնություն, նաև կոչվում է օնկոգենեզ կամ կարցինոգենեզ (ուռացքածնություն), քաղցկեղի առաջացումն է, որի ժամանակ նորմալ բջիջները վերափոխվում են քաղցկեղայինների։ Այս պրոցեսը բնորոշվում է բջջային, գենետիկական և էպիգենետիկական մակարդակներում տեղի ունեցող փոփոխություններով և բջիջների ոչ նորմալ բաժանումով։ Բջիջների բաժանումը ֆիզիոլոգիական գործընթաց է, որը տեղի է ունենում գրեթեր բոլոր հյուսվածքներում որոշակի գործոնների ներգործության հետևանքով։ Նորմայում, պրոլիֆերացիայի և բջիջների ծրագրավորված մահվան (ապոպտոզի տեսքով) միջև առաջացած հավասարակշռությունը պահպանվում է, բջիջների և օրգանների ամբողջականությունը պահպանելու նպատակով։ Քաղցկեղածնության համատարած տեսության համաձայն (սոմատիկ մուտացիայի թեորիա), ԴՆԹ-ում տեղի ունեցող մուտացիաները և էպիմուտացիաները որոնք հանգեցնում են քաղցկեղի առաջացմանը, խանգարելով բջջային կարգավորման այս հին մեխանիզմները և խախտելով պրոլիֆերացիայի և բջիջների մահվան միջև եղած հավասարակշռությունը։ Վերջինս հանգեցնում է բջիջների չկարգավորված բաժանման և այս բջիջների էվոլյուցիային, մարմնում տեղի ունեցող բնական ընտրության հաշվին։ Միայն որոշակի մուտացիաներ են հանգեցնում քաղցկեղի առաջացման, մինչդեռ մուտացիաներից շատերը քաղցկեղ չեն առաջացնում։
Ժառանգվող գեների տարբերակները կարող են հակել անձնավորությանը քաղցկեղի առաջացմանը։ Ի հավելում վերջինիս, միջավայրի այնպիսի գործոնները, ինչպիսիք են քաղցկեղածինները և ճառագայթումը առաջացնում են մուտացիաներ, որոնք կարող են նպաստել քաղցկեղի զարգացմանը։ Ի վերջո, ԴՆԹ-ի նորմալ ռեպլիկացիայի ընթացքում կարող են առաջանալ պատահական մուտացիաներ, որոնք ևս ունակ են հանգեցնելու քաղցկեղի առաջացմանը[1]։ Որոշակի գենային խմբերում մի քանի հաջորդական մուտացիաներին առաջացումն է, որ սովորաբար հանգեցնում է նորմալ բջջից քաղցկեղային բջջի առաջացմանը[2][3][4][5]։ Միջինում, օրինակ, շուրջ 15 «վարորդ » և 60 «ուղևոր» մուտացիաների առաջացում է անհրաժեշտ հաստ աղու քաղցկեղների առաջացման համար[2]։ Մուտացիաներն այն գեներում, որոնք կարգավորում են բջջի բաժանումը, ապոպտոզը (բջջի մահ), և ԴՆԹ-ի վերանորոգումը, կարող են հանգեցնել բջիջների չկարգավորված պրոլիֆերացիայի և քաղցկեղի։
Քաղցկեղի հիմքում հյուսվածքային աճի կարգավորման խանգարումն է։ Նորմալ բջիջը քաղցկեղայինի փոխակերպելու համար, գեները, որոնք կարգավորում են բջջի աճը և տարբերակումը պետք է խանգարված լինեն[6]։ Գենետիկական և էպիգենետիկական փոփոխությունները կարող են իրականանալ տարբեր մակարդակներում, ամբողջական քրոմոսների թվի ավելացումից կամ պակասումից պակասումից, մինչև ԴՆԹ մեկ նուկլեոտիդի մակարդակով, կամ միկրո-ՌՆԹ-ների (որոնք 100-ից 500 գեների էքսպրեսիան են կարգավորում) լռեցումով կամ ակտիվացումով[7][8]։ Գոյություն ունեն այսպիսի գեների երկու ընդգրկուն կատեգորիաների, որոնք ախտահարվում են այս փոփոխությունների արդյունքում։ Օնկոգենները կարող են նորմալ գեներ լինել, որոնք էքսպրեսվում են ոչ անհրաժեշտ բարձր քանակներով (ամպլիֆիկացիա), կամ փոփոխված գեներ, որոնք նոր հատկանիշներով են օժտվում։ Երկու դեպքում էլ, այս գեների էքսպրեսիան քաղցկեղային բջիջների չարորակ ֆենոտիպի առաջացմանն է նպաստում։ Ուռուցքի սուպրեսոսոր (ճնշող) գեները, որոնք ճնշում են բջիջների բաժանումը, ապրելիությունը, կամ քաղցկեղային բջիջների այլ հատկանիշները։ Ուռուցքի սուպրեսոր գեները հաճախ անջատվում են քաղցկեղ-զարգացնող գենետիկական փոփոխությունների արդյունքում։ Եվ վերջապես օնկովիրուսները, որոնք օնկոգեն են պարունակում, դասակարգված են որպես քաղցկեղածին, քանի որ դրանք նպաստում են տիրոջ բջիջների ուռուցքային աճին։ Այս պրոցեսը նաև կոչվում է վիրուսային փոխակերպում։
Պատճառներ
[խմբագրել | խմբագրել կոդը]Գենետիկական և էպիգենետիկական
[խմբագրել | խմբագրել կոդը]Գոյություն ունեն տարբեր դասակարգող աղյուսակներ գենոմային զանազան փոփոխությունների համար, որոնք կարող են նպաստել քաղցկեղային բջիջների առաջացմանը։ Այդ փոփոխություններից շատերը մուտացիաներ են, կամ գենոմային ԴՆԹ-ում նուկլեոտիդային հաջորդականության փոփոխություններ են։ Գոյություն ունեն նաև բազմաթիվ էպիգենետիկական փոփոխություններ, որոնց արդյունքում գեները կամ էքսպրեսվում են, կամ չեն էքսպրեսվում։ Անեուպլոիդիան, քրոմոսոմների ոչ նորմալ թվի առկայություն է՝ գենոմիկ փոփոխություն, որը մուտացիա չէ և կարող է ներառել մեկ կամ ավելի քրոմոսոմների ավելացում կամ շատացում միտոզի ժամանակ տեղի ունեցող սխալների արդյունքում։ Մեծամասշտաբ մուտացիաները կարող են ներառել քրոմոսոմի մի հատվածի դելեցիա կամ ավելացում։ Գենոմային ամպլիֆիկացիան տեղի է ունենում, երբ բջիջը փոքր քրոմոսոմալ տեղամասի բազմաթիվ օրինակներ է ստանում (սովորաբար 20 կամ ավելի), որոնք սովորաբար պարունակում են մեկ կամ ավելի օնկոգեններ և կից գենետիկական նյութ։ Տրանսլոկացիան տեղի է ունենում, երբ երկու տարբեր քրոմոսամային հատվածներ ոչ նորմալ կերպով միաձուլվում են, հաճախ բնորոշ տեղամասում։ Լավ հայտնի օրինակ է Ֆիլադելֆյան քրոմոսոմի առաջացումը, կամ 9 և 22 քրոմոսոմների տրանսլոկացիան, որն առաջանում է քրոնիկ միելոցիտային լեյկեմիայի ժամանակ և որի արդյունքում առաջանում է BCR-ABL միաձուլված սպիտակուց, որն օնկոգեն թիրոզին կինազ է։ Փոքրամասշտաբ մուտացիաները ներառում են կետային մուտացիաները, դելեցիաները և ինսերցիաները, որոնք կարող են տեղի ունենալ գենի պրոմոտորում, ազդելով դրա էքսպրեսիայի վրա, կամ կարող են տեղի ունենալ կոդավորող հաջորդականությունում և ազդել արտադրվող սպիտակուցի կայունության կամ ֆունկցիոնալության վրա։ Մեկ գենի խանգարումը կարող է առաջանալ նաև գենետիկական մատերիալի ինտեգրման արդյունքում ԴՆԹ-վիրուսով կամ ռետրովիրուսով, և այսպիսի իրադարձությունը ևս կարող է հանգեցնել վիրուսային օնկոգենների արտադրության ախտահարված բջջում կամ դրա դուստր-բջիջներում։
ԴՆԹ-ի վնասում
[խմբագրել | խմբագրել կոդը]ԴՆԹ-ի վնասումը դիտարկվում է որպես քաղցկեղի առաջացման առաջնային պատճառ[9]։ 60,000-ից ավելի նոր, բնական կերպով տեղի ունեցող ԴՆԹ-ի վնասումներ են առաջանում, միջինում, մեկ բջջում, օրական, էնդոգեն բջջային պրոցեսների արդյունքում (տես ԴՆԹ-ի վնասում (բնականում տեղի ունեցող) հոդվածը)։

ԴՆԹ-ի լրացուցիչ վնասումներ կարող են առաջանալ էկզոգեն գործոնների հետ շփման արդյունքում։ Էկզոգեն կարցինոգեն նյութի տիպիկ օրինակ է ծխախոտի ծուխը, որը մեծացնում է ԴՆԹ-ի վնասումը, և այս ԴՆԹ-ի վնասումները, հավանաբար մեծացնում են թոքեղի քաղցկեղի առաջացման ռիսկը, ծխողների շրջանում[10]։ Գոյություն ունեն նաև բազմաթիվ այլ օրինակներ, օրինակ արևի ճառագայթների ուլտրամանուշակագույն ճառագայթման ներգործությունը կարևոր է մելանոմայի առաջացման պրոցեսում[11], Helicobacter pylori ինֆեկցիան առաջացնում է մեծ քանակության թթվածնի ռեակտիվ ձևեր, որոնք վնասում են ԴՆԹ-ն և հանգեցնում են քաղցկեղի առաջացմանը[12], և Aspergillus-ի նյութափոխանակության արգասիք աֆլատոքսինը, որը ԴՆԹ-վնասող գործոն է և լյարդի քաղցկեղի պատճառային գործոններից է[13]։
ԴՆԹ-ի վնասումները կարող են նաև առաջանալ էնդոգեն գործոններից (բնական կերպով առաջացող)։ Մակրոֆագերը և նեյտրոֆիլները բորբոքված հաստ աղու էպիթելում թթվածնի ռեակտիվ ձևերի առաջացման աղբյուր են, ինչը հանգեցնում է ԴՆԹ-ի վնասմանը և խթաղում ուռուցքածնությանը[14], և լեղաթթուները մեծ քանակությամբ ճարպերի մեծ քանակությամբ դիետա վարելու դեպքում, ևս առաջացնում են ԴՆԹ-ի վնասում և ասյպիսով, նպաստում են հաստ աղու քաղցկեղի առաջացմանը[15]։
ԴՆԹ-ի այսպիսի էկզոգեն և էնդոգեն վնասման գործոնները ներկայացված են աղյուսակի վերին բջջում։ ԴՆԹ-ի վնասման պրոգրեսիան քաղցկեղի նշված աղյուսակի երկրորդ մակարդակում։ ԴՆԹ-ի վնասման կենտրոնական էլեմենտները, էպիգենետիկական խանգարումները և ԴՆԹ-ի վերանորոգման խանգարումները ներկայացված են կարմիր գույնով։
ԴՆԹ-ի վերանորոգման դեֆիցիտը հանգեցնում է մուտացիաների կուտակմանը և բարձրացնում է քաղցկեղի ռիսկը։ Որպես օրինակ , անձիք, ովքեր ունեն ԴՆԹ-ի վերանորոգման համար պատասխանատու 34 գենենրից յուրաքանչյուրի մուտացիա (տես ԴՆԹ վերանորոգման խանգարում) քաղցկեղի բարձր ռիսկ ունեն, իսկ որոշ մուտացիաների կրողները կյանքի ընթացքում քաղցկեղով հիվանդանալու 100%-անոց հավանականություն ունեն (օրինակ p53-ի մուտացիաները)[16]։ Էմբրիոնալ գծի այսպիսի մուտացիաները ներիայացված են ձախ աղյուսակի բջջում, ԴՆԹ-ի վերանորոգման դեֆիցիտի առաջացման հարցում դրանց դերն ընդգծելով։ Սակայն էմբրիոնալ այսպիսի մուտացիաները (որոնք ունենալով բարձր պենետրանտություն քաղցկեղի համախտանիշներ են առջացնում) քաղցկեղի բոլոր դեպքերի միայն մեկ տոկոսն են կազմում[17]։
Քաղցկեղների մեծամասնությունը կոչվում են ոչ ժառանգական կամ <<սպորադիկ քաղցկեղներ>>։ Սպորադիկ քաղցկեղների շուրջ 30%-ն ունեն ինչ-որ ժառանգական կոմպոնենտ որը դեռևս պարզված չէ, մինչդեռ մածամասնությունը կամ շուրջ 70%-ը չունեն ժառանգական կոմպոնենտ[18]։
Սպորադիկ քաղցկեղների դեպքում, ԴՆԹ-ի վերանորոգման դեֆիցիտը առաջանում է պատահականորեն, ԴՆԹ-ի վերանորոգման գենի դեֆիցիտի պատճառով, բայց առավել հաճախ, ԴՆԹ-ի վերանորոգման համար պատասխանատու գենի էքսպրեսիայի նվազումը կամ բացակայությունը պայմանավորված է էպիգենետիկական խանգարումներվ, որոնք նվազեցնում կամ լռեցնում են գեների էքսպրեսիան։ Սա նշված է աղյուսակի, վերևից հաշված, երրորդ մակարդակում։ Որպես օրինակ 113 կոլոռեկտալ քաղցկեղների գենտիկական հաջորդականությունների ուսումնասիրությունը ցույց է տվել, որ նրանցի միայն 4-ը ունեն ԴՆԹ-ի վերանորոգման MGMT գենի միսենս մուտացիա, մինչդեռ նրանց մեծամասնությունը ունեն MGMT գենի նվազած էքսպրեսիա MGMT պրոմոտոր տեղամասի մեթիլացման պատճառով (էպիգենետիկական խանգարում)[19]։
Երբ ԴՆԹ վերանորոգող գեների էքսպրեսիան նվազած է, սա հանգեցնում է ԴՆԹ-ի վերանորոգման դեֆիցիտի։ Վերջինս ցույց է տրված աղյուսակի 4-րդ մակարդակում։ ԴՆԹ-ի վերանորոգման դեֆիցիտի պատճառով, վնասված ԴՆԹ-ի սովորականաից մեծ քանակներ են մնում բջջում (աղյուսակի 5-րդ մակարդակ), և այս վնասված հատվածների ավելցուկը մեծացնում է մուտացիաների և/կամ էպիմուտացիաների առաջացման հաճախությունը (աղյուսակի վեցերորդ մակարդակ)։ Փորձերի արդյունքները ցույց են տվել, որ ԴՆԹ-ում սխալների վերանորոգման համար պատասխանատու գեների[20][21] կամ հոմոլոգ ռեկոմբինացիոն վերանորոգման գեների մուտացիաները զգալիորեն մեծացնում են մուտացիաների հաճախությունը տվյալ բջիջներում[22][23]։ Քրոմոսոմալ վերադասավորությունները կամ անեուպլոիդիաները ևս շատանում են դեֆեկտիվ ՀՌՎ-ներ ունեցող բջիջներում։ ԴՆԹ-երկպարույրի վերանորոգման կամ այլ ԴՆԹ-վնասվածքների վերանորոգման ընթացքում, պատշաճ կերպով <<չմաքրված>> վերանորոգման տեղամասերը կարող են գեների էպիգենետիկական լռեցման հանգեցնել[24][25]։
Սոմատիկ (մարմնական մուտացիաները) և էպիգենետիկական խանգարումները, որոնք առաջանում են ԴՆԹ-ի վնասվածքների կամ ԴՆԹ-ի վերանորոգման խանգարման արդյունքում։ Այսպես կոչված օջախային դեֆեկտները նորմալ տեսք ունեցող հյուսվածքներ են, որոնցում բազմաթիվ ախտահարումներ կան (որոնք քննարկվելու են ներքևի բաժնում), և խանգարված ու անվերահսկելի կերպով պրոլիֆերացիայի ենթարկվող բջիջներին ես սկզբնավորում։ Այսպիսի օջախային դեֆեկտները (աղյուսակի երկրորդ մակարդակ) բազմաթիվ մուտացիաներ և էպիգենետիկական խանգարումներ են կրում։
Յուրահատուկ քաղցկեղների մեծամասնության դեպքում, սովորաբար անհնար է լինում բացահայտելու առաջնային պատճառը։ Մի քանի դեպքերում, միայն մի պատճառ գոյություն ունի՝ օրինակ HHV-8 վիրուսը (հերպես վիրուս) բոլոր Կապոշիի սարկոմաների պատճառական գործոնն է։ Սակայն, քաղցկեղային համաճարակաբանության տեխնիկաների և ինֆորմացիայի օգնությամբ, հնարավոր է գնահատել հավանական պատճառը բազմաթիվ դեպքերում։ Օրինակ․ թոքի քաղցկեղը տարբեր պատճառներ ունի, ներառյալ ծխախոտի օգտագործումը և ռադոն գազը։ Տղամարդիկ, ովքեր առկա ծխողներ են, 14 անգամ ավելի հաճախ են հիվանդանում քաղցկեղով, կան այն տղամարդիկմ ովքեր երբեք չեն ծխել, ուստի ծխողի մոտ թոքի քաղցկեղի ծխախոտի պատճառով առաջանալու հավանականությունը շուրջ 93% է․ և միայն 7 տոկոսանոց հավանականություն կա, որ թոքի քաղցկեղն առաջանում է ռադոն գազից կամ ինչ-որ այլ պատճառով[26]։ Այսպիսի ստատիստիկ փոխկապակցությունները հնարավոր են դարձնում կանխատեսելու, որ որոշակի նյութեր և պահվածքի մոդելներ քաղցկեղածին են։ Ծխախոտի օգտագործումը առաջացնում է ԴՆԹ-ի էկզոգեն վնասում և այս վնասումները հավանաբար քաղցկեղ են առաջացնում հենց ծխելու պատճառով։ Ավելի քան 5000 բաղադրիչներից, գենոտոքսիկ՝ ԴՆԹ վնասող նյութերը որոնք ունեն և բարձր կոնցենտրացիա և ուժեղագույն մուտագեն էֆեկտներ, ներառում են․ ակրոլեին, ֆորմալդեհիդ, ակրիլոնիտրիլ, 1,3-բութադիեն, ացետալդեհիդ, էթիլեն օքսիդ և իզոպրեն[10]։
Մոլեկուլյար կենսաբանական տեխնիկաների կիարառությունը հնարավորություն է տալիս բնորոշելու մուտացիաները, էպիմուտացիաները կամ քրոմոսոմալ աբերացիաները ուռուցքի ներսում, և վերջերս արագ զարգացումներ են գրանցվել նշված ոլորտում, ինչը թույլ է տալիս կանխորոշել հիվանդի կանխատեսումը, հիմնվելով մուտացիաների տիրույթի վրա, որոշ դեպքերում։ Որպես օրինակ, բոլոր ուռուցքների կեսը ունեն դեֆեկտիվ p53 գեն։ Այս մուտացիան ասոցացված է վատ կանխատեսման հետ, քանի որ այսպիսի բջիջների ավելի քիչ են ենթարկվում ապոպտոզի կամ բջջի ծրագրավորված մահվան, երբ վնասվում են թերապիայի արդյունքում։ Տելոմերազի մուտացիաները ոչնչացնում են լրացուցիչ խոչնդոտները, մեծացնելով բջիջների հնարավոր բաժանումների քանակը։ Այլ մուտացիաներ, թույլ են տալիս ուռուցքին նոր արյունատար անոթներ աճեցնել, ավելի լավ սնուցում ապահովելու նպատակով, կամ մետաստազավորվել, տարածվելով մարմնի այլ տեղամասեր։ Սակայն, քաղցկեղը ձևավորվելուց հետո էլ չի դադարում զարգանալ և էվոլյուցիայի ենթարկվել բջջաային նոր ենթակլոններ ձևավորելով։ Օրինակ, երիկամի քաղցկեղից վերցրած 9 տարբեր հատվածների նմուշներում, հայտնաբերվել են 40 լայնատարած մուտացիաներ, 59 մուտացիաներ, որոնք կիսվել են որոշ բջիջների կողմից բայց ոչ բոլոր տեղամասերում և 29 <<անձնական>> մուտացիաներ, որոնք առկա են միայն որոշ բջիջներում[27]։
Բջիջներին որոնցում կուտակված են այս բոլոր խանգարումները դժվար է հետևել, սակայն վերջրս կատարված երկու գծերի ապացույցները թույլ են տալիս ենթադրել, որ նորմալ ցողունային բջիջները կարող են քաղցկեղային բջիջների աղբյուր լինել[28][29]։ Առաջին հերթին, խիստ դրական կապ գոյություն ունի (Սպիրմանի rho = 0.81; P < 3.5 × 10−8) քաղցկեղի զարգացման ռիսկի միջև հյուսվածքում, և այդ նույն հյուսվածքում նորմալ ցողունային բջիջների բաժանումների քանակի։ Կոռելյացիոն կապը ուսումնասիրել 31 քաղցկեղների համար և տարածվել են 5 կարգով[30]։ Այս կոռելացիան նշանակում է, որ եթե նորմալ ցողունային բջիջները հյուսվածքում մեկ անգամ բաժանվում են, քաղցկեղի առաջացած ռիսկն այդ հյուսվածքում կազմում է 1X. Իսկ եթե դրանք բաժանվում են 1000 անգամ, քաղցկեղի ռիոսկը 1000X է։ Եվ եթե հյուսվածքի նորմալ ցողունային բջիջը բաժանվում է 100000 անգամ, քաղցկեղի առաջացման ռիսկն այդ հյուսվածքում կազմում է շուրջ 100000X։ Այս տվյալները թույլ են տալիս վստահորեն մտածել, որ քաղցկեղի առաջցման գլխավոր գործոնը նորմալ ցողունային բջիջների բաժանումն է, ինչը նշանակում է, որ քաղցկեղն առաջանում է նոյրմալ ցողունային բջիջներից[29]։ Եվ երկրորդ հերթին, ստատիստիկան ցույց է տալիս, որ մարդկային քաղցկեղների մեծամասնությունը ախտորոշվում են մեծահասակների շրջանում։ Սրա հնարավոր բացատրությունն այն է, որ բջիջները ժամանակի ընթացքում վնասումներ են կուտակում։ ԴՆԹ-ն միակ բջջային կոմպոնենտն է, որը կարող է վնասումներ կուտակել կյանքի ողջ ընթացքում, և ցուղունային բջիջները միակ բջիջներն են, որոնք ունակ են փոխանցելու իրենց ԴՆԹ-ն զիգոտից սկսած կյանքի ընթացքում առաջացող այլ բջիջներին։ Այլ բջիջները չեն կարող պահել ԴՆԹ-ն կյանքի սկզբից մինչև հնարավոր քաղցկեղի առաջացումը։ Սրանից հետևում է, որ քաղցկեղների մեծ մասը ծագում են ցողունային բջիջներից[28][29]։
Օջախային դեֆեկտների դերը
[խմբագրել | խմբագրել կոդը]
<<Օջախային քաղցկեղացում>> տերմինը առաջին անգամ օգտագործվել է 1953-ին նկարագրելու համար էպիթելի այն հատվածը կամ օջախը (դաշտը) որը նախապես ենթարկվել է ինչ-որ անհայտ պրոցեսի (այդ ժամանակաշրջանում), և քաղցկեղի նկատմամբ հակվածություն է ձեռք բերել[31]։ Այդ պահից, <<օջախային քաղցկեղացում>> կամ <<օջախային դեֆեկտ>> տերմինները օգտագործվել են, նկարագրելու համար նախաքաղցկեղային հյուսվածքները, որոնցում հավանաբար քաղցկեղ է առաջանալու։
Օջախային դեֆեկտները նույնականացվել են քաղցկեղների հետ իրենց կապով և դրանք կարևոր են, քաղցկեղի պրոգրեսի համար[32][33]։ Սակայն, Ռուբինի կողմից նկատվել է, որ «քաղցկեղին վերաբերող հետազոտությունները մեծամասնությունը իրականացվել լավ-ձևավորված ուռուցքների վրա in vivio կամ դիսկրետ նեոպլաստիկ ֆոկուսներում in vitro[34]։ Մինչ այսօր, աօացույցներ կան, սոմատիկ մուտացիաների ավելի քան 80%-ը կարելի է գտնել մարդու կոլոռեկտալ քաղցկեղի մուտատոր ֆենոտիպերում, որտեղ ուռուցքներն առաջանում են վերջնական կլոնալ էքսպանսիայից առաջ․․․ »[35]։ Քաղցկեսղային բջիջներում առաջացող սոմատիկ մուտացիաների կեսից ավելին տեղի է ունենում պրե-նեոպլաստիկ փուլում (օջախային դեֆեկտում), ակնհայտորեն առողջ բջիջների աճի ընթացքում։ Անհրաժեշտ է նաև նշել, որ սպասելի է պրենեոպլաստիկ օջախային դեֆեկտների շրջանում բազմաթիվ էպիգենետիկ խանգարումների առաջացումը[36]։
Հաստ աղում, օջախային դեֆեկտները հավանաբար առաջանում են էպիգենետիկորեն վնասված բջիջների բնական ընտրության արդյունքում, աղիքային կրիպտաներից մեկի հատակում գտնվող ցողունային բջիջներից, հաստ աղու ներքին մակերեսին։ Մուտանտ կամ էպիգենետիկորեն վնասված ցողունային բջիջները կարող են փոխարինել այլ, մոտակայքում գտնվող ցողունային բջիջների, բնական ընտրության արդյունքում։ Սա կարող է ոչ նորմալ հյուսվածք սկզբնավորել։ Այս բաժնի նկարում պատկերված է նոր ռեզեկցված և երկարությամբ բացված հաստ աղու սեգմենտ, որում երևում են հաստ աղու քաղցկեղ և չորս պոլիպներ։ Լուսանկարի ներքևում մուտանտ կամ էպիգենետիկորեն վնասված բջիջերի տեղամասերի սխեմատիկ պատկերն է, որը ցույց է տրված մեծ դեղին օջախի տեսքով։ Բջիջների այս առաջին, խոշոր օջախի (բջիջների մեծ կլոն) ներսում երկրորդ այպիսի մուտացիան, կամ էպիգենտիկական վնասվածքը կարող է տեղի ունենալ, ուստի այդ բջիջները առավելություն ձեռք կբերեն այլ ցողունային բջիջների նկատմամբ տվյալ օջախի ներսում և այս վնասված ցողունային բջիջները կարող են կլոնալ էքսպանսիային ենթարկվելով ձևավորել երկրորդային օջախ կամ ենթակլոն, առաջնային օջախի ներսում։ Վերջինս նշված է նկարում, չորս ավելի փոքր օջախների տեսքով որոնք տարբեր գույներ ունեն, առաջնային դեղին օջախի ներսում։ Այս նոր օջախների (ենթա-կլոններ) ներսում, վերոնկարագրված պրոցեսը կարող է կրկնվել բազմաթիվ անգամներ, ձևավորելով էլ ավելի փոքր օջախներ, որոնք նշված են չորս երկրորդային օջախների տեսքով (որոնք ևս տարբեր գույներ ունեն), որոնք ևս ենթարկվում են կլոնալ էքսպանսիայի, մինչև նշված ցողունային բջիջները կամ պոլիպներ, կամ չարորակ նորագոյացություններ (քաղցկեղ) են առաջացնում։ Լուսանկարում երևացող օջախային դեֆեկտը տվյալ սեգմենտում ձևավորել է չորս պոլիպ (որոնք նշված են իրենց չափերով՝ 6, 5 ու երկու 3մմ, և քաղցկեղ, որն իր ամենաերկար առանցքով 3սմ-ի է հասնում)։ Այս նորագոյացությունները նաև նշված են ներքևի նկարում չորս փոքր դեղնաշագանակագույն օղերի տեսքով և ավելի մեծ՝ կարմիր տեղամաս (քաղցկեղ)։ Լուսանկարի քաղցկեղն առաջացել է կույր աղիքում, որտեղ հաստ աղին միանում են բարակ աղուն (նշված է) և որտեղ որդանման ելունն է (նշված է)։ Լուսանկարում ճարպը տեղակայված է հաստ աղու արտաքին պատից դուրս։ Հաստ աղու ներկայացված սեգմենտում, հաստ աղիքը կտրված և բացված է երկայնքով, հաստ աղու ներքին մակերեսը տեսանելի դարձնելու և ներքին էպիթելիալ շերտում առաջացած պոլիպներն ու քաղցկեղը երևան
բերելու համար։
Ընդհանուր առմամբ, սպորադիկ քաղցկեղներն առաջանում են պրենեոպալաստիկ կլոնների ձևավորման հետևանքով, որոնք տարածվում են բնական ընտրության շնորհիվ, ինչին հետևում է ներքին ենթակլոնների առաջացումը առաջնային կլոնի ներսում և ապա ենթա-ենթակլոնների առաջացումը ենթակլոնների ներսում, ուստի քաղցկեղը պետք է որ ասոցացված լինի և դրան պետք է որ նախորդեն կուտակվող դեֆեկտներով օջախները, որոնք արտացոլում են նախաքաղցկեղային իրադարձությունների հաջողությունը։ Օջախի ամենատարածուն հատվածն (արտաքին դեղին հստակ չեզրագծված տեղամասը) արտացոլում է չարորակ նորագոյացության ձևավորման պրոցեսի ամենավաղ իրադարձությունը։
ԴՆԹ-ի սպեցիֆիկ վերանորոգման դեֆիցիտների փորձնական գնահատման արդյունքում, բազմաթիվ ԴՆԹ-ի վերանորոգման դեֆիցիտներ հայտնաբերվել են նաև օջախային դեֆեկտներում, որոնք շրջապատում են այդ քաղցկեղները։ Ներքևի աղյուսակում քաղցկեղում էպիգենետիկական վնասվածքների պատճառով առաջացած ԴՆԹ-ի վերանորոգման դեֆիցիտներ են ներկայացված, և փոքր էպիգենետիկորեն պայմանավորված ԴՆԹ-ի վերանորոգման դեֆիցիտների փոքր ինչ ավելի ցածր հաճախություններ շրջապատող օջախային դեֆեկտներում։
| Քաղցկեղ | Գեն | Քաղցկեղի հաճախություն | Օջախային դեֆեկտի հաճախություն | Հղումներ |
|---|---|---|---|---|
| Կոլոռեկտալ | MGMT | 46% | 34% | [37] |
| Կոլոռեկտալ | MGMT | 47% | 11% | [38] |
| Կոլոռեկտալ | MGMT | 70% | 60% | [39] |
| Կոլոռեկտալ | MSH2 | 13% | 5% | [38] |
| Կոլոռեկտալ | ERCC1 | 100% | 40% | [40] |
| Կոլոռեկտալ | PMS2 | 88% | 50% | [40] |
| Կոլոռեկտալ | XPF | 55% | 40% | [40] |
| Գլուխ և պարանոց | MGMT | 54% | 38% | [41] |
| Գլուխ և պարանոց | MLH1 | 33% | 25% | [42] |
| Գլուխ և պարանոց | MLH1 | 31% | 20% | [43] |
| Ստամոքս | MGMT | 88% | 78% | [44] |
| Ստամոքս | MLH1 | 73% | 20% | [45] |
| Կերակրափող | MLH1 | 77%–100% | 23%–79% | [46] |
Լուսանկարում ներկայացված բացված խթաղու սեգմենտի փոքր պոլիպներից որոշները, կարող են համեմատաբար բարորակ նորագոյացություններ լինել։ 10մմ-ից փոքր պոլիպները, որոնք հայտնաբերվել են կոլոնոսկոպիայի ժամանակ և վերահսկվել են կրկնվող կոլոնոսկոպիաներով երեք տարվա ընթացքում, ենթարկվել են հետևյալ փոփոխությունների՝ 25%-ը չի փոխվել չափերով, 35%-ը հետզարգացման կամ կնճռոտման են ենթարկվել և 40%-ը մեծացել են[47]։
Գենոմի անկայունություն
[խմբագրել | խմբագրել կոդը]Քաղցկեղները դրսևորում են գենոմային անկայունություն կամ մուտատոր ֆենոտիպ[48]։ Կորիզում սպիտակուց կոդավորող ԴՆԹ-ն կազմում է ընդհանուր ԴՆԹ-ի 1,5%-ը[49]։ Այս սպիտակուց կոդավորող ԴՆԹ-ում (էկզոններ), միջին քաղցկեղային բջիջը կարող է ունենալ 60-ից 70 պրոտեին վնասող մուտացիաներ, որոնցից երեքը կամ չորսը կարող են լինել «վարորդ» մուտացիաներ իսկ մնացածները «ուղևոր» մուտացիաներ[36]։ Սակայն ամբողջական գենոմում (ներառյալ սպիտակուց չկոդավորող հաջորդականությունները՝ ինտրոններ) ԴՆԹ-ի հաջորադականությունների մուտացիաների միջին թիվը կրծքագեղձի քաղցկեղում շուրջ 20000 է[50]։ Մելանոմային հյուսվածքի միջին նմուշում (մելանոմաները ունեն էկզոնային մուտացիաների ավելի բարձր հաճախություն[36]) ընդհանուր ԴՆԹ հաջորդականությունների մուտացիաների միջին թիվը շուրջ 80000 է[51]։ Մուտացիաների այսպիսի բարձր հաճախությունները քաղցկեղային բջջի ընդհանուր գենոմում թույլ են տալիս ենթադրել, որ հաճախ օջախային դեֆեկտում վաղ վնասումը, որը հանգեցնում է քաղցկեղի առաջացմանը (oրինակ՝ վերևում նկարագրված նկարում դեղին դաշտը) ԴՆԹ-ի վերանորոգման դեֆիցիտն է։ Պարզվել է, որ հաստ աղիքի քաղցկեղները շրջապատող խոշոր օջախային դեֆեկտները (որոնք քաղցկեղի տեղամասից սկսած ամեն կողմից մոտ 10սմ երկարություն ունեն) հաճախ էպիգենետիկական մուտացիաներ են ունենում ԴՆԹ-ի վերանորոգման երկու կամ երեք սպիտակուցներում (ERCC1, XPF և/կամ PMS2) օջախային դեֆեկտի ամբողջ տեղամասում[40]։ Երբ ԴՆԹ-ի վերանորոգող գեների էքսպրեսիան նվազում է, ԴՆԹ-ի վնասումները կուտակվում են բջջում ավելի մեծ քանակներով, քան նորմայում և վնասումների այս ավելցուկը մեծացնում է մուտացիաների և/կամ էպիմուտացիաների հաճախությունը։ Մուտացիաների հաճախությունը կտրուկ կերպով աճում է բջիջներում դեֆեկտավոր ԴՆԹ-ի սխալ հաջորդկամություններն ուղղող (վերանորոգող)[20][21] կամ, հոմոլոգ ռեկոմբինացիոն վերանորոգող համակարգի[23] խանգարումների դեպքում։ ԴՆԹ-ի վերանորոգման խանգարումները ինքնին կարող են հանգեցնել մուտացիաների կուտակմանը սխալների հակված տրանսվնասումային սինթեզի անցնելով այս վնասումները, կարող է մուտացիաներ ծնել։ Ի լրացում վերջինիս, կուտակվող վնասումների սխալ վերանորոգումը կարող է էպիմուտացիաներ սկզբնավորել։ Այս նոր մուտացիաները և/կամ էպիմուտացիաները կարող են օժտել բջիջներին պրոլիֆերատիվ առավելությամբ, սկզբնավորելով օջախային դեֆեկտ։ Չնայած մուտացիաները/էպիմուտացիաները ԴՆԹ վերանորոգող համակարգում ինքնին, սելեկտիվ առավելությամբ չեն շնորհում, սակայն դրանք կարող են ուղեկցել (չշտկելով դրանք) լրացուցիչ մուտացիաներին/էպիմուտացիաներին, որոնք ապահովում են պրոլիֆերատիվ ակտիվությունը։
Չհիմնավորված վարկածներ
[խմբագրել | խմբագրել կոդը]Գոյություն ունեն քաղցկեղածնության և քաղցկեղի բուժման տարբեր վարկածներ որոնք գլխավոր գիտական կարծիքից դուրս են, գիտական տվյալների փոքրաքանակ լինելու, տրամաբանության, կամ ապացույցների բացակայության պատճառով։ Այս վարակծները կարող են օգտագործվել քաղցկեղի ալտերնատիվ բուժումներն արդարացնելու համար։ Վերջիններս անհրաժեշտ է տարբերակել կարցինոգենեզի այն թեորիաներից, որոնք տրամաբանական հիմք ունեն քաղցկեղի կենսաբանության հիմնական գործունեության շրջանակներում, որոնցից հնարավոր է ստուգելի հիպոթեզներ ստեղծել։
Որոշ ալտերնատիվ վարկածներ, այնուամենայնիվ հիմնավորվում են գիտական ապացույցներով և հետզհետե ճանաչում են ձեռք բերում։ Որոշ հետազոտողներ հավատում են, որ քաղցկեղն առաջանում է ավելի շուտ անեուպլոիդիայի պատճառով (քրոմոսոմների թվային անոմալիաներ)[52], քան էպիմուտացիաների։ Քաղցկեղը դիտարկվում է նաև որպես մետաբոլիկ հիվանդություն, որում թթվածնի բջջային մետաբոլիզմը էներգիա սինթեզող ուղուց (օքսիդատիվ ֆոսֆորիլացում՝ շնչառական շղթա) դեպի թթվածնի ռեակտիվ ձևեր սինթեզող ուղի[53]։ Վերջինիս պատճառով էներգիայի ստացումը օքսիդացիոն ֆոսֆորիլացումից շեղվում է դեպի անաէրոբ գլիկոլիզ (Վարբուրգի հիպոթեզ) և թթվածնի ռեակտիվ ձևերի կուտակումը հանգեցնում է օքսիդատիվ սթրեսի առաջացման (քաղցկեղի առաջացման օքսիդատիվ սթրեսի վարկած)[53]։ Քաղցկեղածնության այս բոլոր թեորիաները կարող են ավելի շուտ լրացնող, քան հակասող լինել։ ԴՆԹ-ի մեթիլացման աբերանտ (անոմալ) մոդելները՝ հիպերմեթիլացում և հիպոմեթիլացում, նորմալ հյուսվածքների հետ համեմատած, ասոցացված են մեծ թվով նորագոյացությունների հետ (տես ԴՆԹ մեթիլացում քաղցկեղում)։
Շատ հեղինակներ կասկածի են ենթարկում այն ենթադրությունը, որ քաղցկեղն առաջանում է հաջորդական պատահական մուտացիաների արդյունքում, համարելով վերջինս գերպարզեցված և դրա փոխարեն առաջարկելով, որ քաղցկեղն առաջանում է մարմնի անկարողությունից ճնշելու բջիջների ծրագրավորված պրոլիֆերացիայի հակումը[54]։ Աստրոբիոլոգների կողմից մշակված վարկածի համաձայն, քաղցկեղը ատավիզմ է՝ էվոլյուցիոն վերադարձ դեպի ավելի վաղ բազմաբջիջ կյանքի ձևը։ Այդ գեները պատասխանատու են բջջի չկարգավորված աճի համար և քաղցկեղային բջիջների միջև փոխազդեցությունը խիստ նման է կյանքի առաջին բազմաբջիջ ձևերում փոխազդեցությանը՝ միասին հավաքվելու և աճելու տեսակետից[55]։ Այդ գեները դեռևս գոյություն ունեն ավելի բարդ մետազոաների գենոմում, ինչպիսին մարդն է, չնայած համեմատաբար վերջերս ձևավորված գեները վերահսկում են դրանք։ Երբ ավելի նոր վերահսկող գեները ինչ-որ պատճառով ձախողում են, բջիջը կարողանում է վերափոխվել իր ավելի պրիմիտիվ ծրագրավորմանը և անվերահսկելիորեն բազմանալ։ Այս վարկածն ալտերնատիվ է այն (հիմնական) վարկածին, որ քաղցկեղները սկզբնավորվում են վնասված բջիջներից և մարմնի ներսում էվոլյուցիայի են ենթարկում։ Դրա փոխարեն քաղցկեղային բջիջները պրիմիտիվ գեների ֆիքսված քանակություն ունեն, որոնք պրոգրեսիվորեն ակտիվանում են, ինչը դրանց սահմանափակ փոփոխականություն է թույլ տալիս[56]։ Մեկ այլ էվոլյուցիոն վարկած վերադառնում է էուկարոիոտ (կորիզավոր) բջիջների ծագմանը մեծաքանակ հորիզոնական գենային տեղափոխությունների միջոցով, երբ ինֆեկցող վիրուսների գենոմները կտրատվել են (ուստի ատենուացվել (թուլացել) են) տիրոջ կողմից, բայց դրաց կտորները ինտեգրվել են տիրոջ գենոմում, որպես իմուն պաշտպանություն։ Քաղցկեղն այժմ ծագում է, երբ հազվադեպ սոմատիկ մուտացիաները ռեկոմբինացնում են այսպիսի կտորները բջիջների պրոլիֆերացիան ֆունկցիոնալ կերպով ուժեղացնող գեների[57]։
Քաղցկեղային բջջի կենսաբանություն
[խմբագրել | խմբագրել կոդը]Հաճախ, բազմաթիվ քաղցկեղ առաջացնող գենետիկական փոփությունների կուտակման համար տարիներ են պահանջվում։ Այս ժամանակամիջոցում, նախաքաղցկեղային բջջի կենսաբանական պահվածքը դանդաղորեն փոխվում է նորմալ բջջին բնորոշ հատկանիշներից դեպի քաղցկեղանման հատկանիշներ։ Նախաքաղցկեղային բջիջները կարող են կոնկրետ տեսք ունենալ մանրադիտակի տակ։ Տարբերակվող հատկանիշների մեջ են մտնում բաժանվող բջիջների քանակության մեծացումը, բջջակորիզի չափի և ձևի փոփոխությունները, բջջի մասնագիտացված հատնկանիշների կորուստ և նորմալ հյուսվածքային կառուցվածքի կորուստ։ Դիսպլազիան բջջի ավելցուկային պրոլիֆերացիայի ձև է, որը բնութագրվում է նորմալ հյուսվածքային կառուցվածքի կորստով և բջջային կառուցվածքի փոփոխությունով դեպի նախա-քաղցկեղային։ Այս վաղ նեոպլաստիկ փոփոխությունները պետք է տարբերակել հիպերպլազիայից, որը բջիջների արտաքին գրգռով պայմանավորված դարձելի վիճակ է, ինչպես օրինակ հորմոնալ խանգարումների կամ քրոնիկ գրգռման դեպքում։
Դիսպլազիաների ամենածանր դասը կոչվում է <<carcinoma in situ>> (քաղցկեղ տեղում)։ Լատիներենում <<in situ>> նշանակում է <<տեղում>>, ուստի կարցինոման մնում է իր սկզբնավորման տեղում և ինվազիայի չի ենթարկում այլ հյուսվածքները։ Այնուամենայնիվ carcinoma in situ-ն կարող է զարգանալ, սկզբնավորելով ինվազիվ չարորակ ուռուցք և սովորաբար հեռացվում է վիրահատական եղանակով, եթե դա հնարավոր է։
Կլոնալ էվոլյուցիա
[խմբագրել | խմբագրել կոդը]Ինչպես կենդանիների պոպուլյացիան է ենթարկվում քվոլյուցիայի, բջիջների չվերահսկվող պոպուլյացիան ևս էվոլյուցիայի է ենթարկվում։ Այս անցանկալի պրոցեսը կոչվում է սոմատիկ էվոլյուցիա՝ դա այն է, թե ինչպես քաղցկեղն ավելի չարորակ է դառնում[58]։
Բջջային մետաբոլիզմի փոփոխությունների մեծամասնությունը թույլ է տալիս բջիջներին աճելու խանգարված կերպով, հանգեցնելով մահվան։ Սակայն քաղցկեղի սկզբնավորմանը զուգընթաց, քաղցկեղային բջիջները սկսում են էվոլյուցիայի և բնական ընտրության ենթարկվել՝ նոր գենետիկական փոփոխություններով բջիջներից մի քանիսը, որոնք բազմանալու և կենդանի մնալու առավելություն են ձեռք բերել, սկսում են շարունակաբար բազմանալ և շուտով դոմինատանտում են աճող ուռուցքում, իսկ այն բջիջները, որոնք ավլեի քիչ նախընտրելի գենետիկական փոփոխություններ են ձեռք բերել, մրցակցությունից դուրս են մնում[59]։ Հենց այս մեխանիզմով է, որ այնպիսի պաթոգենները, ինչպիսին է MRSA-ն դառնում են հակաբիոտիկակայուն (կամ ՄԻԱՎ-ը դեղորայքակայուն է դառնում), և հենց այս պատճառով է, որ բույսերն ախտահարող պաթոգենները և վնասատուները կարող են պեստիցիդ-կայուն դառնալ։ Այս էվոլյուցիային բացատրում է, թե ինչու են վերադարձող քաղցկեղների բջիջները քաղցկեղային-դեղորայք ռեզիստենտ դառնում (որոշ դեպքերում ռադիացիա (ճառագայթում) կամ ռադիոթերապիա ռեզիստենտ)։
Քաղցկեղային բջիջների կենսաբանական հատկություններ
[խմբագրել | խմբագրել կոդը]
2000 թվականին Հանահանի և Վայնբերգի կողմից հրապարակված հոդվածում չարորակ ուռուցքների ընդհանուր հատկանիշները հավաքագրված են ներքևում և հետևյալն են[60]․
- Աճի ազդանշանների առումով ինքնաբավության ձեռքբերում, որը հանգեցնում է չվերահսկվող աճի։
- Աճը դադարեցնող ազդանշանների հանդեպ զգայունության կորուստ, որը ևս հանգեցնում է չվերահսկվող աճի։
- Ապոպտոզի ունակության կորուստ, թույլ տալու համար աճը անկախ գենետիկական սխալներից և աճը դադարեցնող արտաքին ազդանշաններից։
- Ծերացման ունակության կորուստ, որը հանգեցնում է անսահմանափակ ռեպլիկատիվ պոտենցիալի առաջացմանը (անմահություն)
- Կայուն անգիոգենեզի ունակության ձեռքբերում, ինչը թույլ է տալիս ուռուցքին աճելու սննդանյութերի պասիվ դիֆուզիայի սահմանափակումներից այն կողմ։
- Հարևան հյուսվածքներն ինվազիայի ենթարկելու ունակություն, որով պայմանավորված է կարցինոմայի ինվազիվությունը։
- Մետաստազավորվելու ունակության ձեռքբերում հեռակա հատվածներում՝ չարորակ ուռուցքների դասական հատկանիշ (կարցինոմաներ և այլն)։
Սակայն նշված քայլերի իարականացումը խիստ հազվադեպ կլիներ առանց հետևյալի․
- Գենետիկական սխալներն ուղղելու ունակության կորուստ, որը մեծացնում է մուտացիաների քանակությունը (գենոմային անկայունություն), այսպիսով արագացնելով այլ փոփոխությունները։
Նշված կենսաաբնական փոփոխությունները դասական են կարցինոմաներում՝ այլ չարորակ նորգոյացությունները կարող են այս բոլորին հասնելու անհրաժեշտություն չունենալ։ Օրինակ, հյուսվածքների ինվազիան և մետաստազավորումը դեպի հեռակա տեղամասեր լեյկոցիտների նորմալ հատկություններ են և այս քայլերը անհրաժեշտ չէ հաղթահարել լեյկեմիաների զարգացման ընթացքում։ Տարբեր քայլերը միշտ չէ, որ կոնկրետ մուտացիաներ են արտացոլում։ Օրինակ մեկ գենի ինակտիվացումը, որը կոդավորում է p53 սպիտակուցը, գենոմային անկայունություն է առաջացնում, ինչպես նաև ապոպտոզից խուսափում և մեծացած անգիոգենեզ։ Ոչ բոլոր քաղցկեղային բջիջներն են բաժանվող։ Ավելի շուտ դրանց մի մասը, որոնք կոչվում են քաղցկեղի ցողունային բջիջներ ինքնառեպլիկացվում են և դիֆերենցված բջիջներ են առաջացնում[61]։
Քաղցկեղը, որպես բջջային փոխազդեցությունների դեֆեկտ
[խմբագրել | խմբագրել կոդը]Նորմայում, հենց հյուսվածքը վնասվում կամ ինֆեկցվում է, վնասված բջիջները բորոբոքում են հարուցում, խթանելով ֆերմենտների ակտիվացման և ցիտոկինային գեների էքսպրեսիայի որոշակի մոդելներ շրջապատող հյուսվածքում[62][63]։ Մոլեկուլների տարբեր խմբեր են սինթեզվում, որոնք աշխատում են որպես մեդիատորներ, սկզբնավորելով բիոքիմիական փոփոխությունների հաջորդական կասկադներ[64]։ Ամեն ցիտոկինը կապվում է տարբեր տեսակի բջիջների իր սպեցիֆիկ ընկալչին և ամեն տեսակի բջիջը տարբեր կերպ է պատասխանում փոփոխելով ներբջջային ազդակային տրասդուկցիայի տարլբեր ուղիների ակտիվությունը, կախված բջջի կողմից սինթեզված ռեցեպտորից և բջջի ներսում գտնվող ազդակային մոլեկուլներից[65][66]։ Ընդհանուր առումով, այս վերածրագրավորման գործընթացը սկզբնավորում է բջջային ֆենոտիպի աստիճանական փոփոխություն, որն ի վերջո բերելու է հյուսվածքային ֆունկցիայի վերականգնման և անհրաժեշտ կառուցվածքային ամբողջականության պահպանման[67][68]։ Ուստի հյուսվածքը կարող է լավանալ, կախված վնասման տեղամասում բջիջների պրոդուկտիվ փոխազդեցությունից և իմուն համակարգից[69]։ Լավացման բանալի գործոնը ցիտոկինի գենի էքսպրեսիայի վերահսկումն է, որը թույլ է տալիս բջիջների փոխլրացնող խմբերին պատասխանել բորոբոքային միջնորդանյութերի ազդակներին այնպես, որ հյուսվածքի ֆիզիոլոգիայում աստիճանաբար անհրաժեշտ փոփոխություններ տեղի ունենան[70][71][72]։ Քաղցկեղային բջիջները կամ կայուն (գենետիկական), կամ անկայուն (էպիգենետիկական) փոփոխություններ ունեն իրենց գենոմում, որը մասնակիորեն ճնշում է դրանց հաղորդակցումը (փոխազդեցությունը) շրջապատող հյուսվածքների և իմուն համակարգի հետ[73][74]։ Քաղցկեղային բջիջները չեն հաղորդակցվում իրենց հյուսվածքային միկրոմիջավայրի հետ այնպես, որ հյուսվածքային ամբողջականությունը պահպանվի։ Դրա փոխարեն քաղցկեղային բջիջների տեղաշարժը և ողջ մնալը հնարավոր է դառնում այն տեղամասերում, որտեղ դրանք կարող են վատացնել հյուսվածքային ֆունկցիան[75][76]։ Քաղցկեղները ողջ են մնում ակտիվացնելով այն ազդակային ուղիները, որոնք նորմայում պաշտպանում են հյուսվածքը իմուն համակարգից։
Քաղցկեղային բջջի կողմից հյուսվածքային ֆունկցիայի վերափոխման օրինակ է տրանսկրիպցիայի գործոն NF-κB-ի ակտիվացումը[77]։ NF-κB-ն ակտիվացնում է մի քանի գեներ, որոնք ներառված են բորբոքման և ռեգեներացիայի միջև միմյանց փոխարինման վրա, կոդավորել ցիտոկիններ, ադհեզիայի գործոններ և այլ մոլեկուլներ, որոնք կարող են փոխել բջջի ճակատագիրը[78]։ Բջջային ֆենոտիպերի այսպիսի վերածրագրավորումը նորմայում թույլ է տալիս ամբողջովին ֆունկցոինալ ամբողջական հյուսվածք ձևավորել[79]։ NF-κB-ի ակտիվությունը խիստ կերպով վերահսկվում է բազմաթիվ սպիտակուցների կողմից, որոնք միասին թույլ են տալիս գեների միայն դիսկրետ խմբերի ակտիվացում NF-κB-ի կողմից կոնկրետ տեղում, կոնկրետ ժամանակ[80]։ Սիգնալային փոխազդոցությունների այսպիսի խիստ վերահսկումը, պաշտպանում է հյուսվածքները ավելցուկային բորբոքումից և վերահսկում է, որ բջիջների տարբեր տիպերը աստիճանաբար փոխլրացնող ֆունկցիաներ ձեռք բերեն և յուրահատուկ դիրքեր ունենան։ Գենենտիկական ծրագրավորման և բջջային փոխազդեցությունների միջև եղած փոխվերահսկման կորուստը թույլ է տալիս քաղցկեղային բջիջներին մետաստազներ առաջացնել։ Քաղցկեղային բջիջները անոմալ կերպով են պատասխանում ցիտոկիններին և ակտիցացնում են ազդակային կասկադներ, որոնք պաշտպանում են նրանց իմուն համակարգից[77][81]։
Ձկների շրջանում
[խմբագրել | խմբագրել կոդը]Յոդի դերը ծովաձկներում (որոնք հարուստ են յոդով) և քաղցրահամ ջրերի ձկներում (յոդի դեֆիցիտ ունեցող) դեռևս ամբողջովին հասկացված չէ, բայց տվյալներ կան, որ քաղցրահամ ջրերի ձկները ավելի հակված են ինֆեկցիաների և, մասնավորապես, նեոպլաստիկ և աթերոսկլերոտիկ հիվանդությունների, ի տարբերություն ծովաձկների[82][83]։ Ծովային կռճիկային ձկները, ինչպիսիք են շնաձկները, կատվաձկները և այլն, ավելի քիչ են քաղկեղով ախտահարվում և հետևապես այս փաստը նպաստում է բժշկական հետազոտությունների իրականացմանը և կարող է կենդանիների շրջանում (հատկապես մարդկանց) քաղցկեղածնությունը հասկանալու առումով օգտակար լինել[84]։
Մեխանիզմներ
[խմբագրել | խմբագրել կոդը]Անվերահսկելի կերպով բաժանվելու համար, գեները, որոնք վերահսկում են բջջի աճը, հենց իրենք պետք է դուրս գան վերահսկողությունից[85]։ Պրոտոօնկոգենները գեներ են, որոնք խթանում են բջջային աճը և միտոզները միչդեռ ուռուցքի սուպրեսոր գեները ընկճում են բջջի աճը, կամ ժամանակավորապես դադարեցնում են բջջի բաժանումը ԴՆԹ-ի վերանորոգումն իրականցնելու համար[4]։ Սովորաբար, անվերահսկելի աճին հասնելու համար պահանջվում են մի քանի հաջորդական մուտացիաներ այդ գեներում։ Այդ հասկացությունը կոչվում է «օնկոէվոլյուցիա»։ Այդ գեներում իարականացվող մուտացիաները բջջին անվերահսկելիորեն բաժանվելու ազդանշաններով են ապահովում։ Բայց չկարգավորվող բջջային բաժանումը պահանջում է նաև, որ քաղցկեղային բջիջը կրկնապատկի իր բոլոր բջջային կոմպոնենտները երկու դուստր բջիջ ստեղծելու համար։ Անաէրոբ գլիկոլիզի ակտիվացումը (Վարբուրգի էֆեկտ), որը միշտ չէ որ պրոտոօնկոգեննրի կամ ուռուցքի սուպրեսոր գեների[86] մուտացիաներով է պայմանավորված, ապահովում է անհրաժեշտ կառուցվածքներով, որոնք անհրաժեշտ են բջիջների բաժանման համար, ուստի անհրաժեշտություն է քաղցկեղածնության պրոցեսում[53]։
Օնկոգեններ
[խմբագրել | խմբագրել կոդը]Օնկոգենները խթանում են բջջային աճը տարբեր մեխանիզմենրով։ Դրանցից շատերը հորմոններ են սինթեզում, որոնք «քիմիական մեսենջերներ» են բջիջների միջև և խթանում են միտոզը, և որոնց էֆեկտը կախված է թիրախ բջջի կամ հյուսվածքի ազդակային տրանսդուկցիայից։ Այլ կերպ ասած, երբ ռեցիպիենտ բջջի հորմոնային ընկալիչը դրդվում է, ազդանշանը հաղորդվում է բջջի մակերեսից դեպի բջջակորիզ, գենային տրանսկրիպցիայի կարգավորման նպատակով, ժառանգական նյութի մակարդակով։ Որոշ օնկոգեններ ազդակային տրանսդուկցիայի մի մասն են, ինքին, կամ իրենք հենց ազդակային ռեցեպտորներ են բջիջներում և հյուսվածներում, այսպիսով վերահսկելով նմանօրինակ հորմոնների հանդեպ զգայունությունը։ Օնկոգենները հաճախ միտոգեններ են առաջացնում, կամ ներառված են ԴՆԹ-ի տրանսկրիպցիայի և սպիտակուցի սինթեզի գործընթացում, որը ստեղծում է սպիտակուցներ և ֆերմենտներ, որոնք պատասխանատու են որոշակի վերջնանյութեր և բիոքիմաիական նյութերի ստեղծման հարցում, որոնք բջիջն օգտագործում է, կամ որոնց հետ փոխազդում է։
Մուտացիաները պրոտոօնկոգեններում, որոնք նորմայում օնկոգենների լռակյաց գործընկերներն են, կարող են փոփոխել սեփական էքսպրեսիան կամ ֆունկցիան, մեծացնելով վերջնանյութ հանդիսացող սպիտակուցի ակտիվությունը։ Երբ վերջինս տեղի է ունենում, պրոտոօնկոգենները օնկոգենների են վերածվում, և այս փոփոխությունը խանգարում է բջջային ցիկլի կարգավորման նորմալ հավասարակշռությունը, դարձնելով անվերահսկելի աճը հնարավոր։ Քաղցկեղի առաջացման ռիսկը չի կարող նվազեցվել գենոմից պրոտոօնկոգեններկ հեռացման միջոցով, նույնիսկ եթե դա հնարավոր լինել, քանի որ պրոտոօնկոգենները անհրաժեշտ են օրգանիզմի աճի, վերանորոգման և հոմեոստազի համար։ Միայն այն ժամանակ, երբ դրանք մուտացիայի են ենթարկվում, աճի ազդանշաններն ավելցուկային են դառնում։
Քաղցկեղի շուրջ հետազոտությունների ժամանակ հայտնաբերված առաջին օնկոգեններից մեկը Ras օնկոգենն է։ Պրոտոօնկոգենների Ras ընտանիքի մուտացիաները (ներառյալ H-Ras-ը, N-Ras-ը և K-Ras-ը) շատ հաճախ են հանդիպում, և դրանք հնարավոր է հայտնաբերել մարդկային ուռուցքների 20-ից 30%-ում[87]։ Ras-ն ի սկզվանե հայտնաբերվել է Հարվեյի սարկոմայի վիրուսի գենոմում և հետազոտողները զարմացել են, որ այս գենը ոչ միայն ներառված է մարդկային գենոմում, այլև և կապվում է խթանող վերահսկող էլեմենտի հետ, ունակ է բջջայի գծի կուլտուրաներում քաղցկեղ առաջացնել[88]։
Պրոտոօնկոգեններ
[խմբագրել | խմբագրել կոդը]Պրոտոօնկոգենները տարբեր ճանապարհներով են խթանում բջջային աճը։ Դրանցից շատերը հորմոններ են սինթեզում, որոնք «քիմիական մեսենջերներ» են բջիջների միջև և խթանում են միտոզը, և որոնց էֆեկտը կախված է թիրախ բջջի կամ հյուսվածքի ազդակային տրանսդուկցիայից։ Որոշ օնկոգեններ ազդակային տրանսդուկցիայի մի մասն են, ինքին, կամ իրենք հենց ազդակային ռեցեպտորներ են բջիջներում և հյուսվածներում, այսպիսով վերահսկելով նմանօրինակ հորմոնների հանդեպ զգայունությունը։ Օնկոգենները հաճախ միտոգեններ են առաջացնում, կամ ներառված են ԴՆԹ-ի տրանսկրիպցիայի և սպիտակուցի սինթեզի պրոցեսում, որը ստեղծում է սպիտակուցներ և ֆերմենտներ, որոնք պատասխանատու են որոշակի վերջնանյութեր և բիոքիմաիական նյութերի ստեղծման հարցում, որոնք բջիջն օգտագործում է, կամ որոնց հետ փոխազդում է։
Մուտացիաները պրոտոօնկոգեններում, որոնք նորմայում օնկոգենների լռակյաց գործընկերներն են, կարող են փոփոխել սեփական էքսպրեսիան կամ ֆունկցիան, մեծացնելով վերջնանյութ հանդիսացող սպիտակուցի ակտիվությունը։ Երբ վերջինս տեղի է ունենում, պրոտոօնկոգենները օնկոգենների են վերածվում, և այս փոփոխությունը խանգարում է բջջային ցիկլի կարգավորման նորմալ հավասարակշռությունը, դարձնելով անվերահսկելի աճը հնարավոր։ Քաղցկեղի առաջացման ռիսկը չի կարող նվազեցվել գենոմից պրոտոօնկոգեններկ հեռացման միջոցով, նույնիսկ եթե դա հնարավոր լինել, քանի որ պրոտոօնկոգենները անհրաժեշտ են օրգանիզմի աճի, վերանորոգման և հոմեոստազի համար։ Միայն այն ժամանակ, երբ դրանք մուտացիայի են ենթարկվում, աճի ազդանշաններն ավելցուկային են դառնում։ Անհրաժեշտ է նշել, որ գենը, որն ունի աճ-խթանող դեր, կարող է բարձրացնել բջջի քաղցկեղածին պոտենցիալը այն վիճակներում, երբ աճը թույլ թվող բոլոր անհրաժեշտ բջջային մեխանիզմներն ակտիվացել են[89]։ Այս վիճակը նաև ներառում է յուրահատուկ ուռուցքի սուպրեսոր գեների (տես ներքևում) ինակտիվացում։ Եթե բջիջն անհրաժեշտ բարդությունները, դրա աճը կարող է դադարել և այն կարող է մահանալ։ Սա դարձնում է քաղցկեղի փուլի և տիպի նույնականացումը խիստ կարևոր բուժման ստրատեգիաների մշակման հարցում։
Ուռուցքի սուպրեսոր գեներ
[խմբագրել | խմբագրել կոդը]
Ուռուցքի սուպրեսոր գեները կոդավորում են հակապրոլիֆերատիվ ազդանշաններ և սպիտակուցներ, որոնք ճնշում են միտոզը և բջջային աճը։ Ընդհանուր առումով, ուռուցքի սուպրեսորները տրանսկրիպցիայի գործոններ են, որոնք ակտիվանում են բջջային սթրեսի կամ ԴՆԹ-ի վնասման միջոցով։ Հաճախ ԴՆԹ-ի վնասումն առաջացնում է ազատ-լողացող գենետիկական նյութ բջջի ներսում, ինչպես նաև այլ նշաններ և խթանում է ֆերմենտներ և ուղիներ, որոնք հանգեցնում են ուռուցքի սուպրեսոր գեների ակտիվացմանը։ Այսպիսի գեների ֆունկցիան բջջային ցիկի ձերբակալումն է, ԴՆԹ-ի վերանորոգումն իրականացնելու համար, կանխարգելելով, որ մուտացիաներն անցնեն դուստր բջիջներին։ P53 սպիտակուցն ուսումնասիրված ամենակարևոր սուպրեսոր գեների արգասիքը՝ տրանսկրիպցիայի գործոն է, որն ակտիվացվում է սթրեսորներով, ներառյալ հիպօքսիա և ուլտրամանուշակագույն ճառագայթներով վնասում։
Չնայած քաղցկեղների շուրջ կեսը հավանաբար ներառում են p53-ի մուտացիաներ, ուռուցքի սուպրեսոր այս գործոնի ֆունկցիան վատ է հասկացված։ P53-ը ակնհայտորեն երկու ֆունկցիա ունի՝ մեկը կորիզային դերն է, որպես տրանսկրիպցիոն գործոն, մյուսը ցիտոպլազմատիկ դերն է բջջային ցիկլի կարգավորման պրոցեսում, ինչպես նաև բջջի բաժանման և ապոպտոզի կարգավորումը։
Վարբուրգի հիպոթեզի համաձայն գլիկոլիզից ստացված էներգիայի օգտագործումը քաղցկեղային բջջի համար նախընտրելի է, վերջինիս աճն ապահովելու համար։ P53-ը, ըստ ժամանակակից տվյալների կարգավորում է շնչառական (օքսիդատիվ ֆոֆորիլացում) և գլիկոլիտիկ ուղիների միջև միմյանց անցումը[90]։
Սակայն մուտացիան կարող է վնասել ուռուցքի սուպրեսոր գենը ինքնին, կամ ազդակային ուղին, որն ակտիվացնում է այդ գենը կարող է «անջատվել»։ Սրա կանխատեսելի հետևանքը ԴՆԹ-ի վերանորոգման դադարեցումը, կամ ճնշումն է։ ԴՆԹ-ի վնասումները կուտակվում են առանց վերանորոգման, անխուսափելիորեն հանգեցնելով քաղցկեղի առաջացմանը։
Ուռուցքի սուպրեսոր գեների մուտացիաները, որոնք տեղի է են ունենում էմբրիոնալ գծի բջիջներում, փոխանցվում են հաջորդներին և մեծացնում են քաղցկեղի ախտորոշման հավանականությունը ապագա սերունդներում։ Այդպիսի ընտանիքների անդամներն ունենում են քաղցկեղով բարձր հիվանդացություն և բազմաթիվ ուռուցքների լատենտության նվազում։ Ուռուցքների տիպերը սովորաբար յուրահատուկ են ուռուցքի սուպրեսոր գենի ամեն տիպի մուտացիայի համար, և որոշ մուտացիաներ կոնկրետ տեսակի քաղցկեղներ են առաջացնում, իսկ այլ մուտացիաներ այլ տեսակի քաղցկեղներ են առաջացնում։ Ուռուցքի մուտանտ սուպրեսոր գենի ժառանգման մոդելը հետևյալն է՝ ախտահարված ընտանիքի անդամը ժառանգում է դեֆեկտավոր գենը մի ծնողից և նորմալ գենի օրինակը մյուս ծնողից։ Օրինակ, անձիք, ովքեր ժառանգում են մեկ մուտանտ p53-ի ալել (և հետևապես հետերոզիգոտ են մուտացված p53-ով) կարող են ձեռք բերել մելանոմաներ և ենթաստամոքսային գեղձի քաղցկեղներ, որը հայտնի է որպես Լի-Ֆռաումենի համախտանիշ։ Այլ ժառանգվող ուռուցքի սուպրեսոր գեների համախտանիշները ներառում են Rb մուտացիաներ, որոնք կապված են ռետինոբլաստոմաների հետ, և APC գենի մուտացիաներ, որոնք ասոցացված են հաստ աղու ադենոպոլիպոզային քաղցկեղի հետ։ Հաստ աղու ադենոպոլիպոզային քաղցկեղը կապված է երիտասարդ հասակում հաստ աղում առաջացած բազմաթիվ պոլիպների հետ, որոնք հետագայում բերում են հաստ աղու քաղցկեղի առաջացմանը։ Ի վերջո, BRCA1 և BRCA2 ժառանգվող մուտացիաները հանգեցնում են վաղ կրծքագեղձի քաղցկեղի առաջացմանը։
1971-ի առաջարկվել է, որ քաղցկեղի զարգացման համար ամենաքիչը երկու մուտացիա է անհրաժեշտ։ Վերջինս հայտնի է որպես Խանդսոնի երկու հարվածի հիպոթեզ՝ ժառանգված էմբրիոնալ գծի մուտացիան ուռուցքի սուպրեսոր գենում քաղցկեղ կառաջացնի միայն այն դեպքում, եթե մեկ այլ մոտացիա տեղի ունենա օրգանիզմի կյանքի ուշ շրջանում, որը կինակտիվացնի ուռուցքի այդ սուպրեսոր գենի մյուս ալելը[91]։
Սովորաբար, օնկոգենները դոմինանտ են, քանի որ դրանք պարունակում են ֆունկցիան ուժեղացնող մուտացիաներ (gain-of-function ), մինչդեռ մուտացված սուպրեսորները ռեցեսիվ են, քանի որ դրանք պարունակում են ֆունկցիայի կորստով մուտացիաներ (loss-of-function): Ամեն բջիջ ունի նույն գենի երկու պատճեն՝ մեկը մորից, մյուսը հորից և և դեպքերի մեծամասնությունում ֆունկցիան ուժեղացնող կոնկրետ պրոտոօնկոգենի մուտացիայի միայն մեկ օրինակը բավարար է այդ գենը իսկական օնկոգեն դարձնելու համար։ Մյուս կողմից, ֆունկցիայի կորստով մուտացիաները պետք է տեղի ունենան ուռուցքի սուպրեսոր գենի երկու ալելներում, որպեսզի գենը ամբողջովին ոչ ֆունկցիոնալ դառնա։ Սակայն, գոյություն ունեն դեպքեր, երբ ուռուցքի սուպրեսոր գենի միայն մեկ օրինակի առկայությունը կարող է դարձնել մյուս՝ վայրի տիպի (պոպուլյացիայում լայն տարածում ունեցող) ալելը ոչ ֆունկցիոնալ։ Այս երևույթն անվանում են դոմինանտ նեգատիվ էֆեկտ և այն կարելի դիտարկել բազմաթիվ p53 մուտացիաների դեպքում։
Խանդսոնի երկու հարվածի մոդելը վերջերս կասկածի է ենթարկվել մի քանի հետազոտողների կողմից։ Որոշ ուռուցքների դեպքում սուպրեսոր գեների միայն մեկ ալելի ինակտիվացումը բավական է քաղցկեղային ուռուցքներ առաջացնելու համար։ Այս երևույթը կոչվում է հապլոանբավարարարություն և ցույց է տրվել մի շարք փորձնական ուղիներով։ Ուռուքները, որոնք առաջանում են հապպլոանբավարարության պատճառով, սովորաբար կյանքի ընթացքում ավելի ուշ են առաջանում համեմատած «երկու հարվածով» առաջացածների[92]։
Բազմաթիվ մուտացիաներ
[խմբագրել | խմբագրել կոդը]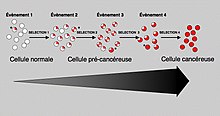
Ընդհանուր առումով, երկու տեսակի գեների մուտացիաներն էլ անհրաժեշտ են քաղցկեղի սկզբնավորման համար։ Օրինակ մեկ օնկոգենով սահմանափակված մուտացիան կարող է ճնշվել նորմալ միտոզով, վերահսկմամբ և ուռուցքի սուպրեսոր գեներով, որը բացատրվում է Խանդսոնի հիպոթեզով[3]։ Միայն մեկ սուպրեսոր գենի մուտացիան կարող է քաղցկեղի զարգացման պատճառ չդառնալ օրինակ «օգնող գեների» պատճառով, որոնք կրկնօրինակում են դրա ֆունկցիաները։ Միայն երբ բավականաչափ պրոտոօնկոգեններ են մուտացիայի ենթարկվում և բավականաչափ ուռուցքի սուպրեսոր գեներ են ինակտիվանում կամ վնասվում, բջջի աճի ազդանշանները այնքան շատ են, որ այլևս չեն կարգավորում այն, և բջիջն արագորեն դուրս է գալիս վերահսկողությունից[4]։ Հաճախ, որովհետև այդ գեները կարգավորում են այն պրոցեսները, որոնք կանխում են գեների վնասման մեծ մասը, մուտացիաների քնաակությունն ավելանում է մեծացմանը զուգընթաց, քանի որ ԴՆԹ-ի վնասումները ձևավորում է հետադարձ դրական կապ։ Ուռուցքի սուպրեսոր գեների մուտացիաները, որոնք անցել են ոչ թե ուղղակի բջիջների հաջորդ սերնդին, այլ դրանց հաջորդներին, կարող են առաջացնել քաղցկեղներ ժառանգելու բարձր հավանականություն։ Այսպիսի ընտանիքների անդամներն ունեն բազմաթիվ ուռուցքների բարձրացած հիվանդացություն և նվազած լատենտություն։ Մւուտանտ ուռուցքի սուպրեսորների ժառանգում հետևյալն է՝ ախտահարված անդամը ժառանգում է դեֆեկտավոր գենի օրինակը մի ծնողից և նորմալ պատճեն մյուս ծնողից։ Քանի որ ուռուցքի սուպրեսոր գեները գործում են ռեցեսիվ եղանակով (ուշադրություն դարձրեք սակայն, որ կան բացառություններ), նորմալ պատճենի կորուստը քաղցկեղային ֆենոտիպ է սկզդբնավորում։ Մասնավորապես անձիք ովքեր p53-մուտացիայով հետերոզիգոտ են, հաճախ տառապում են Լի-Ֆռաումենի համախտանիշով, և նրանց մոտ, ովքեր հետերոզիգոտ են Rb մուտացիայով, հաճախ ռետինոբլաստոմա է զարգանում։ Նույն կերպով, հաստ աղու ադենոմատոզ պոլիպոզի մուտացիաները կապված են հաստ աղու ադենոպոլիպոզ քաղցկեղին, որի ժամանակ երիտասարդ հասակում խթաղում հազարավոր պոլիպներ են ձևավորվում, իսկ BRCA1 և BRCA2 մուտացիաները հանգեցնում են կրծքագեղձի քաղցկեղի վաղ առաջացման։
Նոր գաղափարը, որը հնչեցվել է 2011-ին, բազմաթիվ մուտացիաների հիպոթեզի ծայրահեղական տարբերակ է որն իր հետևորդների կողմից անվանվել է քրոմոտրիպսիս։ Այս գաղափարը, որը ներառում է քաղցկեղների բոլոր դեպքերի 2-3%-ը, և ոսկրային քաղցկեղների 25%-ը, ներառում է քրոմոսոմի կատաստրոֆիկ փշրում տասնյակ կամ հարյուրավոր մանր մասերի և համա սխալ կերպով հետհավաքում։ Այս փշրումը հավանաբար տեղի է ունենում բջջի նորմալ բաժանման ընթացքում, երբ քրոմոսոմը փաթեթավորվում է, սակայն փշրման պատճառը հայտնի չէ։ Այս մոդելի համաձայն, քաղցկեղն առաջանում է մեկ, մեկուսացված իրադարձության պատճառով, բազմաթիվ մուտացիաների դանդաղ կուտակման փոխարեն[93]։
Ոչ մուտագենային կարցինոգենեզ
[խմբագրել | խմբագրել կոդը]Բազմաթիվ մուտագեններ հայտնի են նաև որպես կարցինոգեններ, սակայն որոշ կարցինոգեններ մուտագեններ չեն։ Մուտագեն չհանդիսացող կարցինոգենների օրինակ են ալկոհոլը և էստրոգենը։ Սրանք նպաստում են քաղցկեղի առաջացմանը միտոզի խթանման հաշվին։ Միտոզների ավելի բարձր քանակությունը ավելի քիչ հնարավորություններ է թողնում վնասված ԴՆԹ-ն վերանորոգելու համար ԴՆԹ-ի ռեպլիկացիայի ընթացքում, մեծացնելով գենետիկական սխալի հավանականությունը։ Միտոզի ընթացքում տեղ ունեցող սխալները կարող են նպաստել դուստր բջիջների կողմից քրոմոսոմների սխալ թվի ստացմանը, որը կարող է հանգեցնել անեուպլոիդիայի և ի վերջո քաղցկեղի։
Ինֆեկցիաների դերը
[խմբագրել | խմբագրել կոդը]Բակտերիալ
[խմբագրել | խմբագրել կոդը]Helicobacter pylori-ն հայտնի է որպես MALT-լիմֆոմայի պատճառ։ Բակտերիաների այլ տիպեր այլ քաղցկեղներ են առաջացնում։
Վիրուսային
[խմբագրել | խմբագրել կոդը]Բացի այդ, շատ քաղցկեղներ առաջանում են վիրուսային ինֆեկցիայի հետևանով՝ սա հատկապես ճիշտ է այնպիսի կենդանիների համար, ինչպիսիք են թռչունները և մի փոքր պակաս՝ մարդիկ։ Մարդկային քաղցկեղների 12%-ի պատճառը վիրուսային վարակն է[94]։ Վիրուսով առաջացած ուռուցքների առաջացման ընթացքի ձևը կարելի է բաժանել երկու տեսակի՝ սուր վերափոխող և դանդաղ վերափոխող։ Սուր վերափոխող վիրուսների դեպքում, վիրուսային մասնիկները կրում են գեն, որը գերակտիվ օնկոգեն է կոդավորում, որը կոչվում է վիրուսային օնկոգեն (v-onc), և վարակված բջիջը վերափոխվում է անմիջապես v-onc-ի էքսպրեսիայից հետո։ Ի հակադրում վերջինիս, դանդաղ տրանսֆորմացնող վիրուսների դեպքում, վիրուսային գենոմը ներդրվում է (հատկապես եթե վիրուսային գենոմի ներդնումը պարտադիր է, օրինակ, ինչպես ռետրովիրուսների դեպքում), պրոտոօնկոգենի մոտ տիրոջ գենոմում։ Վիրուսային պրոմոտերը կամ այլ տրանսկրիպցիայի կարգավորման էլեմենտներն, իրենց հերթին, առաջացնում են բջիջների չվերահսկվող պրոլիֆերացիա։ Քանի որ վիրուսային գենոմի ներդնումը սպեցիֆիկ չէ պրոտոօնկոգենների համար և պրոտոօնկոգենի մոտ ներդնման հավանականությունը ցածր է, դանդաղ տրանսֆորմացնող վիրուսները ունեն շատ ավելի երկարատև ուռուցքային լատենտություն, սուր տրանսֆորմացնող վիրուսների հետ համեմատած, որոնք արդեն իսկ կրում են վիրուսային օնկոգենը։
Վիրուսները, որոնք հայտնի են որպես քաղցկեղ առաջացնողներ, ինչպես օրինակ ՄՊՎ-ն (արգանդի վզիկի քաղցկեղ) և ԷԲՎ-ն (լիմֆոմայի տիպ), բոլորը ԴՆԹ վիրուսներ են։ Կարծիք կա, որ երբ վիրուսն ախտահարում է բջիջը, այն ներդնում է իր ԴՆԹ-ի մի մասը բջջի աճի գեների մոտ, առաջացնելով բջջի բաժանում։ Փոփոխված բջիջների խումբը, որը ձևավորվել է առաջին բաժանվածից, ունի միևնույն վիրուսային ԴՆԹ-ն աճի գեների մոտ։ Փոփոխված բջիջների այս խումբն այժմ յուրահատուկ է, քանի որ աճի նորմալ վերահսկումը կորսված է։
ՏԵղակայումից կախված բջիջները կարող են ճառագայթման միջոցով վնասված լինել, ծխախոտի ծխում պարունակվող քիմիական նյութերով և բակտելիալ ինֆեկցիայով հարուցված բորբոքմամբ կամ այլ վիրուսներով։ Յուրաքանչյուր բջիջ վնասվելու շանս ունի։ Բջիջները հաճախ մաահանում են, երբ վնասվում են, կենսական անհրաժեշտություն ունեցող պրոցեսի խանգարման կամ կամ իմուն համակարգի պատճառով, սակայն երբեմն այդ վնասումը անջատում է քաղցկեղի մեկ գենը։ Մեծահասակների շրջանում, կան տասնյակ հազարավոր կամ հարյուր հազարավոր այդպիսի գեներ։ Հավանականությունը, որ այսպիսի բջիջներից ինչ-որ մեկը քաղցկեղ կառաջացնի շատ ցածր է[փա՞ստ]։
Երբ վնասումը տեղի է ուենում փոփոխված բջիջների ցանկացած տեղամասում, մեկ ուրիշ բան է տեղի ունենում։ Բջիջներից յուրաքանչյուրը աճի պոտենցիալ ունի։ Փոփոխված բջիջները ավելի արագ են սկսում բաժանվել, երբ տեղամասը վնասված է ֆիզիկական, քիմիական կամ վիրուսային գործոններով։ Ախտաբանական օղակ է սկսում գործել՝ տեղամասի վնասումը ստիպելու է վնասված բջիջներին բաժանվել, մեծացնելով հետագա շեղումների հավանականությունը։
Կարցինոգենեզի այս մոդելը բավականին հայտնի է, քանի որ այն բացատրում է, թե ինչպես է քաղցկեղը զարգանում։ Սպասելի է, որ ճառագայթումից վնասված բջիջները մահանալու են կամ ամենաքիչը ավելի վատ դրության մեջ են հայտնվելու, քանի որ դրանց գեների մի մասը չի աշխատում։ Վիրուսները մեծացնում են գործող գեների քանակությունը։
Տարբերակներից մեկն այն է, որ մարդկությունը կարող է ստեղծել հազարավոր պատվաստումներ, կանխելու համար ցանկացած վիրուսային վարակ, որը կարող է փոփոխել մեր բջիջները։ Վիրուսները կարող են տարբեր ազդեցություն ունենալ մարմնի տարբեր հատվածներում։ Կարող է հնարավոր լինել բազմաթիվ քաղցկեղների կանխումը իմունիզացնելով անձին գեթ մեկ վիրուսի դեմ։ Օրինակ, հավանական է, որ մասնավորապես ՄՎՊ-ն բերանի լորձաթաղանթների քաղցկեղների առաջացման հարցում մասնակցություն ունի։
Հելմինթոզներ
[խմբագրել | խմբագրել կոդը]Որոշակի պարազիտային որդեր հայտնի են իրենց կարցինոգենությամբ[95]։ Դրանք ներառում են․
- Clonorchis sinensis-ը (այդ օրգանիզմ առաջացնում է կլոնորխիազ) և Opistorchis viverrini (որն առաջացնում է օպիստորխազ) ասոցացված են խոլանգիոսարկոմայի հետ[96]։
- Schistosoma տեսակները (օրգանիզմն առաջացնում է շիստոսոմիազ) որն ասոցացված է միզապարկի քաղցկեղի հետ։
Էպիգենետիկա
[խմբագրել | խմբագրել կոդը]Էպիգենետիկան գեների էքսպրեսիայի քիմիական նյութերով և ԴՆԹ-ի կառուցվածքի ոչ մուտացիոն փոփոխություններով կարգավորման մասին ուսմունք է։ Էպիգենետիկայի վարկածը պնդում է, որ ԴՆԹ-ի ոչ մուտացիոն փոփոխությունները կարող են բերել գենի էքսպրեսիայի փոփոխության։ Նորմայում, օնկոգենները լուռ են, օրինակ, ԴՆԹ-ի մեթիլացման հաշվին։ Մեթիլացման կորուստը կարող է հանգեցնել օնկոգենների անոմալ էքսպրեսիայի, բերելով քաղցկեղածնության։ Էպիգենետիկական փոփոխությունների հայտնի մեխանիզմները ներառում են ԴՆԹ-ի մեթիլացումը, հիստոնային սպիտակուցների մեթիլացումը կամ ացետիլացումը, որոնք կպած են քրոմոսոմային ԴՆԹ-ին որոշակի տեղամասերում։ Դեղամիջոցների որոշ խմբեր, որոնք հայտնի են որպես HDAC (հիստոնների դեացետիլազի) ինհիբիտորներ և ԴՆԹ մեթիլտրանսֆերազնեի ինհիբիտորներ, կարող են վերակարգավորել քաղցկեղային բջջի էպիգենետիկական ազդանշանները։
Էպիմուտացիաները ներառում են CpG կղզյակների մեթիլացումներ և դեմեթիլացումներ գեների պրոմոտեր տեղամասերում, ինչի արդյունքում առաջանում է համապատասխան գենի տեղամասի ճնշում, կամ ապա-ճնշում[97][98][99]։ Էպիմուտացիաները կարող են տեղի ունենալ նաև հիստոնների ացետիլացման, մեթիլացման, ֆոսֆորիլացման կամ այլ վնասումների ձևով, ստեղծելով հիստոնային կոդ, որը ճնշում կամ ակտիվացնում է գեների էքսպրեսիան, և այսպիսի հիստոնների էպիմուտացիաները կարող են կարևոր էպիգենետիկական գործոններ լինել քաղցկեղի զարգացման հարցում[100][101]։ Ի լրացում վերջինիս, քաղցկեղածին էպիմուտացիաները կարող են տեղի ունենալ քրոմոսոմների կառուցվածքի վնասման պատճառվ, որն առաջանում է այնպիսի սպիտակուցներով, ինչպիսին է HMGA2-ը[102]։ Հետագա էպիմուտացիաները հանգեցնում են միՌՆԹ-ների մեծացած կամ փոքրացած էքսպրեսիայի։ Օրինակ miR-137-ի ավելցուկային էքսպրեսիան կարող է առաջացնել 491 գեների լռեցում, իսկ miR-137-ի էպիգենետիկական լռեցումը դիտվում է կոլոռեկտալ քաղցկեղների 32% դեպքերում[8]։
Քաղցկեղային ցողունային բջիջներ
[խմբագրել | խմբագրել կոդը]Կարցինոգենեզի զարգացման նոր մոտեցումը գալիս է զարգացման կենսաբանության ինտեգրումից ուռուցքաբանության մեջ։ Քաղցկեղային ցողունային բջիջների վարկածն առաջարկում է, որ հետերոգեն ուռուցքների տարբեր տիպի բջիջները առաջանում են մեկ բջջից, որը կոչվում է Քաղցկեղային Ցողունային Բջիջ։ Քաղցկեղային ցողույնային բջիջները կարող են առաջանալ հասուն ցողունային բջջից կամ տարբերակված բջջից մարմնի ներսում։ Այս բջիջները պերսիստում են, որպես ուռուցքի ուռուցքի ենթակոմպոնենտ և ունենում են ցողունային բջիջների բանալի հատկանիշները։ Վերջինս սկզբնավորում է տարբեր տեսակի բջիջներ, որոնք ունակ են ինքնանորացման և հոմեոստատիկ վերահսկողության[103]։ Հետագայում, քաղցկեղի վերադարձը և մետաստազների առաջացումը ևս վերագրվում է այս բջիջներին։ Քաղցկեղի ցողունային բջիջների վարկածը չի հակասում քաղցկեղածնության ավելի վաղ վարկածներին։ Քաղցկեղի ցողունային բջիջների վարկածը առաջարկվել է ուռուցքների հետերոգենությունը բացատրելու նպատակով։
Կլոնալ էվոլյուցիա
[խմբագրել | խմբագրել կոդը]Մինչ գենետիկական և էպիգենետիկական վնասումները ուռուցքի սուպրեսոր գեներում և օնկոգեններում փոփոխում են բջիջների պահվածքը, այդ վնասումներն ի վերջո հանգեցնում են քաղցկեղի առաջացմանը, նեոպլաստիկ բջիջների և դրանց միկրոմիջավայրի վրա ունեցած ազդեցության միջոցով[58]։ Նորագոյացություններում մուտանտ բջիջները մրցակցում են տարածության և ռեսուրսների համար։ Ուստի, մուտացիա կրող կլոնը ուռուցքի սուպրեսոր գենում կամ օնկոգենում, կաճի և կբազմանա միայն այն դեպքում, եթե այդ մուտացիան դրանց մրցակցային առավելություն տա այլ կլոնների և նորմալ բջիջների նկատմամբ տվյալ միկրոմիջավայրում[104]։ Այսպիսով, քաղցկեղածնության պրոցեսը ֆորմալ կերպով Դարվինյան էվոլյվուցիա է իրենից ներկայացնում, որը հայտնի է որպես սոմատիկ կլոնային էվոլյուցիա[59]։ Հետագայում քաղցկեղածնության Դարվիանյան մեխանիզմների լույսի ներքո վարակծ է առաջարկվել, քաղցկեղի տարբեր ձևերը կարող են դասակարգվել որպես պուբերտատային և գերոնտոլոգիական։ Անթրոպոլոգիական հետազոտությունները պրոցեսն այժմ դիտարկում են քաղցկեղը, որպես բնական էվոլյուցիոն պրոցես, որի ընթացքում բնական ընտրությունը ոչնչացնում է միջավայրին չհարմարված ֆենոտիպերը, մինչդեռ մյուսները ողջ են մնում։
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ Tomasetti C, Li L, Vogelstein B (2017 թ․ մարտի 23). «Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention». Science. 355 (6331): 1330–1334. Bibcode:2017Sci...355.1330T. doi:10.1126/science.aaf9011. PMC 5852673. PMID 28336671.
- ↑ 2,0 2,1 Wood LD, Parsons DW, Jones S, Lin J, Sjöblom T, Leary RJ, և այլք: (2007 թ․ նոյեմբեր). «The genomic landscapes of human breast and colorectal cancers». Science. 318 (5853): 1108–13. Bibcode:2007Sci...318.1108W. CiteSeerX 10.1.1.218.5477. doi:10.1126/science.1145720. PMID 17932254.
- ↑ 3,0 3,1 Knudson AG (2001 թ․ նոյեմբեր). «Two genetic hits (more or less) to cancer». Nature Reviews. Cancer. 1 (2): 157–62. doi:10.1038/35101031. PMID 11905807.
- ↑ 4,0 4,1 4,2 Belikov, Aleksey V. (2017 թ․ սեպտեմբերի 22). «The number of key carcinogenic events can be predicted from cancer incidence». Scientific Reports. 7 (1): 12170. Bibcode:2017NatSR...712170B. doi:10.1038/s41598-017-12448-7. PMC 5610194. PMID 28939880.
- ↑ Fearon ER, Vogelstein B (1990 թ․ հունիս). «A genetic model for colorectal tumorigenesis». Cell. 61 (5): 759–67. doi:10.1016/0092-8674(90)90186-I. PMID 2188735.
- ↑ Croce CM (2008 թ․ հունվար). «Oncogenes and cancer». The New England Journal of Medicine. 358 (5): 502–11. doi:10.1056/NEJMra072367. PMID 18234754.
- ↑ Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, Bartel DP, Linsley PS, Johnson JM (2005 թ․ փետրվար). «Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs». Nature. 433 (7027): 769–73. Bibcode:2005Natur.433..769L. doi:10.1038/nature03315. PMID 15685193.
- ↑ 8,0 8,1 Balaguer F, Link A, Lozano JJ, Cuatrecasas M, Nagasaka T, Boland CR, Goel A (2010 թ․ օգոստոս). «Epigenetic silencing of miR-137 is an early event in colorectal carcinogenesis». Cancer Research. 70 (16): 6609–18. doi:10.1158/0008-5472.CAN-10-0622. PMC 2922409. PMID 20682795.
- ↑ Kastan MB (2008 թ․ ապրիլ). «DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture». Molecular Cancer Research. 6 (4): 517–24. doi:10.1158/1541-7786.MCR-08-0020. PMID 18403632.
- ↑ 10,0 10,1 Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (2011 թ․ նոյեմբեր). «A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants». Food and Chemical Toxicology. 49 (11): 2921–33. doi:10.1016/j.fct.2011.07.019. PMID 21802474.
- ↑ Kanavy HE, Gerstenblith MR (2011 թ․ դեկտեմբեր). «Ultraviolet radiation and melanoma». Seminars in Cutaneous Medicine and Surgery. 30 (4): 222–8. doi:10.1016/j.sder.2011.08.003. PMID 22123420.
- ↑ Handa O, Naito Y, Yoshikawa T (2011). «Redox biology and gastric carcinogenesis: the role of Helicobacter pylori». Redox Report. 16 (1): 1–7. doi:10.1179/174329211X12968219310756. PMID 21605492.
- ↑ Smela ME, Hamm ML, Henderson PT, Harris CM, Harris TM, Essigmann JM (2002 թ․ մայիս). «The aflatoxin B(1) formamidopyrimidine adduct plays a major role in causing the types of mutations observed in human hepatocellular carcinoma». Proceedings of the National Academy of Sciences of the United States of America. 99 (10): 6655–60. doi:10.1073/pnas.102167699. PMC 124458. PMID 12011430.
- ↑ Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (2012 թ․ հունվար). «Early-stage formation of an epigenetic field defect in a mouse colitis model, and non-essential roles of T- and B-cells in DNA methylation induction». Oncogene. 31 (3): 342–51. doi:10.1038/onc.2011.241. PMID 21685942.
- ↑ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (2011 թ․ օգոստոս). «Carcinogenicity of deoxycholate, a secondary bile acid». Archives of Toxicology. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ↑ Malkin D (2011 թ․ ապրիլ). «Li-fraumeni syndrome». Genes & Cancer. 2 (4): 475–84. doi:10.1177/1947601911413466. PMC 3135649. PMID 21779515.
- ↑ Fearon ER (1997 թ․ նոյեմբեր). «Human cancer syndromes: clues to the origin and nature of cancer». Science. 278 (5340): 1043–50. Bibcode:1997Sci...278.1043F. doi:10.1126/science.278.5340.1043. PMID 9353177.
- ↑ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (2000 թ․ հուլիս). «Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland». The New England Journal of Medicine. 343 (2): 78–85. doi:10.1056/NEJM200007133430201. PMID 10891514.
- ↑ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (2005 թ․ հունիս). «O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions». Gut. 54 (6): 797–802. doi:10.1136/gut.2004.059535. PMC 1774551. PMID 15888787.
- ↑ 20,0 20,1 Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (1997 թ․ ապրիլ). «Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2». Proceedings of the National Academy of Sciences of the United States of America. 94 (7): 3122–7. Bibcode:1997PNAS...94.3122N. doi:10.1073/pnas.94.7.3122. PMC 20332. PMID 9096356.
- ↑ 21,0 21,1 Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (2006 թ․ դեկտեմբեր). «Differing patterns of genetic instability in mice deficient in the mismatch repair genes Pms2, Mlh1, Msh2, Msh3 and Msh6». Carcinogenesis. 27 (12): 2402–8. doi:10.1093/carcin/bgl079. PMC 2612936. PMID 16728433.
- ↑ German J (1969 թ․ մարտ). «Bloom's syndrome. I. Genetical and clinical observations in the first twenty-seven patients». American Journal of Human Genetics. 21 (2): 196–227. PMC 1706430. PMID 5770175.
- ↑ 23,0 23,1 Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (2002 թ․ մարտ). «Disruption of Brca2 increases the spontaneous mutation rate in vivo: synergism with ionizing radiation». EMBO Reports. 3 (3): 255–60. doi:10.1093/embo-reports/kvf037. PMC 1084010. PMID 11850397.
- ↑ O'Hagan HM, Mohammad HP, Baylin SB (2008 թ․ օգոստոս). Lee JT (ed.). «Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island». PLoS Genetics. 4 (8): e1000155. doi:10.1371/journal.pgen.1000155. PMC 2491723. PMID 18704159.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (2007 թ․ հուլիս). «DNA damage, homology-directed repair, and DNA methylation». PLoS Genetics. 3 (7): e110. doi:10.1371/journal.pgen.0030110. PMC 1913100. PMID 17616978.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Villeneuve PJ, Mao Y (1994 թ․ նոյեմբեր). «Lifetime probability of developing lung cancer, by smoking status, Canada». Canadian Journal of Public Health. 85 (6): 385–8. PMID 7895211.
- ↑ Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, և այլք: (2012 թ․ մարտ). «Intratumor heterogeneity and branched evolution revealed by multiregion sequencing». The New England Journal of Medicine. 366 (10): 883–92. doi:10.1056/NEJMoa1113205. PMC 4878653. PMID 22397650.
- ↑ 28,0 28,1 López-Lázaro M (2015 թ․ օգոստոս). «Stem cell division theory of cancer». Cell Cycle. 14 (16): 2547–8. doi:10.1080/15384101.2015.1062330. PMC 5242319. PMID 26090957.
- ↑ 29,0 29,1 29,2 López-Lázaro M (2015 թ․ մայիս). «The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis». Oncoscience. 2 (5): 467–75. doi:10.18632/oncoscience.159. PMC 4468332. PMID 26097879.
- ↑ Tomasetti C, Vogelstein B (2015 թ․ հունվար). «Cancer etiology. Variation in cancer risk among tissues can be explained by the number of stem cell divisions». Science. 347 (6217): 78–81. doi:10.1126/science.1260825. PMC 4446723. PMID 25554788.
- ↑ Slaughter DP, Southwick HW, Smejkal W (1953 թ․ սեպտեմբեր). «Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin». Cancer. 6 (5): 963–8. doi:10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q. PMID 13094644.
- ↑ Bernstein C, Bernstein H, Payne CM, Dvorak K, Garewal H (2008 թ․ փետրվար). «Field defects in progression to gastrointestinal tract cancers». review. Cancer Letters. 260 (1–2): 1–10. doi:10.1016/j.canlet.2007.11.027. PMC 2744582. PMID 18164807.
- ↑ Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (2010). «Deficient Pms2, ERCC1, Ku86, CcOI in field defects during progression to colon cancer». Journal of Visualized Experiments: JoVE (41): 1931. doi:10.3791/1931. PMC 3149991. PMID 20689513.
- ↑ Rubin H (2011 թ․ մարտ). «Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture». BioEssays. 33 (3): 224–31. doi:10.1002/bies.201000067. PMID 21254148.
- ↑ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (2000 թ․ փետրվար). «Genetic reconstruction of individual colorectal tumor histories». Proceedings of the National Academy of Sciences of the United States of America. 97 (3): 1236–41. Bibcode:2000PNAS...97.1236T. doi:10.1073/pnas.97.3.1236. PMC 15581. PMID 10655514.
- ↑ 36,0 36,1 36,2 Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (2013 թ․ մարտ). «Cancer genome landscapes». review. Science. 339 (6127): 1546–58. Bibcode:2013Sci...339.1546V. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
- ↑ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (2005 թ․ սեպտեմբեր). «MGMT promoter methylation and field defect in sporadic colorectal cancer». Journal of the National Cancer Institute. 97 (18): 1330–8. doi:10.1093/jnci/dji275. PMID 16174854.
- ↑ 38,0 38,1 Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (2011 թ․ հոկտեմբեր). «Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence». Langenbeck's Archives of Surgery. 396 (7): 1017–26. doi:10.1007/s00423-011-0812-9. PMID 21706233.
- ↑ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, և այլք: (2010 թ․ նոյեմբեր). «Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers». Gut. 59 (11): 1516–26. doi:10.1136/gut.2009.194787. PMID 20947886.
- ↑ 40,0 40,1 40,2 40,3 Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, Nfonsam V, Krouse RS, Bernstein H, Payne CM, Stern S, Oatman N, Banerjee B, Bernstein C (2012 թ․ ապրիլ). «Deficient expression of DNA repair enzymes in early progression to sporadic colon cancer». Genome Integrity. 3 (1): 3. doi:10.1186/2041-9414-3-3. PMC 3351028. PMID 22494821.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (2011 թ․ փետրվար). «Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa». Oral Oncology. 47 (2): 104–7. doi:10.1016/j.oraloncology.2010.11.006. PMID 21147548.
- ↑ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (2009 թ․ հոկտեմբեր). «Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma». Otolaryngology–Head and Neck Surgery. 141 (4): 484–90. doi:10.1016/j.otohns.2009.07.007. PMID 19786217.
- ↑ Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). «Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene». American Journal of Otolaryngology. 32 (6): 528–36. doi:10.1016/j.amjoto.2010.11.005. PMID 21353335.
- ↑ Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (2009 թ․ նոյեմբեր). «Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions». Human Pathology. 40 (11): 1534–42. doi:10.1016/j.humpath.2009.01.029. PMID 19695681.
- ↑ Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). «Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley» (PDF). Asian Pacific Journal of Cancer Prevention. 13 (8): 4177–81. doi:10.7314/APJCP.2012.13.8.4177. PMID 23098428.
- ↑ Agarwal A, Polineni R, Hussein Z, Vigoda I, Bhagat TD, Bhattacharyya S, Maitra A, Verma A (2012). «Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma». International Journal of Clinical and Experimental Pathology. 5 (5): 382–96. PMC 3396065. PMID 22808291. Review.
- ↑ Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T, Larsen S, Osnes M (1996 թ․ սեպտեմբեր). «Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years». Gut. 39 (3): 449–56. doi:10.1136/gut.39.3.449. PMC 1383355. PMID 8949653.
- ↑ Schmitt MW, Prindle MJ, Loeb LA (2012 թ․ սեպտեմբեր). «Implications of genetic heterogeneity in cancer». Annals of the New York Academy of Sciences. 1267 (1): 110–6. Bibcode:2012NYASA1267..110S. doi:10.1111/j.1749-6632.2012.06590.x. PMC 3674777. PMID 22954224.
- ↑ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, և այլք: (2001 թ․ փետրվար). «Initial sequencing and analysis of the human genome». Nature. 409 (6822): 860–921. Bibcode:2001Natur.409..860L. doi:10.1038/35057062. PMID 11237011.
- ↑ Yost SE, Smith EN, Schwab RB, Bao L, Jung H, Wang X, Voest E, Pierce JP, Messer K, Parker BA, Harismendy O, Frazer KA (2012 թ․ օգոստոս). «Identification of high-confidence somatic mutations in whole genome sequence of formalin-fixed breast cancer specimens». Nucleic Acids Research. 40 (14): e107. doi:10.1093/nar/gks299. PMC 3413110. PMID 22492626.
- ↑ Berger MF, Hodis E, Heffernan TP, Deribe YL, Lawrence MS, Protopopov A, և այլք: (2012 թ․ մայիս). «Melanoma genome sequencing reveals frequent PREX2 mutations». Nature. 485 (7399): 502–6. Bibcode:2012Natur.485..502B. doi:10.1038/nature11071. PMC 3367798. PMID 22622578.
- ↑ Rasnick D, Duesberg PH (1999 թ․ հունիս). «How aneuploidy affects metabolic control and causes cancer». The Biochemical Journal. 340 (3): 621–30. doi:10.1042/0264-6021:3400621. PMC 1220292. PMID 10359645.
- ↑ 53,0 53,1 53,2 López-Lázaro M (2010 թ․ մարտ). «A new view of carcinogenesis and an alternative approach to cancer therapy». Molecular Medicine. 16 (3–4): 144–53. doi:10.2119/molmed.2009.00162. PMC 2802554. PMID 20062820.
- ↑ Soto AM, Sonnenschein C (2004 թ․ հոկտեմբեր). «The somatic mutation theory of cancer: growing problems with the paradigm?». BioEssays. 26 (10): 1097–107. doi:10.1002/bies.20087. PMID 15382143.
- ↑ Davies PC, Lineweaver CH (2011 թ․ փետրվար). «Cancer tumors as Metazoa 1.0: tapping genes of ancient ancestors». Physical Biology. 8 (1): 015001. Bibcode:2011PhBio...8a5001D. doi:10.1088/1478-3975/8/1/015001. PMC 3148211. PMID 21301065.
- ↑ Dean, Tim. "Cancer resembles life 1 billion years ago, say astrobiologists", Australian Life Scientist, 8 February 2011. Retrieved 15 February 2011.
- ↑ Sterrer, W (2016 թ․ օգոստոս). «Cancer - Mutational Resurrection of Prokaryote Endofossils» (PDF). Cancer Hypotheses. 1 (1): 1–15. Արխիվացված է օրիգինալից (PDF) 2022 թ․ մարտի 3-ին. Վերցված է 2020 թ․ հունվարի 30-ին.
- ↑ 58,0 58,1 Nowell PC (1976 թ․ հոկտեմբեր). «The clonal evolution of tumor cell populations». Science. 194 (4260): 23–8. Bibcode:1976Sci...194...23N. doi:10.1126/science.959840. PMID 959840.
- ↑ 59,0 59,1 Merlo LM, Pepper JW, Reid BJ, Maley CC (2006 թ․ դեկտեմբեր). «Cancer as an evolutionary and ecological process». Nature Reviews. Cancer. 6 (12): 924–35. doi:10.1038/nrc2013. PMID 17109012.
- ↑ Hanahan D, Weinberg RA (2000 թ․ հունվար). «The hallmarks of cancer». Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9. PMID 10647931.
- ↑ Cho RW, Clarke MF (2008 թ․ փետրվար). «Recent advances in cancer stem cells». Current Opinion in Genetics & Development. 18 (1): 48–53. doi:10.1016/j.gde.2008.01.017. PMID 18356041.
- ↑ You H, Lei P, Andreadis ST (2013 թ․ դեկտեմբեր). «JNK is a novel regulator of intercellular adhesion». Tissue Barriers. 1 (5): e26845. doi:10.4161/tisb.26845. PMC 3942331. PMID 24868495.
- ↑ Taniguchi K, Wu LW, Grivennikov SI, de Jong PR, Lian I, Yu FX, Wang K, Ho SB, Boland BS, Chang JT, Sandborn WJ, Hardiman G, Raz E, Maehara Y, Yoshimura A, Zucman-Rossi J, Guan KL, Karin M (2015 թ․ մարտ). «A gp130-Src-YAP module links inflammation to epithelial regeneration». Nature. 519 (7541): 57–62. Bibcode:2015Natur.519...57T. doi:10.1038/nature14228. PMC 4447318. PMID 25731159.
- ↑ Busillo JM, Azzam KM, Cidlowski JA (2011 թ․ նոյեմբեր). «Glucocorticoids sensitize the innate immune system through regulation of the NLRP3 inflammasome». The Journal of Biological Chemistry. 286 (44): 38703–13. doi:10.1074/jbc.M111.275370. PMC 3207479. PMID 21940629.
- ↑ Wang Y, Bugatti M, Ulland TK, Vermi W, Gilfillan S, Colonna M (2016 թ․ մարտ). «Nonredundant roles of keratinocyte-derived IL-34 and neutrophil-derived CSF1 in Langerhans cell renewal in the steady state and during inflammation». European Journal of Immunology. 46 (3): 552–9. doi:10.1002/eji.201545917. PMC 5658206. PMID 26634935.
- ↑ Siqueira Mietto B, Kroner A, Girolami EI, Santos-Nogueira E, Zhang J, David S (2015 թ․ դեկտեմբեր). «Role of IL-10 in Resolution of Inflammation and Functional Recovery after Peripheral Nerve Injury». The Journal of Neuroscience. 35 (50): 16431–42. doi:10.1523/JNEUROSCI.2119-15.2015. PMC 6605511. PMID 26674868.
- ↑ Seifert AW, Maden M (2014). «New insights into vertebrate skin regeneration». International Review of Cell and Molecular Biology. Vol. 310. էջեր 129–69. doi:10.1016/B978-0-12-800180-6.00004-9. ISBN 978-0-12-800180-6. PMID 24725426.
- ↑ Kwon MJ, Shin HY, Cui Y, Kim H, Thi AH, Choi JY, Kim EY, Hwang DH, Kim BG (2015 թ․ դեկտեմբեր). «CCL2 Mediates Neuron-Macrophage Interactions to Drive Proregenerative Macrophage Activation Following Preconditioning Injury». The Journal of Neuroscience. 35 (48): 15934–47. doi:10.1523/JNEUROSCI.1924-15.2015. PMID 26631474.
- ↑ Hajishengallis G, Chavakis T (2013 թ․ հունվար). «Endogenous modulators of inflammatory cell recruitment». Trends in Immunology. 34 (1): 1–6. doi:10.1016/j.it.2012.08.003. PMC 3703146. PMID 22951309.
- ↑ Nelson AM, Katseff AS, Ratliff TS, Garza LA (2016 թ․ փետրվար). «Interleukin 6 and STAT3 regulate p63 isoform expression in keratinocytes during regeneration». Experimental Dermatology. 25 (2): 155–7. doi:10.1111/exd.12896. PMC 4724264. PMID 26566817.
- ↑ Vidal PM, Lemmens E, Dooley D, Hendrix S (2013 թ․ փետրվար). «The role of "anti-inflammatory" cytokines in axon regeneration». Cytokine & Growth Factor Reviews. 24 (1): 1–12. doi:10.1016/j.cytogfr.2012.08.008. PMID 22985997.
- ↑ Hsueh YY, Chang YJ, Huang CW, Handayani F, Chiang YL, Fan SC, Ho CJ, Kuo YM, Yang SH, Chen YL, Lin SC, Huang CC, Wu CC (2015 թ․ հոկտեմբեր). «Synergy of endothelial and neural progenitor cells from adipose-derived stem cells to preserve neurovascular structures in rat hypoxic-ischemic brain injury». Scientific Reports. 5: 14985. Bibcode:2015NatSR...514985H. doi:10.1038/srep14985. PMC 4597209. PMID 26447335.
- ↑ Yaniv M (2014 թ․ սեպտեմբեր). «Chromatin remodeling: from transcription to cancer». Cancer Genetics. 207 (9): 352–7. doi:10.1016/j.cancergen.2014.03.006. PMID 24825771.
- ↑ Zhang X, He N, Gu D, Wickliffe J, Salazar J, Boldogh I, Xie J (2015 թ․ հոկտեմբեր). «Genetic Evidence for XPC-KRAS Interactions During Lung Cancer Development». Journal of Genetics and Genomics = Yi Chuan Xue Bao. 42 (10): 589–96. doi:10.1016/j.jgg.2015.09.006. PMC 4643398. PMID 26554912.
- ↑ Dubois-Pot-Schneider H, Fekir K, Coulouarn C, Glaise D, Aninat C, Jarnouen K, Le Guével R, Kubo T, Ishida S, Morel F, Corlu A (2014 թ․ դեկտեմբեր). «Inflammatory cytokines promote the retrodifferentiation of tumor-derived hepatocyte-like cells to progenitor cells». Hepatology. 60 (6): 2077–90. doi:10.1002/hep.27353. PMID 25098666.
- ↑ Finkin S, Yuan D, Stein I, Taniguchi K, Weber A, Unger K, և այլք: (2015 թ․ դեկտեմբեր). «Ectopic lymphoid structures function as microniches for tumor progenitor cells in hepatocellular carcinoma». Nature Immunology. 16 (12): 1235–44. doi:10.1038/ni.3290. PMC 4653079. PMID 26502405.
- ↑ 77,0 77,1 Vlahopoulos SA, Cen O, Hengen N, Agan J, Moschovi M, Critselis E, Adamaki M, Bacopoulou F, Copland JA, Boldogh I, Karin M, Chrousos GP (2015 թ․ օգոստոս). «Dynamic aberrant NF-κB spurs tumorigenesis: a new model encompassing the microenvironment». Cytokine & Growth Factor Reviews. 26 (4): 389–403. doi:10.1016/j.cytogfr.2015.06.001. PMC 4526340. PMID 26119834.
- ↑ Grivennikov SI, Karin M (2010 թ․ փետրվար). «Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer». Cytokine & Growth Factor Reviews. 21 (1): 11–9. doi:10.1016/j.cytogfr.2009.11.005. PMC 2834864. PMID 20018552.
- ↑ Rieger S, Zhao H, Martin P, Abe K, Lisse TS (2015 թ․ հունվար). «The role of nuclear hormone receptors in cutaneous wound repair». Cell Biochemistry and Function. 33 (1): 1–13. doi:10.1002/cbf.3086. PMC 4357276. PMID 25529612.
- ↑ Lu X, Yarbrough WG (2015 թ․ փետրվար). «Negative regulation of RelA phosphorylation: emerging players and their roles in cancer». Cytokine & Growth Factor Reviews. 26 (1): 7–13. doi:10.1016/j.cytogfr.2014.09.003. PMID 25438737.
- ↑ Sionov RV, Fridlender ZG, Granot Z (2015 թ․ դեկտեմբեր). «The Multifaceted Roles Neutrophils Play in the Tumor Microenvironment». Cancer Microenvironment. 8 (3): 125–58. doi:10.1007/s12307-014-0147-5. PMC 4714999. PMID 24895166.
- ↑ Venturi, Sebastiano (2011). «Evolutionary Significance of Iodine». Current Chemical Biology. 5 (3): 155–162. doi:10.2174/187231311796765012. ISSN 1872-3136.
- ↑ Venturi S (2014). «Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective». Human Evolution. 29 (1–3): 185–205. ISSN 0393-9375.
- ↑ Walsh CJ, Luer CA, Bodine AB, Smith CA, Cox HL, Noyes DR, Maura G (2006 թ․ դեկտեմբեր). «Elasmobranch immune cells as a source of novel tumor cell inhibitors: Implications for public health». Integrative and Comparative Biology. 46 (6): 1072–1081. doi:10.1093/icb/icl041. PMC 2664222. PMID 19343108.
- ↑ Vogelstein B, Kinzler KW (2004 թ․ օգոստոս). «Cancer genes and the pathways they control». Nature Medicine. 10 (8): 789–99. doi:10.1038/nm1087. PMID 15286780.
- ↑ Brand KA, Hermfisse U (1997 թ․ ապրիլ). «Aerobic glycolysis by proliferating cells: a protective strategy against reactive oxygen species». FASEB Journal. 11 (5): 388–95. doi:10.1096/fasebj.11.5.9141507. PMID 9141507.
- ↑ Bos JL (1989 թ․ սեպտեմբեր). «ras oncogenes in human cancer: a review». Cancer Research. 49 (17): 4682–9. PMID 2547513.
- ↑ Chang EH, Furth ME, Scolnick EM, Lowy DR (1982 թ․ հունիս). «Tumorigenic transformation of mammalian cells induced by a normal human gene homologous to the oncogene of Harvey murine sarcoma virus». Nature. 297 (5866): 479–83. Bibcode:1982Natur.297..479C. doi:10.1038/297479a0. PMID 6283358.
- ↑ Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V (2008 թ․ ապրիլ). «The role of ATF-2 in oncogenesis». BioEssays. 30 (4): 314–27. doi:10.1002/bies.20734. PMID 18348191.
- ↑ Matoba S, Kang JG, Patino WD, Wragg A, Boehm M, Gavrilova O, Hurley PJ, Bunz F, Hwang PM (2006 թ․ հունիս). «p53 regulates mitochondrial respiration». Science. 312 (5780): 1650–3. Bibcode:2006Sci...312.1650M. doi:10.1126/science.1126863. PMID 16728594.
- ↑ Knudson AG (1971 թ․ ապրիլ). «Mutation and cancer: statistical study of retinoblastoma». Proceedings of the National Academy of Sciences of the United States of America. 68 (4): 820–3. Bibcode:1971PNAS...68..820K. doi:10.1073/pnas.68.4.820. PMC 389051. PMID 5279523.
- ↑ Fodde R, Smits R (2002 թ․ հոկտեմբեր). «Cancer biology. A matter of dosage». Science. 298 (5594): 761–3. doi:10.1126/science.1077707. PMID 12399571.
- ↑ Stephens PJ, Greenman CD, Fu B, Yang F, Bignell GR, Mudie LJ, և այլք: (2011 թ․ հունվար). «Massive genomic rearrangement acquired in a single catastrophic event during cancer development». Cell. 144 (1): 27–40. doi:10.1016/j.cell.2010.11.055. PMC 3065307. PMID 21215367.
{{cite journal}}: Unknown parameter|lay-url=ignored (օգնություն); Unknown parameter|laysource=ignored (օգնություն) - ↑ Carrillo-Infante C, Abbadessa G, Bagella L, Giordano A (2007 թ․ հունիս). «Viral infections as a cause of cancer (review)». International Journal of Oncology. 30 (6): 1521–8. doi:10.3892/ijo.30.6.1521. PMID 17487374.
- ↑ Safdar A (2011 թ․ հունիսի 1). Management of Infections in Cancer Patients. Springer. էջեր 478–. ISBN 978-1-60761-643-6. Վերցված է 2011 թ․ օգոստոսի 17-ին.
- ↑ Samaras V, Rafailidis PI, Mourtzoukou EG, Peppas G, Falagas ME (2010 թ․ հունիս). «Chronic bacterial and parasitic infections and cancer: a review». Journal of Infection in Developing Countries. 4 (5): 267–81. doi:10.3855/jidc.819. PMID 20539059.
- ↑ Daniel FI, Cherubini K, Yurgel LS, de Figueiredo MA, Salum FG (2011 թ․ փետրվար). «The role of epigenetic transcription repression and DNA methyltransferases in cancer». Cancer. 117 (4): 677–87. doi:10.1002/cncr.25482. PMID 20945317. Review.
- ↑ Kanwal R, Gupta S (2012 թ․ ապրիլ). «Epigenetic modifications in cancer». Clinical Genetics. 81 (4): 303–11. doi:10.1111/j.1399-0004.2011.01809.x. PMC 3590802. PMID 22082348.
- ↑ Pattani KM, Soudry E, Glazer CA, Ochs MF, Wang H, Schussel J, Sun W, Hennessey P, Mydlarz W, Loyo M, Demokan S, Smith IM, Califano JA (2012). Tao Q (ed.). «MAGEB2 is activated by promoter demethylation in head and neck squamous cell carcinoma». PLOS ONE. 7 (9): e45534. Bibcode:2012PLoSO...745534P. doi:10.1371/journal.pone.0045534. PMC 3454438. PMID 23029077.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Sampath D, Liu C, Vasan K, Sulda M, Puduvalli VK, Wierda WG, Keating MJ (2012 թ․ փետրվար). «Histone deacetylases mediate the silencing of miR-15a, miR-16, and miR-29b in chronic lymphocytic leukemia». Blood. 119 (5): 1162–72. doi:10.1182/blood-2011-05-351510. PMC 3277352. PMID 22096249.
- ↑ Hitchler MJ, Oberley LW, Domann FE (2008 թ․ դեկտեմբեր). «Epigenetic silencing of SOD2 by histone modifications in human breast cancer cells». Free Radical Biology & Medicine. 45 (11): 1573–80. doi:10.1016/j.freeradbiomed.2008.09.005. PMC 2633123. PMID 18845242.
- ↑ Baldassarre G, Battista S, Belletti B, Thakur S, Pentimalli F, Trapasso F, Fedele M, Pierantoni G, Croce CM, Fusco A (2003 թ․ ապրիլ). «Negative regulation of BRCA1 gene expression by HMGA1 proteins accounts for the reduced BRCA1 protein levels in sporadic breast carcinoma». Molecular and Cellular Biology. 23 (7): 2225–38. doi:10.1128/MCB.23.7.2225-2238.2003. PMC 150734. PMID 12640109.
- ↑ Dalerba P, Cho RW, Clarke MF (2007). «Cancer stem cells: models and concepts». Annual Review of Medicine. 58: 267–84. doi:10.1146/annurev.med.58.062105.204854. PMID 17002552.
- ↑ Zhang W, Hanks AN, Boucher K, Florell SR, Allen SM, Alexander A, Brash DE, Grossman D (2005 թ․ հունվար). «UVB-induced apoptosis drives clonal expansion during skin tumor development». Carcinogenesis. 26 (1): 249–57. doi:10.1093/carcin/bgh300. PMC 2292404. PMID 15498793.
Լրացուցիչ նյութեր
[խմբագրել | խմբագրել կոդը]- Tokar EJ, Benbrahim-Tallaa L, Waalkes MP (2011). «Chepter 14. Metal Ions in Human Cancer Development». In Astrid Sigel, Helmut Sigel and Roland K. O. Sigel (ed.). Metal ions in toxicology: effects, interactions, interdependencies. Metal Ions in Life Sciences. Vol. 8. RSC Publishing. էջեր 375–401. doi:10.1039/9781849732116-00375. ISBN 978-1-84973-091-4.
- Dixon K, Kopras E (2004 թ․ դեկտեմբեր). «Genetic alterations and DNA repair in human carcinogenesis». Seminars in Cancer Biology. 14 (6): 441–8. doi:10.1016/j.semcancer.2004.06.007. PMID 15489137.
- Kleinsmith LJ (2006). Principles of cancer biology. San Francisco: Pearson Benjamin Cummings. ISBN 978-0-8053-4003-7.
- Sarasin A (2003 թ․ նոյեմբեր). «An overview of the mechanisms of mutagenesis and carcinogenesis». Mutation Research. 544 (2–3): 99–106. doi:10.1016/j.mrrev.2003.06.024. PMID 14644312.
- Schottenfeld D, Beebe-Dimmer JL (2005). «Advances in cancer epidemiology: understanding causal mechanisms and the evidence for implementing interventions». Annual Review of Public Health. 26: 37–60. doi:10.1146/annurev.publhealth.26.021304.144402. PMID 15760280.
- Tannock I, Hill R, Bristow R, Harrington L (2005). The basic science of oncology (4th ed.). New York: McGraw-Hill. ISBN 978-0-07-138774-3.
- Wicha MS, Liu S, Dontu G (2006 թ․ փետրվար). «Cancer stem cells: an old idea--a paradigm shift». Cancer Research. 66 (4): 1883–90, discussion 1895–6. doi:10.1158/0008-5472.CAN-05-3153. PMID 16488983.
