Ալկեններ

Ալկեն կամ օլեֆին օրգանական քիմիայում անվանում են այն չհագեցած ածխաջրածիններին, որոնցում պարունակվում է առնվազն մեկ ածխածին-ածխածին կրկնակի կապ[1]։ Պարզագույն ացիկլիկ ալկենները պարունակում են միայն մեկ կրկնակի կապ և ոչ մի այլ ֆունկցիոնալ խումբ։ Սրանք հայտնի են որպես մոնո-եններ. առավել հաճախ հենց ալկեն անվանումը վերաբերվում է մեկ կրկնակի կապով միացություններին։ Սրանք առաջացնում են CnH2n ընդհանուր բանաձևով ածխաջրածիների հոմոլոգիական շարք[2]՝ երկու ջրածնի ատոմով պակաս քան միևնույն քանակի ածխածնի ատոմներ պարունակող գծային ալկաններում։
Պարզագույն ալկենը էթիլենն է (C2H4), որը Մաքուր և կիրառական քիմիայի միջազգային միավորման (IUPAC) անվանակարգով անվանվում է էթեն. Նավթաքիմիական արդյունաբերությունում ալկենները հաճախ անվանվում են օլեֆիններ։ Կամրջակային ալկենների համար գործում է Բրեդտի կանոնը, համաձայն որի կրկնակի կապը չի կարող տեղակայված լինել համակարգի կամրջակային ածխածնի ատոմների վրա եթե օղակը բավականաչափ մեծ չէ (8 և ավել ածխածնի ատոմ)։ Արոմատիկ ածխաջրածինները հաճախ պատկերվում են որպես ցիկլիկ պոլի-եններ, սակայն նրանց կառուցվծքը և հատկությունները տարբեր են և նրանք չեն դիտարկվում որպես ալկեններ[2]։
Կառուցվածք[խմբագրել | խմբագրել կոդը]
Կապեր[խմբագրել | խմբագրել կոդը]

Ի տարբերություն եզակի կապի, որը բաղկացած է մեկ սիգմա կովալենտ կապից, ածխածին-ածխածին կրկնակի կապը բաղկացած է մեկ սիգմա և մեկ պի կապերից։ Այս կրկնակի կապը ավելի ուժեղ է մեկ կովալենտ կապից (611 կՋ/մոլ C=C –ի պարագայում և 347 կՋ/մոլ՝ C–C -ի)[1] և նաև ավելի կարճ է՝ միջինում 1.33 Անգստրեմ (133 պմ) երկարությամբ։
Կրկնակի կապի յուրաքանչյուր ածխածնի ատոմ առաջացնում է երեք կովալենտ սիգմա կապ երեք այլ ատոմների հետ՝ ի հաշիվ երեք sp2 հիբրիդացված օրբիտալների։ Չհիբրիդացված 2p ատոմական օրբիտալը, որը գտնվում է երեք հիբրիդացված օրբիտալների ստեղծած հարթությանն ուղղահայաց, վերածածկվում է հարևան ածխածնի համապատասխան օրբիտալի հետ՝ առաջացնելով պի կապ։ Այս կապը գտնվում է C–C առանցքից դուրս՝ առանցքը պարունակող հարթության երկու կողմերում.
Կրկնակի կապի շուրջ պտույտը արգելակված է, քանի որ այն ենթադրում է պի կապի ճեղքում, ինչը պահանջում է մեծ էներգիա (264 կՋ/մոլ էթիլենի համար)։ Որպես արդյունք, տեղակալված ալկենները կարող են գոյություն ունենալ երկու իզոմերներից որևէ մեկի տեսքով։ Այս իզոմերները անվանվում են ցիս- կամ տրանս- իզոմերներ, առավել բարդ կառուցվածքի ալկենների համար կարող է կիրառվել նաև '''E,Z''' անվանակարգումը։ Օր.՝ բութ-2-ենի երկու իզոմերներից (Z)-բութ-2-ենի (նույն ցիս-2-բութեն) երկու մեթիլ խմբերը գտնվում են կրկնակի կապի միևնույն կողմում, իսկ (E)-բութ-2-ենում (նույն տրանս-2-բութեն) մեթիլ խմբերը գտնվում են սիգմա կապի հակադիր կողմերում։ Այս երկու իզոմերները որոշակիորեն տարբերվում են իրենց ֆիզիկական և քիմիական հատկություններով։
Տեսք[խմբագրել | խմբագրել կոդը]
Ինչպես թույլ է տալիս հաշվարկել վալենտային էլեկտրոնային զույգերի վանողականության տեսությունը (VSEPR)՝ ալկենների մոլեկուլների երկրաչափությունը ենթադրում է կրկնակի կապի ածխածնի ատոմներից յուրաքանչյուրի սիգմա կապերի միջև 120° անկյուն։ Որոշ դեպքերում այս անկյունը կարող է տատանվել, մոլեկուլում առկա տարածական (ստերիկ) լարվածության պատճառով, որոը առաջանում է մոլեկուլում առկա (և կրկնակի կապին միացած) ֆունկցիոնալ խմբերի միջև ոչ-կովալենտային փոխազդեցությունների արդյունքում։ Օր.՝ պրոպիլենում C-C-C կապի անկյունը 123.9° է։
Դասակարգում[խմբագրել | խմբագրել կոդը]
Ալկենները կարող են դասակարգվել ըստ մի շարք չափանիշների.
Ըստ շղթայի կառուցվածքի՝
- Ացիկլիկ կամ գծային։ Սրանք այն ալկեններն են, որոնց ածխածնային շղթան գծային է։
- Ցիկլիկ։ Ինչպես անվանումն է հուշում, սրանք այն ալկեններն են, որոնց կրկնակի կապը պարունակվում է ածխածնային ցիկլի կառուցվածքում։ Ցիկլիկ ալկենների համար հոմոլոգիական շարքի ընդհանուր բանաձևը կլինի CnH2n-2։
Ըստ կրկնակի կապերի քանակի՝
- Մոնո-եններ կամ առավել հաճախ՝ ալկեններ։ սրանք այն մոլեկուլներն են, որոնք պարունակում են մեկ կրկնակի կապ, այս հոդվածում դիտարկվում են հիմնականում սրանց հատկությունները։
- Դիեններ։ սրանք այն մոլեկուլներն են, որոնք պարունակում են երկու կրկնակի կապ, ընդ որում սրանք իրենց հերթին բաժանվում են զուգորդված և մեկուսացված դիենների, որոնցից առաջինների հատկությունները էականորեն տարբերվում են սովորական ալկենների քիմիական հատկություններից, իսկ մեկուսացված դիենները հիմնականում ունեն նույն հատկությունները ինչ որ մոնո-ենները։

- Տրի- և պոլիեններ։ սրանք մոլեկուլի կազմում համապատասխանաբար երեք և ավել կրկնակի կապեր պարունակող միացություններն են։ Օր՝ սքվալենը իրենից ներկայացնում է պոլիեն, որի մոլեկուլում պարունակվում են վեց կրկնակի կապեր։ Այն հանդիսանում է բավական կարևոր ածխաջրածին, որը արտադրվում է բոլոր կենդանի օրգանիզմների կողմից որպես բիոքիմիական ինտերմեդիատ։
Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Ալկենների ֆիզիկական հատկությունները համեմատելի են համապատասխան ալկանների հատկությունների հետ։ Այս երկու խմբերի միջև հիմնական տարբերությունը այն է, որ ալկենների թթվայնության աստիճանը ավելի բարձր է քան համապատասխան ալկաններինը։ Ագրեգատային վիճակը պայմանավորված է մոլեկուլային զանգվածով։ Պարզագույն ալկենները՝ էթենը, պրոպենը և բութենը գազեր են։ C5-C16 գծային ալկենները հեղուկներ են իսկ ավելի բարձր ալկենները յուղանման պինդ միացություններ են։
Անվանակարգում[խմբագրել | խմբագրել կոդը]
IUPAC անվանում[խմբագրել | խմբագրել կոդը]
Ալկենների անվանումը IUPAC կանոնների համաձայն կազմելու համար անհրաժեշտ է համապատասխան ալկանի անվան –ան վերջածանցը փոխարինել –են վերջածանցով։ Օր.՝ CH3-CH3 –ը եթան ալկանն է, հետևաբար CH2=CH2 –ի անվանումը կլինի էթեն. Ավելի բարձր ալկեններում, որոնցում գոյություն ունի կրկնակի կապի դիրքային իզոմերիա, օգտագործվում են համարակալման և անվանակարգման հետևյալ կանոնները։
- Համարակալում ենք առավել երկար ածխածնային շղթան այն ուղղությամբ, որի պարագայում կրկնակի կապ պարունակող ածխածնի ատոմը կստանա առավել փոքր համար.
- Կրկնակի կապի դիրքը ցույց է տրվում առաջին (համարակալման ժամանակ փոր թիվ ստացած) ածխածնի ատոմի թվով.
- Ճյուղավորումները անվանվում են ինչպես համապատասխան ալկանների պարագայում.
- Համարակալվու են ածխածնի ատոմները, գտնվում և անվանվում են տեղակալիչները, տրվում է հիմնական շղթայի անվանումը, ապա կրկնակի կապի դիրքը։

Երկրաչափական իզոմերների նշանակում[խմբագրել | խմբագրել կոդը]
Հիմնական հոդված։ Ցիս-տրանս իզոմերիա Երկտեղակալված ալկենների պարագայում, երբ յուրաքանչյուր ածխածնի ատոմ ունի մեկական տեղակալիչ, շնորհիվ նրա, որ կրկնակի շուրջ պտույտն արգելակված է, ի հայտ է գալիս երկրաչափական իզոմերիա, և անհրաժեշտ է լինում անվանման մեջ նշել այս կամ այն իզոմերը։ Այդ նպատակով կարող է օգտագործվել ցիս- տրանս- նշանակումը։ Եթե երկու տեղակալիչները գտնվում են կապի միևնույն կողմում, ապա միացությունը նշանակվում է որպես ցիս-, իսկ այն դեպքում, երբ տեղակալիչները գտնվում են կապի տարբեր կողմերում՝ միացությունը նշանակվում է տրանս-։

E,Z- նշանակում[խմբագրել | խմբագրել կոդը]
Հիմնական հոդված։ '''E,Z''' անվանակարգում Այն դեպքերում, երբ ալկենը կրկնակի կապի մոտ ունի մեկից ավել տեղակալիչ (հատկապես 3 կամ 4 տեղակալիչների պարագայում), կրկնակի կապի երկրաչափության բնութագրումը ցիս- տրանս- նշանակման տրամաբանությամբ դժվարանում է, և դրա համար կիրառում են E և Z նշանակումը. Այս նշանները գալիս են գերմաներեն «"entgegen"» (հակադիր) և «"zusammen"» (միասին) բառերից։ Եթե առավել ավագ (որոշվում է Կանի-Ինգոլդի-Պրելոգի կանոնով) տեղակալիչները գտնվում են կրկնակի կապի նույն կողմում ապա ալկենը նշանակվում է Z, իսկ հակառակ դեպքում՝ E։ Այսպիսով E նշանակումը համարժեք է տրանս- նշանակմանը և Z –ը՝ ցիս-ին։ Անվան մեջ այս նշանակումները գրվում են փակագծերի մեջ, շեղատառ մեծատառերով, և տեղադրվում են կրկնակի կապի դիրքը ցույց տվող թվի առջև՝ թվից առանձնացվելով գծիկով (Օր.՝ (Z)-2-բութեն)։
Կրկնակի կապ պարունակող խմբեր[խմբագրել | խմբագրել կոդը]
IUPAC –ի կողմից ճանաչվում է կրկնակի կապ պարունակող ածխաջրածնային խմբերի երկու անվանումներ վինիլ- և ալլիլ- խմբերը[2]։

Ստացում[խմբագրել | խմբագրել կոդը]
Արտադրական մեթոդներ[խմբագրել | խմբագրել կոդը]
Ալկենները արտադրվում են ածխաջրածինների կրեկինգի միջոցով։ Որպես հումք հաճախ հանդիսանում է բնական գազի կոնդենսատի բաղադրիչները (հիմնականում էթանը և պրոպանը) ԱՄՆ-ում և միջին արևելքում և նավթը Եվրոպայում և Ասիայում։ Բարձր ջերմաստիճանների տակ և ցեոլիտների ներկայությամբ ալկանները տրոհվում են ավելի փոքր մոլեկուլների՝ առաջացնելով հիմնականում ալիֆատիկ ալկենների և ավելի ցածր մոլեկուլային կշռով ալկաններ։ Պրոցեսի ավարտին, խառնուրդը ենթարկվում է ֆրակցիոն թորման։ Այս պրոցեսը օգտագործվում է մինչև վեց ածխածնի ատոմ պարունակող ալկենների արտադրական ստացման համար[3]։
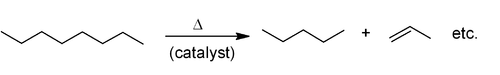
Այս մեթոդին նման է նաև կատալիտիկ դեհիդրոգենացումը, որի ժամանակ ալկանը բարձր ջերմաստիճաններում կորցնում է ջրածին՝ առաջացնլով համապատասխան ալկեն[1]։

Պոկման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
Ալկենների լաբորատոր ստացման հիմնական մեթոդներից է ալկիլ հալոգենիդների, ալկոհոլների և նման միացությունների էլիմինացման ռեակցիաները։ Առավել տարածված է β-պոկումը E2 կամ E1 մեխանիզմներով[4], սակայն α-պոկման ռեակցիաներ ևս օգտագործվում են։ Ալկենների ստացման համար E2 մեխանիզմը հանդիսանում է ավելի հուսալի և նախընտրելի β-էլիմինացման մեթոդ համեմատած E1 մեխանիզմի հետ, քանի որ ավելի լայն հնարավորություններ են ընձեռում ռեակցիայի սելեկտիվության վերահսկման համար։ Ալկիլ հալոգենիդներից ալկենների ստացման ռեակցիաները կոչվում են դեհիդրոհալոգենացման ռեակցիաներ։ Պոկման ռեակցիաների համար գործում է Զայցևի կանոնը, որի համաձայն, տարբեր պրոդուկտների առաջացման հավանականության պարագայում գերակշռում է առավել տեղակալված ալկենը (C=C կապին առավել քիչ ջրածնի ատոմ միացած իզոմերը)։ Որպես դեհիդրոհալոգենացնող ագենտ հաճախ օգտագործվում են ուժեղ հիմքեր, ինչպիսին են ալկալիական մետաղների ալկոհոլատների լուծույթները համապատասխան սպիրտներում։ E2 մեխանիզմի իրականացման պարագայում պրոտոնը պոկվում է հեռացող խմբի նկատմամբ անտի- դիրքից, բացառիկ դեպքերում, երբ առկա են կառուցվածքով պայմանավորված արգելքներ, պոկումը կարող է տեղի ունենալ սին- դիրքից, սակայն այս դեպքերում ռեակցիայի արագությունը նկատելիորեն նվազում է[5]։

Ալկոհոլներից ալկենների ստացումը կարող է իրականացվել երկու ճանապարհով, մի դեպքում սպիրտային խումբը փոխարկվում է ավելի լավ հեռացող խմբի, ինչպիսիք են տոզիլատ կամ տրիֆլատ խմբերը, ինչից հետո պոկումը կրկին իրականացվում է հիմքերի ազդեցությամբ, գերակշռելիորեն E2 մեխանիզմով, ինչը բավականին նման է դեհիդրոհալոգենացման ռեակցիաներին։ Մյուս եղանակը սպիրտներից ջրի պոկումն է, որը կոչվում է դեհիդրում, որի տիպիկ օրինակ է հանդիսանում խիտ ծծմբական թթվի ազդեցությամբ էթանոլի դեհիդրումը մինչև էթիլենի, այս եղանակով պոկումը իրականացվում է հիմնականում E1 մեխանիզմով, այսինքն սկզբում տեղի է ունենում հեռացող խմբի պոկում, ապա, առաջացող կարբկատիոնի կայունացում՝ հարևան դիրքից պրոտոնի պոկմամբ։
CH3CH2OH + H2SO4 → H2C=CH2 + H3O+ + HSO4−
Ակլոհոլները կարող են նաև փոխարկվել համապատասխան խմբերի, որոնք նպաստում են ավելի մեղմ պայմաններում պոկմանը, մասնավորապես քսանտենները ենթարկվում են Չուգաևի էլիմինացման որը հանդիսանում է սին- պոկման օրինակ և ընթանում է որպես ներմոլեկուլային պրոցես։ Նման եղանակ է նաև Գրիեկոյի էլիմինացիան։ Ալկոհոլների թերմիկ դեհիդրում կարող է իրականացվել դրանց գոլորշիները մինչև 400 oC տաքացված ալյումինի օքսիդի վրայով անցկացնելիս։

Ալկենների ստացման այլ տարբերակ է հանդիսանում 1,2-դիհալոգենիդների (վիցինալ դիհալոգենիդների) և ակտիվ մետաղների (Zn, Mg) կամ յոդիդ անիոնի փոխազդեցությունը որն այլ կերպ կոչվում է դիհալո-էլիմինացում։

Նշվածին նման ռեակցիա է հանդիսանում β-հալոեթերների ալկօքսի-հալո էլիմինացումը (Բուրդի օլեֆինների ստացում)։ Ալկեններ ստացվում են նաև համապատասխան էսթերների պիրոլիզից։
Ալկենները անուղղակի ճանապարհներով կարող են ստացվել ալկիլ ամիններից։ Ամինային խումբը չի հանդիսանում լավ հեռացող խումբ, այդ պատճառով ամինային խումբը նախ և առաջ ալկիլացվում է (Հոֆմանյան ճեղքման ժամանակ) կամ օքսիդացվում է մինչև ամինի օքսիդ (Կոուպի ռեակցիայի ժամանակ), ինչի հետևանքով հնարավոր է դառնում սահուն էլիմինացումը։ Կոուպի ռեակցիան ևս հանդիսանում է սին- էլիմինացման օրինակ, որը տեղի ունի 150 °C կամ ցածր ջերմաստիճաններում, օր[6].

Հոֆմայնան ճեղքումը ունի որոշ առանձնահատկություններ, որոնցից է այն, որ ճեղքումը ընթանում է Զայցևի կանոնին հակառակ, այսինքն այս դեպքում առավելապես ստացվում է ավելի քիչ ճյուղավորված ալկեն։ Ալկեններ ստացվում են նաև α-հալոսուլֆոններից՝ Ռամբերգ Բաքլունդի ռեակցիայի արդյունքում՝ եռանդամանի սուլֆոնային ցիկլիկ միջանկյալ միացության առաջացմամբ։
Ստացումը կարբոնիլային միացություններից[խմբագրել | խմբագրել կոդը]
Ալկենների ստացման այլ կարևոր եղանակ է կարբոնիլային միացության (ինչպիսիք են ալդեհիդները և կետոնները) համակցումը կարբանիոնի համարժեք խմբեր պարունակող միացությունների հետ, որի արդյունքում կրկնակի կապը առաջանում է երկու ֆրագմենտներց։ Այսպիսի ռեակցիաները երբեմն անվանվում են օլեֆինացման ռեակցիաներ։ Այս ռեակցիաներից առավել լավ հայտնին է Վիտտիգի ռեակցիան սակայն այլ նմանատիպ ռեակցիաներ ևս հայտնի են։
Վիտտիիգի ռեակցին իրենից ներկայացնում է ալդեհիդի կամ կետոնի փոխազդեցությունը Ph3P=CHR կառուցվածքով Վիտտիգի ռեագենտի (կամ ֆոսֆորանի) հետ, որը հանգեցնում է ալկենի և Ph3P=O-ի առաջացման։ Վիտտիգի ռեագենտը ինքնին հեշտությամբ ստացվում է տրիֆենիլֆոսֆինից և համապատասխան ալկիլ հալոգենիդից, ռեակցիան բավականաչափ ընդհանուր է, և մի շարք ֆունկցիոնալ խմբեր (օրինակ՝ էսթերները) կայուն են դրա նկատմամբ[7]։

Վիտտիգի ռեակցիային նման է Պետերսոնի օլեֆինացումը։ Այս դեպքում ֆոսֆորանների փոխարեն կիրառվում է ավելի դժվարամատչելի սիլիցիումային ռեագենտ, սակայն այն թույլ է տալիս կարգավորել E- կամ Z- վերջանյութերի առաջացումը։ E- սելեկտիվությամբ է ընթանում նաև Ջուլիայի օլեֆինացումը, որի դեպքում օգտագործվում է ֆենիլ սուլֆոնից գեներացված կարբանիոն։ Տակիի օլեֆինացման ժամանակ կիրառվում են օրգանոքրոմային միջանկյալ միացություններ, և այս մեթոդը ևս բերում է E- պրոդուկտների առաջացման։ Տեբբեյի ռեագենտի՝ տիտանօրգանական միացությունների կիրառումը օգտագործվում է հիմնականում մեթիլաժենային միացությունների ստացման ժամանակ, այս պարագայում փոխազդում են անգամ էսթերները և ամիդները։ Կարբոնիլային միացությունները կարող են ենթարկվել վերականգնողական համակցման իրենք իրենց հետ՝ առաջացնելով համապատասխան ալկեններ։ Սիմմետրիկ ալկենները ստացվում են մետաղական տիտանով վերականգնման պարագայում (ՄակՄյուրեյի ռեակցիա). Երկու տարբեր կետոնների համակցման համար կիրառվում են ավելի բարդ և անուղղակի մեթոդներ, ինչպիսին է Բարտոն-Կելլոգի ռեակցիան։
Ստացումը ալկեններից.[խմբագրել | խմբագրել կոդը]
Մետաթեզիսի և հիդրովինիլացման ռեակցիաներ
Հիմնական հոդված։ Օլեֆինների մետաթեզիս
Ալկենները կարող են ստացվել այլ ալկենների հետ փոխանակման ռեակցիաների արդյունքում, այս ռեակցիաները կոչվում են օլեֆինների մետաթեզիսի ռեակցիաներ։ Հաճախ, էթիլենի պոկումը նպաստում է փոխազդեցությունը մինչև վերջանյութի ստացում ընթանալոն։ Հաճախ ստացվում են տարբեր երկրաչափական իզոմերներ, սակայն ռեակցիան ընթանում է տարբեր ֆունկցիոնալ խմբերի ներկայությամբ։ Ռեակցիայի ժամանակ կիրառվում է ռութենիումային կոմպլեքս հանդիսացող կատալիզատորներ (Գրուբսի կատալիզատորներ)։ Այս մեթոդը հատկապես շատ օգտագործվում է նուրբ սինթեզների ժամանակ, քանի որ կատալիզատորները բավականին թանկարժեք են, որպես օրինակ բերված է մուսկոնի սինթեզը։

Ալկենների ստացման այլ կարևոր մեթոդ է անցումային մետաղներով կատալիզվող ալկենների միացումը կամ հիդրովինիլացումը այլ ալկենների[8]։ Ընդհանուր առմամբ այն ներառում է ջրածնի և ալկենիլ խմբի միացումը մյուս մոլեկուլի (ֆրագմենտի) կրկնակի կապին։ Հիդրովինիլացման ռեակցիան առաջին անգամ հայտնաբերվել է Ալդերսոնի, Ջենների և Լիդսեյի կողմից՝ կիրառելով ռոդիումի կամ ռութենիումի աղեր։ Ներկայումս ռեակցիայի ժամանակ կիրառվում են երկաթ, կոբալտ, նիկել կամ պալադիում պարունակող կատալիզատորներ։ Միացումը կարող է իրականացվել բարձր ռեգիո- և ստերեոսելեկտիվությամբ ինչի վրա կարող են անդրադառնալ մետաղային կենտրոնին միացած լիգանդները և սուբստրատը, հաճախ հակաիոնը ևս շատ մեծ դեր է խաղում[9][10][11]։
Քիմիական հատկություններ[խմբագրել | խմբագրել կոդը]
Ալկենները համեմատաբար կայուն միացություններ են, սակայն ավելի ռեակցիոնունակ են քան ալկանները, շնորհիվ մոլեկուլում ածխածին-ածխածին կրկնակի կապի առկայության։ Ալկենների ռեակցիաների մեծ մասը ենթադրում են կրկնակի կապի խզում՝ նոր եզակի կապերի առաջացմամբ։ Ալկենները հանդիսանում են նավթաքիմիայի հիմնական հումք, քանի որ դրանք կարող են մասնակցել բազմատեսակ քիմիական փոխարկումների՝ հանգեցնելով տարբեր վերջանյութերի։
Միացման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
Ալկենները մասնակցում են մի շարք միացման ռեակցիաների, որոնք ընթանում են կրկնակի կապի բացմամբ։ Ալկեններին միացման ռեակցիաների մեծ մասը ենթարկվում է էլեկտրոֆիլ միացման մեխանիզմին։ Որպես միացման ռեակցիաների օրինակներ են հանդիսանում հիդրոհալոգենացումը, հալոգենացումը, հալոհիդրինների առաջացումը, օքսիմերկուրացումը, հիդրոբորացումը, դիքլորոկարբենի միացումը, Սիմմոնս-Սմիտի ռեակցիան, կատալիտիկ հիդրումը, էպօքսիդացումը, ռադիկալային պոլիմերացումը և հիդրօքսիլացումը։

Հիդրում (հիդրոգենացում)[խմբագրել | խմբագրել կոդը]
Ալկենների հիդրման արդյունքում ստացվում են համապատասխան ալկանները։ Ռեակցիան տարվում է ճնշման տակ և 200 oC ջերմաստիճանում՝ մետաղական կատալիզատորի առկայությամբ։ Առավել տարածված արտադրական կատալիզատորներ են հանդիսանում պլատինի, պալադիումի կամ նիկելի հիմքի վրա ստացված կատալիզատորները։ Լաբորատոր պրակտիկայում հաճախ օգտագործվում է Ռենեյի նիկելը (նիկելի և ալյումինի համաձուլվածքը)։ Այս ռեակցիայի պարզագույն օրինակն է էթիլենի հիդրումը՝ էթանի առաջացմամբ։
CH2=CH2 + H2 → CH3-CH3
Հիդրատացում[խմբագրել | խմբագրել կոդը]
Հիդրատացում է կոչվում ջրի մոլեկուլի միացումը կրկնակի կապին, որի արդյունքում ստացվում են սպիրտներ։ Ռեակցիան կատալիզվում է ուժեղ թթուներով, ինչպիսին է ծծմբական թթուն։ Ռեակցիան ունի արտադրական կիրառություն, և օգտագործվում է էթիլենից էթանոլի ստացման համար։
CH2=CH2 + H2O → CH3-CH2OH
Ալկենները կարող են փոխարկվել սպիրտների նաև օքսիմերկուրացման-դեմերկուրացման ռեակցիայի կամ հիդրոբորացման-օքսիդացման ռեակցիայի արդյունքում։
Հալոգենացում[խմբագրել | խմբագրել կոդը]
Էլեկտրոֆիլ հալոգենացման արդյունքում բրոմի կամ քլորի միացումը ալկեններին բերում է համապատասխան վիցինալ դիբրոմո կամ դիքլորոալկանների (1,2-դիհալիդներ կամ էթիլենդիհալիդներ) առաջացման։ Այս ռեակցիայի արդյունքում ալկենները գունազրկում են բրոմաջուրը, ինչը հանդիսանում է ալկենների հայտնաբերման որակական եղանակ։
CH2=CH2 + Br2 → BrCH2-CH2Br
Այս եղանակը կարող է կիրառվել նաև որպես չհագեցած կապերի քանակական անալիզի մեթոդ, որի արդյունքում ստացվում է տվյալ միացության կամ խառնուրդի այսպես կոչված բրոմային թիվը որը հանդիսանում է չհագեցվածության աստիճանի չափ։ Ռեակցիան տեղի ունի, քանի որ կրկնակի կապի բարձր էլեկտրոնային խտությունը կապին մոտեցող բրոմի մոլեկուլում հարուցում է Br-Br կապի շեղում՝ հարուցելով ժամանակավոր դիպոլ։ Սրա արդյունքում կրկնակի կապին առավել մոտ Br ատոմը ձեռք է բերում մասնակի դրական լիցք, ինչի հետևանքով հանդես է գալիս որպես էլեկտրոֆիլ։
Պոլիմերացում[խմբագրել | խմբագրել կոդը]
Ալկենների պոլիմերացումը կարող է իրականացվել նաև սենյակային ջերմաստիճանում, մթնոլորտային ճնշման տակ։ Այն իրականացվում է Նոբելյան մրցանակի դափնեկիր քիմիկոսներ Կառլ Ցիգլերի և Ջուլիո Նատտայի ստեղծած կատալիզատորի՝ տրիէթիլայլյումինի և տետրաքլորտիտանի ներկայությամբ ալկենների պոլիմերացմամբ, որի ժամանակ ստացվում են շատ բարձր մոլեկուլային զանգվածով և արժեքավոր ֆիզիկական հատկություններով պոլիմերներ և համապոլիմերներ։
Գրականություն[խմբագրել | խմբագրել կոդը]
- А.Н. Несмеянов, Н.А. Несмеянов // Начала Органической Химии. в 2х томах, М., "Химия", 1969
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 1,2 Wade, L.G. (Sixth Ed., 2006). Organic Chemistry. Pearson Prentice Hall. էջեր 279. ISBN 1-4058-5345-X.
- ↑ 2,0 2,1 2,2 Moss, G. P.; Smith, P. A. S.; Tavernier, D. (1995). «Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995)». Pure and Applied Chemistry. 67 (8–9): 1307–1375. doi:10.1351/pac199567081307.
- ↑ Wade, L.G. (Sixth Ed., 2006). Organic Chemistry. Pearson Prentice Hall. էջեր 309. ISBN 1-4058-5345-X.
- ↑ Saunders, W. H. (1964). Patai, Saul (ed.). The Chemistry of Alkenes. Wiley Interscience. էջեր 149–150.
- ↑ Cram, D.J.; Greene, Frederick D.; Depuy, C. H. (1956). «Studies in Stereochemistry. XXV. Eclipsing Effects in the E2 Reaction1». Journal of the American Chemical Society. 78 (4): 790–796. doi:10.1021/ja01585a024.
- ↑ Bach, R.D.; Andrzejewski, Denis; Dusold, Laurence R. (1973). «Mechanism of the Cope elimination». J. Org. Chem. 38 (9): 1742–3. doi:10.1021/jo00949a029.
- ↑ Snider, Barry B.; Matsuo, Y; Snider, BB (2006). «Synthesis of ent-Thallusin». Org. Lett. 8 (10): 2123–6. doi:10.1021/ol0605777. PMC 2518398. PMID 16671797.
- ↑ Vogt, D. (2010). «Cobalt-Catalyzed Asymmetric Hydrovinylation». Angew. Chem. Int. Ed. 49 (40): 7166–8. doi:10.1002/anie.201003133. PMID 20672269.
- ↑ Grutters, M. M. P. Muller, C. Vogt, D. (2006). «Highly Selective Cobalt-Catalyzed Hydrovinylation of Styrene». J. Am. Chem. Soc. 128 (23): 7414–5. doi:10.1021/ja058095y. PMID 16756275.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Hilt, G. Danz, M. Treutwein, J. (2009). «Cobalt-Catalyzed 1,4-Hydrovinylation of Styrenes and 1-Aryl-1,3-butadienes». Org. Lett. 11 (15): 3322–5. doi:10.1021/ol901064p. PMID 19583205.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Sharma, R. K. RajanBabu, T. V. (2010). «Asymmetric Hydrovinylation of Unactivated Linear 1,3-Dienes». J. Am. Chem. Soc. 132 (10): 3295–7. doi:10.1021/ja1004703. PMC 2836389. PMID 20163120.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)
| ||||||||||||||||||||||||||||||||||||||

