Բենզոլ
| Բենզոլ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | բենզոլ |
| Ավանդական անվանում | ֆենիլ ջրածնի, բենզիլ |
| Քիմիական բանաձև | C₆H₆ |
| Մոլային զանգված | 1,3E−25 կիլոգրամ[1][2] գ/մոլ |
| Խտություն | 0,88 ± 0,01 գ/սմ³[3] գ/սմ³ |
| Դինամիկ մածուցիկություն | 0,0652 պուազեյլ Պա/վ |
| Իոնիզացման էներգիա | 9,24 ± 0,01 Էլեկտրոն-վոլտ և 1,5E−18 ջոուլ[4] կՋ/մոլ |
| Հալման ջերմաստիճան | 42 ± 1 ℉, 6 °C[5] և 5,53 °C[4] °C |
| Եռման ջերմաստիճան | 176 ± 1 ℉, 80 °C[5] և 80,09 °C[4] °C |
| Այրման ջերմաստիճան | 12 ± 1 ℉ և −11 ± 0 °C[6] |
| Ինքնաբռնկման ջերմաստիճան | 498 ± 1 °C[6] |
| Գոյացան էնթալպիա | 82 930 ջոուլ մեկ մոլի համար[7] և 49 080 ջոուլ մեկ մոլի համար[7] կՋ/մոլ |
| Գոլորշու ճնշում | 75 ± 1 mm Hg |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | 0,180 գ/100 մլ |
| Բեկման ցուցիչ | 1,501 |
| Դիպոլ մոմենտ | 0 Կլ·մ[4] |
| Դասակարգում | |
| CAS համար | 71-43-2 |
| PubChem | 241 |
| EINECS համար | 200-753-7 |
| SMILES | C1=CC=CC=C1 |
| ЕС | 200-753-7 |
| RTECS | CY1400000 |
| ChEBI | 236 |
| Թունավորություն | |
| ՄԲ50 | 520 |
| Թունավորություն | NFPA 714 |
| IDLH | 1595 ± 1 mg/m³ |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
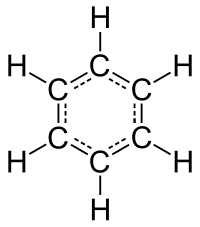
Բենզոլ կամ բենզեն (C6H6, PhH), քիմիական բանաձևը՝ , օրգանական միացություն, պարզագույն արոմատիկ ածխաջրածին։ Բենզոլը կանոնավոր վեցանկյուն է, որում C – C կապի երկարությունը 0,1407 նմ է, իսկ կովալենտային անկյունը՝ 130°։ Ածխածին–ածխածին և ածխածին–ջրածին σ–կապերը գոյանում են ածխածնի sp2 hիբրիդային օրբիտալների վրածածկից՝ առաջացնելով հարթ ցիկլիկ σ–կմախք։
Պատմություն[խմբագրել | խմբագրել կոդը]
Մաքուր վիճակում բենզոլը 1833 թվականին ստացել է Էյլարդ Միչերլիխը բենգոյական թթվի կալցիումական աղի չոր թորումից, որտեղից էլ՝ բենզոլ անվանումը։ Նույնիսկ ածխածնի քառավալենտության հաստատումից և ալկեններում ու ալկիններում չհագեցած կապ հասկացությունը մտցնելուց հետո բենզոլի կառուցվածքը մնաց հանելուկային, քանի որ, այդքան չհագեցած լինելով, այն պասիվ էր միացման ռեակցիաներում։

Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Անգույն, յուրահատուկ հոտով, դյուրաշարժ, ցնդող հեղուկ է։ Հալման ջերմաստիճանը՝ 5,5 °С, եռմանը՝ 80,1 °С, խտությունը՝ 879, 1 կգ/մ³։ Լավ է լուծվում օրգանական լուծիչներում, վատ՝ ջրում։ Բենզոլը ջրի հետ առաջացնում է 69,25 °С ում եռացող ազեոտրոպ խառնուրդ։
Քիմիական հատկություններ[խմբագրել | խմբագրել կոդը]
Բենզոլի մոլեկուլն ունի 6-րդ կարգի սիմետրիայի առանցք և հարթ է, π էլեկտրոնների տեսքը ունի փակված միասնական էլեկտրոնային համակարգի ձև։ Ստանում են քարածխի չոր թորման արդյունքներից և նավթի արոմատացմամբ։ Բենզոլը քիմիական արդյունաբերության կարևորագույն ելանյութերից է։ Բենզոլը չի գունազրկում կալիումի պերմանգանատի ջրային լուծույթն ու բրոմաջուրը։
- բենզոլը սովորական պայմաններում չի օքսիդանում,
- բենզոլը սովորական պայմաններում միացման ռեակցիա չի տալիս և դրանով տարբերվում է ալկեններից։
Տեղակալման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
- Հալոգենացում
Բրոմի և քլորի հետ բենզոլը փոխազդում է միայն կատալիզատորի առկայությամբ։ Որպես կատալիզատոր վերցնում են մետաղների անջուր հալոգենիդներ (AICI3, AIBr3, FeCI3, FeIBr3, SnCI4, TiCI4 և այլն)։ Բրոմացման կամ քլորացման արդյունքում առաջանում են բենզոլի համապատասխան բրոմ կամ քլորածանցյալները.

Որպես ռեակցիայի արգասիք անջատվում է նաև քլորաջրածին, որը կլանում են ջրով և ստացված լուծույթում հայտաբերում քլորիդ իոնը արծաթի նիտրատի լուծույթով։
- Նիտրացում
Ռեակցիան իրականացվում է նիտրացնող խառնուրդով (խիտ ծծմբական և ազոտական թթուների խառնուրդ), և ստացվում է նիտրոբենզոլ.
- Ալկիլացում
Բենզոլային օղակի ջրածնի ատոմի տեղակալումը ալկիլ խմբով անվանվում է ալկիլացում և ընթանում է ալկիլ հալոգենիդների կամ ալկենների և բենզոլի փոխազդեցությունից՝ AICI3, FeCI3, FeBr3 կատալիզատորների առկայությամբ (ՖրիդելԿրաֆտսի ռեակցիա)։

Միացման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
Բենզոլը դժվարությամբ է մտնում միացման ռեակցիաների մեջ, քանի որ միացման ռեակցիաների հետևանքով արոմատիկությունը խախտվում է, վերանում է օղակը կայունացնող 6–էլեկտրոնանոց ընդհանուր ամպը։
- Հիդրում
Ջրածնի միացումը բենզոլին և իր հոմոլոգներին ընթանում է բարձր ջերմաստիճանի և ճնշման պայմաններում՝ մետաղական կատալիզատորների առկայությամբ.
- Քլորացում
Քլորի միացումը բենզոլին ռադիկալային մեխանիզմով ընթացող ռեակցիա է և իրականացվում է ուլտրամանուշակագույն ճառագայթման ու տաքացման պայմաններում։ Բենզոլի ռադիկալային քլորացումը հանգեցնում է հեքսաքլորցիկլոհեքսանի (հեքսաքլորան)՝ առաջացմանը, որը վնասատու միջատների դեմ պայքարի միջոց է.
Օքսիդացում և այրում[խմբագրել | խմբագրել կոդը]
Բենզոլը չի օքսիդանում նույնիսկ ուժեղ օքսիդիչներով (KMnO4, K2CrO4 և այլն)։ Դա հաստատվել է փորձով։ Բենզոլն օդում այրվում է ծխացող բոցով, ինչը պայմանավորված է բենզոլի մոլեկուլում ածխածնի մեծ զանգվածային բաժնով.
Բենզոլի կիրառում[խմբագրել | խմբագրել կոդը]
Բենզոլը կիրառվում է որպես լուծիչ և ներքին այրման շարժիչների վառելիքի որակի լավացման հավելանյութ, այն ելանյութ է օրգանական միացություններից շատ շատերի սինթեզի համար։ Նիտրացման ռեակցիայով ստացվում է նիտրոբենզոլ՝ C6H5NO2, որն անիլինի ստացման սկզբնանյութն է, իսկ անիլինից ստացվում են շատ մեծ թվով դեղանյութեր և ներկանյութեր։ Բենզոլի քլորացումից ստացված քլորբենզոլն օգտագործվում է որպես լուծիչ։ Բենզոլն օգտագործվում է նաև օծանելիքի ստացման համար։ Այն ելանյութ է բարձրամոլեկուլային միացությունների մոնոմերների սինթեզի համար։
Բենզոլի հոմոլոգներն օգտագործվում են որպես լուծիչներ, ինչպես նաև զանազան ներկանյութեր, դեղանյութեր, պայթուցիկ, հոտավետ նյութեր ստանալու համար և այլն։ Բենզոլի և մյուս ածխաջրածինների քլորածանցյալները թունաքիմիկատներ են և գյուղատնտեսության մեջ օգտագործվում են որպես բույսերի պաշտպանության քիմիական միջոցներ, օրինակ՝ հեքսաքլորցիկլոհեքսանը, որն ստացվում է բենզոլին քլոր միացնելիս, և հեքսաքլորբենզոլը, որն ստացվում է բենզոլի ջրածինները քլորով տեղակալելիս։ Լայն կիրառություն ունի ստիրոլը, որը հեշտությամբ պոլիմերվում է՝ առաջացնելով արժեքավոր պոլիմեր՝ պոլիստիրոլ. Օգտագործվում է ֆենոլի, ացետոնի, ստիրոլի, պայթուցիկ նյութերի, ներկանյութերի, օծանելիքի, միջատասպանների արտադրություններում։ Բենզոլի գոլորշիները օրգանիզմի համար թունավոր են։ Շնչառական ուղիներով և մաշկի միջով օրգանիզմ թափանցելով՝ բենզոլն առաջացնում է սուր և քրոնիկական թունավորումներ։ Թունավորման նշաններն են՝ գլխացավ, գլխապտույտ, սրտխառնոց, փսխում, արյան ճնշման անկում, ծանր թունավորման դեպքերում՝ ցնցումներ և գիտակցության կորուստ։
Պայքարի հուսալի միջոցը լավ օդափոխումն է։ Բենզոլի թույլատրելի քանակն օդում 20 մգ/մ³ է։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 benzene
- ↑ 2,0 2,1 BENZENE
- ↑ 3,0 3,1 Hazardous Substances Data Bank
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 5,0 5,1 5,2 5,3 BENZENE
- ↑ 6,0 6,1 http://www.cdc.gov/niosh/ipcsneng/neng0015.html
- ↑ 7,0 7,1 7,2 7,3 Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics // J. Chem. Educ. — ACS, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- ↑ Claus, Adolph K.L. (1867) Theoretische Betrachtungen und deren Anwendungen zur Systematik der organischen Chemie (Theoretical considerations and their applications to the classification scheme of organic chemistry), Freiburg, Germany, p. 207
- ↑ Dewar, James (1867) "On the oxidation of phenyl alcohol, and a mechanical arrangement adapted to illustrate structure in the non-saturated hydrocarbons," Proceedings of the Royal Society of Edinburgh 6: 82–86.
- ↑ Ալբերդ Լամբերգ (1869) "Bemerkungen zur aromatischen Theorie" (Observations on the aromatic theory), Berichte der Deutschen Chemischen Gesellschaft 2: 140–142.
- ↑ Armstrong, Henry E. (1887) "An explanation of the laws which govern substitution in the case of benzenoid compounds," Journal of the Chemical Society, 51, 258–268; see p. 264.
Գրականություն[խմբագրել | խմբագրել կոդը]
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Բենզոլ» հոդվածին։ |
| ||||||||||||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 2, էջ 392)։ |


![{\displaystyle {\mathsf {C_{6}H_{6}+Cl_{2}{\xrightarrow[{}]{FeCl_{3}}}C_{6}H_{5}Cl+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d48ae47e593005848b4abfd855049b67f6f5ea50)
![{\displaystyle {\mathsf {C_{6}H_{6}+HNO_{3}{\xrightarrow[{}]{H_{2}SO_{4}}}C_{6}H_{5}NO_{2}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce592053321be27ccfa295dc0a41142fe6d5b4f6)


![{\displaystyle {\mathsf {C_{6}H_{6}+15O_{2}{\xrightarrow[{}]{}}12CO_{2}+6H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9e139a875642e3a23ca4267282b3dc3027bbdf0)