Օրգանական միացություններ

Օրգանական միացությունները այն նյութերն են, որոնք պարունակում են ածխածնի ատոմներ` այլ նյութերի հետ միացություններում։ Օրգանական միացությունների որոշ օրինակներ են սպիտակուցները, ճարպերը, ածխաջրերը։
Օրգանական միացությունների առանձնահատկությունները[խմբագրել | խմբագրել կոդը]
Ի տարբերություն անօրգանական նյութերի օրգանական նյութերն ունեն մի շարք բնորոշ առանձնահատկություններ։ Ամենից առաջ ածխածնի ատոմները ընդունակ են միանալու իրար հետ՝ առաջացնելով շղթաներ կամ օղակներ, որն այնքան էլ բնորոշ չէ անօրգանական միացություններին։ Դա օրգանական միացությունների բազմազանության պատճառներից մեկն է[1]։
Օրգանական մոլեկուլներում ատոմների միջև կապը կովալենտային է։ Ուստի օրգանական նյութերը սովորաբար հանդիսանում են ոչ էլեկտրոլիտներ[2]։
Եթե իոնային (անօրգանական) միացությունները հեշտությամբ ջրում դիսոցվում են իոնների և դրանց միջև ռեակցիաները ընթանում են շատ արագ, ապա պարզ (միակի) C-C և C-H կապեր պարունակող օրգանական նյութերը ռեակցում են իրար հետ մեծ դժվարությամբ կամ ընդհանրապես չեն փոխազդում[3]։
Օրգանական միացությունները 400-600°С տաքացնելիս ամբողջապես քայքավում և ածխանում են, իսկ թթվածնի ներկայությամբ՝ այրվում։ Դա բացատրվում է ածխածնի ատոմների միջև կապերի համեմատաբար ոչ մեծ ամրությամբ (355,6 կջ/մոլ)[4]։
Օրգանական միացությունների կարևոր առանձնահատկությունը հանդիսանում է այն, որ դրանց մոտ շատ տարածված է իզոմերիայի երևույթը[3][5][6]։
Ածխածնի ատոմի առանձնահատկությունը բացատրվում է իր կառուցվածքով՝ այն ունի չորս արժեքական էլեկտրոններ։ Ածխածնի ատոմները այլ ատոմների, ինչպես նաև իրար հետ, առաջացնում են ընդհանուր էլեկտրոնային զույգեր։ Ընդ որում ածխածնի յուրաքանչյուր ատոմի արտաքին մակարդակում գտնվում են ութ էլեկտրոններ, որոնցից չորսը միաժամանակ պատկանում են այլ ատոմների։
Օրգանական քիմիայում սովորաբար օգտվում են կառուցվածքային բանաձևերից, քանի որ մոլեկուլում ատոմներն ունեն տարածական դասավորություն։ Կառուցվածքային բանաձևերը օրգանական քիմիայի լեզուն է[7]։
Կառուցվածքային բանաձևերում կովալենտային կապը նշվում է գծիկով։ Ինչպես և անօրգական միացությունների կառուցվածքային բանաձևերում, յուրաքանչյուր գծիկ նշանակում է ընդհանուր էլեկտրոնային զույգը, որով ատոմները կապված են մոլեկուլներում։ Օգտագործվում են նաև փորձային և էլեկտրոնային բանաձևեր։ Պատկերենք էթիլենի և ացետիլենի համար համապատասխան բանաձևերը.
| Փորձային բանաձև | Էլեկտրոնային բանաձև | Կառուցվածքային բանաձև |
|---|---|---|
| C2H4 |  |
 |
| C2H2 | H։ C։ C։ H ացետիլեն |
Օրգանական քիմիայում օքսիդացման աստիճան հասկացության փոխարեն կիրառվում է արժեքականություն հասկացությունը։ Գրգռված վիճակում ածխածնի ատոմի արժեքականությունը միշտ հավասար է չորսի և այն առաջացնում է չորս կովալենտային կապ։
Օրգանական միացությունների քիմիական կառուցվածքը Ա.Մ. Բուտլերովի տեսությունը[խմբագրել | խմբագրել կոդը]
Օրգանական քիմիայի զարգացման ընթացքում խոշորագույն իրադարձություն էր անցած դարի 60-ական թվականներին ռուս մեծ գիտնական Ա.Մ. Բուտլերովի կողմից ստեղծված օրգանական միացությունների կառուցվածքի տեսությունը։ Այդ տեսությունը դրեց օրգական քիմիայի գիտական հիմքը և բացատրեց դրա կարևորագույն օրինաչափությունները։ Իր տեսության հիմնադրույթները Ա.Մ. Բուտլերովը շարադրել է 1861 թ. սեպտեմբերի 19-ին Շպեյերում կայացած բնախույզների և բժիշկների միջազգային համագումարում կարդացած «Քիմիական կառուցվածքի տեսության մասին» զեկուցման մեջ։ Հետագայում այն հաջողությամբ զարգացվել է ինչպես իր, այնպես էլ իր աշակերտների կողմից։
Կառուցվածքի տեսության հիմնադրույթները հանգում են հետևյալին.
- Մոլեկուլներում ատոմները իրար հետ միացած են որոշակի հաջորդականությամբ՝ համապատասխան իրենց արժեքականությանը։ Ատոմների կապի կարգը կոչվում է քիմիական կառուցվածք։
- Նյութի հատկությունները կախված են ոչ միայն նրանից, թե ինչ ատոմներ և ինչ քանակությամբ են մտնում դրա մոլեկուլի բաղադրության մեջ, այլ նաև նրանից, թե դրանք ինչ կարգով են միացած իրար հետ, այսինքն մոլեկուլի քիմիական կառուցվածքից։
- Մոլեկուլ առաջացնող ատոմները կամ ատոմների խմբերը փոխադարձաբար ազդում են մեկը մյուսի վրա, որից և կախված է մոլեկուլի ռեակցիաունակությունը։
Պարզաբանենք այդ դրույթները։ Մինչ Ա.Մ. Բուտլերովը անհնարին է համարվել մոլեկուլի կառուցվածքը՝ այսինքն ատոմների միջև քիմիական կապի կարգը ճանաչելը։ Շատ գիտնականներ նույնիսկ ժխտում էին ատոմների և մոլեկուլների իրական լինելը։ Ա.Մ. Բուտլերովը հերքեց այդ պատկերացումները։ Նա ելնում էր ատոմների և մոլեկուլների իրական գոյության մատերիալիստական և փիլիսոփայական ճիշտ պատկերացումներից, մոլեկուլում ատոմների միջև քիմիական կապերի ճանաչման հնարավորությունից։ Նա ցույց տվեց, որ մոլեկուլների կառուցվածքը կարելի է հաստատել փորձնական ճանապարհով՝ ուսումնասիրելվ նյութերի քիմիական փոխարկումները։ Եվ հակառակը, գիտենալով մոլեկուլների կառուցվածքը, կարելի է դուրս բերել միացության քիմիական հատկությունները[8]։
Քիմիական կառուցվածքի տեսությունը հաշվի է առնում ածխածին տարրի առանձնահատկությունները։ Օրգանական միացությունների կառուցվածքի ուսումնասիրումը մնում է օրգանական քիմիայի հիմնական խնդիրը և մեր ժամանակներում։ Դրա համար, բացի քիմիականից, լայնորեն կիրառվում են հետազոտման ֆիզիկական եղանակներ, այնպիսիք, ինչպիսին են սպեկտրազննությունը, միջուկային մագնիսական ռեզոնանսը, մասս-սպեկտրաչափությունը, դիպոլների էլեկտրական մոմենտների որոշումը, ռենտգենա- և էլեկտրոնագրությունը։ Իզոմերների գոյությունը բխում է օրգանական միացությունների կառուցվածքի տեսության հիմնադրույթներից։ Ա.Մ. Բուտլերովի մեծ հաջողությունը եղել է կառուցվածքի տեսության հիման վրա բութանի երկու իզոմերների կանխագուշակումը (ածխաջրածինների մոտ, սկսած բութանից, հնարավոր է մոլեկուլներում ատոմների միացման տարբեր կարգ)։1887 թ. Ա.Մ. Բուտլերովը սինթեզել է կանխատեսած իզոմերները, որը հանդիսացավ կառուցվածքի տեսության ճշտության փայլուն հաստատումը։ Դա իզոբութանն էր, որը նորմալ բութանից տարբերվում է մոլեկուլի կառուցվածքով, չնայած երկուսն էլ ունեն C4H10 փորձային բանաձևը։



Այսպիսով, քիմիական կառուցվածքի տեսությունը բացատրում է օրգանական միացությունների բազմազանությունը։ Այն պայմանավորված է քառարժեք ածխածնի ընդունակությամբ առաջացնելու շղթաներ և օղակներ, միանալու այլ տարրերի ատոմներին, ինչպես նաև իզոմերիայի առկայությամբ։ Քիմիական կառուցվածքի տեսությունում մեծ ուշադրություն դարձվում մոլեկուլում ատոմների և ատոմային խմբերի փոխադարձ ազդեցությանը։ Այն գոյություն ունի ցանկացած նյութի (օրգանական և անօրգանական) մոլեկուլում։ Դա պարզաբանենք հետևյալ միացությունների օրինակներով. NaOH,Al(OH)3,C2H5OH,NO2OH (ազոտական թթու),SO2(OH)2 (ծծմբական թթու)։ Դրանք բոլորը պարունակում են հիդրօքսիլ OH խումբ (հիդրօքսո կամ օքսիխումբ)։ Այնուամենայնիվ ջրային լուծույթում նյութերի հատկությունները հաջորդաբար փոխվում են.NaOH-ը ուժեղ հիմք է,Al(OH)3-ը երկդիմի հիդրօքսիդ է,C2H5OH-ը գործնականորեն չեզոք նյութ է, ազոտական և ծծմբական թթուները առաջացնում են H+ իոններ։OH խմբի տարբեր քիմիական բնույթի պատճառը պայմանավորված է իր հետ կապված ատոմների և ատոմային խմբերի ազդեցությամբ։ Կենտրոնական ատոմի ոչ մետաղական հատկությունների աճմամբ թուլանում է դիսոցումը ըստ հիմքի տեսակի և աճում է դիսուցումը ըստ թթվի տեսակի (Na,Al,C2H5,NO2,SO2 շարքում)։
Մեկը մյուսի վրա փոխադարձ ազդեցություն կարող են ունենալ նաև անմիջապես միմյանց հետ չկապված ատոմները։ Օրինակ,քլորի տարբեր ռեակցիոնունակությունը քլորէթանում CH3-CH2-Cl և քլորէթիլենում CH2=CH-Cl պայմանավորված է քլորի ատոմի վրա էթիլենային (CH3-CH2-) և վինիլային (CH2=CH-) խմբերի տարբեր ազդեցությամբ։ Քլորէթանի մոլեկուլում քլորը շատ ռեակցիաունակ է, իսկ քլորէթիլենի մոլեկուլում՝ անտարբեր։ Մոլեկուլում ատոմների փոխադարձ ազդեցության օրինաչափությունների բացահայտման մեջ մեծ ծառայություն ունի Ա.Մ. Բուտլերովի աշակերտ Վ.Վ. Մարկովնիկովը։
Ժամանակակից տեսանկյունից կառուցվածքի տեսության հիմնադրույթները պահանջում են որոշ լրացումներ կապված էլեկտրոնային և տարածական կառուցվածքի հետ։ Այդ դեպքում կառուցվածքի հիմնադրույթերի 2 կետում պետք է ընդգծել, որ օրգանական միացությունների հատկությունները որոշվում են մոլեկուլների կառուցվածքով, ինչպես նաև իրենց քիմիական, տարածական և էլեկտրոնային կառուցվածքով։
Քիմիական կառուցվածքի Ա.Մ. Բուտլերովի տեսությունը հանդիսանում է օրգանական քիմիայի տեսական հիմքի կարևորագույն մասը։ Ըստ նշանակության, այն կարելի է համեմատել Դ.Ի. Մենդելեևի տարրերի պարբերական համակարգի հետ։ Վերջինիս նման այն հնարավորություն տվեց կանոնակարգել (սիստեմավորել) հսկայական գործնական նյութ, նախապես կանխատեսել նոր նյութերի գոյությունը, ինչպես նաև ցույց տալ դրանց ստացման ճանապարհը։ Իսկ դա ապահովեց օրգանական սինթեզի չտեսնված հաջողությունները։ Այժմ էլ քիմիական կառուցվածքի տեսությունը ծառայում է ուղենիշ օրգանական քիմիայի բոլոր հետազոտություններում։
Օրգանական միացությունների հոմոլոգիական շարքերը[խմբագրել | խմբագրել կոդը]
Օրգանական միացությունների բազմազանության մեջ կարելի է առանձնացնել նյութերի խմբեր, որոնք քիմիական հատկություններով նման են և մեկը մյուսից տարբերվում են CH2 խմբով։
Քիմիական հատկություններով համանման և մեկը մյուսից CH2 խմբով տարբերվող միացությունները կոչվում են հոմոլոգներ։ Հարաբերական մոլեկուլային զանգվածի աճման կարգով դասավորված հոմոլոգները առաջացնում են հոմոլոգիական շարք։CH2 խումբը կոչվում է հոմոլոգիական տարբերություն։
Հոմոլոգիական շարքի օրինակ է ծառայել սահմանային ածխաջրածինների (ալկանների) շարքը։ Այդ շարքի պարզագույն ներկայացուցիչը մեթանն է։ Մեթանի հոմոլոգներն են՝ էթանը C2H6,պրոպանը C3H8, բութանը C4H10,պենտանը C5H12,հեքսանը C6H14,հեպտանը C7H16 և այլն։ Ցանկացած հաջորդ հոմոլոգի բանաձև կարելի է ստանալ նախորդ ածխաջրածնի բանաձևին ավելացնելով հոմոլոգիական տարբերությունը։
Հոմոլոգիական շարքի բոլոր անդամների մոլեկուլների բաղադրությունը կարելի է արտահայտել միասնական ընդհանուր բանաձևով։ Սահմանային ածխաջրածինների դիտարկված հոմոլոգիական շարքի համար այդ բանաձևն է՝ CnH2n+2,որտեղ n-ը ածխածնի ատոմների թիվն է։
Հոմոլոգիական շարք կարելի է կառուցել օրգանական միացությունների տարբեր դասերի համար։ Իմանալով հոմոլոգիական շարքի որևէ անդամի բաղադրությունը կարելի է հետևություն անել այդ շարքի ներկայացուցիչների հատկությունների մասին։ Դա պայմանավորված է հոմոլոգ հասկացության կարևորությունը օրգանական քիմիան ուսումնասիրելիս։
Օրգանական միացությունների դասակարգումը[խմբագրել | խմբագրել կոդը]
Օրգանական միացությունները դասակարգվում են ըստ ածխածնային շղթայի կառուցվածքի և մոլեկուլի կազմի մեջ մտնող ֆունկցիոնալ խմբերի։
Դասակարգումը ըստ ածխածնային շղթայի կառուցվածքի[խմբագրել | խմբագրել կոդը]
Ըստ ածխածնային շղթայի կառուցվածքի օրգանական միացությունները բաժանվում են երկու խմբի՝ ացիկլիկ (բաց շղթայով) և ցիկլիկ։ Ացիկլիկ միացությունների կարևորագույն ներկայացուցիչներն են ալիֆատիկ ածխաջրածինները, որոնք կազմված են միայն ածխածնի և ջրածնի ատոմներից և կարող են լինել հագեցած և չհագեցած, ճյուղավորված և չճյուղավորված, օրինակ՝



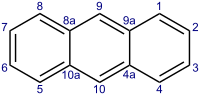
Ցիկլիկ միացությունները, կախված ցիկլի կազմի մեջ մտնող ատոմների բնույթից, բաժանվում են կարբոցիկլիկ և հետերոցիկլիկ խմբերի։ Կարբոցիկլիկ միացությունների ցիկլերը կազմված են միայն ածխածնի ատոմներից և բաժանվում են երկու խմբի՝ ալիֆատիկ ցիկլիկ (ալիցիկլիկ) և արոմատիկ։ Ալիցիկլիկ միացությունների ներկայացուցիչներն են ցիկլոպրոպանը և ցիկլոբութենը։ Արոմատիկ ածխաջրածինները պարունակում են բենզոլի օղակ՝




Հետերոցիկլիկ միացությունների ցիկլի կազմի մեջ բացի ածխածնի ատոմներից մտնում են նաև մեկ կամ մի քանի այլ տարրերի ատոմներ։ Հետերոցիկլիկ միացությունները կարող են լինել հագեցած, չհագեցած, արոմատիկ.օրինակ.
Դասակարգումը ըստ ֆունկցիոնալ խմբերի բնույթի[խմբագրել | խմբագրել կոդը]
Ֆունկցիոնալ խմբերը մտնում են միացության կազմի մեջ որպես ածխածնային շղթայի տեղակալիչներ և պայմանավորում են տվյալ միացության պատկանելիությունը որոշակի դասի։ Նույն դասին պատկանող, այսինքն միևնույն ֆունկցիոնալ խումբ ունեցող միացությունները ցուցաբերում են նման քիմիական հատկություններ։ Աղյուսակում բերված է օրգանական միացությունների դասակարգումը ըստ ֆունկցիոնալ խմբի բնույթի։
Աղյուսակից երևում է, որ առաջին չորս դասերի ներկայացուցիչները պարունակում են միայն ածխածնի և ջրածնի ատոմներ, այսինքն ածխաջրածիններ են։ Ալկանները չեն պարունակում ֆունկցիոնալ խմբեր, միացության մեջ տարրերը կապված են պարզ կովալենտ կապերով։ Ֆունկցիոնալ խմբերի բացակայությունը պայմանավորում է ալկանների ցածր ռեակտիվությունը։ Ալկենները որպես ֆունկցոնալ խումբ պարունակում են կրկնակի կապ, ալկինները՝ եռակի կապ, իսկ արենները՝ երեք կրկնակի կապ ունեցող վեցանդամանի ցիկլ։
Հաջորդ դասերում ածխածինը կապված է պարզ կապեր ունեցող, ֆունկցոնալ խմբերի կազմի մեջ մտնող էլեկտրաբացասական ատոմի հետ։ Հալոգենածանցյալները պարունակում են ածխածին-հալեգոն կապ, եթերները՝ երկու ածխածին կապված նույն թթվածնի հետ, ալկոհոլները՝ ածխածին-թթվածին,ամինները՝ ածխածին-ազոտ,թիոլները՝ ածխածին-ծծումբ և այլն։
Մնացած դասերի կազմի մեջ մտնող ֆունկցիոնալ խմբերը պարունակում են կրկնակի կապ ածխածնի և թթվածնի միջև՝ ալդեհիդներ, կետոններ, կարբոնաթթուներ, անհիդրիդներ, էսթերներ, ամիդներ։
Օրգանական միացությունների հիմնական դասերը.
| Ֆունկցիոնալ խմբեր | Ֆունկցիոնալ խմբերի անվանումը | Դասի անունը | Դասի ընդհանուր բանաձևը |
|---|---|---|---|
| պարունակում է միայն C-C և C-H կապեր | Ալկաններ | CnH2n+2 | |
 |
Ալկեններ | R-CH=CH-R' | |
| Ալկիններ |  | ||
 |
Ֆենիլ | Ֆենիլածանցյալներ | C6H5-R |
| -F,-Cl,-Br,-J (Hal) | Հալոգեններ | Հալոգենածանցյալներ | R-Hal |
| -OH | Հիդրօքսի | Սպիրտներ,ֆենոլներ | R-OH |
| -OR | Ալկօքսի | Պարզ եթերներ | R-OR |
| -SH | Թիո | Թիոլներ | R-SH |
| -SR | Ալկիլթիո | Թիոեթերներ | R-SR |
| -SO3H | Սուլֆո | Սուլֆոթթուներ | R-SO3H |
| -NH2,>NH,>NH | Ամինա | Ամիններ | R-NH2,R2-NH,R3N |
| -NO2 | Նիտրո | Նիտրոմիացություններ | R-NO2 |
| -C≡N | Ցիանո, նիտրիլ | Նիտրիլներ | |
| >C=O | Կարբոնիլ | Ալդեհիդներ,Կետոններ | 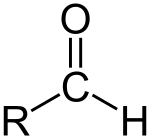  |
| -COOH | Կարբօքսիլ | Կարբոնաթթուներ |  |
| -COOR | Ալկօքսիկարբոնիլ | Բարդ եթերներ |  |
| -CONH2 | Կարբօքսիամիդային | Ամիդներ |  |
Մեկ ֆունկցիոնալ խումբ պարունակող միացությունները կոչվում են մոնոֆունկցիոնալ, նույն խմբի երկու և ավելի դեպքում՝ պոլիֆունկցոնալ, տարբեր ֆունկցոնալ խմբերի դեպքում՝ հետերոֆունկցիոնալ։
Օրինակ՝




- HO—CH2—CH2—OH (էթանդիոլ, պոլիֆունկցիոնալ)
- HOСН2—CH2Cl (2-քլոր-էթանոլ, հետերոֆունկցիոնալ)
Օրգանական միացությունների անվանակարգը[խմբագրել | խմբագրել կոդը]
Օրգանական քիմիայում օգտագործվում են միացությունների տրիվիալ կամ գործածական անունները, որոնք տրվում էին միացությունների օրգանական քիմիայի զարգացման առաջին փուլում և հիմնականում արտահայտում են նրանց ստացման աղբյուրները, եղանակը կամ առավել աչքի ընկնող հատկությունները և կիրառման ասպարեզները (մրջնաթթու,քացախաթթու,գլիցերին,պիրոխաղողաթթու և այլն)։
Որոշ միացությունների համար այդ անվանումները պահպանվել և կիրառվում են մինչ այսօր (ամինաթթուներ,ածխաջրեր,ալկալոիդներ,ստերոիդներ),սակայն, օրգանական քիմիայի բուռն զարգացման շնորհիվ, այժմ նկարագրված է մոտ 12 միլիոն բնական և արհեստական ծագում ունեցող օրգանական միացություն, և այդ բազմության մեջ կողմնորոշվելու համար այժմ կիրառվում է տեսական և կիրառական քիմիայի միջազգային միության կողմից (IUPAC-տեսական և կիրառական քիմիայի միջազգային միություն) առաջարկված անվանակարգը։ Դա կանոնների համակարգ է, որը հնարավորություն է տալիս յուրաքանչյուր միացության տալ միանշանակ անվանում։ Այլ կերպ ասած, անվանակարգը՝ դա քիմիական լեզուն է, որն օգտագործվում է միացությունների կառուցվածքը անվան միջոցով արտահայտելու համար։
Սիստեմատիկ տեղակալիչային անվանակարգ[խմբագրել | խմբագրել կոդը]
IUPAC-ի սիստեմատիկ անվանակարգից օգտվելու համար անհրաժեշտ է ծանոթանալ հետևյալ հասկացությունների հետ՝ օրգանական ռադիկալ, հիմնական կառուցվածք, բնութագրիչ խումբ, տեղակալիչ։
Ածխածնի ատոմները, կախված ածխածնի այլ ատոմների հետ ունեցած կապերի քանակից, կարող են լինել առաջնային (մեկ ածխածնի ատոմի հետ),երկրորդային (երկու ածխածնի ատոմի հետ),երրորդային (երեք ածխածնի ատոմների հետ),չորրորդային (չորս ածխածնի ատոմների)։

Օրգանական ռադիկալներ են կոչվում մոլեկուլների մնացորդները, որոնք առաջանում են (մեր երևակայության մեջ, իրականում նման ձևով գոյություն չունեն) մոլեկուլներից մեկ կամ մի քանի ջրածնի ատոմ հեռանալու արդյունքում և համապատասխանաբար ունեն մեկ կամ մի քանի ազատ վալենտականություն։ Միավալենտ ռադիկալների անվանումը կազմելիս «ան» վերջածանցը փոխարինվում է «իլ»-ով.
Օրինակ՝
Ալկիլ ռադիկալներ (ալիֆատիկ շարքի)
- -CH3 մեթիլ
- -CH3-CH2- էթիլ
Արիլ ռադիկալներ (արոմատիկ շարքի)
- C6H5- ֆենիլ
- C6H5CH2- բենզիլ
Իզոմեր ռադիկալների դեպքում անհրաժեշտ է նշել ազատ վալենտականության դիրքը, ղեկավարվելով հետևյալ կանոններով.
ն-տառը ռադիկալի անվան առջև ցույց է տալիս, որ ազատ վալենտականությունը գտնվում է չճյուղավորված շղթայի ծայրով.


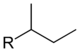

Երկրորդ.(երկրորդային) նախածանցը նշանակում է, որ ազատ վալենտականությունը գտնվում է երկրորդային ածխածնի մոտ, երրորդ.(երրորդային) նախածանցը՝ երրորդային ածխածնի մոտ։
Լայն տարածում ունեն նաև վինիլ (CH2=CH-),ալիլ (CH2=CH-CH2-),ֆենիլ (C6H5-),բենզիլ (C6H5CH2-) ռադիկալները։ Ալիֆատիկ շարքի ռադիկալների ընդհանուր անուններն են ալկիլ, ալկենիլ, ալկինիլ, արոմատիկ շարքինը՝ արիլ։ Երկվալենտ ռադիկալների համար, որոնց ազատ վալենտականությունը գտնվում են մոլեկուլի ծայրերին, օգտագործվում է վերջածանց «իլեն»,եթե նույն ածխածնի մոտ «իլիդեն».
- -CH- մեթիլեն
- -CH2CH2- էթիլեն
- -CH2CH2CH2- տրիմեթիլեն
Այլ օրգանական միացությունների համար նույնպես օգտվում են ռադիկալների հասկացությունից։ Կարբոնաթթուների ռադիկալները կոչվում են ացիլ ռադիկալներ։ Օրինակ՝
- CH3-CO- ≡CH3C(O)- ացետիլ
- C6H5CO- ≡C6H5C(O)- բենզոիլ
Հիմնական կառուցվածքը տվյալ միացության հիմքը կազմող քիմիական կառուցվածքն է։ Օրինակ, ացիկլիկ միացություններում հիմնական կառուցվածք է հանդիսանում գլխավոր ածխածնային շղթան, իսկ ցիկլիկ միացություններում՝ ցիկլը։
Բնութագրիչ խումբ են կոչվում այն ֆունկցիոնալ խմբերը, որոնք կապված են հիմնական կառուցվածքի հետ և որոշ դեպքերում մասամբ մտնում են նրա կազմի մեջ։
Տեղակալիչ են համարվում ցանկացած ատոմ կամ ատոմների խմբեր, որոնք տեղակալվում են հիմնական կառուցվածքի ջրածնի ատոմները։ Այսինքն, տեղակալիչ կարող է լինել ցանկացած բնութագրիչ խումբ կամ ածխաջրածնային ռադիկալ։
Տեղակալիչների ավագության կարգը.
| Ֆունկցիոնալ խումբ | նախածանց | վերջածանց |
|---|---|---|
| -(C)OOH1 | - | ոնաթթու |
| -COOH | կարբօքսի | կարբոնաթթու |
| -SO3H | սուլֆո | սուլֆոնաթթու |
| -(C)≡N | - | նիտրիլ |
| -CHO | օքսո | ալ |
| -CHO | ֆորմիլ | կարբալդեհիդ |
| -(C)=O | օքսո | ոն |
| -OH | հիդրօքսի | ոլ |
| -SH | մերկապտո | թիոլ |
| -NH2 | ամինա | ամին |
1(C)-փակագծում նշված ածխածնի ատոմը մտնում է հիմնական շղթայի մեջ։
Բնութագրիչ խմբեր, որոնք նշվում են միայն նախածանցի ձևով.
| Միացության դաս | խումբ | նախածանց |
|---|---|---|
| Հալոգենածանցյալներ | -Br,-J,-F,-Cl | բրոմ,յոդ,ֆտոր,քլոր |
| Պարզ եթերներ | -OR | ալկօքսի |
| Սուլֆիդներ | -SR | ալկիլթիո |
| Նիտրոմիացություններ | -NO2 | նիտրո |
Միջազգային տեղակալիչային (սիստեմատիկ) անվանակարգի կանոնները[խմբագրել | խմբագրել կոդը]
Օրգանական միացության անվանումը կազմվում է հետևյալ կանոնակարգով՝
- 1.Ընտրվում է հիմնական կառուցվածքը, որը իրենից ներկայացնում է ամենաերկար շղթան և պարունակում է՝
- ա) տեղակալիչների ու բ) չհագեցած կապերի ամենամեծ քանակը։
- 2.Համարակալվում են հիմնական շղթայի ածխածիններն այնպես, որ ավագ բնութագրիչ խումբը ստանա ամենափոքր համարը կամ գտնվի ամենափոքր համարը կրող ածխածնի մոտ։ Ավագ բնութագրիչ խումբը պայմանավորում է միացության
դասը անվան վերջավորությունը։
- 3.Հավասար պայմանների դեպքում որպես հիմնական կառուցվածք ընտրվում է ավելի մեծ թվով տեղակալիչ կրող շղթան։
- 4.Հագեցվածությունը արտահատվում է վերջածանցներով (ան-հագեցած, են-կրկնակի կապ, ին-եռակի կապ)։
- 5.Մնացած տեղակալիչները նշվում են այբբենական կարգով (նշվում են ածխածնի համարները)։
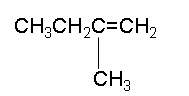
- HC≡C-CH2-CH=CH2 պենտեն-4-ին-1
- CH2=CCl-CH=CH2 2-քլորբութադիեն-1,3
- CH3-CH(CH3)-CH(OH)-COOH 2-հիդրօքսի 3-մեթիլբութանաթթու
- CH3-CH(CH3)-CH(SH)-CH(NH2)-COOH 2-ամինա-3-մերկապտո-4-մեթիլպենտանաթթու
Ռադիկալա-ֆունկցիոնալային անվանակարգ[խմբագրել | խմբագրել կոդը]
Սպիրտների,կետոնների,պարզ եթերների անվանման համար նշված երկու անվանակարգումներից բացի, կիրառվում է նաև ռադիկալաֆունկցիոնալային անվանակարգը։ Մեկ տեղակալիչ ունեցող միացությունների անվանումը այս դեպքում կազմվում է ածխաջրածնի ռադիկալի անունից, իսկ բնութագրիչ խմբի առկայությունը արտահայտվում է դասի անվանումով՝ էթիլ սպիրտ,վինիլմեթիլկետոն և այլն։ Օրինակ՝
- CH3
- |
- N-C2H5 N,N-դիմեթիլէթանամին
- |
- CH3
- CH3-CH2-CH2-OH պրոպիլ սպիրտ
- C6H5COCH3 մեթիլֆենիլկետոն
Ավելի բարդ միացությունների դեպքում տեղակալիչների դիրքերը նշվում են թվերով, օրթո-,մետա-,պարա- նախածանցներով կամ հունական տառերով՝α,β,γ,δ և այլն։
- γ β α
- H2N-CH2-CH2-CH2-COOH γ-ամինակարագաթթու
Քիմիական կապերը օրգանական միացություններում[խմբագրել | խմբագրել կոդը]
Օրգանական մոլեկուլը քիմիական կապերի որոշակի հաջորդականությամբ ատոմների համակցություն է։ Օրգանական միացությունների մոլեկուլներում հանդիպում են պարզ, կրկնակի և եռակի կապեր, այսինքն հանդիպում են σ և π կապեր։ Նշված կապերի առաջացման համար կարևոր նշանակություն ունի ատոմի հիբրիդացման տեսակը։
Հիբրիդացումով է բացատրվում կապերի առաջացումը այն դեպքերում, երբ հիմնական վիճակում չզույգված էլեկտրոնների թիվը փոքր է նրա առաջացրած քիմիական կապերի թվից։ Ենթադրվում է, որ տարբեր ատոմային օրբիտալները, որոնք մոտ են էներգիայի մակարդակով, փոխազդելով միմյանց հետ, առաջացնում են հիբրիդային օրբիտալներ՝ միանման ձևի և հավասար էներգիայով։ Ըստ հիբրիդացմանը մասնակցող օրբիտալների թվի, ածխածնի ատոմի համար հնարավոր են երեք հիբրիդացման տեսակներ՝ sp3,sp2,sp։ Հիմնական վիճակում ածխածնի ատոմի էլեկտրոնները բաշխված են հետևյալ կերպ՝ 1s22s22p2։
- 1.sp3 հիբրիդացում։ Ածխածնի ատոմի գրգռման հետևանքով էլեկտրոնը 2s օրբիտալից տեղափոխվում է 2p օրբիտալ, առաջացնելով 2s2p3։ Այս չորս օրբիտալների փոխազդեցությունից առաջանում է չորս հավասար sp3 հիբրիդային օրբիտալներ՝ 1s22(sp3)4,որոնց միջև անկյունները հավասար են 109,5°,իսկ ատոմի տարածական կառուցվածքը քառանիստ (տետրաէդրիկ) է։sp3 հիբրիդացումը բնորոշ է ալկաններին,ալկիլ ռադիկալների և նրանց ածանցյալների կազմի մեջ գտնվող ածխածնի ատոմների համար, օրինակ.մեթանի,տետրաքլորմեթանի և այլն։
- 2.sp2 հիբրիդացում։ Ածխածնի ատոմը հիմնական վիճակից վերածվում է 1s22(sp3)2p-ի, երեք հիբրիդացված օրբիտալների միջև վալենտային անկյունները հավասար են 120°,նրանք գտնվում են մեկ հարթության մեջ, իսկ հիբրիդացմանը չմասնակցող Pz օրբիտալը ուղղահայաց է հարթությանը։sp2 հիբրիդացումը բնորոշ է ալկենների,նրանց ռադիկալների և ածանցյալների, որոշ ֆունկցիոնալ խմբերի (կարբոնիլ, կարբօքսիլ) կազմի մեջ մտնող ածխածնի ատոմների համար և այլն։
- 3.sp հիբրիդացում։ Ածխածնի ատոմը հիմնական վիճակից վերածվում է 1s2(2sp)22p2,գոյանում են երկու հավասարազոր օրբիտալներ, որոնց միջև անկյունը հավասար է 180°,իսկ հիբրիդացմանը չմասնակցած երկու օրբիտալները ուղղահայած են միմյանց։ Նման կառուցվածքը բնորոշ է եռակի կապ ունեցող միացություններին՝ ալկիններին,նիտրիլներին։
Կովալենտ կապերի առաջացում[խմբագրել | խմբագրել կոդը]
- 1.Ալիֆատիկ միացություններում ածխածինները գտնվում են sp3 հիբրիդացված վիճակում և միմյանց հետ կապված են սիգմա (σ) կապերով։σ կապերը կարող են առաջանալ հիբրիդացված և չհիբրիդացված ատոմային օրբիտալների փոխազդեցությունից՝ օրինակ,էթանում,ածխածինների միջև (-C-C-) σ կապերը առաջանում են sp3 հիբրիդացված օրբիտալների վերածածկումից, իսկ ածխածին-ջրածին կապերը՝ ածխածնի sp3 և ջրածնի s-օրբիտալների միջև։σ կապերը առաջանում են երկու ատոմների միջուկները կապող գծի վրա (առավել կարճ տարածությունը)։
- 2.Կրկնակի կապը ներկայացնում է իրենից σ և π կապերի համակցություն և բնորոշ է չհագեցած միացություններին,ալկեններին։ Այդ դասերի օրգանական միացություններում կրկնակի կապ կարող է գոյանալ ինչպես ածխածնային ռադիկալներում, այնպես էլ ածխածնի և այլ ատոմների՝ O,N,S միջև։ Այս դեպքում կրկնակի կապի գոյացմանը մասնակցող ատոմը նույնպես ենթարկվում է sp3 հիբրիդացման։π կապը իրենից ներկայացնում է σ-կապերի հարթությանը ուղղահայած Pz օրբիտալների կողմնային վերածածկման արդյունք՝

Եթե էլեկտրոնային խտությունը տարածվում է միայն երկու ատոմների միջուկների միջև, դա երկկենտրոնային, տեղայնացված (լոկալիզացված) կապ է։ Այդպիսի տեղայնացված կապեր շատ են հանդիպում բնական ծագում ունեցող միացություններում, օրինակ, չհագեցած ճարպաթթուներում, և այլն։
Կովալենտ կապը բնութագրվում է կապի էներգիայով, երկարությամբ, բևեռայնությամբ, բևեռունակությամբ։
Զուգորդում,մեզոմերիա[խմբագրել | խմբագրել կոդը]
Եթե երկու կրկնակի կապերը բաժանված են միմյանցից պարզ կապով, կամ ընդհանուր դեպքում, կրկնակի կապի հարևան ատոմի pz օրբիտալի վրա գտնվում է չբաշխված էլեկտրոնային զույգ, կամ օրբիտալը ազատ է, ապա նրանք նույնպես վերածածկվում են, առաջացնելով ընդհանուր π էլեկտրոնային համակարգ։ Այդպիսի համակարգերը կոչվում են զուգորդված։ Օրինակ, բութադիեն-1,3 և վինիլքլորիդ։
- CH2=CH-CH=CH2
- CH2=CH-Cl
1.π,π-զուգորդում
Պարզագույն զուգորդված համակարգի օրինակ է հանդիսանում բութադիեն-1,3-ը։ Այս մոլեկուլում բոլոր ածխածնի ատոմները գտնվում են sp2 հիբրիդացման վիճակում և բոլոր σ-կապերը գտնվում են մեկ հարթության վրա։ Հետևաբար բոլոր ածխածինների չհիբրիդացված Pz օրբիտալները ուղղահայած լինելով σ-կապերի հարթությանը, զուգահեռ են միմյանց և ունեն կողմնային վերածածկման հնարավորություն։


Այսինքն, վերածածկումը կատարվում է ոչ միայն C-1 և C-2,C-3 և C-4 զույգերի միջև, այլ նաև մասնակիորեն C-2 և C-3 միջև և տեղի է ունենում p-էլեկտրոնների ընդհանրացում՝ չորս pz-էլեկտրոններ միաժամանակ գտնվում են չորս ածխածինների միջուկների դաշտում, առաջացնելով ընդհանուր π-էլեկտրոնային ամպ։ Այսպիսով π-կապերը տեղայնացված չեն (տեղի է ունեցել ապատեղայնացում, դելոկալիզացիա) և առաջացած համակարգը կոչվում է π,π-զուգորդված համակարգ։π,π զուգորդում կարող է տեղի ունենալ նաև հետերոածխածնային մոլեկուլներում, երբ զուգորդված կրկնակի կապը առաջացել է ածխածնի և այլ հետերոատոմի միջև, օրինակ,-C=O։ Նման զուգորդմանը հանդիպում ենք α,β չհագեցած կարբոնիլ միացություններում՝
- 1.CH2=CH-COH պրոպենալ (ակրոլեին)
- 2.CH2=CH-COOH պրոպենաթթու (ակրիլաթթու)
2.p,π-զուգորդում
p,π-զուգորդումը տեղի է ունենում այն դեպքերում, երբ կրկնակի կապի հարևան X ատոմը p-օրբիտալի վրա ունի կովալենտ կապի առաջացմանը չմասնակցող էլեկտրոնային զույգ։ Հիմնականում, դա լինում է հալոգենների, թթվածնի, ազոտի դեպքում։ Այդ ատոմների p-օրբիտալների վրա գտնվում են երկու էլեկտրոններ (չբաշխված էլեկտրոնային զույգ),որոնք π-կապ առաջացնող օրբիտալների հետ մտնում են զուգորդման մեջ՝
C=C-X X=O,Hal,S
Օրինակ, դիվինիլ եթեր, վինիլքլորիդ

CH2=CH-O-CH=CH2
Զուգորդման յուրահատուկ տեսակ է σ-π զուգորդումը (հիպերկոնյուգացիա, Նատան-Բեյկերի էֆեկտ)։ Զուգորդման այս ձևը առաջանում է, երբ մեթիլ խումբը միացած է կրկնակի կապ ունեցող ածխածնի հետ, օրինակ՝ քացախաթթվում, տոլուոլում։ Զուգորդմանը մասնակցում են σ-կապի և կրկնակի (-C=O) կապի էլեկտրոնները, որի շնորհիվ մեթիլ խմբի ջրածինները դառնում են ավելի շարժուն և հեշտությամբ տեղակալվում են հալոգեններով։ Զուգորդում առաջանում է ոչ միայն չեզոք մոլեկուլներում, այլ նաև լիցքավորված մասնիկներում և ռադիկալներում։
Ռեզոնանսի տեսություն։
Համաձայն այս տեսության (Լ.Պոլինգ, Ջ.Ուելանդ) իրական մոլեկուլը կամ մասնիկը նկարագրվում է մի քանի, այսպես կոչված, ռեզոնանսային կամ կանոնիկ (սահմանային),կառուցվածքներով, որոնք միմյանցից տարբերվում են միայն էլեկտրոնների բաշխումով և իրականում գոյություն չունեն՝
- CH2=CH-CH2+↔+CH2-CH=CH2
- Ալիլ-կատիոն
- CH2=CH-CH2-↔-CH2-CH=CH2
- Ալիլ-անիոն
- CH2=CH-CH2•↔•CH2-CH=CH2
- Ալիլ ազատ ռադիկալ
(երկկողմանի սլաքը ռեզոնանսի պատկերման հատուկ նշանն է)։
Իրական էլեկտրոնային բաշխումը կարելի է ստանալ սահմանային կանոնիկ կառուցվածքների վերածածկումից և պատկերել ռեզոնանսային հիբրիդի ձևով։ Եթե ածխածնի p-օրբիտալի վրա գտնվում են մեկ չզույգված էլեկտրոն, ապա այդպիսի մասնիկը կոչվում է ազատ ռադիկալ։ Հարևան դիրքում կրկնակի կապ լինելու դեպքում առաջանում է զուգորդում։ Ածխածնի ատոմի p-օրբիտալը ազատ լինելու դեպքում մասնիկը կոչվում է կարբկատիոն։ Լիցքավորված ատոմի հարևան դիրքում գտնվող π-կապի օրբիտալների և ազատ օրբիտալների միջև առաջանում է զուգորդում։
Բազմակենտրոն զուգորդված համակարգերի առաջացման ժամանակ տեղի է ունենում կապերի երկարության մասնակի հավասարում։π-էլեկտրոնների ապատեղայնացումը ուղեկցվում է էներգիայի անջատումով։ Համակարգի էներգիան նվազում է, այն դառնում է ավելի կայուն։ Օրինակ, բութադիեն 1,3-ի զուգորդումը ուղեկցվում է 15 կՋ/մոլ էներգիայի անջատումով։ Դրանով է բացատրվում ալիլային բնույթի իոնների և ռադիկալների, ացիլ ռադիկալների կայունությունը։




Բազմաթիվ օրգանական ռեակցիաները հնարավոր են շնորհիվ թթուների անիոնների (կարբօքսիլատ-իոն, ֆոսֆատ-իոն, սուլֆոնատ-իոն) հարաբերական կայունության, որը նույնպես էլեկտրոնների զուգորդման և ապատեղայնացման արդյունք է.

Զուգորդման էներգիա։
Թերմոդինամիկական կայունության աստիճանը արտահայտվում է տեղայնացված կապերով համակարգի և զուգորդված π-էլեկտրոնային համակարգի էներգիաների տարբերությամբ։ Էներգիաների այդ տարբերությունը կոչվում է զուգորդման էներգիա։ Որքան երկար է զուգորդման շղթան, այնքան մեծ է էներգիայի շահույթը և ավելի կայուն միացությունը։ Բնական ծագում ունեցող բազմաթիվ միացությունների կազմում հանդիպում ենք երկար զուգորդված շղթաների, որոնց շնորհիվ այդ միացությունները կրում են «պոլիեններ» ընդհանուր անունը և(կարոտինոիդներ, վիտամին A և այլն)։ Օրգանական թթուների կայունությունը նույնպես պայմանավորված է զուգորդումով։
Փակ շղթայով զուգորդված համակարգեր[խմբագրել | խմբագրել կոդը]
Արոմատիկություն։ Այս տերմինը առաջարկվել է Կեկուլեի կողմից բենզոլի և նրա ածանցյալների դասակարգման համար և պայմանավորված է որոշ ներկայացուցիչների բուրավետությամբ։ Կառուցվածքային տեսության զարգացումը հնարավորություն տվեց բացատրել արոմատիկ միացությունների քիմիական կայունությունը նրանց յուրահատուկ կառուցվածքով։ Քննարկենք բենզոլի կառուցվածքը։ Բենզոլի մոլեկուլում ցիկլ կազմող ածխածնի վեց ատոմները գտնվում են sp2 հիբրիդացման վիճակում և առաջացնում են 12 σ-կապերի (C-C,C-H)։ Բոլոր σ-կապերը գտնվում են նույն հարթության վրա։ Վեց ածխածինների pz-օրբիտալները դասավորվում են σ-կապերի հարթությանը ուղղահայաց և վերածածկվում են միմյանց հետ կողմնային հատվածներում։π-էլեկտրոնային խտությունը սիմետրիկ ձևով տարածվում է σ-կապերի հարթության երկու կողմերում(վերևում և ներքևում),այսինքն ապատեղայնացված է։ Այսպիսի համակարգը փակ զուգորդված համակարգ է և կոչվում է արոմատիկ։


Բենզոլի զուգորդման էներգիան կազմում է 227,8 կՋ/մոլ։ Դրանով է բացատրվում բենզոլի բարձր թերմոդինամիկական կայունությունը։
Կոնդեսացված զուգորդված համակարգերի (նավթալին, անտրացեն, ֆենանտրեն) թերմոդինամիկական կայունությունը ավելի ցածր է, քան բենզոլինը, ինչը պայմանավորված է կոնդեսացված արեններում էլեկտրոնային խտության ոչ լրիվ հավասար բաշխումով։
-
Անտրացեն
-
Ֆենանտրեն
Արոմատիկության չափանիշները[խմբագրել | խմբագրել կոդը]
Ըստ Հյուկելի, համակարգը համարվում է արոմատիկ, եթե՝
- 1.մոլեկուլը ունի ցիկլիկ կառուցվածք,
- 2.ցիկլի բոլոր ատոմները գտնվում են sp2 հիբրիդացման վիճակում և բոլոր ցիկլերը հարթ են,
- 3.ապատեղայնացված π-էլեկտրոնային համակարգի առաջացմանը մասնակցում են (4n+2) թվով էլեկտրոններ, որտեղ n=0,1,2,3,...։
Արոմատիկ միացություններ են ցիկլոպրոպենիլ-կատիոնը (2 π-էլեկտրոն,n=0),բենզոլը (6 π էլեկտրոն,n=1),նավթալինը (n=2)`
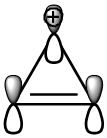
Ցիկլոօկտատետրաենը (π-էլեկտրոնների թիվը-8) արոմատիկ միացություն չէ,քանի որ չի համապատասխանում արոմատիկության չափանիշներին։
Կոնդեսացված բենզոլային համակարգերը համապատասխանում են արոմատիկության չափանիշներին-նավթալին (10 π-էլեկտրոն,n=2),անտացենը և ֆենանտրենը (14 π-էլեկտրոն,n=3)։
Հետերոցիկլիկ արոմատիկ միացություններ[խմբագրել | խմբագրել կոդը]
Այս միացությունները բացի ածխածնի ատոմներից, պարունակում են նաև այլ տարրեր, ազոտ, ծծումբ և թթվածին։ Հինգանդամանի հետերոցիկլիկ միացություններում (պիրոլ, թիոֆեն, ֆուրան) արոմատիկ համակարգը առաջանում է հինգ p-օրբիտալների վրա գտնվող վեց էլեկտրոնների մասնակցությամբ՝ ածխածնի չորս ատոմների մեկական էլեկտրոնների և մեկ հետերոատոմի չբաշխված էլեկտրոնային զույգի՝ էլեկտրոնային սեքստետի առաջացումով։ Այդպիսի համակարգերը կոչվում են էլեկտրոնավելցուկային, քանի որ 6 էլեկտրոնները հավասարաչափ պատկանում են 5 ատոմների, իսկ պիրոլի ազոտը կոչվում է «պիրոլային ազոտ»։


Քանի որ ազոտի չբաշխված էլեկտրոնային զույգը մասնակցում է արոմատիկ սեքստետի առաջացմանը և չի կարող միացնել պրոտոն, պիրոլը հիմնային հատկություններ չի ցուցաբերում։ Ընդհակառակը, պիրոլը, ըստ կառուցվածքի լինելով ամին, ցուցաբերում է թույլ թթվային հատկություններ։ Նման միացությունները տալիս են էլեկտրաֆիլ տեղակալման և միացման ռեակցիաներ։ Զուգորդման էներգիան աճում է, իսկ ռեակցիոնունակությունը ընկնում է հետևյալ շարքում՝
Պիրոլ>ֆուրան>թիոֆեն»բենզոլ
Վեցանդամանի հետերոցիկլերը կարող են պարունակել մեկից ավելի հետերոատոմ։ Մեկ հետերոատոմով ցիկլերից առավել կարևոր նշանակություն ունեն պիրիդինը և կոնդեսացված ցիկլեր խինոլինը և ակրիդինը՝
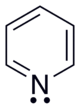


Պիրիդինի մոլեկուլում ազոտի ատոմը գտնվում է sp2 հիբրիդային վիճակում, արոմատիկ սեքստետի առաջացմանը տրամադրում է մեկ էլեկտրոն։ Հետևաբար պիրիդինի արոմատիկ համակարգը առաջանում է sp2 հիբրիդացման վիճակում գտնվող վեց ատոմների σ-կապերի առաջացմանը չմասնակցող pz-օրբիտալների վրա գտնվող մեկական էլեկտրոններից (բենզոլի նման)։ Ի տարբերություն պիրոլի, պիրիդինի ազոտի չբաշխված էլեկտրոնային զույգը չի մասնակցում զուգորդմանը, և շնորհիվ ազոտի բարձր էլեկտրաբացասականության էլեկտրոնային խտությունը շեղված է դեպի ազոտի ատոմը։ Նման համակարգերը հանդիսանում են էլեկտրոնդեֆիցիտային (էլեկտրոնպակասորդային), իսկ ազոտը կոչվում է «պիրիդինային ազոտ»։ Պիրիդինը ավելի թույլ հիմք է, քան տրիմեթիլամինը, սակայն կարող է փոխազդել հանքային թթուների հետ աղերի առաջացումով։
Ատոմների փոխադարձ ազդեցությունը օրգանական մոլեկուլներում[խմբագրել | խմբագրել կոդը]
Ոչ բևեռային կապեր։ Կովալենտ σ և π կապերի էլեկտրոնային խտությունը հավասարաչափ է բաշխված երկու ատոմների միջև միայն այն դեպքերում, երբ այդ ատոմների էլեկտրաբացասականությունները մոտ կամ հավասար են։ Նման կապերը կոչվում են ոչ բևեռային։
Օրինակ՝ CH3-CH3,CH2=CH2։
Բևեռային կապեր։ Եթե կապ առաջացնող ատոմները տարբերվում են իրենց էլեկտրաբացասականությամբ, ապա կապի էլեկտրոնները շեղվում են դեպի ավելի էլեկտրաբացասական ատոմը։ Այդպիսի կապը բևեռացված է։ Բևեռային կապերով կապված ատոմները կրում են մասնակի լիցքեր δ-,δ+ (դելտա)։ Օրգանական մոլեկուլներում հաճախ հանդիպող տարրերի էլեկտրաբացասականություններն են՝
| Na | Li | H | S | C | I | Br | Cl | N | O | F |
|---|---|---|---|---|---|---|---|---|---|---|
| 0,9 | 1,0 | 2,1 | 2,5 | 2,5 | 2,5 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
Քանի որ Hal,O,N ատոմները ածխածնի համեմատությամբ օժտված են ավելի մեծ էլեկտրաբացասականությամբ, ապա ավելի մեծ էլեկտրաբացասականությամբ, ապա հալոգենածանցյալներում, սպիրտներում, ամիններում կապերը բևեռացված են։ Հետերոատոմների էլեկտրաակցեպտոր ազդեցության հետևանքով ածխածնի ատոմի վրա էլեկտրոնային խտությունը նվազում է և գոյանում մասնակի դրական լիցք.
Cδ+→Clδ- Cδ+→Oδ- Cδ+→Nδ-
Ածխածնի ատոմները տարբեր հիբրիդացման վիճակներում տարբերվում են իրենց էլեկտրաբացասականությամբ։ Այդ պատճառով sp3 և sp2 վիճակում գտնվող ածխածինների միջև կապը բևեռացված է՝
sp3 < sp2 < sp
Եվ այս շարքում ձախից աջ մեծանում է էլեկտրաբացասականությունը։
Ինդուկտիվ էֆեկտ[խմբագրել | խմբագրել կոդը]
Կովալենտ կապերի էլեկտրոնային խտության տեղաշարժը σ-կապերի շղթայով տեղակալիչների ազդեցության հետևանքով կոչվում է ինդուկտիվ էֆեկտ - I։ Այդ էֆեկտը ունի էլեկտրաստատիկ բնույթ և մարում է 3-4 կապ հետո (աստիճանաբար նվազում է)։ Տեղակալիչները, որոնք իրենց կողմ են ձգում էլեկտրոնային խտությունը, ցուցաբերում են բացասական ինդուկտիվ էֆեկտ (-I) և կոչվում են էլեկտրաակցեպտորներ։ Այն տեղակալիչները, որոնց ազդեցության տակ էլեկտրոնային խտությունը տեղաշարժվում է դեպի σ-կապերի շղթան, ցուցաբերում են դրական ինդուկտիվ էֆեկտ՝ +I և կոչվում են էլեկտրադոնոր։ Մեկուսացված π-կապը, կամ միասնական π-էլեկտրոնային ամպը (բաց և փակ զուգորդված համակարգերում) կարող են հեշտությամբ բևեռանալ էլեկտրաակցեպտոր կամ էլեկտրադոնոր տեղակալիչների ազդեցության տակ։ Այս դեպքերում ինդուկտիվ էֆեկտը տարածվում է π-կապի վրա, և այդ ազդեցությունը նշում ենք Iπ։ Օրինակ՝ մեթիլ խումբը ցուցաբերում է +Iπ էֆեկտ, երբ կապված է sp2 հիբրիդացված ածխածնի ատոմի հետ.
H3C→CH=CH2

π-կապերի բևեռացումը նշվում է կլոր սլաքով։CH3-խումբը հանդես է գալիս որպես էլեկտրադոնոր տեղակալիչ, բայց զուգորդման չի մասնակցում։
Մեզոմեր էֆեկտ կամ զուգորդման էֆեկտ[խմբագրել | խմբագրել կոդը]
Էլեկտրոնային խտության վերաբաշխումը զուգորդված համակարգում համակարգին մասնակից տեղակալիչի ազդեցության տակ կոչվում է մեզոմեր էֆեկտ, «M»։
Որպեսզի տեղակալիչը մասնակցի զուգորդմանը, նա պետք է ունենա կամ կրկնակի կապ (π,π զուգորդում),կամ չբաշխված էլեկտրոնային զույգ կրող հետերոատոմ (p,π-զուգորդում)։M- էֆեկտը հաղորդվում (տարածվում) է համակարգով հավասարաչափ, առանց մարելու։ Զուգորդված համակարգի էլեկտրոնային խտությունը նվազեցնող տեղակալիչները դրսևորում են բացասական մեզոմեր էֆեկտ (-M)։ Զուգորդված համակարգի էլեկտրոնային խտությունը հարստացնող (դեպի համակարգ մղող) տեղակալիչները ցուցաբերում են դրական մեզոմեր էֆեկտ (+M)։ Այդ խմբին են պատկանում հետերոատոմները կամ հետերոատոմ պարունակող ֆունկցիոնալ խմբերը (ամինախումբ, հիդրօքսիլ խումբ և այլն)։ Այն դեպքերում, երբ զուգորդված համակարգի (բաց կամ փակ) կազմի մեջ է մտնում կրկնակի կապ պարունակող տեղակալիչ, դրսևորվում են -M էֆեկտ։ Առավել հաճախ այդ դերում հանդես են գալիս կարբոնիլ և կարբօքսիլ խմբերը։ Նրանք համակարգ են ներդնում էլեկտրաբացասական թթվածնի ատոմ, որը և ձգում է իր կողմը ամբողջ համակարգի էլեկտրոնային խտությունը։
Նման ազդեցություն ունեն վինիլային բնույթի ռադիկալները։ Այդպիսի խմբերում ցուցաբերում են -M։ Եթե տեղակալիչը զուգորդված համակարգին մասնակցում է իր չբաշխված էլեկտրոնային զույգով, ապա ստեղծվում է π-ավելցուկային համակարգ՝ հետերոատոմի երկու էլեկտրոնը հարստացնում է համակարգի էլեկտրոնային խտությունը։ Այդպիսի տեղակալիչները ցուցաբերում են +M էֆեկտ՝

Օրգանական միացության մոլեկուլում ինդուկտիվ և մեզոմեր էֆեկտները գործում են միաժամանակ։ Արդյունքում տեղի է ունենում գումարային էֆեկտ։ Ընդհանուր դեպքում ընդունված է ղեկավարվել հետևյալ կանոնով՝ մեզոմեր էֆեկտը գերակշռում է ինդուկտիվին։
Օրգանական միացությունների ռեակցիոնունակությունը, թերմոդինամիկական կայունությունը, նրանց միջև ընթացող ռեակցիաների արագությունը, բիոլոգիական ակտիվությունը, ռեակցիաների ուղղությունը և այլ հատկությունները կախված են նրանց կառուցվածքից, կոնֆիգուրացիայից, կապի բնույթից, մոլեկուլում էլեկտրոնային խտության վերաբաշխումից, հարձակվող ռեագենտի բնույթից, ռեակցիայի պայմաններից։
Տեղակալիչների էլեկտրոնային էֆեկտները.
| Տեղակալիչ | Էլեկտրոնային էֆեկտները | Տեղակալիչների էլեկտրոնային (գումարային) ազդեցությունը զուգորդված և արոմատիկ համակարգերում | |
|---|---|---|---|
| Ինդուկտիվ | Մեզոմեր | ||
| Ալկիլ- (մեթիլ-,էթիլ- և այլն) | +I | - | էլեկտրադոնոր |
| -NH2, (-NHAlK,-NAlK2 | -I | +M | +M»-I էլեկտրադոնոր |
| -OH | -I | +M | +M>-I էլեկտրադոնոր |
| Ալկօքսի-(մետօքսի-,էթօքսի- և այլն) | -I | +M | +M>-I էլեկտրադոնոր |
| Հալոգեններ | -I | +M | -I>+M,էլեկտրաակցեպտոր |
| -NO2 | -I | -M | էլեկտրաակցեպտոր |
| -COOH | -I | -M | ,, |
| -SO3H | -I | -M | ,, |
| >C=O | -I | -M | ,, |
Իզոմերիա[խմբագրել | խմբագրել կոդը]
Օրգանական քիմիային բնորոշ է միևնույն մոլեկուլային բանաձև ունեցող, բայց հատկություններով տարբերվող միացությունների գոյությունը։ Այս երևույթը իր բացատարությունը գտավ Բուտլերովի օրգանական միացությունների կառուցվածքային տեսության մեջ և պայմանավորված է ածխածնի յուրահատուկ կառուցվածքով և կապեր հաստատելու ունակությամբ։ Հաստատվեց միևնույն մոլեկուլային բանաձև ունեցող, բայց ատոմների և կապերի հաջորդականությամբ կամ տարածական դասավորվածությամբ տարբերվող միացությունների գոյության հնարավորությունը։ Այդպիսի միացությունները կոչվեցին իզոմերներ։ Համաձայն IUPAC-ի կանոնների, տարբերում են երկու տեսակի իզոմերներ՝
- 1.կառուցվածքային և 2.տարածական (ստերեոիզոմերներ)։
Կառուցվածքային իզոմերիա[խմբագրել | խմբագրել կոդը]
Մոլեկուլի կառուցվածքը որոշվում է ատոմների միջև եղած կապերի բնույթով և հաջորդականությամբ։ Մոլեկուլները, որոնք ունեն նույն մոլեկուլային բանաձևը, բայց տարբեր կառուցվածքային բանաձևեր, կոչվում են կառուցվածքային իզոմերներ։
Կառուցվածքային իզոմերիայի տեսակներից են.
- 1.պայմանավորված ածխածնային շղթայի կառուցվածքով։
Օրինակ՝ բութան և մեթիլպրոպան,C4H10
- CH3CH2CH2CH3-բութան
- CH3CH(CH3)2-2-մեթիլպրոպան
- 2.Տեղակալիչի դիրքի իզոմերիա։ Օրինակ՝ C4H9J
- CH3CJHCH2CH3-2-յոդբութան
- JCH2CH2CH2CH3-1-յոդբութան
- 3.Ֆունկցիոնալ իզոմերիա, որը պայմանավորված է տարբեր ֆունկցիոնալ խմբերի առկայությամբ՝ օրինակ, դիմեթիլեթեր և էթանոլ,C2H6O
- CH3OCH3-դիմեթիլեթեր
- C2H5OH-էթանոլ
- 4.Մետամերիա։ Իզոմերիայի այս տեսակը պայմանավորված է ֆունկցիոնալ խմբի պոլիվալենտ ատոմի հետ կապված նույն հոմոլոգիական շարքին պատկանող տարբեր ալիլ ռադիկալներով։
Օրինակ՝ C2H5OC2H5 CH3OCH(CH3)2
- Տաուտոմերիա։ Իզոմերիայի այս ձևը իրականանում է շնորհիվ շարժուն ջրածնի և կոչվում է դինամիկ իզոմերիա։ Տաուտոմերները անընդհատ կարող են անցնել մեկը մյուսի։ Օրինակ ացետոքացախաթթվային էսթերը փոխազդում է և որպես կետո միացություն և որպես չհագեցած հիդրօքսիմիացություն։ Դա պայմանավորված է նրանով, որ տվյալ միացությունը հանդես է գալիս երկու իզոմեր ձևերով՝ ացետոքացախաթթվային եթերի կետո- և ենոլային ձևերով՝
CH3-CO-CH2-CO-O-C2H5-կետո ձև
CH3-C(OH)=CH-CO-O-C2H5-ենոլ ձև

Ստերեոիզոմերիա,կոնֆիգուրացիա,կոնֆորմացիա[խմբագրել | խմբագրել կոդը]
Ստերեիզոմերներ են կոչվում այն միացությունները, որոնք ունեն նույն մոլեկուլային կառուցվածքը (կապերի և ատոմների հաջորդականությունը) և տարբերվում են միայն միմյանց հետ կապ չունեցող ատոմների տարածական դասավորվածությամբ։
Ստերեոիզոմերները իրենց հերթին կարող են լինել կոնֆիգուրացիոն և կոնֆորմացիոն տիպի։«Կոնֆիգուրացիա» տերմինը նշանակում է, որ հայտնի կառուցվածք ունեցող մոլեկուլում գոյություն ունի ատոմների և կապերի որոշակի հաջորդականություն, որը պայմանավորված չէ մոլեկուլի հատվածների պտույտով պարզ C-C կապերի շուրջը։ Կոնֆիգուրացիան տվյալ մոլեկուլում ատոմների որոշակի տարածական դասավորությունն է, օրինակ՝ sp3-քառանիստ կոնֆիգուրացիա,sp 2-հարթ կոնֆիգուրացիա։
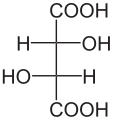
Տարբեր կոնֆիգուրացիա ունեցող իզոմերները կոչվում են կոնֆիգուրացիոն իզոմերներ, օրինակ՝ D- և L- գլիցերինային ալդեհիդները, ցիս- և տրանս-բութենները։



«Կոնֆորմացիա» տերմինը նշանակում է հայտնի կոնֆիգուրացիա ունեցող մոլեկուլի կազմի մեջ մտնող ատոմների կամ ատոմների խմբերի տարածական զանազան դիրքորոշում, որը պայմանավորված է պտույտով մեկ կամ մի քանի պարզ կապերի շուրջը, օրինակ, բութանի շեղված (գոշ) և արգելակված (անտի) կոնֆորմացիաները։

Խիրալություն։
Հայտնի են բազմազան օրինակներ, երբ երկու առարկա միմյանց համար հանդիսանում են հայելապատկեր, օրինակ, աջ և ձախ ձեռքը, աջ և ձախ բյուրեղը և այլն։«Խիրալություն» տերմինը օգտագործում են այն դեպքում, երբ երկու առարկա գտնվում են նման հարաբերության մեջ։ Մոլեկուլների այդպիսի զույգերը կոչվում են էնանթիոմերներ։ Մոլեկուլները երկրաչափական մարմիններ են, որոնց համար կարելի է կիրառել սիմետրիայի հատկությունները։ Սիմետրիայի հիմնական տարրերն են սիմետրիայի առանցքը, սիմետրիայի հարթությունը և սիմետրիայի կենտրոնը։
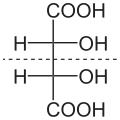
Մոլեկուլները, որոնք ունեն սիմետրիայի տարրեր (առանցք, հարթություն կամ կենտրոն) օժտված են արտացոլման սիմետրիայով և կոչվում են ախիրալ։ Այդպիսի մոլեկուլները չեն կարող կազմել էնանթիոմեր զույգեր և օպտիկական ակտիվություն չեն ցուցաբերում։ Օրինակ, մեզոգինեթթուն։ Սիմետրիայի տարրեր չունեցող մոլեկուլները կոչվում են խիրալ։ Այս միացությունները չեն համընկնում իրենց հայելապատկերի հետ և կարող են գոյություն ունենալ էնանթիոմեր զույգերի ձևով.
-
L(−)-Գինեթթու
-
D(+)-Գինեթթու
-
Մեզոգինեթթու
Սիմետրիայի բացակայությունը պայմանավորված է տվյալ միացություններում ասիմետրիկ ածխածինների, կամ խիրալ կենտրոնների, առկայությամբ։ Այդպես են անվանում ածխածնի այն ատոմները, որոնց չորս կապերը առաջացած են տարբեր ռադիկալների հետ։ Ասիմետրիկ ածխածին պարունակող միացությունները հարթության վրա պատկերելու համար օգտագործում են Ֆիշերի պրոյեկցիոն բանաձևերը։ Այս բանաձևերում ածխածնային շղթան հարթության վրա տեղադրվում է ուղղահայած դիրքով այնպես, որ ավագ խումբը գտնվի վերևում։ Ուղղահայած և հորիզոնական գծերի հատման կետերը համապատասխանում են ասիմետրիկ ածխածիններին, այդ ածխածինները չեն գրվում։ Օրինակ.
Ասիմետրիկ ածխածին պարունակող միացությունները հիմնականում օպտիկապես ակտիվ են։ Օպտիկապես ակտիվ են կոչվում այն միացությունները, որոնք պտտում են բևեռացված լույսի հարթությանը։ Անհրաժեշտ է նշել, որ ոչ բոլոր ասիմետրիկ կենտրոն ունեցող միացություններն են խիրալ և օժտված օպտիկական ակտիվությամբ։ Այն դեպքում, երբ ասիմետրիկ ածխածին պարունակող միացություններում գոյություն ունի սիմետրիայի հարթություն, մոլեկուլը ախիրալ է (մեզոգինեթթու, ցիստին և այլն)։
Բացարձակ և հարաբերական կոնֆիգուրացիա[խմբագրել | խմբագրել կոդը]
Բոլոր խիրալ կենտրոն ունեցող միացությունները ընդունված է բաժանել երկու ստերեոքիմիական շարքերի՝ D և L։ Օրգանական միացությունների բացարձակ կոնֆիգուրացիան դա տեղակալիչների իրական տարածական դասավորվածությունն է խիրալ կենտրոնի շուրջը, որը որոշվում է ճշգրիտ, մասնավորապես ռենտգենոկառուցվածքային անալիզի եղանակով։ Սակայն, որոշելով մի շարք հանգուցային միացությունների, որոնք հայտնի են այժմ որպես էտանոլային միացությունների, բացարձակ կոնֆիգուրացիաները, ապա համեմատելով անհայտ կոնֆիգուրացիա ունեցող միացության հետ, կարելի է որոշել վերջինիս հարաբերական կոնֆիգուրացիան։ Մինչ ճշգրիտ եղանակների ի հայտ գալը, որպես կոնֆիգուրացիոն էտալոն էին ընդունվել D(+) և L(-)-գլիցերինային ալդեհիդները։D-ստերեոքիմիական շարքին են պատկանում խիրալ կենտրոնի այնպիսի կոնֆիգուրացիա ունեցող միացությունները, որոնցում ֆունկցիոնալ խմբերը (OH,NH2,հալոգենները) Ֆիշերի պրոյեկցիաներում գտնվում են ուղղահայաց գծից աջ, իսկ L-շարքին-ձախ։
Օրինակ՝

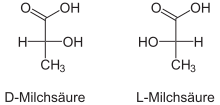
Այժմ բավականին հաճախ D,L համակարգի փոխարեն կիրառվում է R,S-նոր ստերեոքիմիական անվանակարգը, որը հիմնված է խիրալ կենտրոնի մոտ գտնվող տեղակալիչների ավագության նվազման ուղղության վրա (տեղակալիչների ավագությունը որոշվում է խիրալ կենտրոնի հետ կապված տարրի ատոմական համարով)։
Մեկ ասիմետրիկ ածխածին պարունակող միացությունը կարող է հանդես գալ երկու ստերեոիզոմերների ձևով։ Ստերեոիզոմերների թիվը որոշվում է 2n բանաձևով, որտեղ n-ը ասիմետրիկ ածխածինների թիվն է։
Կոնֆիգուրացիոն ստերեոիզոմերները բաժանվում են էնանթիոմերների և դիաստերեոմերների։
Մոլեկուլները, որոնք ունեն նույն կառուցվածքային բանաձևերը, իսկ բոլոր խիրալ կենտրոնների կոնֆիգուրացիաները հակառակն են (միմյանց հայելապատկերն են),կոչվում են էնանթիոմերներ։
Էնանթիոմերներ են D(+) և L(-) գլիցերինային ալդեհիդները,D և L կաթնաթթուները,D և L գլյուկոզները և այլն։ Էնանթիոմերները ունեն նույն քիմիական և ֆիզիկական հատկությունները, բացառությամբ բևեռացված լույսի հարթության պտտման ուղղությունից (պտտման անկյունը նույնն է)։ Աջ պտտող էնանթիոմերները ստանում են (+),իսկ ձախ պտտողները՝ (-) նշանը։ Էնանթիոմերների էկվիմոլային խառնուրդը կոչվում է ռացեմատ։ Ռացեմատները օպտիկապես ակտիվ չեն, քանի որ երկու էնանթիոմերների էֆեկտները կոմպեսում (մարում) են միմյանց։ Պտտման ուղղությունը (նշանը) և աստիճանը (մեծությունը) որոշվում է փորձնական ճանապարհով։
Դիաստերեոմերներ։ Բոլոր ստերեոիզոմերները, որոնք էնանթիոմեր չեն, կոչվում են դիաստերեոմերներ, որոնք նույն կառուցվածքային բանաձևը, բայց տարբերվում են միմյանցից խիրալ կենտրոնների կոնֆիգուրացիայով։ Դիաստերեոմերիայի մասնավոր դեպք է էպիմերիան, երբ իզոմերները տարբերվում են միայն մեկ խիրալ կենտրոնի կոնֆիգուրացիայով։ Դիաստերեոմերները տարբերվում են իրենց ֆիզիկաքիմիական հատկություններով։
Կոնֆորմացիոն իզոմերներ։Բաց շղթայով միացությունների կոնֆորմացիաները[խմբագրել | խմբագրել կոդը]
Ինչպես վերը նշեցինք, ատոմների տարբեր տարածական դասավորվածության հետևանքով, որը առաջանում է պարզ կապերի շուրջ կատարվող պտույտի ժամանակ, առաջանում են կոնֆորմացիոն իզոմերներ (կոնֆորմերներ)։ Կոնֆորմացիոն իզոմերները ընդունված է պատկերել Նյումենի բանաձևերով, որոնց վրա նշվում են տեղակալիչների դիրքերը C-C կապերի շուրջ պտույտ կատարելու դեպքում։ Էթանի օրինակի վրա քննարկենք հնարավոր կոնֆորմերների թիվը, ընդունելով մինիմալ պտույտը հավասար 60°։ Կոնֆորմացիաները, որոնցում տեղակալիչները գտնվում են միմյանց դիմաց (պտտման աստիճանը 0°,կամ 360°),առավել մոտ դիրքում, օժտված են բարձր էներգիայով և կոչվում են «ծածկված»։ Կոնֆորմացիաները, որոնցում տեղակալիչները գտնվում են առավել մեծ հեռավորության վրա (պտտման անկյունը 180°),գտնվում են ցածր էներգետիկ մակարդակի վրա և կոչվում են «արգելակված»։


Էթանի ծածկված կոնֆոմացիայի պոտենցիալ էներգիան 12կՋ/մոլ-ով բարձր է, քան արգելակվածինը։ Դա պայմանավորված է հարևան դիրքերում գտնվող կապերի էլեկտրոնների միջև առաջացող վանող ուժերով, որի հետևանքով զարգանում է այսպես կոչված տորսիոն լարվածություն։ Էթանի տարբեր կոնֆորմերների էներգետիկ մակարդակների տարբերությունը մեծ չէ և սովորական պայմաններում մեկ կոնֆերմերը հեշտությամբ անցնում է մյուսի։ Բութանի մոտ տորսիոն լարվածությանը գումարվում է ևս մեկը, որը առաջանում է մեթիլ խմբերի փոխադարձ վանման հետևանքով և կոչվում է Վան-դեր-Վալսի լարվածություն։ Այս դեպքում համակարգի լարվածությունը ավելի մեծ է։ Հետևաբար մոլեկուլները ձգտում են ընդունել այնպիսի կոնֆորմացիա, որի դեպքում առավել կայուն են։

Էներգետիկ առումով միջին դիրք գրավող կոնֆորմացիաները կոչվում են շեղված, կամ գոշ-կոնֆորմացիաներ։
Ցիկլիկ միացությունների կոնֆորմացիաներ[խմբագրել | խմբագրել կոդը]
Ցիկլոալկաններում, տորսիոն և Վան-դեր-Վալսի լարվածությանը գումարվում է Բայերի անկյունային լարվածությունը։ Վերջինս պայմանավորված է ցիկլում վալենտային անկյունների շեղումով՝ նորմալ տետրաէդրի անկյունից։ Օրինակ, առավել պարզ ներկայացուցչի, ցիկլոպրոպանի վալենտային անկյունները կազմում են 60°,որի հետևանքով առաջանում է մեծ լարվածություն։


Ցիկլոպրոպանում պտույտ C-C կապերի շուրջ չի կատարվում, և ջրածնի բոլոր ատոմները գտնվում են ծածկված դիրքում։ Հետևաբար, ցիկլոպրոպանը չունի կոնֆորմերներ։ Ելնելով վերը նշվածից, հասկանալի է, որ եռանդամ ցիկլը անկայուն է։ Հաջորդ ներկայացուցիչը ցիկլոբութանն է, որի վալենտային անկյունները հավասար են 90°։ Ջրածնի ատոմները գտնվում են ծածկված դիրքում։ Բարձր տորսիոն և անկյունային լարվածության հետևանքով քառանդամ ցիկլը նույնպես անկայուն է։
Ցիկլոպենտանի համար հայտնի է երկու կոնֆորմեր, հարթ ձևի մոտ բացակայում է անկյունային լարվածությունը, քանի որ վալենտային անկյունները հավասար են 108°,որը մոտ է նորմալ արժեքին։ Սակայն հարթ ձևի մոտ ուժեղ է դրսևորվում տորսին լարվածությունը (ծածկման լարվածությունը),որը ծրարի կոնֆորմացիայի դեպքում ավելի ցածր է։


-
Ցիկլոհեքսանի նավակը
-
Ցիկլոհեքսանի բազկաթոռ
Ցիկլոհեքսանում անկյունները հավասար են 120°։ Սրա համար հայտնի են մի շարք կոնֆորմերներ, որոնցից ավելի ցածր լարվածություն ունեն մի քանի որ հարթ, այսպես կոչված, նավակ, բազկաթոռ և զեթաձև կոնֆորմերները։


Նյումենի պրոյեկցիոն բանաձևերը հնարավորություն են տալիս հստակ պատկերացնել ատոմների փոխադարձ դիրքը։ Առանցքին զուգահեռ կապերը կոչվում են աքսիալ, իսկ 109,28° անկյան տակ գտնվողներինը՝ էկվատորիալ։


Ցիկլոհեքսանի բազկաթոռի կոնֆորմացիայում ջրածնի ատոմների դիրքը նույնն է, ինչ էթանի արգելակված կոնֆորմացիայում, իսկ ածխածինները՝ բութանի շեղված կոնֆորմացիայում։ Նավակ կոնֆորմացիայի դեպքում C-2,C-3,C-5,C-6 ածխածինների մոտ գտնվող ջրածինների ծածկված դիրքի շնորհիվ, ցիկլի լարվածությունը մեծ է։ Հետևաբար, բազկաթոռ կոնֆորմերը էներգետիկ տեսակետից ավելի շահավետ է։
Օրգանական միացությունների թթվային և հիմնային հատկությունները[խմբագրել | խմբագրել կոդը]
Բազմաթիվ օրգանական միացությունների ֆիզիկաքիմիական և կենսաբանական դերը պայմանավորված է այդ միացությունների թթվահիմնային հատկություններով։ Նյութափոխանակությանը մասնակից օրգանական միացությունները հիմնականում թույլ թթուներ կամ թույլ հիմքեր են։
Օրգանական քիմիայում թթուների և հիմքերի մի քանի տեսություններից (Արենիուսի, Բրեստեդ-Լոուրիի, Լյուիսի),առավել կիրառելի է 1923 թվականին դանիացի քիմիկոս Յոհան Բրենստեդի և անգլիացի քիմիկոս Թոմաս Լոուրիի կողմից առաջադրվածը, որն անվանում են Բրեստեդ-Լոուրիի տեսություն։ Ըստ այս տեսության, թթուներ են հանդիսանում այն միացությունները, որոնք քիմիական ռեակցիաներում կարող են տրամադրել պրոտոն (պրոտոնների դոնորներ),իսկ հիմքեր՝ այն նյութերը, որոնք կարող են ընդունել պրոտոն (պրոտոնների ակցեպտորներ)։ Ընդհանուր ձևով թթվա-հիմնային փոխազդեցությունը կարելի է ներկայացնել հետևյալ հավասարումով՝
A-H(թթու)+։B(հիմք)↔A-(զուգորդված հիմք)+BH+(զուգորդված թթու)
Այն թթուները, որոնք ռեակցիայում տրամադրում են մեկ պրոտոն, օրինակ HCl կամ HNO3,մոնոպրոտիկ թթուներ են։H2SO4՝ դիպրոտիկ թթու է, քանի որ կարող է տրամադրել երկու պրոտոն իսկ H3PO4՝ եռպրոտիկ թթու է, քանի որ կարող է տրամադրել երեք պրոտոն։ Քացախաթթուն (CH3COOH)՝ օրգանական թթուների ներկայացուցիչը, իր կազմում ունի չորս ջրածնի ատոմ, բայց միայն մեկը, որը կապված է թթվածնի հետ, թթվային է։ Ածխածնի հետ կապված ջրածինները դժվար են պոկվում։ Այդ առումով բազմաթիվ օրգանական թթուները նման են միմյանց.նրանք պարունակում են մեծ թվով ջրածնի ատոմներ, բայց միայն -COOH խմբի մեջ մտնողն է թթվային։
Օրգանական միացությունների թթվայնությունը[խմբագրել | խմբագրել կոդը]
Օրգանական միացությունների մեծամասնությունը կարելի է դիտարկել որպես թթուներ, քանի որ նրանք պարունակում են զանազան տարրերի հետ (O,N,C,S) կապված ջրածնի ատոմներ։ Համապատասխանաբար օրգանական թթուները դասակարգվում են ըստ թթվային կենտրոնի՝ C-H,N-H,O-H,S-H թթուների։ Համաձային Բրեստեդ-Լոուրիի տեսության թթուներ են հանդիսանում ոչ միայն չեզոք մոլեկուլները, այլ նաև իոնները։
Օրգանական միացությունների իոնացման ունակությունները փոխվում են լայն սահմաններում։ Թթվայնությունը գնահատվում է թթվի դիսոցման հաստատունով՝ Ka,կամ նրա բացասական լոգարիթմով՝ pKa։ Որքան փոքր է pKa-ն, այնքան ավելի բարձր է թթվայնությունը։ Թթվային հատկությունները բնութագրելու համար պետք է ղեկավարվել հետևյալ կանոնով.թթվի ուժը որոշվում է տվյալ թթվից առաջացած անիոնի կայունությամբ՝ որքան ավելի կայուն է անիոնը, այնքան ավելի ուժեղ է թթուն։ Անիոնի կայունությունը պայմանավորված է մի քանի գործոններով՝
- 1.թթվային կենտրոնում գտնվող տարրի բնույթով՝ էլեկտրաբացասականությամբ և բևեռունակությամբ,
- 2.անիոնում բացասական լիցքի ապատեղայնացման աստիճանով,
- 3.ռադիկալի բնույթից,
- 4.սոլվատացման էֆեկտներով։
Էլեկտրաբացասականության աճի հետ մեծանում է տարրի բացասական լիցք կրելու հնարավորությունը և առաջացող անիոնի կայունությունը։
Ալիֆատիկ թթուների թթվայնությանը համեմատական գնահատական տալու համար կարելի է համեմատել միայն այն թթուները, որոնց թթվային կենտրոնում նույն պարբերության տարրերն են, և գործնականում չի փոխվում բևեռունակությունը.
CH<NH<OH
SH-թթուների մոտ գերակշռում է բևեռունակության գործոնը՝ ծծմբի ատոմը ունի ազատ օրբիտալ, և բացասական լիցքը հնարավորություն ունի ապատեղայնացվելու ավելի մեծ ծավալում, որը և նպաստում է անիոնի բարձր կայունությունը։ Թիոլները որպես ավելի ուժեղ թթուներ, փոխազդում են ալկալիների, ծանր մետաղների օքսիդների, հիդրօքսիդների և աղերի հետ։ Սպիրտները, որպես ավելի թույլ թթուներ, կարող են փոխազդել միայն ակտիվ մետաղների հետ՝
2R-OH+2Na→2RONa+H2↑
Թիոլների համեմատաբար բարձր թթվայնության վրա է հիմնված մի շարք դեղամիջոցների ազդման մեխանիզմը։ Օրինակ, ունիթիոլը, բրիտանական անտիլյուիզիտը (ԲԱԼ) օգտագործվում են As,Hg,Cr,Bi և այլ մետաղների միացություններով, թիոլային թույներով թունավորումների ժամանակ որպես անտիդոտ։
- ClCH=CHAsCl2-լյուիզիտ
- CH2SH-CHSH-CH2OH-ԲԱԼ
- CH2SH-CHSH-CH2SO3Na-ունիթիոլ
Թիոլային թույներ են կոչվում այն միացությունները (օր՝ լյուիզիտ),որոնք փոխազդելով ֆերմենտների, սպիտակուցների SH-խմբերի հետ ինակտիվացնում են նրանց։
Նույն ռադիկալի դեպքում, ըստ թթվայնության նվազման օրգանական թթուները կարելի է դասավորել հետևյալ հաջորդականությամբ՝
SH>OH>NH>CH
Թթվայնության հարաբերական մեծությունը որոշվում է անիոնի բացասական լիցքի ապատեղայնացումով և սոլվատացման աստիճանով։ Անիոնի կայունությունը աճում է, երբ զուգորդման հետևանքով տեղի է ունենում բացասական լիցքի ապատեղայնացում։ Դրանով է բացատրվում սպիրտների համեմատությամբ ֆենոլների ավելի բարձր թթվայնությունը.ֆենօքսիդ-իոնը ավելի կայուն է, քանի ալկօքսիդ-իոնը՝

R-O--ալկօքսիդ-իոն
Անմիջական շփման ժամանակ ֆենոլները առաջացնում են այրվածքներ։
Կարբոնաթթուների բարձր թթվայնությունը պայմանավորված է անիոնի ռեզոնանսային կայունությամբ՝ բացասական լիցքի հավասարաչափ բաշխումով թթվածնի էլեկտրաբացասական ատոմների միջև։
Թթվային կենտրոնի նույն ատոմի դեպքում, թթվայնությունը կախված է ռադիկալի բնույթից՝ էլեկտրադոնոր տեղակալիչները նվազեցնում են թթվայնությունը՝
- CH3OH>C2H5OH>(CH3)2CHOH>(CH3)3-OH
- HCOOH>CH3COOH>(CH3)3C-COOH
Էլեկտրաակցեպտոր տեղակալիչները նպաստում են թթվային կենտրոնի բացասական լիցքի ապատեղայնացմանը և, հետևաբար թթվային հատկությունների ուժեղացմանը։ Օրինակ, պրոպանաթթվի pKa հավասար է 4,9,իսկ կաթնաթթվի (2-հիդրօքսիպրոպանաթթվի) թթվայնությունը մեկ կարգով բարձր է՝
CH3-CH2-COOH-պրոպանաթթու pKa 4,9

Այսպիսով,α-հիդրօքսիթթուները ավելի ուժեղ թթուներ են, քան համապատասխան կարբոնաթթուները։ Էլեկտրոաակցեպտոր տեղակալիչները զգալիորեն բարձրացնում են և CH թթվայնությունը, օրինակ՝ քլորոֆորմի (CHCl3) pKa=15,7,իսկ մեթանի (CH4) pKa=40,մոնոքլորքացախաթթվի ուժն ավելի մեծ է, քան պրոպիոնաթթվինը՝
Cl←CH2←COOH(մոնոքլորքացախաթթու)>CH3→CH2→COOH(պրոպանաթթու)
Եվ այս շարքում աջից ձախ մեծանում է թթվայնությունը։
Կարբոնաթթուների և նրանց ածանցյալների դերը մեծ է ոչ միայն նյութափոխանակության համար, այլ նաև բազմաթիվ այլ ասպարեզներում։ Օրինակ, ի տարբերություն ֆենոլի ագրեսիվ, տոքսիկ ազդեցության, որը օգտագործվում է որպես հակաախթահանիչ, հզոր անիտեսպթիկ միջոց, նրա որոշ ածանցյալներ ունեն կարևոր նշանակություն սննդարդյունաբերության մեջ։ Այժմ հացահատիկներից պատրաստված զանազան թխվածքների, մթերքների փաթեթների վրա նշվում են բաղադրամասերը և բավականին հաճախ այնտեղ հանդիպում են BHT և BHA հապավումները։ Նշված միացությունները ֆենոլի ածանցյալներն են, որոնք փոխազդելով ազատ ռադիկալների հետ դրսևորում են բարձր հակաօքսիդանտային ակտիվություն։
Օրգանական միացությունների հիմնայնությունը[խմբագրել | խմբագրել կոդը]
Ըստ Բրեստեդ-Լոուրիի հիմքեր են հանդիսանում այն միացությունները, որոնք կարող են ընդունել պրոտոն։ Օրգանական հիմքեր են հանդիսանում բացասական լիցքավորված իոնները (անիոնները) և այն չեզոք մոլեկուլները, որոնց հետերոատոմը ունի չբաշխված էլեկտրոնային զույգ (n-հիմքեր) և կարող են կովալենտ կապ հաստատել պրոտոնի հետ։
Գոյություն ունի ևս մեկ խումբ՝ π-հիմքեր, որոնցում հիմնայնության կենտրոն են հանդիսանում տեղայնացված π-կապի էլեկտրոնները կամ զուգորդված համակարգի π-էլեկտրոնային ամպը։ Այս հիմքերը պրոտոնի հետ առաջացնում են ոչ թե կովալենտ կապ, այլ կարճատև գոյություն ունեցող π-կոմպլեքսներ։
Հիմնային հատկությունների համեմատական արժեքը։
Որպես քանակական բնութագիր օգտագործում են զուգորդված թթվի (BH+) pKa-ի (pKBH+) մեծությունը։ Օրինակ՝ մեթիլամինի հիմնայնությունը որոշվում է իր զուգորդված թթվի-մեթիլամոնիումի իոնի pKa-ով (pKBH+)։
CH3NH2(մեթիլամին(հիմք))+HOH=CH3NH3+(pKa=10,62 մեթիլամոնիումի կատիոն (թթու))+OH-
Որքան ավելի մեծ է pKBH+-ը, այնքան ավելի ուժեղ է հիմքը։
Որքան ավելի մեծ է ատոմի էլեկտրաբացասականությունը, այնքան ավելի ուժեղ է ատոմը պահում չբաշխված էլեկտրոնային զույգը և ավելի փոքր է պրոտոնի հետ կապ հաստատելու հնարավորությունը։
Հիմայնության ուժը կախված է նույն գործոններից, ինչ որ թթվայնությունը, բայց էլեկտրադոնոր և էլեկտրաակցեպտոր խմբերի ազդեցությունը հակառակն է։ Հետևաբար, նույն ռադիկալի դեպքում,O-հիմքերն ավելի թույլ են, քան N-հիմքերը։S-հիմքերում ատոմի էլեկտրոնային խտությունը ցրված է ավելի մեծ ծավալում և լիցքի խտությունն ավելի փոքր է (բևեռայնացման գործոն)։ Այդ պատճառով S-հիմքերն ընդունակ չեն պրոտոնի հետ ամուր կապեր ստեղծելու և այդ հիմքերն ավելի թույլ են, քան O-հիմքերը։ Հետերոցիկլիկ միացություններում հիմնային կենտրոն է հանդիսանում պիրիդինային բնույթի ազոտի ատոմը։
Օրգանական միացություններից ամենաբարձր հիմնայնություն ունեն ամինները։ Ալիֆատիկ ամինները լուծվելով նոսր թթուներում, առաջացնում են տեղակալված ամոնիումի աղեր.
R-NH2+HCl↔RNH3+Cl-(ալկիլամոնիումի քլորիդ)
Տեղակալիչները ազդում են ոչ միայն շնորհիվ էլեկտրոնային էֆեկտների, այլ նաև ազդելով լուծիչի հետ փոխազդեցության վրա։
Ալիֆատիկ ամինների հիմնայնությունը (որոշված գազային ֆազում) աճում է ալկիլային բնույթի (էլեկտրադոնոր) տեղակալիչների կուտակման զուգահեռ՝
NH3<CH3→NH2<(CH3)2NH<(CH3)3N
Եվ այս շարքում ձախից աջ մեծանում է հիմնայնությունը։
Դա բացատրվում է և պայմանավորված է զուգորդված թթվի կատիոնի վրա ռադիկալների կայունացնող ազդեցությամբ (+I)։
Ցիկլիկ ամինները (օր.անիլին),ավելի թույլ հիմքեր են, քան ացիկլիկ ամինները, քանի որ ազոտի էլեկտրոնային զույգը ընդգրկվում է արոմատիկ համակարգում՝ մասնակցում է զուգորդմանը։
Օրգանական ռեակցիաների դասակարգումը[խմբագրել | խմբագրել կոդը]
Բազմազան օրգանական ռեակցիաները դասակարգվում են հաշվի առնելով մի շարք գործոններ՝ ռեակցիային մասնակից մոլեկուլների թիվը, կապերի փոփոխությունների բնույթը, ռեակցիայի արդյունքը։
Ռեակցիոնունակությունը միշտ պետք է գնահատել տվյալ ռեակցիային մասնակցող նյութերի նկատմամբ։ Ընդունված է սուբստրատ անվանել այն մոլեկուլը, որը ածխածնի ատոմ է տրամադրում նոր կապի առաջացման համար, իսկ նրա վրա ազդող միացությունը անվանում են ռեագենտ։ Ըստ սուբստրատի և ռեագենտի մոլեկուլներում կապերի փոփոխության բնույթից ռեակցիաները բաժանվում են ռադիկալային, իոնային և սինխրոն (համաձայնեցված)։
Ռեագենտների և ռեակցիաների դասակարգում[խմբագրել | խմբագրել կոդը]
Ռեակցիոն կենտրոնի վրա գրոհող ռեագենտները կարող են լինել երեք հիմնական տեսակի.ռադիկալային, էլեկտրաֆիլ և նուկլեաֆիլ։
- Ռադիկալ ռեագենտները (R-radical) գոյանում են կովալենտ կապի հոմոլիտիկ ճեղքման ժամանակ։ Ռադիկալները իրենցից ներկայացնում են ատոմներ կամ մի խումբ ատոմներ, որոնք ունեն չզույգված վալենտային էլեկտրոն՝ R1։R2→R1•+R2•
- Էլեկտրաֆիլ և նուկլեաֆիլ ռեագենտները գոյանում են կապի հետերոլիտիկ ճեղքման դեպքում՝
Br|։Br→Br+(էլեկտրաֆիլ)+։Br-(նուկլեաֆիլ)
Էլեկտրաֆիլները մասամբ լրացված վալենտային էլեկտրոնային օրբիտալներով մասնիկներ են։ Նուկլեաֆիլները այն մասնիկներն են, որոնք արտաքին էլեկտրոնային օրբիտալի վրա ունեն էլեկտրոնային զույգ։
Էլեկտրաֆիլ ռեագենտներ, (E-electrophie)`
- դրական լիցքավորված իոններ՝ H+,Br+,R3C+
- չեզոք մոլեկուլներ՝
Cδ+→X
Նուկլեաֆիլ ռեագենտներ (N-nucleophile)
- բացասական լիցքավորված իոններ՝ OH-,Cl-,RCOO-,RO-,HS-,RS-:
- չեզոք մոլեկուլներ ազատ (չբաշխված) էլեկտրոնային զույգ կրող,օրինակ` H2O,ROH,RSH,։NH3,RNH2։
Սինխրոն մեխանիզմով ընթացող են կոչվում այն ռեակցիաները, երբ կապի ճեղքումը և նոր կապի առաջացումը տեղի է ունենում առանց ռադիկալային կամ իոնային բնույթի մասնիկների առաջացման։ Օրինակ՝ էթիլենից ցիկլոբութանի առաջացումը՝
կամ Դիլս-Այդերի դիենային սինթեզի ռեակցիան և այլն։

Ըստ գումարային պրոցեսի արագությունը պայմանավորող (լիմիտավորող) փուլին մասնակցող մոլեկուլների թվի, տարբերում են մոնոմոլեկուլյար և բիմոլեկուլյար ռեակցիաներ։
Հաշվի առնելով վերջնական արդյունքը ռեակցիաները դասակարգվում են հետևյալ կերպ՝
- տեղակալման ռեակցիաներ (S-substitution)՝
- ա) ռադիկալային (SR),բ) էլեկտրաֆիլ (SE),գ) նուկլեաֆիլ (SN)
- միացման ռեակցիաներ (A-addition),երբ տեղի է ունենում կրկնակի կամ եռակի կապի քանդում և պարզ կապերի առաջացում։ Այս ռեակցիաները, կախված առաջին փուլում հարձակվող ռեագենտի բնույթից, լինում են.ա) նուկլեաֆիլ (AN) և բ) էլեկտրաֆիլ (AE)։
- էլիմինացման կամ պոկման ռեակցիաներ (E-elimination)
- օքսիդավերականգնման ռեակցիաներ
- վերախմբավորման ռեակցիաներ
- թթվահիմնային փոխազդեցություններ։
Վերախմբավորման ռեակցիաների շնորհիվ առաջանում են իզոմերի միացություններ (կետո-ենոլ, լակտամ-լակտիմ տաուտոմերիա և այլն)։
Օքսիդավերականգնման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
Օրգանական քիմիայում օքսիդացման ռեակցիաներ են հանդիսանում այն ռեակցիաները, որոնց ընթացքում տեղի է ունենում ջրածնի ատոմների հեռացում մոլեկուլից չհագեցած (կրկնապատիկ) կապերի առաջացումով կամ բևեռացված կապերի առաջացումով ջրածնից ավելի էլեկտրաբացասականություն ունեցող հետերոատոմի հետ։ Օքսիդացման պրոցեսը ընդգրկում է նաև էլեկտրոնների փոխանցումը սուբստրատից ռեագենտ։ Քիմիական ռեակցիաները, որոնց ընթացքում տեղի է ունենում էլեկտրոնների փոխանցում մեկ մոլեկուլից մյուսին, կոչվում են օքսիդավերականգնման։ Օքսիդացում-էլեկտրոնների կորուստ, վերականգնում-էլեկտրոնների ընդունում, էլեկտրոնների դոնորները-վերականգնիչ են, ակցեպտորները-օքսիդիչ։ Օքսիդիչները և վերականգնիչները գործում են որպես զուգորդված օքսիդավերականգնվող զույգեր։
Ածխածնի օքսիացման աստիճանը օքսիդավերականգնման ռեակցիաների ընթացքում փոխվում է։ Ածխաջրածինների այրման ժամանակ օքսիդացումը գնում է մինչև վերջ և առաջանում է ածխածնի դիօքսիդ, իսկ ոչ լրիվ օքսիդացման պայմաններում առաջանում է տարբեր միացությունների խառնուրդ, օրինակ՝
CH4(մեթան)→CH3OH(մեթանոլ)→HCHO(մեթանալ)→HCOOH(մեթանաթթու)→CO2(ածխաթթու գազ)
Հագեցած ածխաջրածինները առավել դժվար օքսիդացող օրգանական միացություններ են և օքսիդանում են միայն խիստ պայմաններում՝ բարձր ջերմաստիճանի և ուժեղ օքսիդիչի ազդեցության դեպքում։ Միջանկյալ պրոդուկտները՝ առաջնային և երկրորդային սպիրտները, ալդեհիդները օքսիդանում են ավելի մեղմ պայմաններում։ Օքսիդավերականգնման ռեակցիաներ են հանդիսանում դեհիդրման և հիդրման ռեակցիաները՝ օրինակ սաթաթթվի օքսիդացումից Կրեբսի եռկարբոնաթթվային ցիկլում առաջանում է ֆումարաթթու՝
- Սաթաթթու + FAD → Ֆումարաթթու + FADH2.
Օքսիդավերականգնման ռեակցիաների մեխանիզմը[խմբագրել | խմբագրել կոդը]
Գոյություն ունի էլեկտրոնների փոխանցման մի քանի եղանակ.
- 1.էլեկտրոնների անմիջական տեղափոխում (մեկ էլեկտրոնային տեղափոխում)։ Նման եղանակով են գործում ցիտոքրոմները, հեմ պարունակող սպիտակուցները շնչառական շղթայում։ Վերականգնված մոլեկուլը կարող է տրամադրել իր էլեկտրոնը ցանկացած վերականգնվող միացության.
Fe2+-1e→Fe3+
- 2.ջրածնի ատոմի տեղափոխում (ազատ ռադիկալային ճեղքում, (օրինակ, ֆումարաթթվի օքսիդացում)՝ R-H
- 3.H- հիդրիդ իոնի ձևով փոխանցում դոնորից ակցեպտորին (դեհիդրոգենազների մասնակցությամբ)։
- 4.Օրգանական միացությունների և թթվածնի անմիջական փոխազդեցություն, որի արդյունքում առաջանում է թթվածնի հետ կովալենտ կապ ունեցող միացություն, օրինակ՝ ալիֆատիկ հիդրօքսիլացում՝ դեղամիջոցների բիոտրանսֆորմացիայի հիմնական ուղիներից մեկը, ստերոիդ հորմոնների սինթեզ և այլն։
Հիդրօքսիլ- և օքսո- խմբերի օքսիդացում
Սպիրտներն ունեն օքսիդանալու ավելի բարձր հնարավորություն հագեցած ածխաջրածինների հետ համեմատ։
CH3-OH-CH2-OH(առաջնային)→CH3CHO→CH3COOH
(CH3)2COOH(երկրորդային)→CH3-CO-COOH
Երրորդային սպիրտները և կետոնները կայուն են օքսիդիչների նկատմամբ և ուժեղ օքսիդիչների ազդեցության դեպքում ճեղքվում են C-C կապերը։
Կենսաբանական համակարգերում սպիրտների և ալդեհիդների օքսիդացումը, ամինաթթունի օքսիդացնող դեզամինացումը կատարվում է ֆերմենտատիվ եղանակներով։ Այդ ռեակցիաներում որպես կոնֆորմենտ հանդես է գալիս NAD+-ը տեղի է ունենում հիդրիդ իոնի տեղափոխություն։
Հասկանալի է, որ վերականգնված կոնֆորմետը (NADH+H+) կարող է մասնակցել որպես ջրածնի դոնոր վերականգնման ռեակցիաներում։

Չհագեցած և արոմատիկ միացությունների օքսիդացում[խմբագրել | խմբագրել կոդը]
Կրկնակի կապ պարունակող միացությունների օքսիդացման ժամանակ որպես միջանկյալ պրոդուկտներ առաջանում են էպօքսիդներ, որոնց հիդրոլիզից առաջանում են դիոլներ՝
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
Արոմատիկ ցիկլերը կայուն են օքսիդացման նկատմամբ։ Կոնդեսացված ցիկլերը (նավթալին, անտրացեն) բենզոլի համեմատ ավելի հեշտ են օքսիդանում։ Չափազանց խիստ պայմաններում բենզոլը ևս կարող է օքսիդանալ.արդյունքում առաջանում է մալեինանհիդրիդ։

Կոնդեսացված արոմատիկ միացությունների էպօքսիդները կանցերոգեն են։ Կենսաբանական համակարգերում էպօքսիդների առաջացումը արոմատիկ միացությունների հիդրօքսիլացման փուլերից մեկն է և կատարվում է ֆերմենտատիվ եղանակով։ Օրինակ՝ ֆենիլալանինից թիրոզինի առաջացումը։

Վերականգնման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
Օքսիդավերականգնման երկակիության շնորհիվ ալդեհիդների վերականգնումից առաջանում են առաջնային սպիրտներ, կետոնների վերականգնումից՝ երկրորդային սպիրտներ։ Նիտրոմիացությունների վերականգնումը մի փոքր այլ կերպ է ընթանում.
R-NO2→R-N=O(նիտրոզոածանցյալ)→R-NH-OH(հիդրօքսիլ-ամինածանցյալ)→R-NH2(ամինածանցյալ)
Դարձելի օքսիդավերականգնման համակարգեր[խմբագրել | խմբագրել կոդը]
Այս համակարգերը բավականին հեշտ վերականգնվելու և օքսիդանալու հատկության շնորհիվ մասնակցում են մեծ թվով կենսաբանական պրոցեսների։ Դարձելի օքսիդավերականգնման համակարգեր են հիդրոխինոն-խինոնային, սուլֆիդ-դիսուլֆիդային համակարգերը։
Խինոնները ուժեղ օքսիդիչներ են։ Տեղակալված խինոնները ուննե կարևոր կենսաբանական դեր, օրինակ, կոէնզիմ Q-ն (ուբիխինոնը) շնչառական շղթայի անդամներից մեկն է և հանդիսանում է պրոտոնների և էլեկտրոնների փոխանցումը սուբստրատից դեպի թթվածին։

Սուլֆիդ-դիսուլֆիդային համակարգեր։
Ցիստեինի օքսիդացումից առաջանում է դիսուլֆիդային կապ և ցիստին ամինաթթուն։ Դիսուլֆիդային կապեր հանդիպում են պեպտիդներում, սպիտակուցներում (երրորդային կառուցվածքը կայունացնող կապերից մեկն է)։ Բազմաթիվ դիսուլֆիդային կապեր կան մազի և բրդի սպիտակուց՝ կեռատինի մեջ։

Գլուտաթիոն եռպեպտիդի (γ-գլուտամիլցիստեիլգլիցին) գործունեությունը նույնպես պայմանավորված է թիոլ-դիսուլֆիդ օքսիդավերականգնման համակարգերի գոյությամբ՝
2CSH→CS-SG
Չափազանց կարևոր դեր ունի դիհիդրոլիպոյաթթուն (6,8-դիթիոօկտանաթթու)։ Նա որպես կոնֆերմենտ մտնում է պիրուվատդեհիդրոգենազա ֆերմենտի կազմի մեջ և մասնակցում օքսիդացնող դեկարբօքսիլացման ռեակցիաներին։

Միացման ռեակցիաների մեխանիզմը[խմբագրել | խմբագրել կոդը]
Միացման ռեակցիաները բնորոշ են ալկենների և ալկինների համար և կարող է ընթանալ երեք հիմնական եղանակներով։
AE-1
AN-1

Էլեկտրաֆիլ միացման ռեակցիաների մեխանիզմը (AE-1)[խմբագրել | խմբագրել կոդը]
Առաջին եղանակի դեպքում պրոցեսը ընթանում է երկու փուլով։ Էլեկտաֆիլ ռեագենտը իր էլեկտրաֆիլ մասով փոխազդեցության մեջ է մտնում կրկնակի կապի էլեկտրոնների հետ, առաջացնելով π-կոմպլեքս, այնուհետև անկայուն σ-կոմպլեքս կարբկատիոն (C+),որը կայունանում է անիոնի միացումով։ Առաջին փուլը ռեակցայի արագությունը պայմանավորող (լիմիտավորող) դանդաղ փուլն է։ Ալկեններից կարող են առաջանալ երկու տիպի կարբկատիոններ, բայց միշտ առաջանում է առավել տեղակալված, և,հետևաբար, առավել կայուն կարբկատիոնը։

Նկարից երևում է, որ առավել տեղակալվածը կարբկատիոն I-ն է։ Այս օրինաչափությունը, երբ ջրածինը միանում է առավել հիդրոգենացված ածխածնի ատոմին, հայտնի է որպես Մարկովնիկովի կանոն և հնարավորություն է տալիս կանխատեսել միացման դիրքը։ Երկրորդ փուլը՝ X- նուկլեաֆիլ մասնիկի արագ միացումն է կարբկատիոնին։
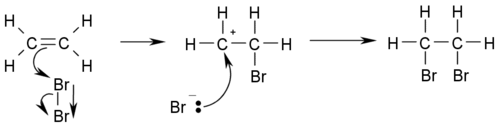
Ալկենների հալոգենացումը կատարվում է AE1 մեխանիզմով.հալոգենի մոլեկուլի (օրինակ բրոմի) հետերոլիտիկ ճեղքման արդյունքում առաջանում է դրական լիցքավորված հալոգենի ատոմ, որը ալկենի π-կապի էլեկտրոնների հետ առաջացնում է π-կոմպլեքս։
Հաջորդ փուլում առաջանում է կարբկատիոն (σ-կոմպլեքս).վերջինս կայունանում է անիոնի միացումով (Br-)։ Առաջանում է 1,2-դիբրոմէթան։ Նույն մեխանիզմով է ընթանում կրկնակի կապին ջրածնի, հալոգենաջրածինների (HHaL),NH3 և այլ HX ընդհանուր բանաձև ունեցող միացությունների միացումը կրկնակի կապի դիրքով։ Ասիմետրիկ ալկենների դեպքում հալոգենաջրածնի միացման արդյունքում առաջանում է ավելի տեղակալված հալոգենածանցյալը։
Ալկենների հիդրատացումը (ջրի միացումը) օրգանիզմում ընթացող առավել կարևոր ռեակցիաներից մեկն է։ Քանի որ ջուրը նուկլեաֆիլ է, որպես կատալիզատոր,H+ դոնոր (էլեկտրաֆիլ ռեագենտ) օգտագործում են ուժեղ թթու (H2SO4)։ Քննարկենք այդ մեխանիզմը էթենի օրինակի վրա։ Պրոտոնը էթենի π-կապի հետ առաջացնում է նախ π-կոմպլեքս, հետո-σ-կոմպլեքս, այսինքն կարբկատիոն։
Կարբկատիոնը, ունենալով ուժեղ էլեկտրաֆիլ կենտրոն, հեշտությամբ փոխազդում է նուկլեաֆիլի (ջրի) հետ առաջացնելով էթիլօքսոնիումի իոն։ Էթիլօքսոնիումի, որպես ուժեղ թթու, անջատում է պրոտոն, ինչը հավասարազոր է կատալիզատորի վերականգնման։ Ոչ սիմետրիկ ալկենների հիդրատացումը կատարվում է ըստ Մարկովնիկովի կանոնի։
Նուկլեաֆիլ միացման ռեակցիաների մեխանիզմը (AN)[խմբագրել | խմբագրել կոդը]
Մասնավոր դեպքում, երբ միացումը գնում է HX տիպի միացության և այնպիսի սուբստրատների միջև, որտեղ կրկնակի կապի հարևան դիրքում գտնվում է Z-էլեկտրաակցեպտոր բնույթի տեղակալիչ (Z=CHO,COR,ներառյալ խինոնները),նշված մեխանիզմներից գործում է երկրորդը։ Տեղի է ունենում նուկլեաֆիլ գրոհ, որի ընթացքում նա տրամադրում է իր զույգ էլեկտրոնները կրկնակի կապի առաջացմանը մասնակից ածխածնին։ Արդյունքում π-էլեկտրոնները տեղայնացվում են հաջորդ ածխածնի ատոմի վրա, առաջացնելով կարբանիոն։ Նշված մեխանիզմը պարզ էլեկտրաֆիլ միացման մեխանիզմից տարբերվուիմ է միայն նրանով, որ լիցքերի արժեքները հակառակն են։ Այդ մեխանիզմով են կատարվում, օրինակ,α,β-չհագեցած կարբոնիլային միացություններին HX տիպի մոլեկուլների միացումը՝ C=C կրկնակի կապի դիրքով։
Այսպիսով, ռեակցիաների ուղղությունը պայմանավորված է ինչպես ստատիկ գործոններով՝ էլեկտրոնային խտության բաշխումով մինչ ռեակցիան և տարածական գործոնով, այնպես էլ դինամիկ գործոններով՝ միջանկյալ կարբկատիոնների հարաբերական կայունությամբ։
Նուկլեաֆիլ միացման մեխանիզմով է տեղի ունենում կարբոնիլ խումբ պարունակող միացությունների (ալդեհիդների կամ կետոնների) փոխազդեցությունը HX կառուցվածքի մոլեկուլների հետ։
Տեղակալման ռեակցիաներ[խմբագրել | խմբագրել կոդը]
Նուկլեաֆիլ տեղակալման ռեակցիաներ (S)[խմբագրել | խմբագրել կոդը]
Նուկլեաֆիլ տեղակալման ռեակցիաներ են տալիս sp3 հիբրիդացված ածխածնի ատոմ պարունակող R-X ընդհանուր բանաձև ունեցող միացությունները։ Այս մեխանիզմով տեղի է ունենում ատոմի կամ ատոմական խմբի տեղակալում այլ ատոմով կամ ատոմական խմբով։ Ընդհանուր ձևով ռեակցիան կարելի է գրանցել այսպես՝
RX+Y-→RY+X-
որտեղ X--լավ հեռացող խումբ է,Y--նուկլեաֆիլ ռեագենտ։
Ռեակցիաներն ընթանում են այն դեպքում, երբ հեռացող խումբը ավելի կայուն է։ Նման ռեակցիաները կարող են ընթանալ մոնոմոլեկուլյար (երկու փուլով) և բիմոլեկուլյար (մեկ փուլով) մեխանիզմով, կախված R ռադիկալի կառուցվածքից, և ռեակցիայի արագության հավասարումը կարող է լինել երկու տեսակի։ Նման մեխանիզմներով են առաջանում սպիրտները, ալկիլհալոգենիդները։
Մոնոմոլեկուլային տեղակալման ռեակցիա.SN1[խմբագրել | խմբագրել կոդը]
Այս մեխանիզմով (մոնոմոլեկուլյար նուկլեաֆիլ տեղակալման մեխանիզմով(SN1) է ընթանում տեղակալումը երրորդային ալկիլհալոգենիդներում և սպիրտներում՝
V=K[R-X]
Օրինակ, երրորդային ալկիլքլորիդի փոխազդեցությունը Y- նուկլեաֆիլ ռեագենտի հետ։ Առաջին փուլում իոնացման հետևանքով առաջանում է կարբկատիոն, որը կայուն է, շնորհիվ ալկիլ խմբերի դրական ինդուկտիվ էֆեկտի (+J)։


Որպես կանոն, ռեակցիաներում առաջին փուլը ընթանում է դանդաղ և պայմանավորում ռեակցիայի ընդհանուր արագությունը։ Կարբկատիոնը ունի հարթ կառուցվածք, նուկլեաֆիլի (Y-) գրոհը կատարվում է հարթության երկու կողմից և խիրալ կենտրոնի առկայության դեպքում առաջանում է ռացեմատ։
Բիմոլեկուլային տեղակալման ռեակցիա.SN2[խմբագրել | խմբագրել կոդը]
Բիմոլեկուլային մեխանիզմով են ընթանում առաջնային, և որոշ երկրորդային ալկիլհալոգենիդների (ոչ ծավալուն տեղակալիչների դեպքում) ռեակցիաները։ Արագության բանաձևը ընդունում է հետևյալ տեսքը՝
V=K[R-X][Y-]
Ռեակցիայի մեխանիզմը կարելի է պատկերել հետևյալ կերպ՝
R-X+Y-→[Y...R...X]→Y-R+X-
Պրոցեսը ընթանում է մեկ փուլով, ակտիվ միջանկյալ կոմպլեքսի առաջացումով, որում R-X կապը մասնակիորեն խզվել է, իսկ R-Y-ը մասնակիորեն գոյացել։ Նուկլեաֆիլ ռեագենտի գրոհը կատարվում է թիկունքից (հակառակ կողմից)։ Ակտիվ կոմպլեքսը ունի հարթ կառուցվածք և նման մեխանիզմը կարող է գործել միայն առաջանային ալկիլային խմբերի համար, քանի որ հարթ ակտիվ կոմպլեքսում չեն կարող գտնվել մեծ ծավալի տեղակալիչներ։ Պարզվել է, որ SN2 տիպի ռեակցիաները կատարվում են կոնֆիգուրացիայի շրջումով։ Եթե միացություններում R-ը երկրորդային ալկիլ է, ապա կախված ալկիլ խմբերի չափսերից և լուծիչի բնույթից, ռեակցիան կարող է ընթանալ SN1 կամ SN2 մեխանիզմով։ Որքան մեծ է ալկիլ ռադիկալները.այնքան ավելի մեծ է SN1 մեխանիզմի հավանականությունը։
Այս եղանակներով է կատարվում ալկիլհալոգենիդներից սպիրտների առաջացումը։ Հիմնային միջավայրում տեղի է ունենում ալիֆատիկ միացությունների ալկիլացմանը մասնակցող (in vivo) S-ադենոզիլմեթիոնինի սինթեզը և այլն։ Իսկ երկու փուլով ընթացող ռեակցիաներից են եթերների առաջացումը ալկիլհալոգենիդների և սպիրտների փոխազդեցությունից, ամինների առաջացումը ալկիլհալոգենիդներից, կարբոնաթթուների էսթերացումը, նրանց հիդրոլիզը՝ (ալկոհոլիզմի և ամինոլիզի ճանապարհով)։
Ռադիկալային մեխանիզմով ընթացող տեղակալման ռեակցիաներ.SR[խմբագրել | խմբագրել կոդը]
Այս ռեակցիաները տեղի են ունենում, երբ հարձակվող ռեագենտը ռադիկալ է (R•)։ Օրինակ, մեթանի քլորացման ռեակցիան՝
Cl2→2Cl•
Cl•+CH4→CH3•+HCl
CH3•+Cl2→CH3Cl+Cl•
Նման մեխանիզմով է ընթանում չհագեցած ճարպաթթուների հիդրոպերօքսիդային օքսիդացումը (գերօքսիդացումը),որը օրգանիզմում կարևոր դեր ունի։
Էլեկտրաֆիլ տեղակալման ռեակցիաներ.SE[խմբագրել | խմբագրել կոդը]
Արոմատիկ միացությունները հակված չեն մասնակցելու միացման կամ օքսիդացման ռեակցիաների, որոնց դեպքում արոմատիկությունը կխանգարվեր։ Բենզոլի, պիրիդինի և այլ արոմատիկ միացությունների հոմոլոգները մեղմ պայմաններում օքսիդացնելիս (կալիումի պերմանգանատով հիմնային միջավայրում կամ կալիումի դիքրոմատով ծծմբական թթվում) օքսիդանում են միայն ածխաջրածնային ռադիկալները՝
Ar-CH3→Ar-COOH
Այս հատկության շնորհիվ դժվարալուծ տոքսիկ արոմատիկ միացությունները վերածվում են լուծելի հիդրոֆիլ միացությունների, որոնք լավ են հեռացվում օրգանիզմից։
Այս միացությունների համար բնորոշ են այնպիսի ռեակցիաներ, որոնք չեն խանգարում արոմատիկ համակարգը։ Այդպիսին են տեղակալման ռեակցիաները։ Այս ռեակցիաները բնորոշ են նաև արոմատիկ և արոմատիկությամբ օժտված հետերոցիկլիկ միացությունները։
Էլեկտրաֆիլ տեղակալման ռեակցիաների մեխանիզմը[խմբագրել | խմբագրել կոդը]
Արոմատիկ կամ հետերոցիկլիկ օղակի π-էլեկտրոնները փոխազդեցության մեջ են մտնում էլեկտրաֆիլ ռեագենտի հետ, առաջացնելով անկայուն π-կոմպլեքս, որը վեր է ածվում σ-կոմպլեքսի 6-π էլեկտրոններից երկուսը էլեկտրաֆիլ ռեագենտի հետ առաջացնում են սովորական կովալենտ կապ և σ-կոմպլեքսը զրկվում է արոմատիկ կառուցվածքից։ Օրինակ, բենզոլի σ-կոմպլեքսը բաղկացած է չորս էլեկտրոնային π-ամպից, որը ապատեղայնացված է հինգ ածխածինների միջև։6-րդ ածխածինը σ-կոմպլեքսի առաջացման հետևանքով անցնում է sp2-ից sp3 հիբրիդացման վիճակի և նրա մոտ գտնվող երկու տեղակալիչները գտնվում են մի հարթության վրա, որն ուղղահայաց է ցիկլի հարթությանը։ Ըստ ռեզոնանսի տեսության σ-կոմպլեքսը կարելի է պատկերել երեք կանոնիկ կառուցվածքների ձևով։

σ-կոմպլեքսը ձգտում է արոմատիկության վերականգնմանը և անջատելով պրոտոն (H+),վերածվում է կայուն տեղակալված միացության։
Տեղակալման կանոնը արոմատիկ օղակում[խմբագրել | խմբագրել կոդը]
Քննարկենք բենզոլի ցիկլում արդեն ներկա գտնվող տեղակալիչի ազդեցությունը ռեագենտի գրոհի ուղղության վրա (մուտք գործող տեղակալիչի դիրք ընտրելու վրա)։ Երբ բենզոլի օղակ մուտք է գործում երկրորդ տեղակալիչը, նա կարող է զբաղեցնել երեք դիրք՝ օրթո, մետա, պարա։ Յուրաքանչյուրի համար գոյություն ունեն կանոնիկ կառուցվածք։ Տեղակալիչի փոխազդեցությունը σ-կոմպլեքսի դրական լիցքի հետ պայմանավորում է տեղակալման դիրքը։
Արոմատիկ ցիկլում գտնվող տեղակալիչները (օրիենտանտները) բաժանվում են երկու խմբի՝ 1-ն կարգի և 2-րդ կարգի։
Առաջին կարգի տեղակալիչները էլեկտրադոնոր խմբերն են՝ ալկիլ ռադիկալները՝ -CH3,-C2H5 և -OH,-OR,-NH2 և այլն։

Ալկիլ ռադիկալների դեպքում Z-ը ավելի ցածր էլեկտրաբացասականություն ունեցող խումբն է, քան հարևան ածխածնի ատոմը, չունի ազատ էլեկտրոնային զույգ։Z-տեղակալիչը կայունացնում է կառուցվածքը էլեկտրոնների ինդուկտիվ տեղաշարժով դեպի հարևան ածխածնի ատոմը։

Հաջորդ տարբերակը, երբ Z-ն ունի ազատ էլեկտրոնային զույգ։ Այս դեպքում, անկախ Z-ի էլեկտրաբացասականությունից, առաջանում է մեզոմեր փոխազդեցություն։ Դրական մեզոմեր (+M) էֆեկտի դեպքում, կարբկատիոնը կարող է հանդես գալ լրացուցիչ ռեզոնանսային կամ կանոնիկ կառուցվածքներով, որտեղ մեծ է էլեկտրոնային խտությունը օ և պ դիրքերում, և, հետևաբար տեղակալումը կկատարվի օրթո և պարա դիրքերում։
Կանոնիկ կառուցվածքների թվի աճը նշանակում է միջանկյալ կարբկատիոնի առաջացման էներգիայի իջեցում, նվազում։ Նշված տարբերակներում մեծանում է էլեկտրոնային ամպի խտությունը օրթո (օ) և պարա (պ) դիրքերում և ներմուծվող էլեկտրաֆիլ տեղակալիչները զբաղեցնում են o և պ դիրքերը (օր.անիլինի, տոլուոլի հետ փոխազդելիս)։
Տոուոլի բրոմացման արդյունքում FeBr3 կատալիզատորի ներկայությամբ առաջանում են օրտո- և պարատեղակալված ածանցյալներ։

Տեղակալիչների կարգը և էլեկտրաֆիլ գրոհի դիրքը.
| Տեղակալիչ Z | կարգ | էլեկտրաֆիլ գրոհի դիրքը |
|---|---|---|
| Ալկիլ,CH3 | I | օրթո, պարա |
| -CH2Cl | I | օրթո, պարա |
| -CCl3 | II | մետա |
| Հալոգեններ | I | օրթո, պարա |
| -CH=CH2 | I | օրթո, պարա |
| -CHO | II | մետա |
| -COR | II | մետա |
| -COOH | II | մետա |
| -CONH2 | II | մետա |
| -NH2,-NHR,-NR2 | I | օրթո, պարա |
| -N+R3 | II | մետա |
| -NO2 | II | մետա |
| -OH | I | օրթո, պարա |
| -OR | I | օրթո, պարա |
| -SH | I | օրթո, պարա |
| -SR | I | օրթո, պարա |
| -SO3H | II | մետա |
Երկրորդ կարգի տեղակալիչները էլեկտրաակցեպտոր խմբեր են։ Էլեկտրոնների տեղաշարժը ածխածնի ատոմից դեպի տեղակալիչը բերում է դրական լիցքի աճի ածխածնի ատոմի վրա։
Նշված կանոնիկ կառուցվածքների ապակայունացումը դժվարացնում է ռեզոնանսային կարբկատիոնների առաջացումը։ Առավել շահավետ է մետա-տեղակալումը, որի դեպքում բացառվում է նման ապակայունացումը։ Երկրորդ կարգի օրիենտանտները կոչվում են մետա-օրիենտանտներ։
Նրանք իջեցնում են (աղքատացնում են) էլեկտրոնային ամպի խտությունը օ և պ դիրքերում և ներմուծվող տեղակալիչները ուղղում են մետա (մ) դիրքերը։ Օրինակ, բենզոաթթվի բրոմացման ժամանակ առաջանում են մ-բրոմբենզոաթթու (SE)։
Այս ռեակցիաների ընթացքը հուշում է մեզ, որ դրական լիցք ունեցող խմբերը (իոնները),օրինակ՝ կարբկատիոնները, հեշտությամբ մուտք կգործեն արոմատիկ համակարգ, այսինքն՝ հալոգենալկանները Լյուիսի թթուների ներկայությամբ (Ֆրիդել-Կրաֆտսի ռեակցիա),ալկենները և սպիրտները թթու միջավայրում լավ ալկիլացվող ագենտներ են։ Նույն մեխանիզմով է ընթանում տեղակալման ռեակցիան հետերոցիկլիկ միացություններում։ Օրինակ՝ պիրոլի սուլֆատացումը։
Էլիմինացման կամ պոկման ռեակցիաներ (E)[խմբագրել | խմբագրել կոդը]
Այս ռեակցիաների ընթացքում առաջանում են ալկեններ. տեղի է ունենում պարզ կապերի քայքայում և գոյանում են կրկնակի կապ՝ սպիրտների դեհիդրատացում, հալոգենածանցյալներից հալոգենաջրածնի անջատում, ամինաթթուներից ամոնիակի անջատում և այլն։ Սխեմատիկ կարելի է պատկերել։




Որտեղ X-ը՝ հալոգենի ատոմ, հիդրօքսիլ խումբ, ամինախումբ և այլն։
HX-ի էլիմինացումը կարող է կատարվել երեք հիմնական եղանակներով։
Առաջին երկու պրոցեսները ընթանում են փուլերով՝ առաջին փուլում առաջանում են կարբկանիոն, երկրորդ դեպքում՝ կարբկատիոն։
Առաջին տիպի էլիմինացումը հազվադեպ է հանդիպում.որպես օրինակ կարող է ծառայել ալդոլների դեհիդրատացումը հիմնային միջավայրում։
Երկրորդ դեպքում առաջացած կարբկատիոնը երկրորդ փուլում անջատում է պրոտոն։ Այս մեխանիզմը գործում է միայն այն դեպքերում, երբ պրոցեսը E1 և SN1 ռեակցիաների առաջին փուլում նույնանման է։ Դա է պատճառը, որ երրորդային հալոգենիդների նուկլեաֆիլ տեղակալման ժամանակ, քիչ քանակությամբ, որպես կողմնակի նյութեր, առաջանում են նաև ալկեններ։SN2 ռեակցիաների դեպքում նման երևույթ չի նկատվում։ Այսինքն, նուկլեաֆիլ տեղակալման և էլիմինացման ռեակցիաները կախված միջավայրից, մրցակից (կոնկուրենտ) ռեակցիաներին են և ընթանում են SN1 (հիմքի ջրային լուծույթում-I) և E1 ( հիմքի սպիրտային լուծույթով-II) մեխանիզմով։
R-Hal→R-OH+Hal (SN1) I տիպ
R-Hal→R-CH=CH2+HHal II տիպ
Սպիրտների դեհիդրատացման ունակությունը կախված է միջանկյալ կարբկատիոնի կայունությունից և նվազում է հետևյալ շարքում։
Երրորդային>երկրորդային>առաջնային
Օրինակ, նույն կատալիզատորի (ուժեղ թթվի H2SO4) ներկայությամբ էթիլ սպիրտի դեհիդրատացումը կատարվում է 200°С-ում, իսկ եռբութիլ սպիրտինը՝ 80°С-ում։
Երրորդ եղանակը՝ (գ)-սինխրոն (համաձայնեցված) մեխանիզմով էլիմինացումը (E2) տեղի է ունենում առաջնային և երկրորդային ալկիլհալոգենիդների մոտ և ավելի էֆեկտիվ է ընթանում, երբ C-H և C-X կապերը «անտիպերիպլանար» են, այսինքն գտնվում են մեկ հարթության մեջ, բայց ընդհանուր ածխածնային շղթայի հակառական կողմերում։
Անհրաժեշտ է նաև նշել, որ էլիմինացման ռեակցիաներում միծտ առաջանում է ավելի տեղակալված ալկեն։
Բերված օրինակում տեղի է ունենում β-ջրածնի ատոմի անջատումը և ավելի տեղակալված ալկենի առաջացում (Զայցևի կանոն)։
Օրգանիզմում ընթացող կատալիտիկ (ֆերմենտատիվ) ռեակցիաների հիմքում ընկած են վերը քննարկված մեխանիզմները։
Տես նաև[խմբագրել | խմբագրել կոդը]
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- Հայկական Հանրագիտարան Արխիվացված 2016-03-14 Wayback Machine
Գրականություն[խմբագրել | խմբագրել կոդը]
- Менделеев Д. И. Периодический закон: В 3 т. на сайте Руниверс
- Некрасов Б. В. Основы общей химии, т. 1. — М.։ «Химия», 1973
- Химическая энциклопедия, п. ред. Кнунянц И. Л., т. 5. — М.։ «Советская энциклопедия», 1988
- Химия։ Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.։ Пер. с нем. — М.։ Химия, 1989
- Бендер М., Бергерон Р., Комияма М. Биоорганическая химия ферментативного катализа. Пер. с англ. — М.: Мир, 1987. — 352 с.
- Дюга Г., Пенни К. Биоорганическая химия. — М.։ Мир, 1983.
- Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия. — М.: Медицина, 1991.
- MIT.edu, OpenCourseWare։ Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Organic-Chemistry.org, Organic Chemistry Portal - Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ Философия науки под ред. А. И. Липкина М.: Эксмо, 2007
- ↑ Manfred T. Reetz: Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future, J. Am. Chem. Soc. 135 (2013) S. 12480−12496.
- ↑ 3,0 3,1 J. Clayden, N. Greeves & S. Warren "Organic Chemistry" (Oxford University Press, 2012), pp. 1-15.
- ↑ D. M. Kiefer "Organic Chemicals' Mauve Beginning" Chem. Eng. News Archive, 1993, vol.71, pp 22–23.
- ↑ C. Elschenbroich "Organometallics," 3rd Ed., (Wiley-VCH, 2006).
- ↑ Robert T. Morrison, Robert N. Boyd, and Robert K. Boyd, Organic Chemistry, 6th edition, Benjamin Cummings, 1992.
- ↑ Roberts, L. The Telegraph History of Aspirin Retrieved 1 december 2012 from http://www.telegraph.co.uk/health/healthnews/8184625/History-of-aspirin.html Արխիվացված 2014-10-08 Wayback Machine
- ↑ Elmar Steingruber "Indigo and Indigo Colorants" Ullmann's Encyclopedia of Industrial Chemistry 2004, Wiley-VCH, Weinheim.