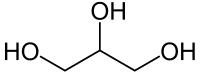
Գլիցերին
| Գլիցերին | |
|---|---|
 | |
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | պրոպանտրիոլ-1,2,3 |
| Ավանդական անվանում | գլիցերին |
| Քիմիական բանաձև | C₃H₈O₃ |
| Ռացիոնալ բանաձև | C3H5(OH)3 |
| Մոլային զանգված | 1,5E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,26 ± 0,01 գ/սմ³[2] գ/սմ³ |
| Հալման ջերմաստիճան | 64 ± 1 ℉[2], 18,1 °C[3], 18 °C[4] և 18,2 °C[5] °C |
| Կազմալուծման ջերմաստիճան | 554 ± 1 ℉[2] |
| Եռման ջերմաստիճան | 290 °C[5] °C |
| Այրման ջերմաստիճան | 320 ± 1 ℉[2] և 160 °C |
| Գոլորշու ճնշում | 0,003 ± 0,001 mm Hg[2] |
| Քիմիական հատկություններ | |
| Օպտիկական հատկություններ | |
| Բեկման ցուցիչ | 1,4729 |
| Դասակարգում | |
| CAS համար | 56-81-5 |
| PubChem | 753 |
| EINECS համար | 200-289-5 |
| SMILES | C(C(CO)O)O |
| ЕС | 200-289-5 |
| RTECS | MA8050000 |
| ChEBI | 733 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Գլիցերին, (1,2,3-տրիօքսիպրոպան, պրոպանտրիոլ-1,2,3), եռատոմ սպիրտների պարզ ներկայացուցիչ[6]։ Իրենից ներկայացնում է մածուցիկ, թափանցիկ հեղուկ[7]։
Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Գլիցերինը անգույն, մածուցիկ, շատ հիգրոսկոպիկ հեղուկ է[8]։ Ունի քաղցր համ, այստեղից էլ ստացել է իր անվանումը(գլիկոս-քաղցր)[9]։
Քիմիական հատկություններ[խմբագրել | խմբագրել կոդը]
Գլիցերինը ունի տիպիկ բազմատոմ սպիրտներին բնորոշ քիմիական հատկություններ[10]։ Գլիցերինի փոխազդեցությունը հալոգենաջրածինների կամ ֆոսֆորի հալոգենիդների հետ ընթանում է մոնո- և դիհալոգենացմամաբ[11]։ Գլիցերինը փոխազդում է կարբոնաթթուների և հանքային թթուների հետ[12]։ Օրինակ ազոտական թթվի հետ փոխազդելիս, գլիցերինն առաջացնում է եռնիտրատ-նիտրոգլիցերին(ստացել է Ասկանյո Սոբրերոն, 1847 թվականին), օգտագործվում է մեր ժամանակներում անծուխ վառոդ ստանալու նպատակով։ Գլիցերինը դեհիդրատացնելիս այն վեր է ածվում թունավոր ակրոլեինի[13][14].
- HOCH2-CH(OH)-CH2OH H2C=CH-CHO + 2 H2O
Այն օքսիդանում է մինչև գլիցերինային ալդեհիդ CH2OHCHOHCHO, դիհիդրօքսիացետոն CH2OHCOCH2OH կամ գլիցերինաթթու CH2OHCHOHCOOH։ Գլիցերինի և բարձրագույն կարբոնաթթուների եթերները՝ ճարպերը հանդիսանում են շատ կարևոր միացություններ մարդու համար, կարևոր կենսաբանական դեր են խաղում նաև ֆոսֆոլիպիդները[15]։
Ստացում[խմբագրել | խմբագրել կոդը]
Գլիցերին առաջին անգամ ստացել է Շելեն 1779 թվականին, ճարպերի օճառացմամբ[16]։ Գլիցերինի հիմնական մասը ստանում են ճարպերի օճառացումից[17]։ Գլիցերինի ստացման սինթետիկ եղանակների հիմնական մասը հիմնված է պրոպիլենի օգտագործման վրա[18]։ 450-500 °C ջերմաստիճաններում պրոպիլենի քլորացումից ստանում են ալիլքլորիդ, HClO-ի հետ միանալիս առաջանում են քլորհիդրիններ, օրինակ՝ CH2ClCHOHCH2Cl, որը ալկալիով մշակելիս առաջանում է գլիցերին[19]։ Գլիցերին կարելի է ստանալ նաև օսլայի հիդրոլիզի միջոցով, առաջացած մոնոսախարիդների հիդրատացմամբ կամ շաքարների սպիրտային խմորումից[20][21]։

Գլիցերինի ածանցյալներ[խմբագրել | խմբագրել կոդը]
Գլիցերիդներ[խմբագրել | խմբագրել կոդը]
Եռգլիցերիդները հանդիսանում են գլիցերինի ածանցյալներ[22]։ Եռգլիցերիդները հանդիսանում են կարևոր բաղադրիչ՝ կենդանի օրգանիզմներում նյութափոխանակության գործընթացներում[23][24]։
Ճարպեր և յուղեր[խմբագրել | խմբագրել կոդը]
Ճարպերը և յուղերը հիդրոֆոբ միացություններ են, ջրում անլուծելի, այնպես ինչպես գլիցերինի մոլեկուլում հիդրօքսիլ խմբերը փոխարինված են ճարպաթթուների մնացորդներով[25][26]։
Կիրառություն[խմբագրել | խմբագրել կոդը]
Գլիցերինի կիրառության ոլորտները շատ բազմազան են։ Օգտագործվում է սննդային հավելանյութերում, լվացող և կոսմետիկ միջոցներում, պլաստմասսաների արտադրությունում, ներկանյութերի արտադրությունում, էլեկտրատեխնիկայում, ռադիոտեխնիկայում և այլն։ Համարակալված է որպես սննդային հավելում[27][28]։ Գլիցերինը օգտագործվում է նաև դինամիտի ստացման համար։
Կայքեր[խմբագրել | խմբագրել կոդը]
Ռուսերեն և անգլերեն լեզուներով.
Անգլերեն լեզվով.
- What is Glycerin?
- Glossary for the Modern Soap Maker Արխիվացված 2004-02-01 Wayback Machine
- Glycerol soap Արխիվացված 2009-02-21 Wayback Machine
- Absolute alcohol using glycerol
- Computational Chemistry Wiki Արխիվացված 2007-02-10 Wayback Machine
- Health.gov dietary guidelines Արխիվացված 2007-10-10 Wayback Machine
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 glycerol
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 http://www.cdc.gov/niosh/npg/npgd0302.html
- ↑ 3,0 3,1 CRC Handbook of Chemistry and Physics 88TH Edition 2007-2008. / David R. Lide, Jr. — Boca Raton: CRC Press, 2007. — P. 3—268.
- ↑ 4,0 4,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ 5,0 5,1 5,2 5,3 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Datta, Rasek Lal (1914). «The Preparation of Allyl Iodide». Journal of the American Chemical Society. 36 (5): 1005–1007. doi:10.1021/ja02182a023.
- ↑ Johnson, Duane T.; Taconi, Katherine A. (2007). «The glycerin glut: Options for the value-added conversion of crude glycerol resulting from biodiesel production». Environmental Progress. 26 (4): 338. doi:10.1002/ep.10225.
- ↑ «Dow achieves another major milestone in its quest for sustainable chemistries» (Press release). Dow Chemical Company. 2007 թ․ մարտի 15.
- ↑ Christoph, Ralf; Schmidt, Bernd; Steinberner, Udo; Dilla, Wolfgang; Karinen, Reetta (2006). «Glycerol». Ullmann's Encyclopedia of Industrial Chemistry. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_477.pub2. ISBN 3527306730.
- ↑ Sims, Bryan (2011 թ․ հոկտեմբերի 25). «Clearing the Way for Byproduct Quality: Why quality for glycerin is just as important for biodiesel». Biodiesel Magazine.
- ↑ Yazdani, S. S. and Gonzalez, R. (2007). «Anaerobic fermentation of glycerol: a path to economic viability for the biofuels industry». Current Opinion in Biotechnology. 18 (3): 213–219. doi:10.1016/j.copbio.2007.05.002. PMID 17532205.
{{cite journal}}: Unknown parameter|laysource=ignored (օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Yu, Bin (2014). «Glycerol». Synlett. 25 (4): 601. doi:10.1055/s-0033-1340636.
- ↑ Walt Bogdanich (2007 թ․ մայիսի 6). «From China to Panama, a Trail of Poisoned Medicine». New York Times. Վերցված է 2007 թ․ մայիսի 8-ին.
- ↑ «10 Biggest Medical Scandals in History». 2013 թ․ փետրվարի 20.
- ↑ Stevens, Alan. «Preserving flowers and decorative foliages with glycerin and dye» (PDF). Արխիվացված է օրիգինալից (PDF) 2020 թ․ մարտի 24-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ Nikolov, Ivan. «Functional Food Design Rules».
- ↑ «Chemicals in Film». Արխիվացված է օրիգինալից 2015 թ․ սեպտեմբերի 29-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ «Glycerin Enema». Drugs.com. Վերցված է 2012 թ․ նոյեմբերի 17-ին.
- ↑ «Glycerin (Oral Route)». Mayo Foundation for Medical Education and Research. Վերցված է 2012 թ․ նոյեմբերի 17-ին.
- ↑ Long, Walter S. (հունվարի 14, 1916 – 13 January 1917). «The Composition of Commercial Fruit Extracts». Transactions of the Kansas Academy of Science. 28: 157–161. doi:10.2307/3624347. JSTOR 3624347.
- ↑ Does Alcohol Belong In Herbal Tinctures? Արխիվացված 2007-10-12 Wayback Machine newhope.com
- ↑ Leffingwell, Georgia and Lesser, Miton (1945) GLYCERIN – Its Industrial and Commercial Applications. Chemical Publishing Co., Inc., Brooklyn, NY.
- ↑ Lawrie, James W. (1928) GLYCEROL AND THE GLYCOLS – Production, Properties and Analysis. The Chemical Catalog Company, Inc., New York, NY.
- ↑ The Manufacture of GLYCEROL – Vol. III (1956). The Technical Press, LTD., London, UK.
- ↑ Hudgens, R. Douglas; Hercamp, Richard D.; Francis, Jaime; Nyman, Dan A.; Bartoli, Yolanda (2007). «An Evaluation of Glycerin (Glycerol) as a Heavy Duty Engine Antifreeze/Coolant Base». doi:10.4271/2007-01-4000.
{{cite journal}}: Cite journal requires|journal=(օգնություն) - ↑ Proposed ASTM Engine Coolant Standards Focus on Glycerin Արխիվացված 2012-11-20 Wayback Machine. Astmnewsroom.org. Retrieved on 15 August 2012.
- ↑ E422
- ↑ Formula E uses pollution-free glycerine to charge cars. fiaformulae.com. 13 September 2014
| ||||||||||||||||||||||||||||||
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Գլիցերին» հոդվածին։ |
| ||||||||||||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 3, էջ 95)։ |

