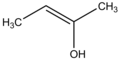
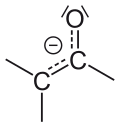
Ենոլներ
Ենոլներ (ալկենոլներ, α-հիդրօքսիալկեններ), R1R²C=CR³OH ընդհանուր քիմիական բանաձևով, կրկնակի կապի ածխածնի ատոմներից մեկին միացած հիդրօքսիլ խումբ պարունակող ալկեններ։ Ենոլ և ալկենոլ բառերը ծագում են "ալկեն" (կամ պարզապես -են) և "ալկոհոլ" բառերից։
Կրկնակի կապի երկու ծայրային ածխածնի ատոմներին հիդրօքիսիլ խմբեր միացած միացությունները կոչվում են ենդիոլներ։ Ենոլների դեպրոտոնացված մոլեկուլները կոչվում են ենոլյատներ։ Ռեդուկտոններ են կոչվում այն միացությունները, որոնք ունեն ենդիոլային կառուցվածք և պարունակում են կրկնակի կապին միացած կարբոնիլային խումբ։
Կետո-ենոլային տաուտոմերիա[խմբագրել | խմբագրել կոդը]

աջ մասում ենոլ ձևն է
Ենոլները փոխարկվում են α-ջրածնի ատոմ պարունակող կարբոնիլային միացությունների (կետոններ, ալդեհիդներ)։ Վերջանյութը մի կողմից ենթարկված է դեպրոտոնացման, իսկ մյուս կողմից՝ պրոտոնացման։ Տաուտոմերիայի այս տեսակը կոչվում է կետո-ենոլային տաուտոմերիա։
Ենոլային ձևը սովորաբար անկայուն է և շատ արագ վեր է ածվում կետոնի։ Պատճառը այն է, որ թթվածինը ավելի էլեկտրաբացասական է, քան ածխածինը։
Բազմակարբոնիլային միացություների տուտոմերիա[խմբագրել | խմբագրել կոդը]
1,3-դիկարբոնիլային և 1,3,5-տրիկարբոնիլային միացություններում (մոնո-) ենոլային ձևը գերակշռում է։ Սրա պատճառը առաջացող ներմոլեկուլային ջրածնային կապերն են[1]։

Հավասարակշռության պահին մալոնդիալդեհիդի (OHCCH2CHO) ավելի քան 99% գտնվում է մոնո-ենոլի ձևով։ Այդ տոկոսը ավելի փոքր է 1,3-ալդեհիդ կետոնների և դիկետոնների համար (ացետիլացետոն։

Ենոլյատներ[խմբագրել | խմբագրել կոդը]
Կետո-ենոլային տաուտոմերիայի ժամանակ տեղի է ունենում կետոնի կամ ենոլի դեպրոտոնացում, որի ժամանակ առաջանում է ենոլյատ[2]։
| Կետո-ենոլային տաուտոմերիա | |||||
|---|---|---|---|---|---|

|

|

| |||
| Կետո և ենոլ ձևի միջև փոխակերպում, α-C-ատոմի դեպրոտոնացում | Ենոլյատ անիոն | Ենոլյատի և ենոլի միջև փոխակերպում, ենոլյատի պրոտոնացում | |||

Ապատեղայնացում[խմբագրել | խմբագրել կոդը]
Վալենտային կապերի տեսությունում այս երևույթը բացատրված է ռեզոնանսի երևույթով։

Մոլեկուլային օրբիտալների տեսությունում այս հանգամանքը բացատրված է երեք ապատեղայնացված մոլեկուլային օրբիտալներով, որոնցից երկուսը զբաղված են։

Սելեկտիվ դեպրոտոնացում ենոլյատի առաջացման ժամանակ[խմբագրել | խմբագրել կոդը]
α-ջրածնի ատոմ պարունակող կետոններում հնարավոր է դեպրոտոնացման երկու տարբեր եղանակ։ Ցածր ջերմաստիճաններում (-78 °C), ապրոտոնային լուծիչներում և խոշոր չհավասարակշռող հեղուկ հիմքերում (ԼԴԱ) "կինետիկական" պրոտոնը կարող է հեռացվել։ "Կինետիկական" պրոտոնը այն պրոտոնն է, որը տարածական տեսանկյունից ամենահասանելին է։

Ենդիոլներ[խմբագրել | խմբագրել կոդը]
Կրկնակի կապի երկու ածխածնի ատոմներին հիդրօքիսիլ խմբեր միացած միացությունները կոչվում են ենդիոլներ։ Ենդիոլները հանդիսանում են ալդոզներից կետոզների ստացման միջանկյալ նյութ (ինտերմեդիատ)։

կենտրոնում ենդիոլն է, իսկ ձախ և աջ մասերում ացիլոինների իզոմերները
Ռեդուկտոններ[խմբագրել | խմբագրել կոդը]
Ռեդուկտոններ են կոչվում այն միացությունները, որոնք ունեն ենդիոլային կառուցվածք և պարունակում են կրկնակի կապին միացած կարբոնիլային խումբ։ Ենդիոլային կառուցվածքը ստաբիլանում է ի հաշիվ ռեզոնանսի, որն առաջանում է կարբոնիլային խմբի հետ տաուտոմերիայից։ Այդ պատճառով հավասարակշռության պահին գերակշռում է ենդիոլային կառուցվածքը, այլ ոչ թե կետոնայինը։ Ռեդուկտոնները ուժեղ վերականգնիչ միացություններ են (հակաօքսիդանտներ) և ուժեղ թթուներ։ Նման ռեդուկտոնների օրինակներ են տարտրոնալդեհիդը, ռեդուկտաթթուն և ասկորբինաթթուն։
| Ռեդուկտոնների օրինակներ | ||
|---|---|---|
 |
 |

|
| տարտրոնալդեհիդ | ռեդուկտաթթու | ասկորբինաթթու (Վիտամին C) |
Տես նաև[խմբագրել | խմբագրել կոդը]
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ W. Caminati, J.-U. Grabow (2006). «The C2v Structure of Enolic Acetylacetone». Journal of the American Chemical Society. 128 (3): 854–857. doi:10.1021/ja055333g. PMID 16417375.
- ↑ Chemistry of Enolates and Enols - Acidity of alpha-hydrogens(անգլ.)