Կորիզային ընկալիչներ

Կորիզային ընկալիչներ, մոլեկուլային կենսաբանությունում` սպիտակուցային բնույթի ընկալիչների տեսակ, որոնք ընկալունակ են ստերոիդային, վահանագեղձի յոդ պարունակող հորմոնների, ինչպես նաև մի շարք այլ մոլեկուլների նկատմամբ։
Կորիզային ընկալիչները տրանսկրիպցիայի գործոններ են, քանի որ կարող են անմիջականորեն միանալ ԴՆԹ-ին և այլ սպիտակուցների հետ կարգավորել գեների էքսպրեսիան[2][3]։ Կորիզային ընկալիչներով գենի էքսպրեսիան սովորաբար կատարվում է այն դեպքում, երբ լիգանդը միանում է ընկալչին։ Սրա արդյունքում ընկալիչը ձևափոխվում է (կոնֆորմացվում) և ակտիվանում, որից հետո` հարուցում գենի էքսպրեսիա[4]։ Այս հատկության շնորհիվ կորիզային ընկալիչները կարգավորում են օրգանիզմի զարգացումը, հոմեոստազն ու նյութափոխանակությունը։
Կորիզային ընկալիչները ընկալիչների մյուս տեսակներից տարբերվում են միայն մեկ հատկությամբ՝ կարողանում են անմիջապես կապվել և կարգավորել ԴՆԹ-ի էքսպրեսիան: Որպես արդյունք, կորիզային ընկալիչները կարևոր նշանակություն ունեն սաղմնային զարգացման և հետծննդյան շրջանում հոմեոստազի կարգավորման համար։
Սրանք դասակարգվում են ըստ ազդման մեխանիզմի և բնույթի[5][6][7][8]։
Տարածվածություն[խմբագրել | խմբագրել կոդը]
Կորիզային ընկալիչները բնորոշ են միայն կենդանական բջիջներին և չեն հանդիպում բույսերի, սնկերի, ջրիմուռների և նախակենդանիների մոտ[9]։ Երկու տեսակի ընկալիչներ հայտնաբերվել են Amphimedon queenslandica սպունգի, երկուսը՝ Mnemiopsis leidyi սանրակրի[10] չորսը՝ Trichoplax adhaerens-ի և 17-ը՝ Nematostella vectensis աղեխորշավորների մոտ[11]։ C. elegans նեմատոդի մոտ կա 270 կորիզային ընկալիչ[12]։ Մարդիկ, մկներն ու առնետներն ունեն համապատասխանաբար 48, 49 և 47 տեսակի ընկալիչներ[13]։
Լիգանդներ[խմբագրել | խմբագրել կոդը]

Լիգանդներն այն նյութերն են, որոնք միանում են և ակտիվացնում ընկալիչներին։ Լիգանդները ճարպալույծ հորմոններ են, վիտամիններ (A, D), քսենոբիոտիկներ։ Քանի որ գեների մեծամասնության էքսպրեսիան կարգավորվում է կորիզային ընկալիչների կողմից, վերջիններիս ակտիվացնող լիգանդները կարող են խորը ազդեցություն թողնել օրգանիզմի վրա։
Այս գեներից շատերը կապված են տարբեր հիվանդությունների առաջացման հետ, որն էլ բացատրում է, թե ինչու ԱՄՆ Սննդի և դեղամիջոցների վերահսկման դեպարտամենտի կողմից հաստատված դեղամիջոցների շուրջ 13 %-ը կորիզային ընկալիչներ են[14]։
Կորիզային ընկալիչներից որոշները «որբ ընկալիչներ» են[15][16], քանի որ սրանց ներսածին (էնդոգեն) լիգանդները դեռևս անհայտ են։ Այս ընկալիչներից որոշները (FXR, LXR, և PPAR) կապում են նյութափոխանակային տարբեր միջանկյալ նյութեր՝ ճարպաթթուներ, լեղաթթուններ և այլն։ Հետևաբար, այս ընկալիչները կարող են գործել որպես նյութափոխանակային սենսորներ։ Կորիզային այլ ընկալիչներ (CAR և PXR) գործում են որպես քսենոբիոտիկների սենսորներ՝ կարգավորելով ցիտոքրոմ P450 ֆերմենտի էքսպրեսիան, որը փոփոխում է այս քսենոբիոտիկներին[17]։
Կառուցվածք[խմբագրել | խմբագրել կոդը]
Կորիզային ընկալիչների մեծ մասի մոլեկուլային զանգվածը տատանվում է 50,000-100,000 դալտոնի սահմաններում։
Սրանք կազմված են կառուցվածքային հետևյալ դոմեններից.[18][19]
- (A-B) N-ծայրային կարգավորիչ դոմեն - պարունակում է ակտիվացնող ֆունկցիա 1 (AF-1), որի գործունեությունը կախված չէ լիգանդի առկայությունից[20]։ AF-1-ի տրանսկրիպցիա առաջացնելու ընդունակությունը շատ թույլ է, սակայն E դոմենում գտնվող AF-2-ի հետ մասնակցում է գեների էքսպրեսիային։ A-B դոմենը խիստ տարբեր է տարբեր ընկալիչներում։
- (C) ԴՆԹ կապող դոմեն (DBD) - պարունակում է երկու ցինկային մատ, որոնք կապում են ԴՆԹ-ի յուրահատուկ հորմոնային պատասխանի տարրերին (hormone response elements - HRE)։
- (D) Առանցքային շրջան - շարժուն դոմեն է, կապում է ԴՆԹ և լիգանդ կապող դոմեններն իրար հետ։
- (E) Լիգանդ կապող դոմեն (LBD) - ունի կայուն կառուցվածք։ Չորրորդային կառուցվածքը կազմված է երեք հակազուգահեռ ալֆա պարույրներից, որոնց մի կողմից սահմանակցվում են երկու, իսկ մյուս կողմից՝ երեք այլ ալֆա պարույրներ։ Լիգանդ կապող ճեղքը դոմենի ներսի կողմում է՝ հակազուգահեռ 3 ալֆա պարույրներից ներքև։ Լիգանդ կապող դոմենը պարունակում է նաև ակտիվացնող ֆունկցիա 2 (AF-2), որի գործունեությունը կախված է լիգանդի առկայությունից[20]։
- (F) C-ծայրային դոմեն - տարբեր ընկալիչներում ունի տարբեր հաջորդականություն։
N-ծայրը (A/B), ԴՆԹ կապող (C) և լիգանդ կապող (E) դոմենները բավականին կայուն են և անկախ միմյանցից, մինչդեռ D և, մասնակիորեն, C ծայրային դոմենները բավականին փոփոխական են[21]։ Դոմենների ուղղվածությունը խիստ տարբեր է[1][22][23]։
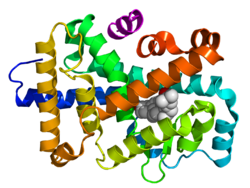
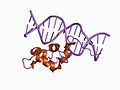
 Վերևում` Կորիզային ընկալչի ամինաթթվային հաջորդականությունը Ներքևում` ԴՆԹ-ին կպած ԴՆԹ կապող դոմենի 3D կառուցվածքը և հորմոնին միացված լիգանդ կապող դոմենը: Գծապատկերն արված է էստրոգենի ընկալչի օրինակով |
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Գործունեության մեխանիզմ[խմբագրել | խմբագրել կոդը]


Կորիզային ընկալիչները բազմաֆունկցիոնալ սպիտակուցներ են։ Կախված ազդման մեխանիզմից և լիգանդի բացակայության դեպքում նրանց դիրքից, ընկալիչները բաժանվում են երկու խմբի։
Փոքր չափսերի ճարպալույծ մոլեկուլներն անցնում են բջջաթաղանթով և կապվում ցիտոզոլում (I տիպի ընկալիչ) կամ կորիզում (II տիպի ընկալիչ) տեղակայված ընկալիչներին։ Միանալուց ընկալիչը ձևափոխվում է և կախված ընկալչի տիպից, կասկադային մեխանիզմով գործի են դրվում են մի շարք գործընթացներ, որոնք վերջում առաջցնում են գեների էքսպրեսիա։ Կորիզային ընկալիչների ևս երկու տեսակ կա. III տիպը նման է I տիպին, իսկ IV տիպը միացած է լինում ԴՆԹ-ին[5][6]։
I տիպի ընկալիչ[խմբագրել | խմբագրել կոդը]
Այս ընկալիչները տեղակայված են ցիտոզոլում։ Երբ լիգանդը միանում է ընկալչին, ջերմային շոկի սպիտակուցն[26][27] անջատվում է, սպիտակուցը՝ հոմոդիմերացվում, ընկալիչը տեղափոխվում է ցիտոզոլից կորիզ և կապվում ԴՆԹ-ի հատուկ տեղամասի հետ, որը հայտնի է հորմոնային պատասխանի տարր անվամբ[28][29]։ I տիպի կորիզային ընկալիչների ենթատիպ 3-ի ներկայացուցիչներն են անդրոգենային, էստրոգենային, գլյուկոկորտիկոիդային և պրոգեստերոնային ընկալիչները[30][31][32]։
Նշվում է, որ կորիզային ընկալիչների ենթատիպ 2-ի որոշ ընկալիչներ հորմոնային պատասխանի տարրերի շրջված կրկնությունների փոխարեն կարող են կապվել ուղիղ կրկնություններին:
Կան նաև կորիզային «որբ ընկալիչներ»[33]։
Կորիզային ընկալչի և ԴՆԹ-ի համալիրն ակտիվացնում է գենի որոշակի հատված։ Սրա վերջնական արդյունքում ձևավորված ի-ՌՆԹ-ի օժանդակությամբ սինթեզվում են այն սպիտակուցները, որոնք պատասխանատու են բջջում կատարվող գործընթացների փոփոխման համար։
II տիպի ընկալիչ[խմբագրել | խմբագրել կոդը]
II տիպի ընկալիչներն, ի տարբերություն I տիպի, անկախ լիգանդի առկայությունից, տեղակայված են կորիզում։ Բացի այդ, ԴՆԹ-ի հետ այս ընկալիչները կապվում են որպես հետերոդիմերներ (սովորոբար՝ RXR-ի հետ)։ Լիգանդի բացակայության դեպքում II տիպի կորիզային ընկալիչները հիմնականում միացված են ճնշող (կոռեպրեսոր) սպիտակուցներին, որոնք ճնշում են գեների էքսպրեսիան։ Լիգանդի միացման դեպքում ճնշող սպիտակուցները տրոհվում են, իսկ դրանց փոխարենն առաջանում են կոակտիվացնող սպիտակուցները։ Այլ սպիտակուցները, ներառյալ ՌՆԹ պոլիմերազը, նպաստում են ի-ՌՆԹ-ի առաջացմանը, որի վերջնական արդյունքը սպիտակուցների սինթեզն է։
II տիպի կորիզային ընկալիչներն ունեն 1 ենթաընտանիք, որը ներառում է ռետինաթթվի ընկալիչը, ռետինոիդային X ընկալիչն ու թիրոիդային հորմոնների ընկալիչը[34]։
III տիպի ընկալիչ[խմբագրել | խմբագրել կոդը]
III տիպի կորիզային ընկալիչները նման են I տիպի ընկալիչներին, և երկուսն էլ կապվում են ԴՆԹ-ին՝ հոմոդիմերների տեսքով։ Սակայն III տիպի ընկալիչներն, ի տարբերություն I տիպի ընկալիչների, կապվում են ուղիղ կրկնություններին:
IV տիպի ընկալիչ[խմբագրել | խմբագրել կոդը]
IV տիպի կորիզային ընկալիչները կապվում են թե որպես մոնոմերներ, թե որպես դիմերներ, սակայն հորմոնային պատասխանի տարրի մեկ կեսին ընկալչի ԴՆԹ կապող մեկ դոմենն է միայն կապվում։
Կոկարգավորիչ (կոռեգուլյատոր) սպիտակուցներ[խմբագրել | խմբագրել կոդը]
Հորմոնային պատասխանի տարրին միացված կորիզային ընկալիչները հավաքագրում են այլ սպիտակուցներ (սրանք կոչվում են տրանսկրիպցիայի կոկարգավորիչներ), որոնք խթանում են կամ ճնշում համապատասխան թիրախային գենի տրանսկրիպցիան մՌՆԹ-ի վրա[35][36]։ Այս կոկարգավորիչներն ունեն տարբեր ֆունկցիաներ։ Օրինակ, քրոմատինի վերամոդելավորում (թիրախային գենը տրանսկրիպցիայի համար դառնում է շատ թե քիչ հասանելի), կամ այլ կոակտիվատոր սպիտակուցների միացման կայունացում։ Կորիզային ընկալիչները կարող են կապել կոկարգավորիչ սպիտակուցների կոնկրետ քանակ և ուղղակիորեն կամ անուղղակիորեն ազդել տրանսդուկցիայի բջջային մեխանիզմների վրա[37]։
Կոակտիվատորներ[խմբագրել | խմբագրել կոդը]
Ագոնիստ լիգանդի և կորիզային ընկալչի միացման արդյունքում ընկալիչը ձևափոխվում է և միանում կոակտիվացնող սպիտակուցներին[38]։ Այս սպիտակուցները հաճախ ունեն ներքին հիստոն ացետիլտրանսֆերազ, որը թուլացնում է հիստոնների կապը ԴՆԹ-ի հետ և դրանով նպաստում գենի տրանսկրիպցիային[39][40]։
Ճնշողներ (կոռեպրեսորներ)[խմբագրել | խմբագրել կոդը]
Անտագոնիստ լիգանդների միացումը կորիզային ընկալիչներին հարուցում է ընկալչի այնպիսի ձևափոխում, որի արդյունքում այն միանում է ճնշող (կոռեպրեսոր) սպիտակուցին։ Այս սպիտակուցներն, իրենց հերթին, հավաքագրում են հիստոն դեացետիլազներին, որոնք էլ ամրացնում են հիստոնների կապը ԴՆԹ-ի հետ և ճնշում գենի տրանսկրիպցիան։
Ագոնիստներ և անտագոնիստներ[խմբագրել | խմբագրել կոդը]

Ագոնիստներ[խմբագրել | խմբագրել կոդը]
Ագոնիստներ են այն կողմնակի նյութերը, որոնք ազդելով ընկալիչների վրա, թողնում են նույն ազդեցությունը, ինչ ընկալիչների բնական լիգանդները։ Ներսածին լիգանդների (էստրոդիոլ, տեստոստերոն և այլն) ակտիվությունը, երբ նրանք կապված են ընկալիչներին, կարգավորում է գեների էքսպրեսիան։ Լիգանդով գենի էքսպրեսիայի խթանումը կոչվում է ագոնիստի պատասխան: Ներսածին (բնական) լիգանդներից բացի կորիզային ընկալիչները կարող են ակտիվանալ նաև որոշ սինթետիկ լիգանդներով։ Օրինակ, գլյուկոկորտիկոիդային ընկալիչը կարող է ակտիվանալ հակաբորբոքային դեղամիջոց դեքսամեթազոնով։
Անտագոնիստներ[խմբագրել | խմբագրել կոդը]
Կան սինթետիկ լիգանդներ, որոնք շրջափակում են բնական լիգանդների կամ ագոնիստների ազդեցությունը, քանի որ մրցակցային ձևով կապվում են ընկալիչների այն տեղամասերին, որոնց պետք է միանան ակտիվացնող լիգանդները։ Նման լիգանդները համարվում են անտագոնիստներ։ Օրինակ՝ միֆեպրիստոն դեղը, որը կապվում է գլյուկոկորտիկոիդային և պրոգեստերոնային ընկալիչներին, շրջափակում է համապատասխանաբար կորտիզոլ և պրոգեստերոն հորմոնների ազդեցությունը։ Անտագոնիստ լիգանդների ազդեցությամբ ընկալիչն այնպես է ձևափոխվում, որ ճնշվում է կոակտիվատորի և խթանվում կոռեպրեսորի կապումը։
Ներհակ ագոնիստներ[խմբագրել | խմբագրել կոդը]
Որոշ կորիզային ընկալիչներ ագոնիստների բացակայության դեպքում թույլ չափով կարող են խթանել գենի տրանսկրիպցիան (սա կոչվում է հիմային ակտիվություն)։ Այն սինթետիկ լիգանդները, որոնք նվազեցնում են կորիզային ընկալիչների հիմային ակտիվությունը, կոչվում են ներհակ (հակադարձ) ագոնիստներ (inverse agonists)[43]:
Ընտրողական ընկալչային մոդուլյատորներ[խմբագրել | խմբագրել կոդը]
Որոշ դեղամիջոցներ, որոնք ազդում են կորիզային ընկալիչների միջոցով, մի տեսակի հյուսվածքում թողնում են ագոնիստական, իսկ մյուսում՝ անտագոնիստական արդյունքներ։ Նման ագոնիստական-անտագոնիստական ազդեցություններ ունեցող դեղամիջոցները կոչվում են ընտրողական ընկալչային մոդուլյատորներ: Դրանցից են ընտրողական անդրոգեն ընկալչային մոդուլյատորը, ընտրողական էստրոգեն ընկալչային մոդուլյատորը և ընտրողական պրոգեստերոն ընկալչային մոդուլյատորը: Ընտրողական ընկալչային մոդուլյատորների ազդման մեխանիզմը խստորեն կախված է լիգանդի և ընկալչի քիմիական կառուցվածքից։ Այն հյուսվածքներում, որտեղ կոակտիվատոր սպիտակուցների խտությունն ավելի բարձր է, քան կոռեպրեսորներինը, լիգանդները գործում են որպես ագոնիստներ։ Դրան հակառակ, այն հյուսվածքներում, որտեղ շատ են կոռեպրեսորները, լիգանդները գործում են որպես անտագոնիստներ[44]։
Այլընտրանքային մեխանիզմներ[խմբագրել | խմբագրել կոդը]

Անդրճնշում[խմբագրել | խմբագրել կոդը]
Կորիզային ընկալիչների ազդման ամենատարածված մեխանիզմը նրանց միացումն է ԴՆԹ-ի հորմոնային պատասխանի տարրին: Այս մեխանիզմը կոչվում է անդրակտիվացում (տրանսակտիվացում): Սակայն, որոշ կորիզային ընկալիչներ կարող են կապվել ոչ միայն ԴՆԹ-ին, այլև այլ տրանսկրիպցիայի գործոններին ևս։ Այս միացումը սովորաբար ապաակտիվացնում է երկրորդ տրանսկրիպցիոն գործոնին և կոչվում է անդրճնշում (տրանսռեպրեսիա)[45]։ Անդրճնշող ընկալիչների օրինակներ են գլյուկոկորտիկոիդային ընկալիչները։ Բացի այդ, ընտրողական գլյուկոկորտիկոիդային ընկալչային որոշ ագոնիստներ կարող են ակտիվացնել վերոհիշյալ ընկալիչներին անդրճնշման, քան թե անդրակտիվացման մեխանիզմով։ Սա ընտրողաբար բարձրացնում է ընտրողական գլյուկոկորտիկոիդների ցանկալի հակաբորբոքային և ոչ ցանկալի նյութափոխանակային արդյունքների բաժանումն իրարից։
Ոչ գենային մեխանիզմ[խմբագրել | խմբագրել կոդը]
Կորիզային ընկալիչների ազդեցությունը գեների վրա և արդյունքի երևան գալը տևում է ժամեր, քանի որ այս գործընթացները բազմափուլ են և բազմագործոնային։ Սակայն դիտարկումները ցույց են տալիս, որ շատ ընկալիչների արդյունքներ (իոնային անցուղիների ակտիվության փոփոխություն) երևան են գալիս մի քանի րոպե անց։ Սա նշանակում է, որ կորիզային ընկալիչները կարող են ունենալ նաև ազդման այլ՝ ոչ գենային ուղիներ, որոնք տարբերվում են վերը նկարագրվածից։ Այն ժամանակ, երբ կորիզային ընկալիչների ոչ գենային ազդեցության մոլեկուլային թիրախները դեռ հայտնի չէին, կարծում էին, որ կան ընկալիչների տեսակներ, որոնք կապված են թաղանթի հետ, և ոչ թե տեղադրված ցիտոպլազմայում կամ կորիզում։ Բացի այդ, թաղանթին միացված ընկալիչները գործում են այլընտրանքային ազդանշանային տրանսդուկցիոն ուղով, որը ներգրավված չէ գենի կարգավորման մեխանիզմում[46][47][48][49]։
Թիրոիդային հորմոնի կորիզային TRβ ընկալչով ոչ գենային ազդանշանման մոլեկուլային մեխանիզմը ներառում է ֆոսֆատիդիլինոզիտոլ 3-կինազը (PI3K)[50]: Այս ազդանշանումը կարող է շրջափակվել TRβ-ում մեկ թիրոզինի փոխարինմամբ ֆենիլալանինով[51]։ Նման մկների[51] հիպոկամպում թուլանում է սինապսային գործունեությունն ու սինապսային ճկունությունը[52][53]։
Ընկալիչների տեսակներ[խմբագրել | խմբագրել կոդը]
Ստորև ներկայացվում են մարդկանց մոտ հանդիպող 48 հայտնի կորիզային ընկալիչներ, ինչպես նաև մի քանիսը, որոնք մարդկանց մոտ չեն լինում[7][8][13]։
| Ենթաընտանիք | Խումբ | Տեսակ | ||||||
|---|---|---|---|---|---|---|---|---|
| NRNC սիմվոլ[7] | Հապավում | Անուն | Գեն | Լիգանդներ | ||||
| 1 | Թիրոիդային հորմոնի ընկալիչ | A | Թիրոիդային հորմոնի ընկալիչ | NR1A1 | TRα | Թիրոիդ հորմոնի ընկալիչ-α | THRA | թիրոիդ հորմոն |
| NR1A2 | TRβ | Thyroid hormone receptor-β | THRB | |||||
| B | Ռետինաթթվի ընկալիչ | NR1B1 | RARα | Ռետինաթթվի ընկալիչ-α | RARA | վիտամին A և նման մոլեկուլներ | ||
| NR1B2 | RARβ | Ռետինաթթվի ընկալիչ-β | RARB | |||||
| NR1B3 | RARγ | Ռետինաթթվի ընկալիչ-γ | RARG | |||||
| C | Պերօքսիսոմ պրոլիֆերատոր ակտիվացված ընկալիչ | NR1C1 | PPARα | Պերօքսիսոմ պրոլիֆերատոր ակտիվացված ընկալիչ -α | PPARA | ճարպաթթուներ, պրոստագլանդիններ | ||
| NR1C2 | PPAR-β/δ | Պերօքսիսոմ պրոլիֆերատոր ակտիվացված ընկալիչ -β/δ | PPARD | |||||
| NR1C3 | PPARγ | Պերօքսիսոմ պրոլիֆերատոր ակտիվացված ընկալիչ-γ | PPARG | |||||
| D | Rev-ErbA | NR1D1 | Rev-ErbAα | Rev-ErbAα | NR1D1 | հեմ | ||
| NR1D2 | Rev-ErbAβ | Rev-ErbAα | NR1D2 | |||||
| F | RAR-related orphan receptor | NR1F1 | RORα | RAR-կախյալ որբ ընկալիչ-α | RORA | Խոլեթտերին, տրետինոին | ||
| NR1F2 | RORβ | RAR-կախյալ որբ ընկալիչ-β | RORB | |||||
| NR1F3 | RORγ | RAR-կախյալ որբ ընկալիչ-γ | RORC | |||||
| H | Լյարդի X ընկալիչ | NR1H3 | LXRα | Լյարդի X ընկալիչ-α | NR1H3 | ստերիններ | ||
| NR1H2 | LXRβ | Լյարդի X ընկալիչ-β | NR1H2 | |||||
| NR1H4 | FXR | Ֆերնեսոիդ X ընկալիչ | NR1H4 | |||||
| NR1H5[54] | FXR-β | Ֆերնեսոիդ X ընկալիչ-β | NR1H5P | |||||
| I | Վիտամին D ընկալիչ | NR1I1 | VDR | Վիտամին D ընկալիչ | VDR | վիտամին D | ||
| NR1I2 | PXR | Պրեգնանե X ընկալիչ | NR1I2 | քսենոբիոտիկներ | ||||
| NR1I3 | CAR | Անդրոստանի ընկալիչ | NR1I3 | անդրոստան | ||||
| X | ԴՆԹ կապող երկու դոմեններով NRs[55][56] | NR1X1 | 2DBD-NRα | |||||
| NR1X2 | 2DBD-NRβ | |||||||
| NR1X3 | 2DBD-NRγ | |||||||
| 2 | Ռետինոիդային X ընկալիչ | A | Հեպատոցիտի կորիզային գործոն-4 | NR2A1 | HNF4α | Հեպատոցիտի կորիզային գործոն-4-α | HNF4A | ճարպաթթուներ |
| NR2A2 | HNF4γ | Հեպատոցիտի կորիզային գործոն-4-γ | HNF4G | |||||
| B | Ռետինոիդային X ընկալիչ | NR2B1 | RXRα | Ռետինոիդային X ընկալիչ-α | RXRA | ռետինոիդներ | ||
| NR2B2 | RXRβ | Ռետինոիդային X ընկալիչ-β | RXRB | |||||
| NR2B3 | RXRγ | Ռետինոիդային X ընկալիչ-γ | RXRG | |||||
| C | Ամորձային ընկալիչ | NR2C1 | TR2 | Ամորձային ընկալիչ 2 | NR2C1 | |||
| NR2C2 | TR4 | Ամորձային ընկալիչ 4 | NR2C2 | |||||
| E | TLX/PNR | NR2E1 | TLX | Drosophila-ի պոչազուրկ գենի համանման | NR2E1 | |||
| NR2E3 | PNR | Ֆոտոընկալչական բջիջների յուրահատուկ կորիզային ընկալիչ | NR2E3 | |||||
| F | COUP/EAR | NR2F1 | COUP-TFI | Ճտի օվալբումին վերընթաց խթանող-տրանսկրիպցիոն գործոն I | NR2F1 | |||
| NR2F2 | COUP-TFII | Ճտի օվալբումին վերընթաց խթանող-տրանսկրիպցիոն գործոն II | NR2F2 | |||||
| NR2F6 | EAR-2 | V-erbA-related | NR2F6 | |||||
| 3 | Էստրոգենային ընկալիչ | A | Էստրոգենային ընկալիչ | NR3A1 | ERα | Էստրոգենային ընկալիչ-α | ESR1 | էստրոգեններ |
| NR3A2 | ERβ | Էստրոգենային ընկալիչ-β | ESR2 | |||||
| B | Էստրոգեն կապված ընկալիչ | NR3B1 | ERRα | Էստրոգեն-կախյալ ընկալիչ-α | ESRRA | |||
| NR3B2 | ERRβ | Էստրոգեն-կախյալ ընկալիչ-β | ESRRB | |||||
| NR3B3 | ERRγ | Էստրոգեն-կախյալ ընկալիչ-γ | ESRRG | |||||
| C | 3-կետոստերոիդային ընկալիչ | NR3C1 | GR | Գլյուկոկորտիկոիդային ընկալիչ | NR3C1 | կորտիզոլ | ||
| NR3C2 | MR | Հանքակորտիկոիդային ընկալիչ | NR3C2 | ալդոստերոն | ||||
| NR3C3 | PR | Պրոգեստերոնի ընկալիչ | PGR | պրոգեստերոն | ||||
| NR3C4 | AR | Անդրոգենի ընկալիչ | AR | տեստոստերոն | ||||
| 4 | Նյարդի աճման գործոն IB-նման | A | NGFIB/NURR1/NOR1 | NR4A1 | NGFIB | Նյարդի աճման գործոն IB | NR4A1 | |
| NR4A2 | NURR1 | Կորիզային ընկալիչ կախյալ 1 | NR4A2 | |||||
| NR4A3 | NOR1 | Նեյրոն-ստացված որբ ընկալիչ 1 | NR4A3 | |||||
| 5 | Ստերոիդոգենիկ գործոն-նման | A | SF1/LRH1 | NR5A1 | SF1 | Ստերոիդոգենիկ գործոն 1 | NR5A1 | ֆոսֆատիդիլնոսիտոլս |
| NR5A2 | LRH-1 | Լյարդի ընկալչի համանման-1 | NR5A2 | ֆոսֆատիդիլնոսիտոլս | ||||
| 6 | Սաղմի բջջի կորզային գործոն-նման | A | GCNF | NR6A1 | GCNF | Սաղմի բջջի կորզային գործոն | NR6A1 | |
| 0 | Միսցելանեոուս | B | DAX/SHP | NR0B1 | DAX1 | Dosage-sensitive sex reversal, adrenal hypoplasia critical region, on chromosome X, gene 1 | NR0B1 | |
| NR0B2 | SHP | Փոքր հետեոդիմերային զույգ | NR0B2 | |||||
Պատմություն[խմբագրել | խմբագրել կոդը]
Ստորև ներկայացվում է կորիզային ընկալիչների հետազոտման համառոտ պատմությունը[57]։
- 1905 – Էռնեստ Սթարլինգը ներմուծեց հորմոն եզրույթը։
- 1926 – Էդվարդ Կալվին Կենդալն (Edward Calvin Kendall) ու Թադեուս Ռեյխստեյնն (Tadeus Reichstein) անջատեցին և որոշեցին կորտիզոնի և թիրոքսինի կառուցվածը։
- 1929 – Ադոլֆ Բութենանդթն (Adolf Butenandt) ու Էդվարդ Ադելբերտ Դոյսին (Edward Adelbert Doisy) անկախ իրարից անջատեցին և որոշեցին էստրոգենի կառուցվածը։
- 1958 – Էլվուդ Ջենսենն (Elwood Jensen) անջատեց էստրոգենի ընկալիչը։
- 1980-ականներ – էստրոգենների, գլյուկոկորտիկոիդների, թիրոիդային հորմոնների ընկալիչների կլոնավորում Պիեռ Չամբոնի (Pierre Chambon), Ռոնալդ Էվանսի (Ronald Evans) և Բյորն Վենստրյոմի (Björn Vennström) կողմից համապատասխանաբար։
Պատկերներ[խմբագրել | խմբագրել կոդը]
-
Մարդու անդրոգենի ԴՆԹ կապող դոմեն։ Ցինկի ատոմները կանաչ գույնով են -
Էստրոգենային ընկալչի ԴՆԹ կապող դոմեն -
Գլյուկոկորտիկոիդային ընկալչի ԴՆԹ կապող դոմեն -
NGFI-B որբ ընկալչի ԴՆԹ կապող դոմեն -
Err2 ստերոիդային ընկալչի ԴՆԹ կապող դոմեն -
Վիտամինի D3-ի ընկալչի կապող դոմեն
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 Կաղապար:PDB; Chandra V, Huang P, Hamuro Y, Raghuram S, Wang Y, Burris TP, Rastinejad F (2008 թ․ հոկտեմբեր). «Structure of the intact PPAR-gamma-RXR-alpha nuclear receptor complex on DNA». Nature. 456 (7220): 350–356. doi:10.1038/nature07413. PMC 2743566. PMID 19043829.
- ↑ Evans RM (1988). «The steroid and thyroid hormone receptor superfamily». Science. 240 (4854): 889–95. doi:10.1126/science.3283939. PMID 3283939.
- ↑ Olefsky JM (2001). «Nuclear receptor minireview series». J. Biol. Chem. 276 (40): 36863–4. doi:10.1074/jbc.R100047200. PMID 11459855.
- ↑ Structural overview of the nuclear receptor superfamily: insights into physiology and therapeutics. Huang P1, Chandra V, Rastinejad F.
- ↑ 5,0 5,1 Mangelsdorf DJ, Thummel C, Beato M, Herrlich P, Schutz G, Umesono K, Blumberg B, Kastner P, Mark M, Chambon P, Evans RM (1995). «The nuclear receptor superfamily: the second decade». Cell. 83 (6): 835–9. doi:10.1016/0092-8674(95)90199-X. PMID 8521507.
- ↑ 6,0 6,1 Novac N, Heinzel T (2004). «Nuclear receptors: overview and classification». Curr Drug Targets Inflamm Allergy. 3 (4): 335–46. doi:10.2174/1568010042634541. PMID 15584884.
- ↑ 7,0 7,1 7,2 «A unified nomenclature system for the nuclear receptor superfamily». Cell. 97 (2): 161–3. 1999. doi:10.1016/S0092-8674(00)80726-6. PMID 10219237.
{{cite journal}}: Cite uses deprecated parameter|authors=(օգնություն) - ↑ 8,0 8,1 Laudet V (1997). «Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor». J. Mol. Endocrinol. 19 (3): 207–26. doi:10.1677/jme.0.0190207. PMID 9460643.
- ↑ Escriva H, Langlois MC, Mendonça RL, Pierce R, Laudet V (1998 թ․ մայիս). «Evolution and diversification of the nuclear receptor superfamily». Annals of the New York Academy of Sciences. 839: 143–6. doi:10.1111/j.1749-6632.1998.tb10747.x. PMID 9629140.
- ↑ Reitzel AM, Pang K, Ryan JF, Mullikin JC, Martindale MQ, Baxevanis AD, Tarrant AM (2011). «Nuclear receptors from the ctenophore Mnemiopsis leidyi lack a zinc-finger DNA-binding domain: lineage-specific loss or ancestral condition in the emergence of the nuclear receptor superfamily?». Evodevo. 2 (1): 3. doi:10.1186/2041-9139-2-3. PMC 3038971. PMID 21291545.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Bridgham JT, Eick GN, Larroux C, Deshpande K, Harms MJ, Gauthier ME, Ortlund EA, Degnan BM, Thornton JW (2010). «Protein evolution by molecular tinkering: diversification of the nuclear receptor superfamily from a ligand-dependent ancestor». PLoS Biol. 8 (10): e1000497. doi:10.1371/journal.pbio.1000497. PMC 2950128. PMID 20957188.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Sluder AE, Maina CV (2001 թ․ ապրիլ). «Nuclear receptors in nematodes: themes and variations». Trends in Genetics : TIG. 17 (4): 206–13. doi:10.1016/S0168-9525(01)02242-9. PMID 11275326.
- ↑ 13,0 13,1 Zhang Z, Burch PE, Cooney AJ, Lanz RB, Pereira FA, Wu J, Gibbs RA, Weinstock G, Wheeler DA (2004). «Genomic analysis of the nuclear receptor family: new insights into structure, regulation, and evolution from the rat genome». Genome Res. 14 (4): 580–90. doi:10.1101/gr.2160004. PMC 383302. PMID 15059999.
- ↑ Overington JP, Al-Lazikani B, Hopkins AL (2006). «How many drug targets are there?». Nature reviews. Drug discovery. 5 (12): 993–6. doi:10.1038/nrd2199. PMID 17139284.
- ↑ Benoit G, Cooney A, Giguere V, Ingraham H, Lazar M, Muscat G, Perlmann T, Renaud JP, Schwabe J, Sladek F, Tsai MJ, Laudet V (2006). «International Union of Pharmacology. LXVI. Orphan nuclear receptors». Pharmacol. Rev. 58 (4): 798–836. doi:10.1124/pr.58.4.10. PMID 17132856.
- ↑ Blumberg B., Evans R.M. Orphan receptors - new ligands and new possibilities, Genes and Development, 12, 3149 - 3155, 1998
- ↑ Mohan R, Heyman RA (2003). «Orphan nuclear receptor modulators». Curr Top Med Chem. 3 (14): 1637–47. doi:10.2174/1568026033451709. PMID 14683519.
- ↑ Kumar R, Thompson EB (1999). «The structure of the nuclear hormone receptors». Steroids. 64 (5): 310–9. doi:10.1016/S0039-128X(99)00014-8. PMID 10406480.
- ↑ Klinge CM (2000). «Estrogen receptor interaction with co-activators and co-repressors». Steroids. 65 (5): 227–51. doi:10.1016/S0039-128X(99)00107-5. PMID 10751636.
- ↑ 20,0 20,1 Wärnmark A, Treuter E, Wright AP, Gustafsson JÅ (2003). «Activation functions 1 and 2 of nuclear receptors: molecular strategies for transcriptional activation». Mol. Endocrinol. 17 (10): 1901–9. doi:10.1210/me.2002-0384. PMID 12893880.
- ↑ Weatherman RV, Fletterick RJ, Scanlan TS (1999). «Nuclear-receptor ligands and ligand-binding domains». Annu. Rev. Biochem. 68: 559–81. doi:10.1146/annurev.biochem.68.1.559. PMID 10872460.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Chandra V, Huang P, Potluri N, Wu D, Kim Y, Rastinejad F (2013 թ․ մարտ). «Multidomain integration in the structure of the HNF-4α nuclear receptor complex». Nature. 495 (7441): 394–398. doi:10.1038/nature11966. PMID 23485969.
- ↑ Lou X, Toresson G, Benod C, Suh JH, Philips KJ, Webb P, Gustafsson JA (2014 թ․ փետրվար). «Structure of the retinoid X receptor α-liver X receptor β (RXRα-LXRβ) heterodimer on DNA». Nat. Struct. Mol. Biol. 21 (3): 277–281. doi:10.1038/nsmb.2778. PMID 24561505.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Կաղապար:PDB; Roemer SC, Donham DC, Sherman L, Pon VH, Edwards DP, Churchill ME (2006 թ․ դեկտեմբեր). «Structure of the progesterone receptor-deoxyribonucleic acid complex: novel interactions required for binding to half-site response elements». Mol. Endocrinol. 20 (12): 3042–52. doi:10.1210/me.2005-0511. PMC 2532839. PMID 16931575.
- ↑ Կաղապար:PDB; Jin L, Martynowski D, Zheng S, Wada T, Xie W, Li Y (2010 թ․ մայիս). «Structural basis for hydroxycholesterols as natural ligands of orphan nuclear receptor RORgamma». Mol. Endocrinol. 24 (5): 923–9. doi:10.1210/me.2009-0507. PMC 2870936. PMID 20203100.
- ↑ Lindquist S.. Craig E. The heat-shock proteins // Annu. Rev. Genet. 1988. V. 22. P. 631-677.
- ↑ Pratt W.B. The role of heat shock proteins in regulating the function, folding and trafficking of the glucocorti-coid receptor//J. Biol. Chem. 1993, V. 268, p. 21455-21458.
- ↑ ohnson J.. Corbisier R., Stensgard *.. Toft D. The involvement of p23, hsp90 and immuniphilins in the assembly of progesterone receptor complexes // J. Steroid Biochem. Mol. Biol. 1996. V. 56. P. 31-37.
- ↑ Bohen S.P. Hsp90 mutants disrupt glucocorticoid receptor ligand binding and destabilize aporeceptor complexes // J. Biol. Chem. 1995. V. 270. P. 29433-29438.
- ↑ Linja MJ, Porkka KP, Kang Z, Savinainen KJ, Jänne OA, Tammela TL, Vessella RL, Palvimo JJ, Visakorpi T (2004 թ․ փետրվար). «Expression of androgen receptor coregulators in prostate cancer». Clin. Cancer Res. 10 (3): 1032–40. doi:10.1158/1078-0432.CCR-0990-3. PMID 14871982.
- ↑ Encio I.J., Detera-Wadleigh S.D. // J. Biol. Chem. 1991. V. 266. P. 7182--7188.
- ↑ Okret S., Wikstrom A.G., Gustafsson J.-A. // Biochemistry. 1985. V. 24. P. 6581--6586
- ↑ Gustavson J.A. Seeking ligands for lonely orphan receptors. Science, 1999., 284., p 1285-1286
- ↑ Klinge CM, Bodenner DL, Desai D, Niles RM, Traish AM (1997 թ․ մայիս). «Binding of type II nuclear receptors and estrogen receptor to full and half-site estrogen response elements in vitro». Nucleic Acids Res. 25 (10): 1903–12. doi:10.1093/nar/25.10.1903. PMC 146682. PMID 9115356.
- ↑ Glass CK, Rosenfeld MG (2000). «The coregulator exchange in transcriptional functions of nuclear receptors». Genes Dev. 14 (2): 121–41. doi:10.1101/gad.14.2.121. PMID 10652267.
- ↑ Aranda A, Pascual A (2001). «Nuclear hormone receptors and gene expression» (abstract). Physiol. Rev. 81 (3): 1269–304. PMID 11427696.
- ↑ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, Zoumpourlis V, Urban RJ, Vlahopoulos SA (2009 թ․ հունիս). «Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?». BioEssays. 31 (6): 629–41. doi:10.1002/bies.200800138. PMID 19382224.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ The multifunctional role of the co-activator CBP in transcriptional regulation. Goldman PS1, Tran VK, Goodman RH.Recent Prog Horm Res. 1997;52:103-19; discussion 119-20.
- ↑ Role of co-activators and co-repressors in the mechanism of steroid/thyroid receptor action. Shibata H1, Spencer TE, Oñate SA, Jenster G, Tsai SY, Tsai MJ, O'Malley BW.Recent Prog Horm Res. 1997;52:141-64; discussion 164-5.
- ↑ The SRC family of nuclear receptor coactivators. Leo C1, Chen JD.Gene. 2000 Mar 7;245(1):1-11.
- ↑ Brzozowski AM, Pike AC, Dauter Z, Hubbard RE, Bonn T, Engström O, Öhman L, Greene GL, Gustafsson JÅ, Carlquist M (1997). «Molecular basis of agonism and antagonism in the oestrogen receptor». Nature. 389 (6652): 753–8. doi:10.1038/39645. PMID 9338790.
- ↑ Shiau AK, Barstad D, Loria PM, Cheng L, Kushner PJ, Agard DA, Greene GL (1998). «The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen». Cell. 95 (7): 927–37. doi:10.1016/S0092-8674(00)81717-1. PMID 9875847.
- ↑ Busch BB, Stevens WC, Martin R, Ordentlich P, Zhou S, Sapp DW, Horlick RA, Mohan R (2004). «Identification of a selective inverse agonist for the orphan nuclear receptor estrogen-related receptor alpha». J. Med. Chem. 47 (23): 5593–6. doi:10.1021/jm049334f. PMID 15509154.
- ↑ Smith CL, O'Malley BW (2004). «Coregulator function: a key to understanding tissue specificity of selective receptor modulators». Endocr Rev. 25 (1): 45–71. doi:10.1210/er.2003-0023. PMID 14769827.
- ↑ Pascual G, Glass CK (2006). «Nuclear receptors versus inflammation: mechanisms of transrepression». Trends Endocrinol Metab. 17 (8): 321–7. doi:10.1016/j.tem.2006.08.005. PMID 16942889.
- ↑ Björnström L, Sjöberg M (2004). «Estrogen receptor-dependent activation of AP-1 via non-genomic signalling». Nucl Recept. 2 (1): 3. doi:10.1186/1478-1336-2-3. PMC 434532. PMID 15196329.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Zivadinovic D, Gametchu B, Watson CS (2005). «Membrane estrogen receptor-alpha levels in MCF-7 breast cancer cells predict cAMP and proliferation responses». Breast Cancer Res. 7 (1): R101–12. doi:10.1186/bcr958. PMC 1064104. PMID 15642158.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Kousteni S, Bellido T, Plotkin LI, O'Brien CA, Bodenner DL, Han L, Han K, DiGregorio GB, Katzenellenbogen JA, Katzenellenbogen BS, Roberson PK, Weinstein RS, Jilka RL, Manolagas SC (2001). «Nongenotropic, sex-nonspecific signaling through the estrogen or androgen receptors: dissociation from transcriptional activity». Cell. 104 (5): 719–30. doi:10.1016/S0092-8674(01)00268-9. PMID 11257226.
- ↑ Storey NM, Gentile S, Ullah H, Russo A, Muessel M, Erxleben C, Armstrong DL (2006). «Rapid signaling at the plasma membrane by a nuclear receptor for thyroid hormone». Proc. Natl. Acad. Sci. U.S.A. 103 (13): 5197–201. doi:10.1073/pnas.0600089103. PMC 1458817. PMID 16549781.
- ↑ Storey NM, O'Bryan JP, Armstrong DL (2002). «Rac and Rho Mediate Opposing Hormonal Regulation of the Ether-A-Go-Go-Related Potassium Channel». Current Biology. 12 (1): 27–33. doi:10.1016/S0960-9822(01)00625-X. PMID 11790300.
- ↑ 51,0 51,1 Martin NP, Marron Fernandez de Velasco E, Mizuno F, Scappini EL, Gloss B, Erxleben C, Williams JG, Stapleton HM, Gentile S, Armstrong DL (2014). «A rapid cytoplasmic mechanism for PI3 kinase regulation by the nuclear thyroid hormone receptor, TRβ, and genetic evidence for its role in the maturation of mouse hippocampal synapses in vivo». Endocrinology. 155 (9): 3713–24. doi:10.1210/en.2013-2058. PMID 24932806.
- ↑ Gilbert ME (2004). «Alterations in synaptic transmission and plasticity in area CA1 of adult hippocampus following developmental hypothyroidism». Brain Res Dev Brain Res. 148 (1): 11–18. PMID 14757514.
- ↑ Moeller LC, Broecker-Preuss M (2011). «Transcriptional regulation by nonclassical action of thyroid hormone». Thyroid Res. 4 Suppl 1: S6. doi:10.1186/1756-6614-4-S1-S6. PMC 3155112. PMID 21835053.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Otte K, Kranz H, Kober I, Thompson P, Hoefer M, Haubold B, Remmel B, Voss H, Kaiser C, Albers M, Cheruvallath Z, Jackson D, Casari G, Koegl M, Pääbo S, Mous J, Kremoser C, Deuschle U (2003). «Identification of farnesoid X receptor beta as a novel mammalian nuclear receptor sensing lanosterol». Mol. Cell. Biol. 23 (3): 864–72. doi:10.1128/mcb.23.3.864-872.2003. PMC 140718. PMID 12529392.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Wu W, Niles EG, El-Sayed N, Berriman M, LoVerde PT (2006). «Schistosoma mansoni (Platyhelminthes, Trematoda) nuclear receptors: sixteen new members and a novel subfamily». Gene. 366 (2): 303–15. doi:10.1016/j.gene.2005.09.013. PMID 16406405.
- ↑ Wu W, Niles EG, Hirai H, LoVerde PT (2007). «Evolution of a novel subfamily of nuclear receptors with members that each contain two DNA binding domains». BMC Evol Biol. 7: 27. doi:10.1186/1471-2148-7-27. PMC 1810520. PMID 17319953.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Tata JR (2005). «One hundred years of hormones». EMBO Rep. 6 (6): 490–6. doi:10.1038/sj.embor.7400444. PMC 1369102. PMID 15940278.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- Vincent Laudet (2006). «The IUPHAR Compendium of the Pharmacology and Classification of the Nuclear Receptor Superfamily 2006E». Nuclear Receptor Compendium. The International Union of Basic and Clinical Pharmacology. Արխիվացված է օրիգինալից 2015 թ․ ապրիլի 2-ին. Վերցված է 2008 թ․ փետրվարի 21-ին.
- «Nuclear Receptor online journal». Home page. published by BioMed Central (no longer accepting submissions since May 2007). Վերցված է 2008 թ․ փետրվարի 21-ին.
- «Nuclear Receptor Resource». Georgetown University. Արխիվացված է օրիգինալից 2008 թ․ մայիսի 11-ին. Վերցված է 2008 թ․ փետրվարի 21-ին.
- «Nuclear Receptor Signaling Atlas (Receptors, Coactivators, Corepressors and Ligands)». The NURSA Consortium. Վերցված է 2008 թ․ փետրվարի 21-ին. «an NIH-funded research consortium and database; includes open-access PubMed-indexed journal, Nuclear Receptor Signaling»
- «Nuclear Receptor Resource». Jack Vanden Heuvel. Վերցված է 2009 թ․ սեպտեմբերի 21-ին.
- The Estrogen Receptor (II): Molecular & Cellular Mechanisms
- Nuclear Protein receptor in youtube
- MECHANISM OF HORMONE ACTION in youtube
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի օրվա հոդված: |