Ձեռքբերովի իմունիտետ



Ձեռքբերովի իմունիտետ (առավել հազվադեպ՝ յուրահատուկ իմունիտետ), պաշտպանական մեխանիզմ, որի ժամանակ կենդանի օրգանիզմը կյանքի ընթացքում իմունիտետ է ձեռք բերում օրգանիզմ ներթափանցած նոր ախտածնի (մանրէ, վիրուս, թույն և այլն) նկատմամբ։ Այն բնածին իմունիտետի հետ պայմանավորում է իմունային համակարգի ամբողջական պատասխանը։
Ձեռքբերովի իմունային համակարգը կազմված է մասնագիտացված բջիջներից ու մեխանիզմներից, որոնք քայքայում կամ կանխում են հարուցիչների (ախտածին, պաթոգեն) զարգացումը։ Հարուցչի հետ փոխազդեցության արդյունքում ձեռքբերովի իմունիտետի շնորհիվ ստեղծվում է իմունոլոգիական հիշողություն, որի արդյունքում օրգանիզմն անընկալունակ է դառնում այս նոր ախտածնի նկատմամբ։ Ձեռքբերովի իմունիտետը հանդիսանում է վակցինացման (պատվաստում) հիմքը։ Բնածին իմունային համակարգի նման, ձեռքբերովի իմունիտետը իրագործվում է պաշտպանական հումորալ և բջջային գործոններով[1]։
Ի տարբերություն բնածին իմունիտետի, ձեռքբերովին խիստ մասնագիտացված է որոշակի ախտածնի նկատմամբ։ Որոշ դեպքերում ձեռքբերովի իմունային համակարգն անկարող է լինում տարբերակել օտարածին մարմինը կամ մոլեկուլը։ Սրա արդյունքներից են՝ խոտային տենդը, ասթման կամ այլ տեսակի ալերգիաները։
Ձեռքբերովի իմունիտետի պաշտպանության հումորալ և բջջային մեխանիզմներն իրականացվում են T և B լիմֆոցիտներով։ Հակածնի առկայության դեպքում B լիմֆոցիտները վերածում են պլազմային (պլազմատիկ) բջիջների, որոնք հակածնի չեզոքացման նպատակով արտադրում են հակամարմիններ (իմունոգլոբիններ)։ Հակամարմիններն արյան հունով տարածվում են և չեզոքացնելով հակածնին, կանխում են նրա և թիրախ բջիջների հանդիպումը[2]։
Ձեռքբերովի իմունիտետի դեպքում ախտածնի նկատմամբ յուրահատուկ ընկալիչները «ձեռք են բերվում» կյանքի ընթացքում՝ օրգանիզմի և հարուցչի հանդիպման հետևանքով, մինչ դեռ բնածին իմունիտետի դեպքում այդ ընկալիչները ծննդյան պահից արդեն առկա։
Ձեռքբերովի իմունային համակարգը բավականին հարմարվող (ադապտացվող) է մարմնական հիպեմուտացիայի[3][4] (մարմնական՝ սոմատիկ բջիջների արագացված մուտացիա) և V(D)J վերախմբավորման (հակածնի ընկալչի գենի հատվածի անվերադարձ գենային վերախմբավորում) շնորհիվ[5]։ Այս մեխանիզմը թույլ է տալիս սակավաթիվ գեներին ստեղծել մեծ թվով հակածնային ընկալիչներ, որոնցից յուրաքանչյուրն այնուհետև ներկայացվում են առանձին լիմֆոցիտների վրա։ Քանի որ գենի վերակազմավորումը յուրաքանչյուր բջջում հարուցում է ԴՆԹ-ի անվերադարձ փոփոխություն, բոլոր բջիջների հետագա սերունդները ժառանգում են այն գեները, որոնք կոդավորում են նույն ընկալիչները, ներառյալ հիշողության B բջիջներն ու հիշողության T բջիջները, որոնք ողջ կյանքի ընթացքում հանդիսանում են յուրարհատուկ անընկալունակության հիմքը[6]։
Ձեռքբերովի իմունային համակարգի աշխատանքի սկզբունքները բացատրվում են իմունային ցանցի տեսությամբ։ Այս տեսությունը, որը հիմնված է կլոնային ընտության սկզբունքների վրա, կիրառվում է ՄԻԱՎ-ի վակցինայի ստացման համար։
Ֆունկցիաներ
[խմբագրել | խմբագրել կոդը]Ձեռքբերովի իմունիտետը զարգանում է ողնաշարավորների մոտ, երբ ախտածին գործոնը, շրջանցելով պաշտպանական բնածին գործոններին, թափանցում է օրգանիզմ, ստեղծում հակածնային բավարար շեմք և դենդրիտային բջիջներին ակտիվացնող այսպես կոչվող "վնասող" ազդակներ[7]։
Ձեռքբերովի իմունիտետի գլխավոր ֆունկցիաներն են.
- Օտարածին՝ "ոչ սեփական" հակածնի ճանաչում հակածնի ներկայացման (պրեզենտացիայի) ժամանակ։
- Այնպիսի պատասխանի ստեղծում, որի արդյունքում առավելագույն չափով կվնասազերծվեն յուրահատուկ հակածիններն ու ախտահարված բջիջները։
- Իմունոլոգիական հիշողության ձևավորում, որի շնորհիվ ախտածինները "կհիշվեն" հիշողության B և T լիմֆոցիտների կողմից։
Լիմֆոցիտներ
[խմբագրել | խմբագրել կոդը]

Ձեռքբերովի իմունային համակարգի հիմնական բջիջները T և B լիմֆոցիտներն են, որոնք լեյկոցիտների հիմնական տեսակներից են։ Մարդու օրգանզմում կան մոտավորապես 2 տրիլիոն լիմֆոցիտներ, որոնք կազմում են լեյկոցիտների մոտավորապես 20-40 %-ը։ Նրանց ամբողջական զանգվածը մոտավորապես հավասար է ուղեղի կամ լյարդի քաշին[8]։ Ծայրամասային արյունը պարունակում է շրջանառվող լիմֆոցիտների մոտ 2 %-ը, մյուս մասն անցնում է հյուսվածքներ և ավշային համակարգ[8]։
Բոլոր ողնաշարավորների մոտ (բացառությամբ Agnatha-ի) B և T բջիջների նախորդ-բջիջները սկզբնապես ձևավորվում են արյունաստեղծման (հեմոպոետիկ) ցողունային բջիջներից` ոսկրածուծի միելոիդ հյուսվածքում[9]։ Լիմֆոցիտների նախաբջիջներն աստիճանաբար գաղթում են և բնակություն հաստատում ուրցագեղձում, փայծաղում, ավշային հանգույցներում և այլուր։ Հետագայում ուրցագեղձի թիմոցիտներում կատարվում է T լիմֆոցիտների տարբերակումը, իսկ ավշային հանգույցներում` B լիմֆոցիտներինը[10][11]։
B լիմֆոցիտները մասնակցում են հումորալ իմունիտետի ձևավորմանը, քանի որ նրանք կարող են վերափոխվել պլազմային (պլազմատիկ) բջիջների, իսկ վերջիններս սինթեզում են հակամարմիններ[12]։ T բջիջները ներգրավված են հիմնականում բջջային իմունիտետի ձևավորման գործընթացում[13][14]։
Մարդու լիմֆոցիտների մոտ 1-2 %-ը յուրաքանչյուր ժամը մեկ կրկին շրջանառվում է, որպեսզի բարելավի երկրորդային ավշային հյուսվածքներում յուրահատուկ հակածին գտնելու հակածին-յուրահատուկ լիմֆոցիտների ընդունակությունը[15]։
Հասուն մարդկանց ծայրամասային ավշային օրգանները պարունակում են T և B լիմֆոցիտների զարգացման 3 տարբեր տարատեսակներ,
- անհաս B և T բջիջներ, որոնք լքել են ոսկրածուծը կամ ուրցագեղձը, մտնում են ավշային համակարգ, սակայն դեռ չեն հանդիպել հակածնին,
- էֆեկտոր բջիջներ, որոնք արդեն ակտիվացվել են հակածնով և ներգրավված են ախտածինների ոչնչացման գործընթացում,
- հիշողության բջիջներ, որոնք ունեն բավականին երկար կյանք։
Հակածնի ներկայացում
[խմբագրել | խմբագրել կոդը]Ձեռքբերովի իմունիտետը հիմնված է իմունային բջիջների՝ օրգանիզմի սեփական բջիջները տարբերակելու և ոչ ցանկալի ախտածինների ոչնչացման ընդունակության վրա։ "Տիրոջ" մարմնի բջիջներն ունեն իրենց "սեփական" հակածինները։ Վերջիններս տարբերվում են այն հակածիններից (օտար հակածիններ), որոնք գտնվում են բակտերիաների կան վիրուսներով վարակված բջիջների վրա։ Ձեռքբերովի իմունիտետը սկսվում է ակտիվացված դենդրիտային բջիջների բջջային մակարդակով օտարածին հակածնի ճանաչումով։ Կանադացի գիտնական Ռալֆ Սթեյմանը 2011 թվականին իմունիտետ ձեռք բերելու հարցում դենդրիտային բջիջների դերի մասին հայտնագործության համար արժանացավ Նոբելյան մրցանակի ֆիզիոլոգիայի կամ բժշկության բնագավառում։
Բացառությամբ անկորիզ բջիջների (ներառյալ՝ էրիթրոցիտները), մյուս բոլոր բջիջներն օժտված են հակածին ներկայացնելու ընդունակությամբ՝ հիստոհամատեղելիության գլխավոր համալիրի (ՀԳՀ) մոլեկուլների օժանդակությամբ[9]։ Որոշ բջիջներ հենց մասնագիտացված են հակածնի ներկայացման համար և, հիմնականում, T բջիջները։ Դենդրիտային բջիջներն ու B լիմֆոցիտները (քիչ քանակով նաև՝ մակրոֆագերը) ունեն հատուկ "կոխթանող" լիգանդներ, որոնք ճանաչվում են T բջիջների վրա գտնվող կոխթանող ընկալիչների կողմից և անվանվում են հակածին ներկայացնող բջիջներ:
Հակածին ներկայացնող բջիջների ազդեցությամբ ակտիվանում են տարբեր տեսակի T բջիջները և վերջիններիս յուրաքանչյուր տեսակ "զինվում" է հատուկ ախտածնի նկատմամբ։ Ակտիվացվող T բջիջների ու զարգացող իմունային պատասխանի տեսակը կախված է մասնավորապես նրանից, թե հակածին ներկայացնող բջիջներից ով է առաջինը հանդիպում ախտածնին[7]։
Արտածին հակածիններ
[խմբագրել | խմբագրել կոդը]
Հյուսվածքներում դենդրիտային բջիջները կլանում են արտածին հակածիններին (բակտերիա, մակաբույծներ, թույներ) և այնուհետև քեմոտաքսիսի միջոցով գաղթում T լիմֆոցիտներով հարուստ ավշային հանգույցներ։ Գաղթի ժամանակ դենդրիտային բջիջները ենթարկվում են մուտացիայի, որի ընթացքում գերազանցապես կորցնում են այլ ախտածիններ կլանելու հատկությունը, և ձեռք են բերում T բջիջների հետ հաղորդակցվելու հատկություն։ Դենդրիտային բջիջներն իրենց ֆերմենտներով ախտածիններին տրոհում են փոքր մասերի, որոնք կոչվում են հակածիններ։ Ավշային հանգույցներում դենդրիտային բջիջները օտարածին (ոչ սեփական) հակածինը ներկայացնում են իրենց մակերեսին, որը կպած է լինում "սեփական" ընկալիչներին՝ հյուսվածահամատեղելիության գլխավոր համալիրի (ՀԳՀ, մարդու մոտ հայտնի է մարդու լեյկոցիտային հակածին անվամբ)[7] մոլեկուլին։ Հակածին-հիստոհամատեղելիության ընկալիչ համալիրը ճանաչվում է ավշային հանգույցների T լիմֆոցիտների կողմից։ Արտածին հակածինները սովորաբար ներկայացվում են հյուսվածահամատեղելիության գլխավոր համալիրի (ՀԳՀ) II տիպի մոլեկուլներով, որոնք ակտիվացնում են T օգնական լիմֆոցիտներին[7]։
Ներսածին հակածիններ
[խմբագրել | խմբագրել կոդը]Ներսածին հակածիններն արտադրվում են ներբջջային բակտերիաների և վիրուսների կողմից[7]։ Վերջիններիս սպիտակուցների տրոհման համար ախտահարված բջիջներն արտադրում են ֆերմենտներ, որից հետո տրոհման արգասիքներից ոմանք միանում են այդ բջիջների մակերեսին գտնվող հիստոհամատեղելիության գլխավոր համալիրի ընկալիչներին և ներկայացվում T բջիջներին։ Ներսածին հակածիննները հիմնականում ներկայացվում են ՀԳՀ-ի I տեսակի ընկալիչներով և ակտիվացնում են ցիտոտոքսիկ T-լիմֆոցիտների CD8 ընկալիչները։ Օրգանզիմում ՀԳՀ-ի I տեսակի ընկալիչներն առկա են բոլոր կորիզավոր բջիջների վրա[7]։
T լիմֆոցիտներ
[խմբագրել | խմբագրել կոդը]

Ցիտոտոքսիկ T Լիմֆոցիտներ
[խմբագրել | խմբագրել կոդը]Ցիտոտոքսիկ T լիմֆոցիտները (T սպանողներ, T քիլլերներ) սպանում են վիրուսներով կամ այլ ախտածին գործոններով վարակված, ինչպես նաև վնասված կամ թերֆունկցիա ունեցող բջիջներին[7]։
Բնական ցիտոտոքսիկ T լիմֆոցիտներն ակտիվանում են, երբ նրանց ընկալիչները (TCR) շփվում են ՀԳՀ-ի I տեսակի մոլեկուլներին։ Այս խնամակցությունը կախված է հակածին-ՀԳՀ համալիրի տեսակից[7]։ Ակտիվացված T լիմֆոցիտները երթարկվում են մի գործընթացի, որը կոչվում է կլոնային ընտրություն (սելեկցիա)։ Սրա հետևանքով լիմֆոցիտները ձեռք են բերում որոշ ֆունկցիաներ և կիսվում են՝ առաջացնելով "զինված" էֆեկտորային բջիջներ։ Ակտիվացված ցիտոտոքսիկ T լիմֆոցիտները շրջում են օրգանիզմով և փնտրում այն բջիջներին, որոնք կրում են ՀԳՀ I դաս+հակածին յուրատատուկ համալիրը։
Հանդիպելով ախտահարված մարմնական բջջին, էֆեկտորային ցիտոտոքսիկ բջիջներն արտադրում են պերֆորին և գրանուլիզին: Այս ցիտոտոքսիններն անցքեր են բացում վնասված բջջի թաղանթի վրա, որը հնարավորություն է տալիս ջրին և իոններին՝ անցնել բջջի ներս։ Արդյունքում՝ բջիջը պայթում է կամ քայքայվում[7]։ Ցիտոտոքսիկ T լիմֆոցիտններն արտադրում են նաև սերինային պրոտեազ գրանզիմ, որը մտնելով բջջի ներս, առաջացնում է նրա ապոպտոզ։ Ախտահարման ընթացքում հյուսվածքների լայնատարած վնասումը կանխելու համար ցիտոտոքսիկ T Լիմֆոցիտների ակտիվացումը խստորեն կարգավորվում է և հիմնականում կատարվում ՀԳՀ-հակածին ազդակի կամ T օգնականների միջոցով փոխանցվող ազդանշանի առկայության դեպքում[7]։
Շատ էֆեկտորային բջիջներ իրենց գործունեության ընթացքում մահանում են և մաքրվում ֆագոցիտների կողմից, իսկ նրանց մի փոքր մասը պահպանվում է որպես հիշողության բջիջներ[9]։ Նույն հակածնի հետ մեկ այլ հանդիպման ժամանակ հիշողության բջիջներն արագորեն վերափոխվում են էֆեկտորների։
T-օգնականներ
[խմբագրել | խմբագրել կոդը]
T օգնական լիմֆոցիտները (CD4+ լիմֆոցիտներ) իմունային պատասխանի միջնորդներ են և մեծացնում են ձեռքբերովի իմունային պատասխանի հնարավորությունները[7]։ Այս բջիջները չունեն ցիտոտոքսիկ կամ ֆագոցիտոզային ակտիվություն, չեն կարող սպանել վարակված բջիջներին կամ վերացնել ախտածինններին, սակայն սրանք կարգավորում և կառավարում են իմունային պատասխանը՝ ուղղորդելով այլ բջիջներին՝ կատարելու համար վերոնշյալ գործողությունները[17]։
T օգնականներն ունեն ընկալիչներ, որոնք ճանաչում են ՀԳՀ-ի II դասի մոլեկուլներին միացված հակածնին։ Ակտիվացված T օգնականներն արտադրում են ցիտոկիններ, որոնք ազդում են այլ բջիջների ակտիվության վրա, ներառյալ՝ հակածին ներկայացնող բջիջների։ T օգնականներն, ի տարբերություն ցիտոտոքսիկ լիմֆոցիտների, կարող են ակտիվանալ ավելի թույլ ազդակներից ևս։ T օգնականները կարող են ակտիվացնել նաև ցիտոտոքսիկ բջիջներին[9]։
T օգնականների պատասխանի տարատեսակներ
[խմբագրել | խմբագրել կոդը]Տարբերում են T օգնականների պատասխանի երկու տարատեսակներ՝ Th1 և Th2, որոնք նախատեսված են տարբեր բնույթի ախտածինների վնասազերծման համար։ Գործոնները, որոնք որոշում են, թե որ ձևով պատասխանը կդրսևորվի, դեռևս լրիվ բացահայտված չեն, սակայն այդ պատասխանները կարևոր դեր ունեն տարբեր ախտածինների վնասազերծման հարցում[7]։
Th1 պատասխանը բնութագրվում է ինտերֆերոն-գամմայի արտադրմամբ, որն ակտիվացնում է մակրոֆագերի բակտերիոցիդային (բակտերիոսպան) ակտիվությունը և նպաստում է նրան, որ B լիմֆոցիտներն արտադրեն օպսոնացնող և կոմպլեմենտ կապող հակամարմիններ, ինչպես նաև խթանում է բջջային իմունիտետը[7]։ T օգնականներն այն գլխավոր գործոններն են, որոնց ազդեցությամբ B լիմֆոցիտները վերածվում են պլազմային բջիջների և սկսում են հակամարմիններ արտադրել։
Th2 պատասխանը բնութագրվում է ինտերլեյկին 5-ի արտադրմամբ, որը խթանում է էոզինոֆիլների պարազիտասպան հատկությունը[18]։ Th2-ը պատասխանի դեպքում արտադրվում է նաև ինտերլեյկին 4, որը նպաստում է B լիմֆոցիտների իմունոգլոբուլինների դասի փոփոխմանը[7]։ Th1 պատասխանը հիմնականում ավելի արդյունավետ է ներբջջային ախտածինների նկատմամբ, մինչև դեռ Th2 պատասխանը հիմնականում գործում է արտաբջջային բակտերիաների, մակաբույծների և նրանց թույների նկատմամբ[7]։ Ցիտոտոքսիկ T բջիջների նման, T օգնականների մեծ մասն իրենց գործունեության ընթացքում մահանում են, իսկ քիչ մասը վերածվում են հիշողության բջիջների[19]։
Մարդկանց և մկների վրա կատարված հետազոտությունները փաստում են T օգնականների տարբեր տարատեսակների առկայության մասին։ Կարգավորիչ T օգնականները համարվում են ձեռքբերովի իմունիտետի կարևոր բացասական կարգավորիչ գործոններ, քանի որ սրանք սահմանափակում են և ճնշում ձեռքբերովի իմունային համակարգի գործունեությունը սեփական հակածիննների նկատմամբ։ Այս մեխանիզմը համարվում է աուտոիմունային հիվանդությունների զարգացման գլխավոր կարգավորիչը[9]։ Ֆոլիկուլային T օգնականներն օգնում են B լիմֆոցիտների կողմից հումորալ իմունիտետի իրականացմանը, քանի որ սրանք կարողանում են գաղթել երկրորդային ավշային օրգաններ՝ դեպի B լիմֆոցիտներ և նրանց հաղորդում այն ազդանշանները, որոնց արդյունքում արտադրվում են հակամարմինները։ Կարգավորիչ T օգնականների նման, ֆոլիկուլային T բջիջները նույնպես նպաստում են իմունոլոգիական անտարբերության (տոլերանտության) առաջացմանը։ Այդ պատճառով ֆոլիկուլային T բջիջների անբավարար քանակի դեպքում օրգանզիմում սինթեզվում են աուտոռեակտիվ հակամարմիններ, և որի արդյունքում առաջանում են աուտոիմունային հիվանդություններ[20]։
T օգնականների դերը հատկապես կարևորվում է ՄԻԱՎ-ի ժամանակ։ T օգնականներն այս հիվանդության հիմնական թիրախներից են[9]։
Գամմա-դելտա T լիմֆոցիտներ
[խմբագրել | խմբագրել կոդը]Գամմա-դելտա T լիմֆոցիտներն (γδ T բջիջներ) ունեն այլ T լիմֆոցիտային ընկալիչներ և իրենց հատկություններով նման են T օգնականներին, ցիտոտոքսիկ T բջիջներին և բնական սպանող լիմֆոցիտներին։ γδ T բջիջներն ունեն հատկություններ, որոնք նրանց դասում են թե ձեռքբերովի, թե բնածին իմունային համակարգերին։ Մի կողմից γδ T բջիջները համարվում են ձեռքբերովի իմունիտետի գործոն, քանի որ V(D)J վերակազմավորման միջոցով կարող են վերադասավորել ընկալիչների գեները։ Մյուս կողմից, նրա որոշ տարատեսակներ կարող են պատկանել բնածին իմունային համակարգին։
B լիմֆոցիտներ
[խմբագրել | խմբագրել կոդը]
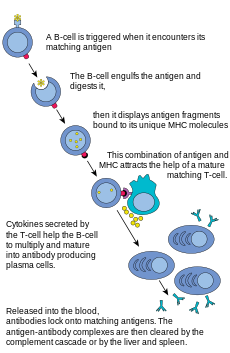

B լիմֆոցիտները համարվում են հակամարմիններ արտադրող գլխավոր բջիջները և պատասխանատու են հումորալ իմունիտետի ձևավորման համար։ Հակամարմինները խոշոր Y-աձև սպիտակուցներ են (իմունոգլոբուլիններ), որոնց շնրոհիվ օրգանիզմի կողմից ճանաչվում և վնասազերծվում են օտարածին մասնիկները։ Կաթնասուններն ունեն հակամարմինների՝ կենսաբանական և կառուցվածքային հատկություններով տարբերվող 5 տեսակներ. IgA, IgD, IgE, IgG և IgM: Ակտիվացումից և պլազմատիկ բջիջների վերածումից հետո B բջիջներն արտադրում են հակամարմիններ, որոնցից յուրաքանչյուրը ճանաչում է հատուկ հակածնին և չեզոքացնում ախտածնին[7]։
T լիմֆոցիտների նման, B լիմֆոցիտներն ունեն հատուկ ընկալիչներ։ Ամեն ընկալիչ ճանաչում և կապում է մեկ հատուկ հակածին։ B և T լիմֆոցիտների ամենաէական տարբերություններից մեկն այն է, թե ինչպես են նրանցից յուրաքանչյուրը "տեսնում" հակածնին։ T բջիջներն իրենց համապատասխան հակածնին ճանաչում են վերջինիս մշակված տարբերակով՝ որպես ՀԳՀ-ի մոլեկուլին միացված պեպտիդ[7], այն դեպքում երբ B լիմֆոցիտները հակածնին ճանաչում են վերջիններիս բնական վիճակում[7]։ Երբ B լիմֆոցիտը հանդիպում է իր յուրահատուկ հակածնին և լրացուցիչ ազդանշանններ է ստանում T օգնականներից, այն ձևափոխվում է էֆեկտորային բջջի, որը հայտնի է պլազմային բջիջ անվամբ[7]։
Պլազմային (պլազմատիկ) բջիջները կյանքի կարճ տևողությամբ (2-3 օր) բջիջներ են, որոնց հիմնական ֆունկցիան հակամարմիններ արտադրությունն է։ Այս հակամաիմինները կապվում են հակածնին, որի արդյունքում ֆագոցիտների համար նրանք դարձնում են ավելի խոցելի, ինչպես նաև հարուցում են կոմպլեմենտի կասկադը[7]։ Պլազմային բջիջների մետավորապես 10 %-ը դառնում են հիշողության B բջիջներ[7]։ Հիշողության բջիջների շնորհիվ նման հակածնի կրկին ներթափանցման դեպքում ապաշտպանական մեխանիզմներն ավելի արագ են գործում[21][22]։
Այլընտրանքային ձեռքբերովի իմունային համակարգ
[խմբագրել | խմբագրել կոդը]Չնայած ձեռքբերովի իմունիտետի գլխավոր մոլեկուլները՝ հակամարմինները և T բջիջների ընկալիչներն առկա են միայն ծնոտավոր ողնաշարավորներ մոտ, առանձին մոլեկուլներ հայտնաբերվել են պարզագույն ծնոտազուրկ ողնաշարավորների մոտ ևս (lamprey, hagfish)։ Այս կենդանիներն ունեն տարատեսակ մոլեկուլներ, որոնք կոչվում են լիմֆոցիտային փոփոխական ընկալիչներ: Սրանք, ծնոտավոր ողնաշարավորների հակածնային ընկալիչների նման, արտադրվում են 1-2 գեների կողմից։ Այս մոլեկուլները, հակամարմինների նման, միանում են հակածիններին[23]։
Ակտիվացված B և T բջիջների մի փոքր մասը վերածվում է հիշողության B և T լիմֆոցիտների։ Նախկինում հանդիպած հակածնի հետ կրկին հանդիպելու դեպքում համապատասխան հիշողության բջիջնեն ակտիվանում են։ Սրա շնորհիվ հակածնի հետ կրկնակի հանդիպման դեպքում օրգանիզմի իմունային պատասխանն ավելի ուժեղ և արագ է զարգանում։ Սրա շնորհիվ օրգանիզմի իմունային համակարգը ինքն իրեն նախապատրաստում է հետագա վարակներից պաշտպանվելու համար։ Իմունոլոգիական հիշողությունը կարող է լինել պասիվ կարճաժամկետ կամ ակտիվ երկարաժամկետ:
Պասիվ ձեռքբերովի իմունիտետ
[խմբագրել | խմբագրել կոդը]Պասիվ հիշողությունը սովորաբար կարճաժամկետ է, տևում է մի քանի օրից մինչև մի քանի ամիս։ Նորածինները չունեն մանրէների հետ շփման նախնական փորձ և խոցելի են վարակների նկատմամբ։ Նրանց մոտ՝ մինչև ծնվելը, պասիվ իմունիտետն առաջանում է մորից պտղին (ընկերքի միջոցով) հակամարմինների փոխանցման միջոցով և մի քանի ամիսների ընթացքում ապահովում է նորածինների իմունիտետը որոշ վարակիչ հիվանդությունների հանդեպ։
Հղիության ընթացքում IgG-ն ընկերքի միջով անցնում է պտղի օրգանիզմ, այդ պատճառով ծննդյան պահին նորածինն ունենում է մոր հակածնային կազմին բնորոշ հակամարմինների բարձր մակարդակ[7]։ Մոր կաթը պարունակում է հակամարմիններ (հիմնականում՝ IgA), որոնք աղիներով կարողանում են թափանցել նորածնի օրգանիզմ և պաշտպանել նրան այնքան ժամանակ, մինչև իր օրգանիզմը կսինթեզի սեփական հակամարմինները[7]։
Սա պասիվ իմունիտետ է, քանի որ պտղի օրգանիզմը իրականում չի ստեղծում հիշողության բջիջներ և չի սինթեզում հակամարմիններ, այլ ուղղակի վերցնում է մոր օրգանիզմից կամ կաթով։ Կարճատև պասիվ իմունիտետը կարող է զարգանալ նաև արհեստական ճանապարհով՝ հակամարմիններով հարուստ շիճուկի ներարկման միջոցով։
Ակտիվ ձեռքբերովի իմունիտետ
[խմբագրել | խմբագրել կոդը]Ակտիվ իմունիտետը հիմնականում երկարատև է և կարող է լինել ձեռքբերովի (ախտածնով վարակվելու պատճառով) և արհեստական (կատարվում է վակցինաներով)։ Հակածին ներարկելուց 1–2 շաբաթ անց ձևավորվումէ իմունիտետը, որը պահպանվում է երկար տարիներ (կարմրուկի դեպքում՝ ամբողջ կյանքի ընթացքում)։
Իմունացում
[խմբագրել | խմբագրել կոդը]Պատմական ողջ ժամանակաշրջանում վարակիչ հիվանդություններն ուղեկցվել են հսկայական թվով մարդկանց հիվանդացությամբ և մեծաքանակ մահերով։ Վերջին 100-150 տարում երկու կարևոր գործոններ՝ իմունացումն ու հիգիենա-սանիտարիան էապես նվազեցրեցին վարակիչ հիվանդությունների տարածումն ու նվազեցրեցին դրանց հետևանքով առաջացող մահերը[9]։ Իմունացումը (վակցինացում) վարակիչ հիվանդություններից պաշտպանվելու հուսալի եղանակ է, որի դեպքում օրգանիզմում առաջանում են հակամարմիններ՝ ուղղված կոնկրետ հիվանդության հարուցիչների դեմ[9]։
Իմունացման սկզբունքն այն է, որ օրգանիզմ են ներմուծում որևէ հակածին, որը հիվանդություն չի առաջացնում, սակայն խթանում է իմունային համակարգն ու օրգանիզմում ձևավորվում են հակամարմիններ[8]։ Վիրուսային հիվանդությունների համար այդ նպատակով ստանում են թույլ վիրուլենտությամբ հակածիններ, իսկ բակտերիային հիվանդությունների դեպքում հիմնականում օգտվում են ախտածինների ոչ բջջային բաղադրիչներից կամ տոքսիկությունից զուրկ թույներից[8][9]։
Իմունոլոգիական բազմազանություն
[խմբագրել | խմբագրել կոդը]
Որպես հակածին կարող են հանդես գալ բազմաթիվ սպիտակուցներ և բազմաշաքարներ (պոլիսախարիդներ)[7]։ Հակածնի այն մասը, որը կապվում է հակամարմնի կամ լիմֆոցիտային ընկալչի հետ, կոչվում է էպիտոպ կամ հակածնային դետերմինանտ։ Հակածինների մեծամասնությունն ունի բազմատեսակ էպիտոպներ և կարող է խթանել հակամարմինների արտադրությունը, T լիմֆոցիտների գործունեությունը[7]։ Ամբողջական լիմֆոցիտների շատ քիչ մասը (0.01%-ից պակաս) կարող է կապել հատուկ հակածնին, որը փաստում է որ միայն քիչ քանակի բջիջներ են պատասխանում հակածնին[9]։
Բազմատեսակ ախտածիններին հիշելու և վնասազերծելու համար իմունային համակարգը պետք է կարողանա տարբերակել տարբեր տեսակի հակածինները[8], ինչպես նաև պետք է առաջանան մեծ բազմազանությամբ հակածիններին ճանաչող ընկալիչներ։ Նույնիսկ հակածնով խթանման բացակայութան դեպքում մարդու օրգանիզմը կարող է արտադրել ավելի քան 1 տրիլիոն տարբեր տեսակի հակամարմիններ[9][24]։
Կլոնային ընտրության (սելեկցիայի) ընթացքում արտադրվում են հսկայական թվով ընկալիչներ[7][8]։ Կլոնային ընտրության տեսության համաձայն ծննդյան պահին օրգանիզմը պատահականորեն առաջացնում է տարատեսակ լիմֆոցիտներ, որոնցից յուրաքանչյուրը կրում է հատուկ հակածնային ընկալիչներ։ Յուրաքանչյուր հակածնային հատուկ ընկալչի առաջացման համար պատասխանատու գեները կատարում են մի գործընթաց, որը կոչվում է V(D)Jվերախմբավորում: Այս գործընթացում մեկ գենի հատվածը վերախմբվում է այլ գենի հատվածի հետ և առաջացնում հատուկ գեն։ Այս ամենի հետևանքով, մինչև հակածնի հետ հանդիպումը, առաջանում են տարբեր տեսակի ընկալիչներ և հակամարմիններ[7]։
Իմունային համակարգի ձեռքբերովի և բնածին մեխանիզմները գործում են իրար հետ համագործակցված, և ոչ թե առանձին-առանձին։ T լիմֆոցիտներն անկարող են գործել առանց հակածին ներկայացվող բջիջների, իսկ B լիմֆոցիտների գործունեությունը խախտվում է առանց T բջիջների։ Այսպիսով, իմունայիան համակարգի տարբեր բաղադիրչները գործում են իրար հետ խիստ փոխկապակցված և ապահովում օրգանիզմը ընդհանուր պաշտպանությունը։
Ձեռքբերովի իմունիտետը հղիության ընթացքում
[խմբագրել | խմբագրել կոդը]Իմունային համակարգի գործունեության հիմքում ընկած է սեփական և օտար բջիջների տարբերակումը։ Այս տեսակետից շատ հետաքրքիր են այն մեխանիզմները, որոնք պաշտպանում են հղի մոր օրգանզիմում զարգացող պտուղը (տվյալ դեպքում՝ օտար, ոչ սեփական) իմունային համակարգի ազդեցությունից։
Կան տարբեր տեսություններ և փաստեր այդ ուղղությամբ, որոնցից երկուսն են տարածված։ Առաջին տեսության համաձայն պտուղը պաշտպանվում է ոչ իմունոլոգիական պատնեշով՝ արգանդով[7]։ Երկրորդն այն է, որ պտուղն ինքն առաջացնում է տեղային իմունային ճնշվածություն[7]։ Ըստ ժամանակակից բացատրությունների հղիության ժամանակ արգանդի գլիկոպրոտեիդները ճնշում են արգանդային իմունային պատասխանը։
Հղիության ընթացքում կենդանածին կաթնասունների (բոլոր կաթնասունները, բացի՝ միանցքանիներից) մոտ ներսածին ռետրովիրուսներն ակտիվանում են և շատանում։ Սրանք արտադրում են իմունաճնշող պրոպեպտիդներ, որոնք, ըստ առկա կարծիքի, պաշտպանում են պտղի օրգանիզմը մոր իմունային համակարգից։ Բացի այդ, ձուլման վիրուսային պրոտեիններն առաջացնում են արգանդի սինցիտիումը[25], որի պատճառով փոքրանում է մոր և զարգացող պտղի միջև բջիջների փոխանակումը (որոշ դեպքերում միայն էպիթելային շերտը չի կարող լիարժեքորեն կանխել դա, քանի որ արյան որոշ բջիջներ կարող են ներդրվել էպիթելային բջիջների արանքում)։ Ընդ որում, ինունաճնշիչ հատկությունը վիրուսներին բնորոշ հատկություն է հանդիսանում։ Նույն գործընթացն է նկատվում նաև ՄԻԱՎ-ի դեպքում[26]։
Իմունային ցանցի տեսություն
[խմբագրել | խմբագրել կոդը]Ձեռքբերովի իմունիտետի աշխատանքի սկզբունքը փորձում են բացատրել իմունային ցանցի տեսությամբ, որը հիմնված է իդիոտոպերի (հակամարմնի տարբեր հատվածներում էպիտոպերի հատուկ ցանց) և "հակաիդիոտոպերի" (հակածնային ընկալիչներ, որոնք հակածնի առկայության դեպքում փոխազդում են իդիոտոպերի հատ) միջև եղած փոխազդեցության վրա։ Այս տեսությունը, որը հիմնված է կլոնային ընտրության տեսության վրա և 1974 թվականից սկսած զարգացվել է հիմնականում Նիլս Ջերնեի (Niels Jerne) և Ջոֆրեյ Հոֆֆմանի (Geoffrey W. Hoffmann) կողմից, ՄԻԱՎ-ի ախտածնությունը և ՄԻԱՎ-ի դեմ վակցինա ստանալու տեսակետից համարվում է համապատասխան։
Ձեռքբերովի իմունիտետի խթանումը
[խմբագրել | խմբագրել կոդը]Բժշկակենսաբանական հետազոտությունների կենտրոնում ձեռքբերովի իմունիտետի մեխանիզմների բացահայտման, ինչպես նաև նրա բարձրացման և խթանման ուսումնասիրություններն են։ Իմունային համակարգի գործունեության մեխանիզմների պարզաբանման հարցերով զբաղվում է իմունոգենետիկան, որը իմունաբանության բաժիններից է և ձևավորվել է 1960–70-ական թվականներին։
Հետաքրքրություն են ներկայացնում Toll-նման ընկալիչների վերաբերյալ կատարվող ուսումնասիրությունները, որոնք հարուցում են տարբեր բջիջների (օրինակ՝ մոնոցիտների) դիմադրությունը բարձրացնող ինտերֆերոնի և այլ ցիտոկինների արտադրություն[27]։ Ցիտոկինները, որոնք արտադրվում են բնածին իմունային պատասխանի ժամանակ, ձեռքբերովի իմունիտետի ակտիվատորներ են[27]։ Անկայուն HbS-ը խմբավորվում է Band-3-ի հետ (էրիթրոցիտների հիմնական ինտեգրալ սպիտակուց)[28], հակամարմինները ճանաչում են այդ կլաստերն ու արագացնում նրա վերացումը ֆագոցիտների կողմից։ Հակամարմիններին միացված խմբավորված (կլաստերացված) Band-3-ի պրոտեիններն ակտիվացնում են կոմպլեմենտին։ Կոմպլեմենտի C3 հատվածները օպսոնիններ են, որոնք ճանաչվում են ֆագոցիտների վրա գտնվող CR1 կոմպլեմենտային ընկալիչներով[6][29]։
Հետազոտությունները փաստում են, որ արևադարձային մալարիայի դեմ մանգաղաձև բջիջների պաշտպանական արդյունքի բնորոշ գիծը ներառում է ձեռքբերովի և բնածին իմունային պատասխանների մեծացում մալարիայի հարուցիչների դեմ, որը ցուցադրում է բնածին իմունիտետից ձեռքբերովի իմունիտետին անցնելը[30][31]։
Էվոլյուցիա
[խմբագրել | խմբագրել կոդը]Ձեռքբերովի իմունային համակարգը, որն առավել լավ ուսումնասիրված է կաթնասունների մոտ, զարգացել է ծնոտավոր ձկների մոտ մոտավորապես 500 միլիոն տարի առաջ։ Այս համակարգի պաշտպանության բազմաթիվ բջիջներ, մոլեկուլներ, հյուսվածքներ հայտնաբերվել են նաև կռճիկային ձկների մոտ[32]։
Հյուսվածահամատեղելիության գլխավոր համալիրը, լիմֆոցիտային ընկալիչները, իմունոգլոբուլիններն ու T լիմֆոցիտների ընկալիչները հայտնաբերվել են ծնոտավոր ողնաշարավորների օրգանիզմում։ Իմունոգլոբուլինների ամենահին դասը՝ IgM-ը, կռճիկային ձկների մոտ թաղանթին կպած է լինում և արտազատվում է B բջիջների խթանման դեպքում[33]։ Մեկ այլ իզոտիպ՝ շնաձկների IgW-ը, համարվում է կաթնասունների IgD-ի համանմանը։ α/β և γ/δ T լիմֆոցիտային ընկալիչները հայտնաբերվել են բոլոր կենդանիների մոտ՝ սկսած ծնոտաբերանայիններից մինչև կաթնասուններ։ Գենի վերախմբավորում առաջացնող գենային հատվածների կազմակերպումը տարբեր է կռճիկային ձկների մոտ[21]։
Լիմֆոիդային բջիջներ են հայտնաբերվել նախաողնաշարավորներից որոշ երկրորդաբերանայինների մոտ (օրինակ՝ ծովային փշամորթներ)[34]։ Սրանք հակածիններին կապում են բնածին իմունային համակարգի պատտերն ճանաչող ընկալիչներով (pattern recognition receptors)։ Ծնոտազուրկ ձկների լիմֆոցիտների երկու տարատեսակներ հակածնին կապելու համար ունեն փոփոխական լիմֆոցիտային ընկալիչներ[35]։ Սրանք առաջանում են ցիտոզին դիմինազով հարուցված ԴՆԹ-ի հատվածների վերախմբավորմամբ[32][36]։
Պատկերներ և տեսանյութեր
[խմբագրել | խմբագրել կոդը]-
Լիմֆոցիտների ակտիվացման ուղին -
1AU1 մարդու ինտերֆերոն-բետտա -
HIV-1 վիրուսի (կարմիր) և հակամարմնի (կանաչ) փոխազդեցությունը -
Իմունոգլոբուլինների գենային կազմակերպումը -
IgG իմունոգլոբուլինի մակերեսը -
IgM -
Իմունային համալիր -
Հակամարմիններ և նրանց տարբեր հատվածամասեր -
ՄԻԱՎ-ի վիրուսին միացված հակամարմին -
Հակածնի ներկայացման ուղի -
Թաղանթին միացված IL-21-ը խթանում է բնական սպանող լիմֆոցիտների զարգացումը -
Դենդրիտային բջիջների ընկալիչների գործունեությունը -
CD8 T լիմֆոցիտների ազդեցության երեք փուլերը -
T լիմֆոցիտներով պայմանավորված բջջային իմունիտետ -
Թիմոցիտների զարգացման մաթեմատիկական պատկերավող մոդել -
Բնական սպանող T լիմֆոցիտների գործունեությունը -
Պլազմային բջիջ
Արտաքին հղումներ
[խմբագրել | խմբագրել կոդը]- The Center for Modeling Immunity to Enteric Pathogens (MIEP)
- Introduction to Immunology Tutorial
- Acquired Immunity
- immune defenses
- Immunity Արխիվացված 2015-11-08 Wayback Machine
- The Lymphatic System
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ Molecular Biology of the Cell. 4th edition Alberts B, Johnson A, Lewis J, et al. New York: Garland Science; 2002
- ↑ Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. Chapter 24, The Adaptive Immune System. Available from: http://www.ncbi.nlm.nih.gov/books/NBK21070/
- ↑ Steele, E.J. Mechanism of somatic hypermutation: critical analysis of strand biased mutation signatures at A:T and G:C base pairs. Mol Immunol. 2009;46:305–320.
- ↑ Peled, J.U., Kuang, F.L., Iglesias-Ussel, M.D., Roa, S., Kalis, S.L., Goodman, M.F. et al, The biochemistry of somatic hypermutation. Annu Rev Immunol. 2008;26:481–511.
- ↑ Oltz, E.M., Osipovich, O. Targeting V(D)J recombinase: putting a PHD to work. Immunity. 2007;27:539–541.
- ↑ 6,0 6,1 Madame Curie Bioscience Database [Internet].Austin (TX): Landes Bioscience; 2000-.
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 7,11 7,12 7,13 7,14 7,15 7,16 7,17 7,18 7,19 7,20 7,21 7,22 7,23 7,24 7,25 7,26 7,27 7,28 Janeway, C.A., Travers, P., Walport, M., and Shlomchik, M.J. (2001). Immunobiology (5th ed.). New York and London: Garland Science. ISBN 0-8153-4101-6.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link). - ↑ 8,0 8,1 8,2 8,3 8,4 8,5 Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., and Walters, P. (2002). Molecular Biology of the Cell (4th ed.). New York and London: Garland Science. ISBN 0-8153-3218-1.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 Janeway C.A., Travers, P., Walport, M., Shlomchik, M.J. (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Dustin, M.L. The cellular context of T cell signaling. Immunity. 2009;30:482–492.
- ↑ Chatila, T.A. Role of regulatory T cells in human diseases. J Allergy Clin Immunol. 2005;116:949–960.
- ↑ Richards, S., Watanabe, C., Santos, L., Craxton, A., Clark, E.A. Regulation of B-cell entry into the cell cycle. Immunol Rev. 2008;224:183–200.
- ↑ LeBien, T.W., Tedder, T.F. B lymphocytes: how they develop and function. Blood. 2008;112:1570–1580.
- ↑ Conley, M.E., Dobbs, A.K., Farmer, D.M., Kilic, S., Paris, K., Grigoriadou, S. et al, Primary B cell immunodeficiencies: comparisons and contrasts. Annu Rev Immunol. 2009;27:199–227.
- ↑ Microbiology and Immunology On-Line Textbook: USC School of Medicine
- ↑ 16,0 16,1 16,2 The NIAID resource booklet "Understanding the Immune System (pdf)".
- ↑ Microbial Ecology in States of Health and Disease: Workshop Summary. Forum on Microbial Health; Board on Global Health; Institute of Medicine. Washington (DC): National Academies Press (US); 2014 Feb 18.
- ↑ Spencer LA, Weller PF. (2010) Eosinophils and Th2 immunity: contemporary insights. Immunol Cell Biol. 88(3):250-6.
- ↑ Front Immunol. 2015 Sep 11;6:469. doi: 10.3389/fimmu.2015.00469. eCollection 2015. Induction of Regulatory T Cells by Intravenous Immunoglobulin: A Bridge between Adaptive and Innate Immunity.Kaufman GN, Massoud AH, Dembele M, Yona M, Piccirillo CA, Mazer BD.
- ↑ Weinstein JS, Hernandez SG, Craft J. (2012) T cells that promote B-Cell maturation in systemic autoimmunity. Immunol Rev. 247(1):160-71.
- ↑ 21,0 21,1 Immunobiology: The Immune System in Health and Disease. 5th edition Janeway CA Jr, Travers P, Walport M, et al.New York: Garland Science; 2001.
- ↑ Front Immunol. 2015 Sep 8;6:456. doi: 10.3389/fimmu.2015.00456. eCollection 2015. Development and Function of Protective and Pathologic Memory CD4 T Cells. Jaigirdar SA, MacLeod MK.
- ↑ M.N. Alder, I.B. Rogozin, L.M. Iyer, G.V. Glazko, M.D. Cooper, Z. Pancer (2005). «Diversity and Function of Adaptive Immune Receptors in a Jawless Vertebrate». Science. 310 (5756): 1970–1973. doi:10.1126/science.1119420. PMID 16373579.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ International Human Genome Sequencing Consortium (2004). «Finishing the euchromatic sequence of the human genome». Nature. 431 (7011): 931–45. doi:10.1038/nature03001. PMID 15496913.
- ↑ Mi S, Lee X, Li X; և այլք: (Feb 2000). «Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis». Nature. 403 (6771): 785–9. doi:10.1038/35001608. PMID 10693809.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Luis P. Villarreal. «The Viruses That Make Us: A Role For Endogenous Retrovirus In The Evolution Of Placental Species». University of California, Irvine (lecture notes). Արխիվացված է օրիգինալից 2007 թ․ հուլիսի 15-ին. Վերցված է 2008 թ․ փետրվարի 3-ին.
- ↑ 27,0 27,1 Uematsu S, Akira S (2007). «Toll-like receptors and Type I interferons». J Biol Chem. 282 (21): 15319–1523. doi:10.1074/jbc.R700009200. PMID 17395581.
- ↑ Kuross SA, Rank BH, Hebbel RP (1988). «Excess heme in sickle erythrocyte inside-out membranes: possible role in thiol oxidation» (PDF). Blood. 71 (4): 876–882. PMID 3355895.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Arese P, Turrini F, Schwarzer E (2005). «Band 3/complement-mediated recognition and removal of normally senescent and pathological human erythrocytes» (PDF). Cell Physiol Biochem. 16 (4–6): 133–146. doi:10.1159/000089839. PMID 16301814.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Williams TN, Mwangi TW, Roberts DJ, Alexander ND, Weatherall DJ, Wambua S, Kortok M, Snow RW, Marsh K (2005). «An Immune Basis for Malaria Protection by the Sickle Cell Trait». PLoS Med. 2 (5): e128. doi:10.1371/journal.pmed.0020128. PMC 1140945. PMID 15916466.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Schofield L, Grau GE (2005). «Immunological processes in malaria pathogenesis». Nature Reviews Immunology. 5 (9): 722–735. doi:10.1038/nri1686. PMID 16138104.
- ↑ 32,0 32,1 Flajnik, MF; Kasahara, M (Jan 2010). «Origin and evolution of the adaptive immune system: genetic events and selective pressures». Nature reviews. Genetics. 11 (1): 47–59. doi:10.1038/nrg2703. PMC 3805090. PMID 19997068.
- ↑ Cooper, M.D., Alder, M.N. The evolution of adaptive immune systems. Cell. 2006;124:815–822.
- ↑ Hibino, T; Loza-Coll, M; Messier, C; Majeske, AJ; Cohen, AH; Terwilliger, DP; Buckley, KM; Brockton, V; Nair, SV; Berney, K; Fugmann, SD; Anderson, MK; Pancer, Z; Cameron, RA; Smith, LC; Rast, JP (2006 թ․ դեկտեմբերի 1). «The immune gene repertoire encoded in the purple sea urchin genome». Developmental biology. 300 (1): 349–65. doi:10.1016/j.ydbio.2006.08.065. PMID 17027739.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Pancer, Z; Amemiya, CT; Ehrhardt, GR; Ceitlin, J; Gartland, GL; Cooper, MD (2004 թ․ հուլիսի 8). «Somatic diversification of variable lymphocyte receptors in the agnathan sea lamprey». Nature. 430 (6996): 174–80. doi:10.1038/nature02740. PMID 15241406.
- ↑ Rogozin, IB; Iyer, LM; Liang, L; Glazko, GV; Liston, VG; Pavlov, YI; Aravind, L; Pancer, Z (Jun 2007). «Evolution and diversification of lamprey antigen receptors: evidence for involvement of an AID-APOBEC family cytosine deaminase». Nature immunology. 8 (6): 647–56. doi:10.1038/ni1463. PMID 17468760.
| ||||||||||||||||||||||||||||||||
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի օրվա հոդված: |












