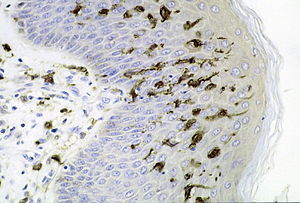
Դենդրիտային բջիջ
| Դենդրիտային բջիջ | |
|---|---|
 | |
| Տեսակ | բջջի տեսակ |
| Ենթադաս | Լեյկոցիտ, antigen-presenting cell? և differentiated hemal cell?[1] |
| MeSH | A11.066.270, A11.436.270, A15.382.066.270 և A15.382.670.260 |
| Foundational Model of Anatomy | 83036 |
| Terminologia Histologica | H1.00.01.0.00038 |
Դենդրիտային բջիջ (ԴԲ, անգլ.՝ Dendritic cells, DC), մասնագիտացված լեյկոցիտար բջիջ, որը իրագործում էանտիգենի ներկայացում։ Հիմնականում ունեն ելուստավոր կառուցվածք։ Դենդրիտային բջիջներն իմուն համակարգում կարևորագույն գործառույթ են կատարում, քանի որ իրանք անհրաժեշտ են T-բջիջ կախյալ պատասխանի համար։ Դենդրիտային բջիջները էքսպրեսսում են հյուսվածքահամատեղելիության մոլեկուլներ՝ (MHC-I) և II (MHC-II), որոնց վրա էլ իրենք T-լիմֆոցիտներին անտիգեն են ներկայացնում։
Գրեթե բոլոր դենդրիտային բջիջները ունեն ոսկրածուծային ծագում, բացի ֆոլիկուլային դենդրիտային բջիջներից, որոնք ունեն մեզենքիմալ ծագում։ Ոսկրածուծային ծագման դենդրիտային բջիջները պատկանում են ինչպես միելոիդ ծլին, այնպես էլ լիմֆոիդ։ Դենդրիտային բջիջնռր կարող են ստացվել նաև ֆիբրոբլաստերից, ինչպես նաև ծայրամասային արյան մոնոցիտներից և ոսկրածուծի ցողունային բջիջներիվ։ Գոյություն ունեն դենդրիտային բջիջների մի քանի տեսակ՝ միելոիդ դենդրիտային բջիջներ, պլազմոցիտոիդ դենդրիտային բջիջներ, ֆոլիկուլյառ դենդրիտային բջիջներ և Լանգերհանսի բջիջներ։
Դենդրիտային բջիջները կարևոր դեր են խաղում աուտոիմուն հիվանդությունների զարգացման համար, ինչպես նաև խաղցկեղի և բազում այլ հիվանդությունների զարգացման գործում։ Մի շարք վիրուսների համար, օրինակ՝ ՄԻԱՎ-ի, դենդրիտային բջիջները թիրախի դեր են խաղում։ Երբեմն դենդրիտային բջիջները քաղցկեղի պատճառ են դառնում՝ չարորակ վերածնման պատճառով։
Դենդրիտային բջիջները առաջին անգամ նկարագրել է Պաուլ Լանգերհանսը՝ 1868թ-ին։ Ինչի արդյունքում իր հայտնաբերված բջիջների որոշ տարատեսակ անվանել են Լանգերհանսի բջիջներ։ Բջիջների գործառույթը հնարավոր եղավ բացահայտել XX դարի երկրորդ կեսին։ 1973թ․-ին Ռալֆ Սթայնմանն և Զանվիլ Կոն-ը գործածության բերեցին «դենդրիտային բջիջ» արտահայտությունը։
2011թ-ին բջիջների բացահայտման համար Սթայմանն արժանացավ ֆիզիոլոգիայի և բժշկության ոլորտում Նոբելյան մրցանակի։
Կառուցվածք
[խմբագրել | խմբագրել կոդը]Դենդրիտային բջիջները ներկայացնում են իրենցից խոշոր (15-20 մկմ շառավղով) շարժուն բջիջներ, որոնք ունեն ապակենտրոն կորիզի տեղակայություն և երկար ցիտոպլազմատիկ ելուստներ, որոնք կարող են գերազանցել 10մկմ-ը[2][3]։ Դենդրիտային բջիջների ցիտոպլազման պարունակում է քիչ քանակությամբ ներբջջային օրգանոիդներ, սակայն բավականին մեծ քանակությամբ միտոքոնդրիումներ[4]։
Անկախ դենդրիտային բջիջների մասնագիտացումից, իրենք ունեն ելուստավոր կառուցվածք, պսևդոպոդիաներ և թավիկներ[5]։
Բոլոր դենդրիտային բջիջները սինթեզում են գլխավոր հյուսվածքահամատեղելիության գործոնները՝ (MHC-I) և II (MHC-II), ինչպես նաև CD80 և CD86 մոլեկուլներ։ Բացի դրանից, իրենք բոլորը կարող զավթել հակածինը պինոցիտոզի և, ավելի հազվադեպ, ֆագոցիտոզի միջոցով։ Դրանից հետո իրենք հակածինը ենթարկում են պրոցեսսինգի (մշակման) և ներկայացնում են T-բջիջներին, ինչի արդյունքում վերջիններս ակտիվանում են[2][6]։
Զարգացում
[խմբագրել | խմբագրել կոդը]Դենդրիտային բջիջների սկիզբ են արյունաստեղծ ցողունային բջիջները, այսինք, դենդրիտային բջիջները, բացի ֆոլիկուլ դենդրիտային բջիջներից, ունեն մեզենքիմալ ծագում և առաջանում են կարմիր ոիսկրածուծում։

Դենդրիտային բջիջներն առաջանում են ինչպես միելոիդ ծլից, այդպես էլ լիմֆոիդ բջիջ նախորդներից։ Դենդրիտային բջիջների տարբերակումը հնարավոր է զարգացման վաղ փուլերում[7]։
Դենդրիտային բջիջների մեծ մասը պատկանում է միելոիդ ծլին։ Համարվում են, որ in vivo դենդրիտային բջիջները կարող են առաջանալ ինչպես գրանուլոցիտ-մոնոցիտային նախորդներից, այդպես էլ մոնոցիտներից։ Միջավայրի մեջ միելոիդ դենդրիտային բջիջները կարելի է ստանալ ոսկրածուծի բջիջներից, որոշ ցիտոկինների ազդեցությամբ (օր՝ GM-CSF, GM-CSF, IL-4)։
Լիմֆոիդ ծլի դենդրտային բջիջները մասնագիտացվում են ընդհանուր լիմֆոիդ նախորդից, ինրօես նաև T- և B- բջիջների նախորդներից։ Զարգացումը կարող է լինել նաև թիմոցիտներից՝ ուրցագեղձում իրենց զարգացման ամենավաղ փուլում (DN1-բջիջներից)։
Դենդրիտային բջիջների միելոյիդ և լիմֆոիդ ծլերի նախորդ բջիջներին ընդհանրացնում է FLT3 ցիտոկինային ընկալչի սինթեզը, որը իրենց տարբերում է իմուն համակարգի այլ բջիջ նախորդներից։ Այսպիսով, դենդրիտային բջիջները կարող են առաջանալ 6—7 բջջային աղբյուրներից[8]։ ՅՈԹ
Ծայրամասային արյան մեջ առկան են անհաս դենդրիտային բջիջներ, որոնքկազմում են ընդհանուր լեյկոցիտների 0,5 % և հանդիսանում են դենդրիտային և Լանգերհանսի բջիջների նախորդներ։ Միելոիդ բջիջների հիմանակն մարկերներն են CD11c և MHC-II մոլեկուլները։
Հիմնական անհաս դենդրիտային բջիջները կազմում են պլազմոցիտոիդ դենդրիտային բջիջները, որոնք պատկանում են լիմֆոիդ ծիլին։ Անհաս դենդրիտային բջիջները անցնում են հյուսվածքներ իրենց մակերեսին գտնվող β-քեմոկինային ընկալիչների միջոցով[9]։ Չնայած նրան, որ դենդրիտային բջիջները գտնվում են գրեթե բոլոր հյուսվածքներում և օրգաններում, իրենց քանակությունը քիչ է, այդ իսկ պատճառով իրենք համեմատաբար ուշ են հայտնաբերվել։ Ինչպես մակրոֆագերը, դենդրիտային բջիջները բաժանվում են մշտականների, որոնք հիմնականում գտնվում են պաշտպանական հյուսվածքներում (մաշկ, լորձաթաղանթ), և բորբոքայինների, որոնք հյուսվածքում հայտվում են բորբոքման ժամանակ[10]։
Գործառույթներ
[խմբագրել | խմբագրել կոդը]Դենդրիտային բջիջների հիմնական գործառույթը հակածինների ներկայացումն է T-բջիներին։ Այդ իսկ պատճառով իրենց դասում են «մասնագիտացված» հակածին ներկայացնող բջիջներին։ Ներկայացման արդյունավետությամբ այն երկու անգամ գերազանցում է մակրոֆագերին, քանի որ սինթեզում է ավելի մեծ քանակությամբ MHC մոլեկուլներ, առավելապես՝ MHC-II, ինչպես նաև կոստպիմուլացնող մոլեկուլներ։ Անտիգենի ներկայացումը T-լիմֆոցիտներին ակտիվացնում է իմուն պատասխանը[10]։
Դենդրիտային բջիջները ակտիվ և անդադար ճանաչում են պաթոգենները (ավելի ճիշտ պաթոգեն-համակցված մոլեկուլյար պատտերները՝ PAMP[11]), որի շնորհիվ Toll-անման ընկալիչների միջոցով այն կարողանում է խժռել հակածիններին՝ պինոցիտոզի և քիչ քանակությամբ ֆագոցիտոզի միջոցով[7]։
Եթե դենդրիտային բջիջների շուրջը օտարածին անտիգեններ չկան, ապա այն խժռում է և ներկայացնում է սեփական բջիջները T-բջիջներին, բայց առանց իմուն պատասխանի խթանման, ինչի արդյունքում աուտոիմուն ռեակցիաներ չեն առաջանում։
Մինչև հակածնով ակտիվացումը, դենդրիտային բջիջները անհաս են և ունեն ցածր ներկայացուցչական ակտիվություն։ Դենդրիտային բջիջների հասունացումը տեղի է ունենում Toll-ընկալչին պաթոգենի կապումով։ Միելոիդ շարքի դենդրիտային բջիջները, ինչպես մակրոֆագերը, կրում են մանոզի, լիպոպոլիսախարիդների համար ինչպես նաև TLR2 և TLR4 ընկալիչներ, ինչը թույլ է տալիս ճանաչել համապատասխանաբար գրամ-դրական և գրամ-բացասական մանրէները։ Պլազմոցիտոիդ դենդրիտային բջիջները կրում են TLR7 և TLR9 ընկալիչները, որոնք ճանաչում են բակտերիաների և վիրուսների ԴՆԹ-ն[12]։
Պաթոգենի ճանաչումից հետո՝ դենդրիտային բջիջներում մեծանում է ցիտոկինների և քեմոկինների սինթեզը, ինչպես նաև մեծանում են ադհեզիվ մոլեկուլների սինթեզը, որոնք անհրաժեշտ են T-բջիջներին անտիգեն ներկայացնելու և իրենց խթանելու համար[6]։
Հիմնականում պրոցեսսինգի ենթարկված անտիգենները ներկայացվում են լիմֆոցիտներին MHC-I մոլեկուլի հետ կոմպլեքսի մեջ։ Այդ գործընթացը կոչվում է խաչաձև ներկայացում[13]։ Մեկ հասուն դենդրիտային բջիջները կարող են ակտիվացնել 100-ից 3 հազար T-բջիջ[7]։
CCL19, CCL21 և CXCL12 քեմոկինների ազդեցությամբ հասուն դենդրիտային բջիջները արտագաղթում են ծածկութային հյուսվածքից՝ հյուսվածքային հեղուկով դեպի ավշային օրգաններ, օրինակ՝ ավշային հանգույցների հարկեղևային գոտի։
Արտագաղթման արդյունքում դենդրիտային բջիջը գրեթե ամբողջությամբ կորցնում է էնդոցիտոզի հատկությունները և իրականացնում է հակածնի պրոցեսսինք՝ հետագայում ներկայացնելով իրեն։ Դենդրիտային բջիջների հայտվելը ավշային հանգույցների T-կախյալ գոտի պայմանավորված է քեմոկինների ընկալիչների էքսպերսսիայի փոփոխությունով։ Պատնեշային հյուսվածքների քեմոկինների ընկալիչների փոխարեն, դենդրիտային բջիջները սկսում են սինթեզել ստրոմայում գտնվող T-բջիջների կողմից սինթեզվող ցիտոկինների համար ընկալիչներ՝ CCR7 և CXCR4։ Այդ հատվածում տեղի է ունենում դենդրիտային բջիջներով հակածնի ներկայացումը T-բջիջներին իրենց CD40, CD80 և CD86 համընկալիչների միջոցով։ Դենդրիտային բջիջների կողմից անտիգենի ներկայացումը լիմֆոցիտներին MHC-II մոլեկուլների միջոցով կոչվում է իմունաբանական սինապս։ Առանց իմունաբանական սինապսի առաջացման հետագա իմուն պատասխանի զարգացոիմն անհնար է[14][15]։
Հենց MHC-II, CD80 և CD86 մոլեկուլների առկայությունը հասուն դենդրիտային բջիջների վրա իրենց սարքում է անտիգեն ներկայացնող։ Ակտիվացված դենտրիտային բջիջները սկսում են սինթեզել CD154 մոլեկուլները, որոնք կապվում են CD40 մոլեկուլների հետ՝ դենդրիտային բջիջների մակերեսին ՏԱՍՆՑԵՑ[16]։ Հասուն դենդրիտային բջիջները, հասցնելով անտիգենը ավշային հանգույվի T կախյալ գոտի, դառնում են իրենց ստրոմայի մաս և կոչվում ինտերռիգիտալ դենտրիտային բջիջներ, քանի որ իրենց՝ մատները հիշեցնող ելուստների արանքներում դեղակայվում են T-լիմֆոցիտները ՏԱՍ[11][17]։
Մշտական միելոիդ դենդրիտային բջիջները տեղակայվում են օրգանների հյուսվածքներում բջիջ-նախորդների կամ անհաս բջիջների տեսքով և հետագայում չեն լքում այդ տարածքը։ Շատ մշտական (ռեզիդենտ) դենդրիտային բջիջները տեղակայված են ուրցագեղձում, փայծաղի սահմանային գոտում, լյարդում, սաղմնային կենտրոններում և այլ օրգաններում[11]։
Նշիկների կամ աղեստամոսքային համակարգի էպիթելի բջիջները սինթեզում են MIP-3α քեմոկին, որը գրավում է անհաս դենդրիտային բջիջները՝ քանի որ իրենք ունեն համապատասխան CCR6 ընկալիչները։ Այս քիմոկինի սինթեզը ակտիվանում է բորբոքման ժամանակ։ Երբ հասունանում են, դենդրիտային բջիջները դադարում են սինթեզել CCR6 և դադարում են արձագանքել MIP-3α-ին, բայց դրանց մակերեսին հայտնվում է մեկ այլ քիմոկինային ընկալիչ ՝ CCR7: Հասունացող դենդրիտային բջիջները սկսում են արձագանքել MIP-3β և SLC քիմոկիններին, որոնք արտադրվում են երկրորդական լիմֆոիդ հյուսվածքների կողմից, ինչի արդյունքում դենդրիտային բջիջները ներգրավվում են ավշային հանգույցների մեջ[17]։
Որոշ գործոններ կարող են համակարգային փոփոխություններ կատարել և նույնիսկ խանգարել դենդրիտային բջիջների գործունեությանը։ Այսպիսով, դիսլիպիդեմիան փոխում է հակածնի ներկայացման գործընթացը, իսկ նիկոտինը վնասում է T-բջիջների պրոլիֆերացիայի և ցիտոկիններ արտադրելու կարողությունը[8]։
Դենդրիտային բջիջների տեսակներ
[խմբագրել | խմբագրել կոդը]Հասուն դենդրիտային բջիջները բաժանվում են երկու տիպի՝ DC1 (միելոիդ) и DC2 (լիմֆոիդ)։ Իրենց հիմնական գործառույթները ներկայացված են ստորև[16]։
| Հատկանիշներ | DC1 | DC2 |
|---|---|---|
| Ծագումնաբանություն | Միելոիդ | Լիմֆոիդ |
| Խթանող ցիտոկիններ | Իլ-12, ԻՖγ | Իլ-10 |
| Ֆենոտիպ | CD11c, CD123 | CD11c-CD123 |
| Սինթեզվող ցիտոկիններ | Իլ-12 | ԻՖγ |
| T-բջիջների վրա ազդեցություն | Ակտիվացում | Աներգիայի խթանում |
Անհաս լիմֆոիդ դենդրիտային բջիջները ներկայացված որպես պլազմոցիտոիդ դենդրիտային բջիջներ։ Լանգերհանսի բջիջներն էպիդերմալ են, իսկ ֆոլիկուլային բջիջներն ոչ թե ոսկրածուծային ծագման են, այլ մեզենքիմալ։ Փայծաղում և միջընդերային ավշահանգույցներում միելոիդ և լիմֆոիդ դենդրիտային բջիջներն ունեն տարբեր հարաներություն։ Մաշկի հետ կապ ունեցող լիմֆատիկ հանգույցներում՝ բացի միելոիդ դենդրիտային բջիջներից առկա են նաև Լանգերհանսի բջիջներ[18]։
Ալտերնատիվ դասակարգման համաձայն՝ դենդրիտային բջիջները ստորաբաժանվում են դասականների և պլազմոցիտոիդների[19]։ Դասկաան դենդրիտային բջիջները խթանում են T-բջջային պատասխանը։ Հենց դասկաան դենդրիտային բջիջներն են գերակշռում ավշային հյուսվածքում։ Դասական դենդրիտային բջիջները լրացուցիչ ստորաբաժանվում են՝ հիմնականների և խաչաձև ներկայացնողների[20]։
Պլազնոցիտոիդ դենդրիտային բջիջները անհաս բջիջներ են, որոնք առաջանում են նույն նախորդից, ինչ դասական դենդրիտային բջիջնը, և տեղակայված են հիմնականում արյան հունում, առավել քիչ՝ ավշային օրգաններում։ Ի տարբերություն այլ դասական դենտրիտային բջիջների՝ պլազմոցիտոիդային դենդրիտային բջիջները գրեթե չեն կարողանում ֆագոցիտոզել, ինրի արդյունքում չեն խժռում անտիգենը։ Պկազմոցիտոիդ բջիջների հիմանակն դերը ինտերֆերոնի արտադրությունն է[21]։
Միելոիդ դենդրիտային բջիջ
[խմբագրել | խմբագրել կոդը]Միելոիդ դենդրիտային բջիջ(ՄԴԲ), դենտրիտային բջիիջների նախորդ։ ՄԴԲ ունեն մոնոցիտներին և մակրոֆագերին նման մոֆոլոգիա, էնդողիտոզային և ֆերմենտատիվ ակտիվություն։ Տեղակայված են վերնամաշկում, բուն մաշկում, շնչառական ուղիներում, աղիներում, ուրցագեղձում, փայծաղում, լյարդում և ավշային հյուսվածքում։ Իրենց բնորոշ է MHC և ադհեզիվ մոլեկուլների քիչ արտադրությունը։
Պինոցիտոզի և ֆագոցիտոզի միջոցով ՄԴԲ-ն զավթում է օտարածին հակածինները, ինչից հետո էքսպեսսում են հակածինային դետերմինանտ՝ MHC-II-ի հետ համակցված։
Դրանից հետո, իրենք արտագաղթում են մոտական ավշային հանգույցները, որտեղ պթանում են անտիգեն-յուրահատուկ T-բջիջների բազմացումը և դիֆֆերենցումը, ինչի արդյունքում հրահրվում է իմուն պատասխանը։ ՄԴԲ-ի մարկերները հանդիսանում են CD1c, CD141 մոլեկուլները[4][9][10]։
Պլազմոցիտոիդ դենտրիտային բջիջ
[խմբագրել | խմբագրել կոդը]Պլազմոցիտոիդ դենդրիտային բջիջներ (ՊԴԲ), լիֆոիդ ծագման անհաս բջիջներ են, որոնք իրենց մորֆոլոգիական կառուցվածքով նման են պլազմատիկ բջիջների։ ՊԴԲ-ն արյան շրջանառության մեջ շրջանառող անհաս դենդրիտային բջիջների ամենայաճախ հանդիպող տեսակն է։ ՊԴԲ-ները փոքր են մոնողիտներից (8—10 մկմ), իրենց կորիզն ունի ավելի քիչ արտահայտված ներփքում։ Բացի արյան հունից, ՊԴԲ-ները տեղայակված են լիմֆոիդ հյուսվածքների T-բջջային գոտիներում՝ նշիկներում, ուրցագեղձում, լյարդում, թոքերում և մաշկում։ IL-3-ի և բակտերիալ հակածինների առկայությամբ՝ ՊԴԲ-ները մասնագիտացվում են հասուն լիմդոիդ դենդրիտային բջիջների․ ՊԴԲ-ները իրենց մակերեսին չեն կրում CD83, CD11b և CD11c մոլեկուլները, որոնք բնորոշ են միելոիդ դենդրիտային բջիջների։ Ինչպես նաև CD13 և CD14 մոլեկուլները նույնպես ավելի բնորոշ են միելոիդ դենդրիտային բջիջներին։ ՊԴԲ-ներում սինթեզվում են RAG գեները, որոնք անյրաժեշտ են անտիգեն հայտնաբերող ընկալիչների վերակառուցման համար։ Իրենց մակերեսին գտնվում են CD45R0 մոլեկուլները, ինպչես նաև ԻԼ-3-ի համար ընկալիչներ։ Բացի դրանից, MHC-II մոլեկուլներն ավելի քիչ են, քան միելոիդ ծագման բջիջների մոտ ոչ միայն մակերեսին, այլ նաև ցիտոպլազմում։ ՊԴԲ-ների գենոմում նկատվում է T-բջջային ընկալիչների գեների վերակառուցում, որոոնք առավել բնորոշ են հենց T-բջիջներին։
ՊԲԴ-ները արտազատում են մեծ քանակությամբ I տիպի ինտերֆերոններ (α, β և ω) ՝ հանդիսանալով արյան բջիջներին ինտերֆերոնի հիմնական մատակարարները, ուստի ՊԲԴ-ները հայտնի են նաև որպես ինտերֆերոն արտադրող բջիջներ։ ՊԲԴ-ները մեծ քանակությամբ ինտերֆերոններ են արտազատում հիմնականում վիրուսային ծագման նուկլեինաթթուներով խթանումից հետո՝առաջին օրվա ընթացքում։ Նրանք նաև պատասխանատու են IL-4 և IL-1, ցիտոկինների արտադրության համար, որոնք ոչ սպեցեֆիկ T-բջիջներին ձևափոպում են երկրորդ տիպի T-հելփերների։ Toll-անման ընկալիչները, որոնք ընկալում են նուկլեինաթթուները, առավելապես նեղակայված են ներբջջային տարածության մեջ՝ ցիտոպլազմատիկ գրանուլների վրա։ Մասնավորապես, սինթեզելով TLR9 ընկալիչներ, որի լիգանդները բակտերիալ CpG-օլիգոնուկլեոտիդներն են, հնարավորություն է լինում հայտնաբերել բակտերալ պատոգենները։ ՊԲԴ-ի մարկերներ են CD303, CD304, CD141 մոլեկուլները, IL-3, CD123 ընկալիչները, ինչպես նաև CD85k և CD85g իմունոգլոբուլինանման ընկալիչները[4][6][7][8][9][22][23]։
ՊԲԴ-ները մտնում են ավշային հանգույցներ նույն ճանապարհով, ինչ T բջիջները, այսինքն՝ հետմազանոթային երակիկների էնդոթելի միջոցով։ Միևնույն ժամանակ, միելոիդային դենդրիտային բջիջների պրեկուրսոր բջիջները ներթափանցում են ավշային հանգույցներ՝ ավիշի աֆֆերենտ (հետադարձ) հոսքով։ Ինչպես նշվեց վերևում, վիրուսներով կամ IL-3-ով ՊԲԴ-ների խթանումից հետո առաջին օրվա ընթացքում ինտերֆերոն է ինտենսիվ սինթեզվում։ Երկրորդ օրվա ընթացքում նրանք տարբերվում են լիմֆոիդ շարքի հասուն դենդրիտային բջիջների։ Հասունանալուն պես ՊԲԴ-ի մակերեսին ավելանում է MHC-II մոլեկուլների քանակը, հայտնվում են CD80 և CD86 մոլեկուլներ։ Հասունացման ընթացքում ՊԲԴ-ները շարունակում են արտազատել ինտերֆերոններ, բայց ավելի քիչ քանակությամբ։ Վիրուսային խթանման դեպքում հասունացող ՊԲԴ-ն նպաստում է ինտերֆերոն γ արտադրող առաջին տիպի T-հելփերների (T1-բջիջների) առաջացմանւ, իսկ Իլ-3-ի խթանման դեպքում՝ ԻԼ-4 արտադրող երկրորդ տիպի T-հելթերների (T2-բջիջների) առաջացմանը[24]։
Ֆոլիկուլային դենդրիտային բջիջներ
[խմբագրել | խմբագրել կոդը]Ֆոլիկուլային դենդրիտային բջիջները (ՖԴԲ) հասուն բջիջներ են, ի տարբերություն մնացած դենդրիտային բջիջների, ունեն մեզենխիմալ ծագում։ Ամուր կապվելով ելոիստների դեսմոսոմների հետ ՝ նրանք ձևավորում են կայուն ցանց, որի շնորհիվ նրանք չեն գաղթում այլ տարածքներ։ ՖԴԲ-ն տեղայնացված է ավշային հանգույցների և փայծաղի բջջային տարածքներում։ Նրանք ներկայացնում են անտիգեն B լիմֆոցիտներին՝ երկրորդական լիմֆոիդ օրգաններում։ ՖԴԲ-ի մակերևույթի վրա գտնվող հակածինը պասիվ է, պահպանում է հակածնի սկզբնական կոնֆորմացիան հակամարմինի հետ միքոին։ Այս բջիջները հանդիսանում են հատուկ միկրոմիջավայր, որտեղ տեղի է ունենում B-լիմֆոցիտների յուրահատուկ գերմուտացիաները, որի արդյունքում սկսում են համապատասխան հակածնի համար սինզվել համապատասպան հակամարմիններ։ Նրանք չեն սինթեզում MHC-II սպիտակուցներ, բայց կրում են բազմաթիվ Fcγ ընկալիչների մոլեկուլներ, CR1 և CR2, ինչը թույլ է տալիս նրանց կապել իմունային կոմպլեքսները և համալիրներում գտվնող հակածինը ներկայացնել B լիմֆոցիտներին։ Եթե հակածինը նորից մտնում է օրգանիզմ, և կապվում է նախկինում արդեն սինթեզված հակամարմինների հետ, ՖԲԴ-ները խթանում են հիշողության B բջիջները[4][11]։
Լանգերհանսի բջիջներ
[խմբագրել | խմբագրել կոդը]
Լանգերհանսի բջիջները միելոիդային շարքի էպիդերմալ դենդրիտային բջիջներ են։ Լանգերհանսի բջիջներն իրենց անունն ստացել են ի պատիվ հայտնաբերող Փոլ Լանգերհանսի, ով դրանք նկարագրել է 19-րդ դարի վերջին,որպես էպիդերմիսի ելուստավոր բջիջներ, սակայն իմունային բջիջներին պատկանելը հաստատվել է ավելի ուշ։ Լանգերհանսի բջիջներ ունեն մի շարք առանձնահատկություններ, որոնք տարբերակում են դրանք մնացած բոլոր դենդրիտային բջիջներից։ Նրանց ցիտոպլազմայում առկա են շերտավորված կուտակումներ, որոնք հայտնի են որպես Բիրբեկի հատիկներ, իսկ մակերեսին առկա է լանգերին ընկալիչը (CD208), որը պատկանում է լեկտիններին և առկա է արդեն արյան մեջ շրջանառվող անհաս բջիջների վրա, ինչպես նաև «ոչ դասական» մոլեկուլ MHC-CD1a, որը նախատեսված է լիպիդային հակածինների ներկայացման համար։
Բիրբեկի հատիկները օվալաձևձգված կառույցներ են ՝ կենտրոնական դասավորությամբ մասնատված ձողով,որոնք ծագում են ատիպիկ հատիկներից և իրենց տեսքով հիշեցնում են թենիսի ռակետներ։ Բիրբեկի հատիկները հավանաբար էնդոսոմներ են, որոնք ներգրավված են անտիգենի զավթման մեջ[25]։ Լանգերհանսի բջիջների ատիպիկ հատիկները մորֆոլոգիապես տարբերվում են լիզոսոմներից՝ թափանցիկ օղի առկայությամբ, որը բաժանում է հատիկի արտաքին հատվածը՝ կենտրոնական հատվածից[4]։ Լանգերհանսի բջիջների ցիտոպլազմայում առկա է գլանային-բշտիկային համակարգ ՝ փոփոխված և հիպերտրոֆիայի ենթարկված Գոլջի համալիր՝ հարթ էնդոպլազմային ցանցի հետ միասին[4]։
Բացի վերը նշված լանգերինից և CD1a-ից, Լանգերհանսի բջիջների մակերեսին առկա են հետևյալ մոլեկուլները՝ E-կադհերին, CD20, CD11c, CD13, CD14 և CD33: Լանգերհանսի բջիջների զարգացումը լիովին պարզաբանված չէ։ Ենթադրվում է, որ դրանք զարգանում են հիմնականում դեղնուցապարկի արյունաստեղծ բջիջներից, ինչպես նաև, փոքր քանակությամբ՝ ոսկրածուծի չտարբերակված բջիջներից[26]։ Լանգերհանսի բջիջները տեղայնացված են վերնամաշկում, ճարպագեղձերում և քրտնագեղձերում, մազի ֆոլիկուլներում, բերանի, քթի, կերակրափողի, թոքերի, հեշտոցի և հաստ աղիքի էպիթելում։ Լանգերհանսի բջիջների հիմնական գործառույթը ամբողջ օրգանիզմի հոմեոստազի կարգավորումն է և մաշկի պաշտպանիչ ռեակցիաների իրականացումը։ Ելուստների միջոցով իրենք կապված են նյարդային վերջավորությունների հետ, ինչպես նաև դերմայի պտկտիկավոր շերտի հեմոցիրկույատոր հունի հետ։ Դրա շնորհիվ Լանգերհանսի բջիջները մասնակցում են երեք կարգավորիչ գործառույթների՝ իմուն, նյարդային և ներզատիչ։ Լանգերհանսի բջիջների առանձնահատուկ գործառույթներից է՝ իմունոգեն հակածնի երկարատև պահպանումը[13]։ Հակածնի զավթումից հետո Լանգերհանսի բջիջները հակածնային պեպտիդները կենտրոնական ավշային անոթներով տեղափոխում են դեպի հարակից ավշային հանգույցներ և մասնակցում ոչ սպեցեֆիկ T-լիմֆոցիտների մասնագիտացմանը T-հելփերների[4][7]։
Կլինիկական նշանակություն
[խմբագրել | խմբագրել կոդը]Դենդրիտային բջիջները ներգրավված են բազմաթիվ վիրուսների նկատմամբ իմունային պատասխանի մեջ և կարող են ախտահարվել մի քանիսով։ Այսպիսով, Լանգերհանսի բջիջները ներգրավված են արագ ՄԻԱՎ վարակով հիվանդալու գործընթացում։ Իրենք սինթեզում են ՄԻԱՎ վիրուսի համար CD4 ընկալիչներ, ինչպես նաև ընկալիչներ քեմոկինների համար։ Անտիգենը գրավելուց կամ ՄԻԱՎ-ով վարակվելուց հետո 30 րոպե անց Լանգերհանսի բջիջները գաղթում են ավշային հանգույցներ, ինչի շնորհիվ նրանք նպաստում են ՄԻԱՎ-ի արագ տարածմանը ամբողջ օրգանիզով[4]։ Դենդրիտային բջիջները ապահովում են ինտերֆերոնների արտադրությունը, երբ վարակվում են այնպիսի վիրուսներով, ինչպիսիք են ցիտոմեգալովիրուսը և գրիպի վիրուսը[15]։ Հանտավիրուսը, երբ մտնում է մարմին, արդյունավետորեն վարակում է դենդրիտային բջիջները ՝ առանց հրահրելու լիզիս կամ ապոպտոզ։ Հանտավիրուսը ակտիվացնում է անհաս բջիջները, ինչի արդյունքում մեծանում է MHC-ի, ինչպես նաև ադհեզիվ մոլեկուլների սինթեզը։ Հանտավիրուսով վարակված բջիջները մեծացնում են բորբոքային ցիտոկինների արտազատումը, մասնավորապես ՝ ուռուցքային նեկրոզի գործոնը և α-ինտերֆերոնը։ Այսպիսով, հանտավիրուսները առաջացնում են ուժեղ իմուն պատասխան, որը վիրուսային վարակի պաթոգենեզի մի մասն է[14]։ Ինչպես նաև հաստատված է, որ ֆոլիկուլային բջիջները կարող են նպաստել պրիոնների բազմացմանը[17]։
Դենդրիտային բջիջները ներգրավված են մի շարք աուտոիմուն հիվանդությունների պաթոգենեզում։ Համակարգային կարմիր գայլախտով հիվանդների մոտ դենդրիտային բջիջների ակտիվությունը պաթոլոգիկորեն մեծանում է, որի արդյունքում ավելանում է ինտերֆերոնների արտազատումը, որոնք խթանում են դենդրիտային բջիջների նախորդ բջիջների տարբերակումը։ Հասուն դենդրիտային բջիջները կլանում են ԴՆԹ-ն, որի պարունակությունը արյան մեջ ավելանում է համակարգային կարմիր գայլախտի ժամանակ, և սկսվում է իմունային պատասխանը.օրգանիզմում ձևավորվում են սեփական ԴՆԹ-ի դեմ հակամարմիններ, որոնք էլ պայմանավորում են հիվանդությունը։ Ապացուցված է դենդրիտային բջիջների դերը գերզգայունության ռեակցիաների, ինչպես նաև աղիքային բորբոքային հիվանդությունների զարգացման մեջ, ինչպիսիք են Քրոնի հիվանդությունը և խոցային կոլիտը։
Երբեմն դենդրիտային բջիջները ենթարկվում են չարորակ դեգեներացիայի։ Օրինակ՝ ֆոլիկուլյար դենդրիտային բջիջներից բխող սարկոմաները սովորաբար ներառում են ավշային հյուսվածքներ, բայց կարող են նաև ազդել լյարդի, լեղուղիների, ենթաստամոքսային գեղձի, վահանագեղձի և այլ օրգանների վրա։ Դենդրիտային բջիջների քանակության ավելացումը ուռուցքային բջիջներում ունի բարենպաստ պրոգնոստիկ նշանակություն։ Դենդրիտային բջիջներն ակտիվացնում են T-հելփերները և ցիտոտոքսիկ T-բջիջները (T-քիլլեր), որոնք կարող են ընկճել ուռուցքների աճը։ Բացի դրանից, դենդրտային բջիջները կարող են օգտագործվել ուռուցքների բուժման իմունոթերապիայի ժամանակ[22][24]։
Կիրառությունը բժշկության մեջ
[խմբագրել | խմբագրել կոդը]Դենդրիտային բջիջների իմուն գործընթացները կառավարելու ունակությունը, ինչպես նաև սահմանված պարամետրերով բջիջներ առաջացնելու ունակությունը հանգեցրել են դրանց օգտագործմանը քաղցկեղի և որոշ աուտոիմուն հիվանդությունների, ինչպես նաև աթերոսկլերոզի բուժման համար իմունոթերապիայում[9]։ Դենդրիտային բջիջների օգտագործմամաբ քաղցկեղային իմունոթերապիան հաջողությամբ փորձարկվել է լյարդաբջջային քաղցկեղ, երիկամների քաղցկեղ, մելանոմա և լիմֆոմա ունեցող հիվանդների մոտ։ Հակաքաղցկեղային իմունոթերապիայում դենդրիտային բջիջների ակտիվացման օգտագործումը հիմնված է՝ ուռուցքի դեմ իմունային պատասխանը ակտիվացնելու նրանց ունակության վրա[26]։ Դենդրիտային բջիջները ակտիվացնելու համար օգտագործվում են ուռուցքային անտիգենների հետ համակցված ցիտոկիններ[25]։ Որպես կանոն, ուռուցքներում դենդրիտային բջիջները քիչ են, այնուամենայնիվ, դենդրիտային բջիջների պոպուլյացիաների խտության բարձրացումը համարվում է բարենպաստ պրոգնոստիկ նշան[21][23]։ Ուռուցքները կազմող դենդրիտային բջիջները կարող են ակտիվացնել T-հելփերները և ցիտոտոքսիկ T բջիջները, որոնք իրենց հերթին կարող են արգելակել ուռուցքի աճը[24][27]։
Իմուն պատասխանի ուժը կարգավորելու ունակության շնորհիվ դենդրիտային բջիջները կարող են օգտագործվել աուտոիմուն հիվանդությունների, մասնավորապես՝ ռևմատոիդ արթրիտի բուժման մեջ։ Դենդրիտային բջիջները կարող են ճնշել աուտեռեակտիվ T բջիջները և դրանով իսկ խոչընդոտել աուտոիմուն գործընթացի զարգացմանը[28][29]։ Դենդրիտային բջիջների աշխատանքի խանգարումները կապված են այլ աուտոիմուն հիվանդությունների զարգացման հետ, ինչպիսիք են համակարգային կարմիր գայլախտը, Քրոնի հիվանդությունը և խոցային կոլիտը, ինչպես նաև գերզգայունթյան ռեակցիաները[16][18][19]։
Դենդրիտային բջիջներն իրենք կարող են ենթարկվել չարորակ վերածնման։ Մասնավորապես, պլազմոցիտոիդ դենդրիտային բջիջների բլաստային նեոպլազիայի դեպքում դեպքում չարորակ պլազմոցիտոիդ դենդրիտային բջիջները ներթափանցում են մաշկի, ոսկրածուծի, նյարդային հյուսվածքի և այլ հյուսվածքների և օրգանների մեջ։ Հանդիպում է նաև լեյկոզ, որն առաջանում է է պլազմոցիտոիդ դենդրիտային բջիջների չարորակ վերածնման հետևանքով։ Այս դեպքում արյան մեջ առկա են մեծ քանակությամբ չարորակ պլազմոցիտոիդ դենդրիտային բջիջներ (արյան բոլոր կորիզավոր բջիջների առնվազն 2% - ը)[30]։
Դենդրիտային բջիջները ակտիվանում են ոչ միայն պաթոգեններով, դրանք կարող են ակտիվացվել արհեստական խթանիչներով։ VSL # 3 պրոբիոտիկ կոկտեյլը ի վիճակի է փոխել անտիգենի էքսպրեսսիան և ցիտոկինների ստեղծումը։ Բարձր չափաբաժիններում պրոբիոտիկը նաև մեծացնում է CD80, CD86, CD40 և MHC մոլեկուլների էքսպրեսսիան։ Պրոբիոտիկների օգնությամբ հնարավոր է կարգավորել դենդրիտային բջիջների քանակը՝ այդպիսով նպաստելով աղիքային հիվանդությունների բուժմանը[31]։
2018 թվականին հնարավոր եղավ ֆիբրոբլաստների ուղղակի վերածրագրավորում իրականացնել հակածին ներկայացնող դենդրիտային բջիջների, որի ընթացքում մարդու և մկան ֆիբրոբլաստներից ստացվեցին հակածին ներկայացնող դենդրիտային բջիջներ[32]։
Դենդրիտային բջիջները մարդու իմունային անբավարարության վիրուսի թիրախներից են։ Դենդրիտային բջիջների ներսում ՄԻԱՎ-ի ներթափանցմանը նպաստող մոլեկուլներից մեկը DC-SIGN մակերեսային սպիտակուցն է[33]։ Դենդրիտային բջիջներ կարող են ներթափանցել նաև որոշ այլ վիրուսներ, օրինակ՝ SARS-ը, որը նաև օգտագործում է DC-SIGN դենդրիտային բջիջներ ներթափանցելու համար[34]։
Հետազոտություն
[խմբագրել | խմբագրել կոդը]
Դենդրիտային բջիջներն առաջին անգամ հայտնաբերվել են 1868 թվականին Պոլ Լանգերհանսի կողմից և հետագայում նրա անունով կոչվել են Լանգերհանսի բջիջներ[4]։ Լանգերհանսը հայտնաբերեց դենդրիտային բջիջները, դեռ համալսարանական տարիներում՝ էպիդերմիսի ոչ պիգմենտային բջիջները հայտնաբերելու մեթոդի միջոցով, որը մշակվել է Յոուլիուս Կոնգեյմի կողմից։ Այնուամենայնիվ, նրա կողմից հայտնաբերված ելուստավոր բջիջների գործառույթը Լանգերհանսը չի սահմանել[35]։
1957 թվականին Ֆրենկ Մաքֆարլեյն Բերնեթը առաջարկեց կլոնային սելեկցիայիտեսություն, որը ենթադրում է, որ իմունային պատասխանի դեպքում ակտիվանում և կիսվում են միայն այն T լիմֆոցիտները, որոնց T բջջային ընկալիչը կապում է անտիգենը[36]։ T բջիջներն ի վիճակի չեն ինքնուրույն արձագանքել անտիգեններին, սակայն միջնորդը, որը անտիգենները կներկայացնի T բջիջներին, մնում է անհայտ[37]։ 1960-ականների սկզբին ձևակերպվեց A-բջիջների գաղափարը ՝ փոքր բջիջներ, որոնք մշակում են անտիգենը և կատարում դրա ներկայացումը T-լիմֆոցիտներին։ 1966 թվականին Ռոբերտ Միշելը և Ռիչարդ Դաթոնը ցույց տվեցին, որ հնարավոր է հասնել T բջիջների ակտիվացմանը՝ դրանց վրա ավելացնելով փայծաղի բջիջների սուսպենզիա։ 1973 թվականին Ռալֆ Սթայնմանը և Զանվիլ Կոնը կիրառեցին «դենդրիտային բջիջներ» տերմինը՝ լիմֆոիդ օրգաններում տեղակայված ելուստավոր բջիջների նկատմամբ։ 2011 թվականին Սթայնմանին շնորհվել է Նոբելյան մրցանակ ֆիզիոլոգիայի և բժշկության ոլորտում՝ դենդրիտային բջիջների հայտնաբերման համար[38]։ 1980-ականների վերջին կուտակվել էին տվյալներ, որոնք ցույց էին տալիս, որ հենց դենդրիտային բջիջներն են «մասնագիտացված» հակածին ներկայացնող բջիջները[39]։
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ անատոմիայի հիմնարար մոդել
- ↑ 2,0 2,1 Талаев Владимир Юрьевич Механизмы управления миграцией миелоидных дендритных клеток и клеток лангерганса // Иммунология. — 2012. — В. 2. — Т. 33. — С. 104–112. — ISSN 0206-4952. Архивировано из первоисточника 8 Օգոստոսի 2021.
- ↑ Reis e Sousa, Caetano (2006-06). «Dendritic cells in a mature age». Nature Reviews. Immunology. 6 (6): 476–483. doi:10.1038/nri1845. ISSN 1474-1733. PMID 16691244.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Грищенко Е. А. Дендритные клетки: основные представления // Аллергология и иммунология в педиатрии. — 2015. — В. 2 (41). — С. 9–17. — ISSN 2500-1175. Архивировано из первоисточника 30 Հուլիսի 2021.
- ↑ «Dendritic Cells | British Society for Immunology». www.immunology.org (անգլերեն). Արխիվացված օրիգինալից 2021 թ․ օգոստոսի 13-ին. Վերցված է 2021 թ․ օգոստոսի 13-ին.
- ↑ 6,0 6,1 6,2 Фалалеева С.а, Курилин В.в, Шкаруба Н.с, Чумасова О.а, Сизиков А.э Характеристика подтипов дендритных клеток периферической крови у больных ревматоидным артритом // Медицинская иммунология. — 2013. — В. 4. — Т. 15. — С. 343–350. — ISSN 1563-0625. Архивировано из первоисточника 1 Օգոստոսի 2021.
- ↑ 7,0 7,1 7,2 7,3 7,4 Талаев Владимир Юрьевич, Плеханова Мария Владимировна Исследование миграции дендритных клеток и трафика антигенов в целях совершенствования средств иммунопрофилактики // Журнал МедиАль. — 2014. — В. 2 (12). — С. 154–171. Архивировано из первоисточника 1 Օգոստոսի 2021.
- ↑ 8,0 8,1 8,2 «British Society for Immunology: Dendritic Cells». Արխիվացված օրիգինալից 2021 թ․ օգոստոսի 13-ին. Վերցված է 2021 թ․ օգոստոսի 13-ին.
- ↑ 9,0 9,1 9,2 9,3 Бобрышев Ю. В., Орехов А. Н. Дендритные клетки и их потенциальная значимость для иммунотерапии атеросклероза // Атеросклероз и дислипидемии. — 2013. — В. 4. — С. 4–15. — ISSN 2219-8202. Архивировано из первоисточника 31 Հուլիսի 2021.
- ↑ 10,0 10,1 10,2 Цветков В. В., Сологуб Т. В, Токин И. И. Биология дендритных клеток человека и их роль в инфекционной патологии // Российский медико-биологический вестник имени академика И. П. Павлова. — 2014. — В. 3. — С. 68–74. — ISSN 0204-3475. Архивировано из первоисточника 6 Օգոստոսի 2021.
- ↑ 11,0 11,1 11,2 11,3 Follicular Dendritic Cells and Germinal Centers(անգլ.) // International Review of Cytology. — 1996-01-01. — Т. 166. — С. 139–179. — ISSN 0074-7696. — Архивировано из первоисточника 30 Հուլիսի 2021.
- ↑ Мяделец О. Д., Кичигина Т. Н., Мяделец В. О., Стефаненко Е. В., Аблецова Ю. П. Сравнительная характеристика клеток Лангерганса производных кожи у человека и белой крысы // Вестник Витебского государственного медицинского университета. — 2008. — В. 1. — Т. 7. — С. 12–23. — ISSN 1607-9906. Архивировано из первоисточника 8 Օգոստոսի 2021.
- ↑ 13,0 13,1
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ 14,0 14,1
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ 15,0 15,1
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ 16,0 16,1 16,2 British Society for Immunology: Dendritic Cells. Дата обращения: 13 августа 2021. Архивировано 13 августа 2021 года.
- ↑ 17,0 17,1 17,2 Хаитов, 2019, с. 195—196․
- ↑ 18,0 18,1 Недоспасов, Купраш, 2021, с. 80.
- ↑ 19,0 19,1 Бобрышев Ю. В., Орехов А. Н. Дендритные клетки и их потенциальная значимость для иммунотерапии атеросклероза // Атеросклероз и дислипидемии. — 2013. — Вып. 4. — С. 4–15. — ISSN 2219-8202. Архивировано 31 июля 2021 года.
- ↑ Недоспасов, Купраш, 2021, с. 81.
- ↑ 21,0 21,1 Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology. — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4.
- ↑ 22,0 22,1 Abbas, Lichtman, Pillai, 2015, p. 110—111.
- ↑ 23,0 23,1 Цветков В. В., Сологуб Т. В, Токин И. И. Биология дендритных клеток человека и их роль в инфекционной патологии // Российский медико-биологический вестник имени академика И. П. Павлова. — 2014. — Вып. 3. — С. 68–74. — ISSN 0204-3475. Архивировано 6 августа 2021 года.
- ↑ 24,0 24,1 24,2 Недоспасов, Купраш, 2021, с. 78.
- ↑ 26,0 26,1 «Células Dendríticas que Atacan al Cáncer». Արխիվացված է օրիգինալից 2009 թ․ մայիսի 10-ին. Վերցված է 2021 թ․ դեկտեմբերի 28-ին.
- ↑ Follicular Dendritic Cells and Germinal Centers (англ.) // International Review of Cytology. — 1996-01-01. — Vol. 166. — P. 139–179. — ISSN 0074-7696. — doi:10.1016/S0074-7696(08)62508-5. Архивировано 30 июля 2021 года
- ↑ McDowell, N. «Cell re-education reverses autoimmune attack». Արխիվացված օրիգինալից 2015 թ․ մայիսի 14-ին. Վերցված է 2021 թ․ դեկտեմբերի 28-ին.
- ↑ Мяделец О. Д., Кичигина Т. Н., Мяделец В. О., Стефаненко Е. В., Аблецова Ю. П. Сравнительная характеристика клеток Лангерганса производных кожи у человека и белой крысы // Вестник Витебского государственного медицинского университета. — 2008. — Т. 7, вып. 1. — С. 12–23. — ISSN 1607-9906. Архивировано 8 августа 2021 года.
- ↑ Flohé S, Lang T, Moll H. Synthesis, stability, and subcellular distribution of major histocompatibility complex class II molecules in Langerhans cells infected with Leishmania major (англ.) // Infection and Immunity. — 1997. — August (vol. 65, no. 8). — P. 3444—3450. — ISSN 0019-9567. — doi:10.1128/iai.65.8.3444-3450.1997.
- ↑
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ Montrasio F., Frigg R., Glatzel M., Klein M. A., Mackay F., Aguzzi A., Weissmann C. Impaired prion replication in spleens of mice lacking functional follicular dendritic cells. (англ.) // Science (New York, N.Y.). — 2000. — 19 May (vol. 288, no. 5469). — P. 1257—1259. — doi:10.1126/science.288.5469.1257. — PMID 10818004.
- ↑ Baumgart D. C., Metzke D., Schmitz J., Scheffold A., Sturm A., Wiedenmann B., Dignass A. U. Patients with active inflammatory bowel disease lack immature peripheral blood plasmacytoid and myeloid dendritic cells. (англ.) // Gut. — 2005. — February (vol. 54, no. 2). — P. 228—236. — doi:10.1136/gut.2004.040360. — PMID 15647187.
- ↑ Langerhans, P. Uber die nerven der menschlichen haut. — 1868. — Т. 1868. — № 44. — С. 325—337.
- ↑ Baumgart D. C., Carding S. R. Inflammatory bowel disease: cause and immunobiology. (англ.) // Lancet (London, England). — 2007. — 12 May (vol. 369, no. 9573). — P. 1627—1640. — doi:10.1016/S0140-6736(07)60750-8. — PMID 17499605.
- ↑ van Nierop K., de Groot C. Human follicular dendritic cells: function, origin and development. (англ.) // Seminars In Immunology. — 2002. — August (vol. 14, no. 4). — P. 251—257. — doi:10.1016/s1044-5323(02)00057-x. — PMID 12163300.
- ↑ «Ralph M. Steinman - Biographical» (անգլերեն). Nobel Media. Արխիվացված օրիգինալից 2012 թ․ օգոստոսի 30-ին. Վերցված է 2011 թ․ հոկտեմբերի 3-ին.
- ↑ Ralph M. Steinman - Biographical (англ.). Nobel Media.
Գրականություն
[խմբագրել | խմբագրել կոդը]- Бурместер Г.-Р., Пецутто А. Наглядная иммунология. — М.: БИНОМ. Лаборатория знаний, 2014. — 320 с. — ISBN 978-5-9963-1731-8
- Иммунология по Ярилину / Недоспасов С. А., Купраш Д. В.. — М.: ГЭОТАР-Медиа, 2021. — 808 с. — ISBN 978-5-9704-4552-2 —
- Хаитов Р. М. Иммунология: структура и функции иммунной системы. — М.: ГЭОТАР-Медиа, 2019. — 328 с. — ISBN 978-5-9704-4962-2
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai Cellular and Molecular Immunology. — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4
