«Գլիցերին»–ի խմբագրումների տարբերություն
| Տող 113. | Տող 113. | ||
== Քիմիական հատկություններ == |
== Քիմիական հատկություններ == |
||
Գլիցերինը ունի տիպիկ բազմատոմ սպիրտներին բնորոշ քիմիական հատկություններ: Գլիցերինի փոխազդեցությունը [[հալոգենաջրածիններ]]ի կամ [[ֆոսֆոր]]ի հալոգենիդների հետ ընթանում է մոնո- և դիհալոգենացմամաբ: Գլիցերինը փոխազդում է [[կարբոնաթթուներ]]ի և հանքային թթուների հետ: Օրինակ [[Ազոտական թթու|ազոտական թթ]]վի հետ փոխազդելիս, գլիցերինն առաջացնում է եռնիտրատ-[[նիտրոգլիցերին]](ստացել է Ասկանյո Սոբրերոն, 1847 թվականին), օգտագործվում է մեր ժամանակներում անծուխ [[վառոդ]] ստանալու նպատակով: |
Գլիցերինը ունի տիպիկ բազմատոմ սպիրտներին բնորոշ քիմիական հատկություններ: Գլիցերինի փոխազդեցությունը [[հալոգենաջրածիններ]]ի կամ [[ֆոսֆոր]]ի հալոգենիդների հետ ընթանում է մոնո- և դիհալոգենացմամաբ: Գլիցերինը փոխազդում է [[կարբոնաթթուներ]]ի և հանքային թթուների հետ: Օրինակ [[Ազոտական թթու|ազոտական թթ]]վի հետ փոխազդելիս, գլիցերինն առաջացնում է եռնիտրատ-[[նիտրոգլիցերին]](ստացել է Ասկանյո Սոբրերոն, 1847 թվականին), օգտագործվում է մեր ժամանակներում անծուխ [[վառոդ]] ստանալու նպատակով: Գլիցերինը դեհիդրատացնելիս այն վեր է ածվում թունավոր ակրոլեինի. |
||
Գլիցերինը դեհիդրատացնելիս այն վեր է ածվում թունավոր ակրոլեինի. |
|||
* HOCH<sub>2</sub>CH(OH)-CH<sub>2</sub>OH <math>\to</math> H<sub>2</sub>C=CH-CHO + 2 H<sub>2</sub>O |
* HOCH<sub>2</sub>CH(OH)-CH<sub>2</sub>OH <math>\to</math> H<sub>2</sub>C=CH-CHO + 2 H<sub>2</sub>O |
||
| ⚫ | |||
Գլիցերինի և բարձրագույն կարբոնաթթուների [[եթերներ]]ը՝ [[ճարպ]]երը հանդիսանում են շատ կարևոր միացություններ մարդու համար, կարևոր կենսաբանական դեր են խաղում նաև ֆոսֆոլիպիդները: |
|||
| ⚫ | Այն օքսիդանում է մինչև գլիցերինային ալդեհիդ CH<sub>2</sub>OHCHOHCHO, [[դիհիդրօքսիացետոն]] CH<sub>2</sub>OHCOCH<sub>2</sub>OH կամ գլիցերինաթթու CH<sub>2</sub>OHCHOHCOOH: Գլիցերինի և բարձրագույն կարբոնաթթուների [[եթերներ]]ը՝ [[ճարպ]]երը հանդիսանում են շատ կարևոր միացություններ մարդու համար, կարևոր կենսաբանական դեր են խաղում նաև ֆոսֆոլիպիդները: |
||
| ⚫ | |||
| ⚫ | Գլիցերին առաջին անգամ ստացել է Շելեն [[1779]] թվականին, [[ճարպերի օճառացում|ճարպերի օճառաց]]մամբ: Գլիցերինի հիմնական մասը ստանում են ճարպերի օճառացումից: Գլիցերինի ստացման սինթետիկ եղանակների հիմնական մասը հիմնված է [[պրոպիլեն]]ի օգտագործման վրա: 450-500 °C ջերմաստիճաններում պրոպիլենի քլորացումից ստանում են ալիլքլորիդ, HClO-ի հետ միանալիս առաջանում են քլորհիդրիններ, օրինակ՝ CH<sub>2</sub>ClCHOHCH<sub>2</sub>Cl, որը ալկալիով մշակելիս առաջանում է գլիցերին: |
||
Գլիցերին կարելի է ստանալ նաև օսլայի հիդրոլիզի միջոցով, առաջացած [[մոնոսախարիդ]]ների հիդրատացմամբ կամ [[շաքար]]ների սպիրտային խմորումից: |
|||
| ⚫ | |||
| ⚫ | Գլիցերին առաջին անգամ ստացել է Շելեն [[1779]] թվականին, [[ճարպերի օճառացում|ճարպերի օճառաց]]մամբ: Գլիցերինի հիմնական մասը ստանում են ճարպերի օճառացումից: Գլիցերինի ստացման սինթետիկ եղանակների հիմնական մասը հիմնված է [[պրոպիլեն]]ի օգտագործման վրա: 450-500 °C ջերմաստիճաններում պրոպիլենի քլորացումից ստանում են ալիլքլորիդ, HClO-ի հետ միանալիս առաջանում են քլորհիդրիններ, օրինակ՝ CH<sub>2</sub>ClCHOHCH<sub>2</sub>Cl, որը ալկալիով մշակելիս առաջանում է գլիցերին: Գլիցերին կարելի է ստանալ նաև օսլայի հիդրոլիզի միջոցով, առաջացած [[մոնոսախարիդ]]ների հիդրատացմամբ կամ [[շաքար]]ների սպիրտային խմորումից: |
||
[[Պատկեր:Glycerol-3DModel.png|200px|մինի|աջից|Գլիցերինի մոլեկուլը]] |
[[Պատկեր:Glycerol-3DModel.png|200px|մինի|աջից|Գլիցերինի մոլեկուլը]] |
||
== Գլիցերինի ածանցյալներ == |
== Գլիցերինի ածանցյալներ == |
||
=== Գլիցերիդներ === |
=== Գլիցերիդներ === |
||
| Տող 132. | Տող 130. | ||
== Կիրառություն == |
== Կիրառություն == |
||
Գլիցերինի կիրառության ոլորտները շատ բազմազան են: Օգտագործվում է սննդային հավելանյութերում, լվացող և կոսմետիկ միջոցներում, [[պլաստմասսա]]ների արտադրությունում, ներկանյութերի արտադրությունում, [[էլեկտրատեխնիկա]]յում, ռադիոտեխնիկայում և այլն: |
Գլիցերինի կիրառության ոլորտները շատ բազմազան են: Օգտագործվում է սննդային հավելանյութերում, լվացող և կոսմետիկ միջոցներում, [[պլաստմասսա]]ների արտադրությունում, ներկանյութերի արտադրությունում, [[էլեկտրատեխնիկա]]յում, ռադիոտեխնիկայում և այլն: Համարակալված է որպես սննդային հավելում <ref>E422</ref>: Գլիցերինը օգտագործվում է նաև [[դինամիտ]]ի ստացման համար: |
||
Համարակալված է որպես սննդային հավելում <ref>E422</ref>: Գլիցերինը օգտագործվում է նաև [[դինամիտ]]ի ստացման համար: |
|||
== Կայքեր == |
== Կայքեր == |
||
| Տող 151. | Տող 148. | ||
{{Սպիրտներ}} |
{{Սպիրտներ}} |
||
[[Կատեգորիա: |
[[Կատեգորիա:Սպիրտներ]] |
||
[[Կատեգորիա:Սննդային հավելումներ]] |
|||
[[Կատեգորիա:Կոսմետիկ նյութեր]] |
|||
04:42, 27 Հոկտեմբերի 2014-ի տարբերակ
| Գլիցերին | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Պրոպանտրիոլ-1,2,3 |
| Ավանդական անվանում | Գլիցերին |
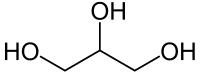
| Քիմիական բանաձև | HOCH2-CH(OH)-CH2OH |
| Ռացիոնալ բանաձև | C3H5(OH)3 |
| Մոլային զանգված | 1,5E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,26 ± 0,01 գ/սմ³[2] գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 18 °C |
| Կազմալուծման ջերմաստիճան | 554 ± 1 ℉[2] |
| Եռման ջերմաստիճան | 290 °C |
| Այրման ջերմաստիճան | 320 ± 1 ℉[2] և 160 °C |
| Գոլորշու ճնշում | 0,003 ± 0,001 mm Hg[2] |
| Օպտիկական հատկություններ | |
| Բեկման ցուցիչ | 1,4729 |
| Դասակարգում | |
| CAS համար | 56-81-5 |
| PubChem | 753 |
| EINECS համար | 200-289-5 |
| SMILES | OCC(O)CO |
| ЕС | 200-289-5 |
| RTECS | MA8050000 |
| ChEBI | 733 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Գլիցերին,(1,2,3-տրիօքսիպրոպան, պրոպանտրիոլ-1,2,3), եռատոմ սպիրտների պարզ ներկայացուցիչ: Իրենից ներկայացնում է մածուցիկ, թափանցիկ հեղուկ:
Ֆիզիկական հատկություններ
Գլիցերինը անգույն, մածուցիկ, շատ հիգրոսկոպիկ հեղուկ է: Ունի քաղցր համ, այստեղից էլ ստացել է իր անվանումը(գլիկոս-քաղցր):
Քիմիական հատկություններ
Գլիցերինը ունի տիպիկ բազմատոմ սպիրտներին բնորոշ քիմիական հատկություններ: Գլիցերինի փոխազդեցությունը հալոգենաջրածինների կամ ֆոսֆորի հալոգենիդների հետ ընթանում է մոնո- և դիհալոգենացմամաբ: Գլիցերինը փոխազդում է կարբոնաթթուների և հանքային թթուների հետ: Օրինակ ազոտական թթվի հետ փոխազդելիս, գլիցերինն առաջացնում է եռնիտրատ-նիտրոգլիցերին(ստացել է Ասկանյո Սոբրերոն, 1847 թվականին), օգտագործվում է մեր ժամանակներում անծուխ վառոդ ստանալու նպատակով: Գլիցերինը դեհիդրատացնելիս այն վեր է ածվում թունավոր ակրոլեինի.
- HOCH2CH(OH)-CH2OH H2C=CH-CHO + 2 H2O
Այն օքսիդանում է մինչև գլիցերինային ալդեհիդ CH2OHCHOHCHO, դիհիդրօքսիացետոն CH2OHCOCH2OH կամ գլիցերինաթթու CH2OHCHOHCOOH: Գլիցերինի և բարձրագույն կարբոնաթթուների եթերները՝ ճարպերը հանդիսանում են շատ կարևոր միացություններ մարդու համար, կարևոր կենսաբանական դեր են խաղում նաև ֆոսֆոլիպիդները:
Ստացում
Գլիցերին առաջին անգամ ստացել է Շելեն 1779 թվականին, ճարպերի օճառացմամբ: Գլիցերինի հիմնական մասը ստանում են ճարպերի օճառացումից: Գլիցերինի ստացման սինթետիկ եղանակների հիմնական մասը հիմնված է պրոպիլենի օգտագործման վրա: 450-500 °C ջերմաստիճաններում պրոպիլենի քլորացումից ստանում են ալիլքլորիդ, HClO-ի հետ միանալիս առաջանում են քլորհիդրիններ, օրինակ՝ CH2ClCHOHCH2Cl, որը ալկալիով մշակելիս առաջանում է գլիցերին: Գլիցերին կարելի է ստանալ նաև օսլայի հիդրոլիզի միջոցով, առաջացած մոնոսախարիդների հիդրատացմամբ կամ շաքարների սպիրտային խմորումից:

Գլիցերինի ածանցյալներ
Գլիցերիդներ
Եռգլիցերիդները հանդիսանում են գլիցերինի ածանցյալներ: Եռգլիցերիդները հանդիսանում են կարևոր բաղադրիչ՝ կենդանի օրգանիզմներում նյութափոխանակության գործընթացներում:
Ճարպեր և յուղեր
Ճարպերը և յուղերը հիդրոֆոբ միացություններ են, ջրում անլուծելի, այնպես ինչպես գլիցերինի մոլեկուլում հիդրօքսիլ խմբերը փոխարինված են ճարպաթթուների մնացորդներով:
Կիրառություն
Գլիցերինի կիրառության ոլորտները շատ բազմազան են: Օգտագործվում է սննդային հավելանյութերում, լվացող և կոսմետիկ միջոցներում, պլաստմասսաների արտադրությունում, ներկանյութերի արտադրությունում, էլեկտրատեխնիկայում, ռադիոտեխնիկայում և այլն: Համարակալված է որպես սննդային հավելում [3]: Գլիցերինը օգտագործվում է նաև դինամիտի ստացման համար:
Կայքեր
Ռուսերեն և անգլերեն լեզուներով.
Անգլերեն լեզվով.
- What is Glycerin?
- Glossary for the Modern Soap Maker
- Glycerol soap
- Absolute alcohol using glycerol
- Computational Chemistry Wiki
- Health.gov dietary guidelines
Ծանոթագրություններ
| ||||||||||||||||||||||||||||||

