AMPA-ընկալիչ

AMPA-ընկալիչ (α-ամինո-3-հիդրօքսի-5-մեթիլ-4-իզոքսազոլպրոպիոնաթթու ընկալիչ, AMPAR), գլուտամինաթթվի իոնատրոպ ընկալիչ, որը փոխանցում է արագ գրգռող ազդանշանները՝ ողնաշարավորների նյարդային համակարգի սինապսներով։ Տվյալ ընկալիչը ակտիվանում է նաև գլուտամատի սինթետիկ անալոգով՝ АМРА ամինաթթվով, որտեղից և ստացել է իր անվանումը։ АМРА-ընկալիչները հայտնաբերվել են գլխուղեղի գրեթե բոլոր կառույցներում, նրանց համարում են նյարդային համակարգի ամենատարածված ընկալիչների տիպը։ Այս ընկալիչները իրենցից ներկայացնում են քառաչափ իոնական պոմպեր, որոնք կարող են կազմված լինել չորս տիպի ենթամիավորներից[1]։ АМРА-ընկալիչները կապված են մարդու կենտրոնական նյարդային համակարգի մի շարք հիվանդությունների հետ, ինչպիսիք են Մարտին-Բելի սինդրոմը, այդ պատճառով նրանց ուսումնասիրմանը մեծ ուշադրություն է դարձվում[2]։
Պատմություն[խմբագրել | խմբագրել կոդը]
Ընկալիչը հայտնաբերվել է Կոպենհագենի համալսարանի դեղաբանական բաժնի մի խումբ գիտնականների կողմից՝ Տագե Հոնորի գլխավորությամբ[3]։ Կանոնավոր քառանկյան տեսք ունեցող АМРА-ընկալիչը, որը կազմված է չորս GluR2 ենթամիավորներից, դարձավ առաջին գլուտամատային ընկալիչը, որը ստացան բյուրեղների տեսքով[4]։
Տարածումը[խմբագրել | խմբագրել կոդը]
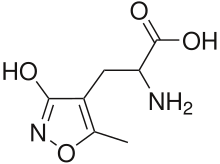
АМРА-ընկալիչները բազմաքանակ և տարածված ընկալիչներ են կենտրոնական նյարդային համակարգում։ GluR1, GluR2 և GluR3 ենթամիավորումների մեծ կոնցետրացիա հայտնաբերվել է հիպոկամպում, առաջնային ուղեղի կեղևի արտաքին շերտում, երկարավուն ուղեղի հանգույցներում, նշաձև մարմնիկում և գլխուղեղի այլ հատվածներում։ GluR4 ենթամիավորումները գլխուղեղի մի շարք հատվածներում պարունակվում է ցածր կոնցետրացիայով, բայց ուղեղիկում, թալամուսում և երկարավուն ուղեղում նրա կոնցետրացիան մեծ է[5]։
Իմունոպրեցիպիտացիայի մեթոդով հաստատվել է, որ հիպոկամպի բրգաձև նեյրոններում արտազատվում է АМРА-ընկալիչները, որոնք կազմված են GluR2 ենթամիավորումներից՝ GluR1 և GluR3 հետ միասին։ Նեյրոնների որոշ ոչ մեծ պոպուլյացիաներում հանդիպում են հոմոմեր (այսինքն կազմված են միայն մեկ տիպի ենթամիավորներից) GluR1 ընկալիչներ։ Այդպիսի ընկալիչները զգալիորեն տարբերվում են այլ АМРА-ընկալիչներից իրենց իոնական թափանցելիությամբ[6]։
АМРА-ընկալիչների գեների էքսպրեսիան փոխվում է օնտոգենեզի ընթացքում։ GluR2 ենթամիավորը առնետի ուղեղում հայտնվում է սաղմնային զարգացման 16-րդ օրից, իսկ մնացած ենթամիավորները զարգանում են զգալի ուշ[5]։ Ինչպես նաև GluR2 ենթամիավորի հարաբերական քանակը կարող է փոխվել սինապսային ճկունության արդյունքում, նյարդային հյուսվածքի մեխանիկական վնասվածքներից և այլ գործոններից։
АМРА-ընկալիչներ նկատվում են քիմիական սինապսի և նախասինապսային, և հետսինապսային թաղանթներում, և քիչ քանակությամբ նեյրոնների պլազմատիկ թաղանթի ոչ սինապսային հատվածներում։ АМРА-ընկալիչների ընդհանուր քանակի 60-70 %-ը բջջում մշտապես գտնվում է էնդոպլազմային ցանցում[7]։ АМРА-ընկալիչները գտնվում են նաև նեյրոգլիայի բջիջներում, նրանք մասնակցում են ապոպտոզի պրոցեսին, որը առաջանում է գլուտամինատային թունավորումից[8]։ АМРА-ընկալիչների ակտիվացիան գլիայի բջիջներում բերում է NO-սինթազի Ca2+-կախյալ ակտիվացմանը և ցիկլիկ գուանոզինմոնոֆոսֆատի հետագա սիթեզը[9]։
| Ենթամիավորների անվանման տեսակներ | Գեների տեղակայում մարդու քրոմոսոմներում |
Ամինաթթուների քանակը երկար սպլայս-ձևում |
|---|---|---|
| GluR1, GluRA, GRIA1, GluA1 | 5 q31.1 | 906 |
| GluR2, GluRB, GRIA2, GluA2 | 4 q32-q33 | 901 |
| GluR3, GluRC, GRIA3, GluA3 | X q25-q26 | 894 |
| GluR4, GluRD, GRIA4, GluA4 | 11 q22 | 902 |
Ենթամիավորների կառուցվածքը և ֆունկցիաները[խմբագրել | խմբագրել կոդը]

Ինչպես նշվեց վերևում, կառուցվածքով АМРА-ընկալիչը քառանկյուն է, որի մեջ կարող են մտնել 4 տիպի ենթամիավորներ (GluR1—GluR4)՝ տարբեր դասավորությամբ։ АМРА-ընկալիչների մեծամասնությունը համարվում է հետերոտետրամերներ, որոնք կազմված են «դիմերների դիմերով»․ յուրաքանչյուր երկրորդ դիմերի մեկ ենթամիավորը սովորաբար GluR2-ն է, իսկ մյուսը՝ GluR1, GluR3 կամ GluR4[11][12][13][14]։ АМРА-ընկալիչները, որոնց բաղադրության մեջ մտնում են GluR2 ենթամիավորները, որոնք Q/R-սայթում պարունակում են արգինին, համարվում են կալցիումի իոնների համար անթափանցելի, իսկ մյուսները թափանցելի են այդ իոնի համար[15]։
АМРА-ընկալիչների ենթամիավորները կազմված են չորս դոմենից (կառուցվածքա-ֆունկցիոնալ տեղամասերից)՝ ոչ բջջային N-ծայրային դոմենից (անգլ.՝ amino-terminal domain, ATD), արտաբջջային դոմենից, որը կապում է լիգանդները (անգլ.՝ ligand-binding domain, LBD), տրանսմեմբրանային դոմենից (անգլ.՝ transmembrane domain, TMD) և ներբջջային С-ծայրային դոմենից (անգլ.՝ carboxyl-terminal domain, CTD)։ Ենթամիավորումների քառանկյուն տեսքը ստացվում է լիգանդ-կապող, տրանսմեմբրանային և N-ծայրային դոմենների համապատասխան ենթամիավորների փոխազդեցության արդյունքում[16][17]։ Ընկալիչների հավաքագրումը տեղի է ունենում հատիկավոր էնդոպլազմային ցանցում[18], որտեղ հատուկ կառույցներ ապահովում են ենթամիավորների պտույտը և փոխադարձ դասավորությունը։ Ապացուցված է, որ էնդոպլազմային ցանցի ներսում տեղի է ունենում ընկալիչների կոնֆորմացիայի փոփոխություն, ինչը կախված է նրանց ֆունկցիոնալ ակտիվությունից՝ լիգանդի կապումից (գլուտամատ), ակտիվացմամբ, դեսենսիտիզացմամբ և այլն․ այսպիսի կոնֆորմացիոն փոփոխությունները կարող են ազդել դեպի արտաքին թաղանթ ընկալիչների տեղափոխման պրոցեսի վրա։ Բացի այդ, ընկալիչների տեղափոխման մեջ զգալի դեր խաղում են N-ծայրային դոմենը և նրա միավորները[18][19]. Кроме того, значительную роль в олигомеризации рецепторов и их транспорте играют N-концевые домены их субъединиц[20][21]։ Վերջնական ձևավորումից հետո АМРА-ընկալիչները ազատվում են ցիտոպլազմայի մեջ։
Լիգանդի կապման դոմեն[խմբագրել | խմբագրել կոդը]

АМРА-ընկալիչի լիգանդ կապող դոմենը ձևավորվում է երկու արտաբջջային մասնիկներից, որոնց անվանում են S1 և S2[22]։ Այս երկու սեգմենտները ձևավորում են մի կառույց, որը հիշեցնում է չանչ, ընդ որում S1 սեգմենտը, որը գտնվում է N-ծայրի թաղանթային М1 սեգմենտի վրա, ձևավորում է նրա մի մասը, իսկ S2 սեգմենտը, որը տեղակայված է М3 և М4 մասնիկների միջև, ձևավորում է մյուսը։ Գլուտամատի կապման վայրը գտնվում է չանչի մեջ՝ երկու սեգմենտների միջև։ S1 սեգմենտների (որոնք պատկանում են տարբեր դոմենների) մակերևութային կապերը լրացուցիչ տեղ են ազատում այլ ալոստերիկ մոդուլյատորների կապման համար[4]։
Ընկալիչի ակտիվացիան սկսվում է կապող լիգանդի հետ ագոնիստի միացմամբ։ Գլուտամինաթթուն, АМРА-ն և նրանց հոմոլոգները պարունակում են կառույցներ, որոնք համապատասխանում են α-ամինո- и α-կարբօքսիլային խմբերին․ այս խմբերը միանում են ընկալչի որոշակի ամինաթթվային մնացորդի հետ։ Այնուհետև АМРА-ընկալիչի ակտիվացման պրոցեսում՝ լիգանդի մոլեկուլի միացման շնորհիվ, տեղի է ունենում լիգանդ-դոմենի տարածական կառուցվածքի փոփոխություն։ Ագոնիստի հետ միացումից հետո S1 և S2 սեգմենտները դառնում են ավելի նեղ, քան ընկալչի ազատ վիճակում։ S2 սեգմենտը տեղաշարժվում է և առաջ է բերում ամինաթթուների մնացորդների կարճ շղթաների կոնֆորմացիոն փոփոխություն, որոնք իրար են կապում լիգանդ-կապող և տրանսմեմբրանային դոմենները, տրանսմեմբրանային դոմենային թաղանթների М3 սեգմենտները, իրենց հերթին, ցրվում են, բջջային թաղանթում բացելով իոնական պոմպը)[23]։ S1 և S2 սեգմենտների միմյանց նկատմամբ տեղաշարժը տանում է լիգանդ-կապող և տրանսմեմբրանային դոմենների անկայուն վիճակի։ Մակրոմոլեկուլի կայունությունը կարող է վերականգնվել «չանչի» լիգանդի-կապման դոմենի հակադարձ բացման դեպքում, ինչը տեղի է ունենում իոնական պոմպի փակման դեպքում և տանում է լիգանդ-ընկալիչ համակարգի կապի քանդում։ Մակրոմոլեկուլի կայունության վերականգնման այլ եղանակ համարվում է ենթամիավորումների հպման մակերեսների (ձևավորում են դոմեն) կոնֆորմացիայի փոփոխությունը։ Կայունության դեպքում մակրոմոլեկուլը վերականգնվում է, լիգանդը մնում է կապված, սակայն իոնային պոմպը փակվում է։ ընկալչի այսպիսի վիճակը անվանում են «դեսենսիտացիոն»․ այս վիճակում գտնվելու ժամանակ ընկալիչը ակտիվ չէ (քանի որ իոնական պոմպը փակ է), բայց չի կարող նաև ակտիվանալ, քանի որ ագոնիստի միացման վայրը արդեն զբաղված է[24].։
Ենթամիավորների պրե-ի-ՌՆԹ-ների ալտերնատիվ սպլայսինգը կարող է տանել ընկալչի երկու նման թևերի առաջացման, որոնք կոչվում են ֆլիպ- և ֆլոպ-ձևեր։ Այս ձևերը ալոստերիկ մոդուլյատորների նկատմամբ ունեն տարբեր զգայունություն, ինչպես նաև նրանց մոտ տարբեր կերպ են ընթանում կոնֆորմացիոն փոփոխությունները՝ ընկալչի ակտիվացման, ինակտիվացման և դեսենսիտիզացիայի ժամանակ[25][26]։
N-ծայրային դոմեն[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչի յուրաքանչյուր ենթամիավորի առաջին 400-450 N-ծայրային ամինաթթվային մնացորդները (ինչպես բոլոր այլ գլուտամատային իոնոտրոպ ընկալիչներում) ձևավորում են N-ծայրային դոմենը։ Գլուտամատային իոնոտրոպ ընկալիչներում N-ծայրային դոմենի ամինաթթվային հաջորդականությամբ շատ նման է գլուտամատային մետաբոոտրոպ ընկալիչների լիգանդ-կապող դոմենին և բակտերիաների պերպլազմայի որոշ սպիտակուցներին։ Ենթադրվւոմ էր, N-ծայրային դոմենը ընկալիչների էվոլյուցիայի վաղ փուլերում նախատեսված էր էնդոֆեն լիգանդների կապման համար, բայց հետագայում կորցրեց այդ հատկությունը[27][28][29][30][31]։ Գենետիկական ինժեներիայի մեթոդների միջոցով ստեղծվել են АМРА-ընկալիչի մեծ քանակությամբ մուտանտ ենթամիավորներ, որոնց մոտ N-ծայրային դոմենը ամբողջությամբ բացակայում է։ Այդպիսի ենթամիավորները կարող են ձևավորել ամբողջությամբ գործող ընկալիչներ, սակայն հետագայում այս փորձերի շնորհիվ պարզվեց, որ N-ծայրային դոմենը կատարում է կարգավորիչ ֆունկցիա․ նրա բացակայությունը ազդում է իոնային պոմպի բացման հավանակության, ինակտիվացիայի արագության, դեսենսիտիզացիայի և այլ նկարագրերի վրա[20][21][32][33][34][35][36]։ Բացի այդ, N-ծայրային դոմենում հայտնաբերվել են այնպիսի կարգավորիչ մոլեկուլների կենտրոններ, ինչպիսիք են ֆենիլէթանոլամինը, իֆենպրոդիլը, ինչպես նաև պենտրակսինը[37][38]։
Տրանսմեմբրանային դոմեն[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչի տրանսմեմբրանային դոմենը կազմված է չորս տրանսմեմբրանային սեգմենտներից՝ М1, М2, М3 և М4։ Հետազոտությունների սկզբում տրանսմեմբրանային դոմենի այսպիսի կառուցվածքը որոշակի տարակուսանքի մեջ գցեց․ եթե ամինաթթվային շղթան բջջային թաղանթը անցնում է զույգ քանակով, ապա նրա С-ծայրը և N-ծայրը պետք է գտնվեն թաղանթի միևնույն կողմում, բայց միևնույն ժամանակ մոլեկուլա-կենսաբանական մեթոդներով հաստատվել էր, որ ընկալչային ենթամիավորի С-ծայրային մասը գտնվում է բջջի ներսում, իսկ N-ծայրը՝ դրսում։ Հակադրությունը անհետացավ, երբ պարզվեց, որ М2 սեգմենտը չի անցնում թաղանթի մեջով, այլ ծռվում է և դուրս է գալիս ներբջջային մասում()[39]։
GluR2-ենթամիավորներ պարունակող АМРА-ընկալիչների իոն անցկացնելու հատկությունը կախված է այդ ենթամիավորումի ի-ՌՆԹ-ի հետտրանսկրիպցիոն ձևափոխումից․ կոդոնը, որը համապատասխանում է գլուտամինի ի-ՌՆԹ-ին (Q) (գտնվում է М2 (Q/R-սայթ) սեգմենտի ծալքի վերին սպիտակուցի վրա), կարող է փոխարինվել արգինինի (R) կոդոնով[40]։ Այս ձևափոխումը զգալի կերպով ազդում է ընկալչի պոմպով անցնող իոնային տրանսպորտի վրա․ АМРА-ընկալիչի Q-ձևը անց է կացնումի Са2+ իոնները և կարող է փակվել իոնային պոմպի բազմաամինային արգելակիչներով, իր հերթին R-ձևը գրեթե անթափանցելի է կալցիումի իոնների համար և զգայուն չէ ներբջջային բազմաամինային արգելակիչների նկատմամբ[41]։ АМРА-ընկալիչների ճնշող մեծամասնությունը նյարդային համակարգում R-ձևի են։
Ընկալչային քառանկյան կազմավորման ժամանակ М2 և М3 սեգմենտները առաջացնում են սեփական իոնային պոմպերը։ М2 սեգմենտը ձևավորում է նրա այն մասը, որը կազմում է բջջային թաղնթի ներքին մասը, М3 սեգմենտը այն, որը մտնում է արտաքին մասի կազմի մեջ, М1 սեգմենտը՝ գտնվելով իոնային պոմպի մեմբրանի հարթության արտաքին մակերեսին, ձևավորում է ընկլչի տրանսմեմբրանային դոմենի հատուկ պարագիծը, М4 սեգմենտը ձևավորում է հարևան ենթամիավորի М2 և М3 սեգմենտների մակերեսներին կոմպլեմենտար մակերես[4]։
С-ծայրային դոմեն[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչի С-ծայրային դոմենը համարվում է ամենաքիչ պահպանողական դոմենը․ նրա առաջնային կառուցվածքը տարբերվում է բոլոր այլ ենթամիավորներից։ Այս դոմենը պարունակում է արտաբջջային սպիտակուցների կապման մի շարք հատվածներ, որոնք կարգավորում են ընկալչի շարժումը բջջային թաղանթի վրա, նրանց իոնաթափանցելիությունը և այլ նկարագրերը[42]։ Բացի այդ, С-ծայրային դոմենի ենթամիավորների տարբեր տիպեր կարող են փոխազդել տարբեր ազդանշանային սպիտակուցների հետ՝ օրինակ, С-ծայրային դոմենի GluR1 ենթամիավորը փոխազդում է գուանոզինմոնոֆոսֆատ-կախյալ պրոտեինկինազի հետ[43], С-ծայրային դոմեն GluR4-ը՝ С պրոտեինկինազի հետ[44]։ Այսպիսի փոխազդեցությունը ապահովում է ընկալչի ակտիվացիան և ինակտիվացիան, մեմբրանային տրանսպորտը և ներբջջային պրոցեսների այլ պատասխան գործընթացները։
| Ենթամիավորներ, որոնք ձևավորում են ընկալիչը |
Բացման հավանականությունը գլուտամատի ակտիվացումից հետո |
Բացի վիճակում մնալու միջին ժամանակը (մվ) | էլեկտաթափանցելիություն |
|---|---|---|---|
| GluR1-flip | 0,4-1,0[45][46] | 0,2-0,9[45] | 8, 15, 23, 31[45][47][48] |
| GluR2-flipQ | 0,61[49] | 0,32; 1,47[50] | 7, 15, 24, 36[50][51] |
| GluR3-flip | 0,82[52] | ||
| GluR4-flip | 0,77[46] | 0,14; 3,3[53] | 9, 20, 31, 45[53][54] |
Տրանսմեմբրանային կարգավորիչ սպիտակուցներ[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչների ուսումնասիրությունները, որոնք ներմուծվել էին արհեստական հետերոգեն համակարգեր (գորտի ձվաբջիջ, ոչ նեյրոնային բջջային կուլտուրաներ), ցույց են տվել, որ նրանց բնութագրերը տարբերվում են այն ընկալիչներից, որոնք ուսումնասիրվել են կենդանի նյարդային բջիջներում։ Այդ անհամապատասխանությունները վկայում են կարգավորող կոմպոնենտի առկայության մասին, որը բնորոշ է միայն նյարդային հյուսվածքին։ Մեծ տարբերությունների պատճառները պարզ դարձան տրանսմեմբրանային սպիտակուցների ուսումնասիրումից հետո, որոնք կարգավորում են АМРА-ընկալիչների ակտիվությունը (անգլ.՝ transmembrane AMPA receptor regulatory Proteins, TARPs)։ TARP-ը բջջային թաղանթի սպիտակուցներն են՝ չորս տրանսմեմբրանային դոմեններից կազմված, որոնք փոխազդում են տարբեր ներբջջային սպիտակուցների հետ[54][55][56]. С каждым тетрамером рецептора связаны два или четыре регуляторных белка, которые взаимодействуют с различными внутриклеточными белками[57][58]։ TARP-ի առավել տարածված տեսակները (γ-2, γ-3, γ-4 и γ-8) փոխազդում են բոլոր չորս տիպի ենթամիավորների հետ։ TARP γ-2 (ստարագազին) առաջին անգամ հայտնաբերվել է ուղեղիկում որպես սպիտակուց, որը անհրաժեշտ է АМРА-ընկալիչը էնդոպլազմային ցանցից բջջաթաղանթ տեղափոխելու համար[59]։ Տրանսպորտային ֆունկիցայի հետ մեկտեղ, տրանսմեմբրանային կարգավորիչ գեները՝ կապվելով АМРА-ընկալիչների հետ, մեծացնում են իոնական պոմպի թափանցելիությունը և նրա բացման հավանականությունը, դանդաղեցնում է ինակտիվացիան և դեսենսիտիզացիան[54][60][61]։
Դեղաբանություն[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչների հիմնական էնդոգենային լիգանդը համարվում է գլուտամատը, որը միանում է չանչանման կառույցի հետ՝ լիգանդ կապող դոմենի յուրաքանչյուր ենթամիավորում, այդ կերպ, ընկալիչը ունի գլուտամատի կապման 4 տեղամաս։ Իոնական պոմպի բացումը տեղի է ունենում, երբ ագոնիստը միանում է 2 տեղամասում, բայց մեծ քանակությամբ տեղամասերի հետ կապումը մեծացնում է պոմպի թափանցելիությունը և նրա բաց մնալու միջին ժամանակը։ Գլուտամատի երկու կարբօքսիլային և մեկ ամինախումբը ձևավորում են ինը ջրածնական կապեր՝ ընկալչի լիգանդ կապող դոմենի տարբեր ամինաթթվային մնացորդների միջև[62]։
Ագոնիստներ[խմբագրել | խմբագրել կոդը]
Գլուտամատի հետ մեկտեղ, АМРА-ընկալիչը կարող է ակտիվանալ այլ բնական և արհեստական լիգանդներով՝ իբոտենաթթու, վիլարդին, ինչպես նաև մի շարք ածանցյալներով, այդ թվում АМРА ածանցյալներով։ Այս ագոնիստներից մի քանիսը ընտրողաբար են GluR1/GluR2 և GluR3/GluR4 ենթամիավորների նկատմամբ՝ օրինակ, Сl-НІВО (իբոտենաթթվի ածանցյալ) ակտիվացնում է GluR1 և GluR2-ը 275 և 1600 անգամ ավելի փոքր կոնցետրացիայով, քան GluR3 և GluR4 համապատասխանաբար։ Սակայն, չնայած ֆարմակոլոգիական միջոցներով հնարավոր է տարբերակել GluR1/GluR2 և GluR3/GluR4 ազդեցությունը, 2011 թվականին չեն նկարագրվել լիգանդներ, որոնք թույլ կտային առանձնացնել ընկալիչի տարբեր ենթամիավորումների ազդեցությունը։
| Ագոնիստ | GluR1 | GluR2 | GluR3 | GluR4 |
|---|---|---|---|---|
| L-գլուտամատ | 3,4-22[63][64][65][66] | 6.2-296[63][67][68] | 1.3-35[63][64][65] | 560[69] |
| АМРА | 1,3-8,7[65][70][71] | 66[68] | 1,4-130[65][70][71] | 1,3[71] |
| Կաինաթթու | 32-34[66][70] | 130-170[72] | 31-36[65][70] | |
| Վիլարդին | 11,5[73] | 6.3[50] | ||
| F-Վիլարդին | 0.47[73] | 0.2-0.5[50][74] | 20,9[74] | 11,9[74] |
| Br-Վիլարդին | 2,8[73] | 0,84[50] | ||
| І-Վիլարդին | 33,6[73] | 1,5[50] | ||
| Br-НІВО | 14[63] | 5,4[63] | 202[63] | 39[63] |
| Cl-НІВО | 4,7[75] | 1.7[75] | 2700[75] | 1300[75] |
| (S)-CPW399 | 24,9[76] | 13.9[76] | 224[76] | 34.3[76] |
| (S)-ATPA | 22[77] | 7.9[77] | 7.6[77] | |
| ACPA | 1,1-11[65][78] | 15[78] | 0,1-5[65][78] | 1,1[78] |
| (S)-4-AHCP | 4,5[79] | 7.2[79] | 15[79] | |
| (S)-Thio-ATPA | 5,2[80] | 13-40[80] | 32[80] | 20[80] |
| 2-Et-Tet-AMPA | 42[81] | 52[81] | 18[81] | 4[81] |
| (S)-2-Me-Tet-AMPA | 0,16[71] | 3,4[68] | 0,014[71] | 0,009[71] |
| SYM2081 | 132[64] | 453[64] | ||
| Դոմոյաթթու | 1,3[66] | 0,97[64] | 21[64] |
Մրցակցային անտագոնիստներ[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչների մրցակցային անտագոնիստները սովորաբար պարունակում են α-ամինախումբ, որը միացած է հետերոցիկլիկ մասի հետ[82]։ Ընկալչի առաջին ուսումնասիրված անտագոնիստները կվինոքսալինդիոններն են (en:CNQX, DNQX, NBQX)։ Հետաքրքիր է, որ տրանսմեմբրանային սպիտակուցների առկայության դեպքում, CNQX և DNQX (բայց ոչ NBQX) դառնում են թույլ մասնավոր ագոնիստներ։ CNQX և DNQX առաջ են բերում կապող լիգանդի դոմենի «չանչի» մասնակի փակում, ինչը համապատասխանում է մասնակի ագոնիստների գործունեությանը[62]։ Ըստ գոյություն ունեցող հիպոթեզի, տրանսմեմբրանային կարգավորիչ սպիտակուցները ազդում են «չանչի» բացման աստիճանի վրա և այն սարքում բավարար՝ իոնական պոմպի բացման ինդուկցման համար[83]։ Ի տարբերություն կվինոքսալինդիոնների, NS1209 և UВР282 միացությունները կայունացնում են S1-S2 կոմպլեքսը առավել բաց վիճակում, քան բնորոշ է լիգանդի հետ չմիացած ընկալիչին։
| Антагонист | GluR1 | GluR2 | GluR3 | GluR4 |
|---|---|---|---|---|
| CNQX | 0,6[66] | 0,18[84] | 2,11[85] | |
| DNQX | 0,25[86] | 0,45[84] | 1,66[85] | 0,19-0,49[86] |
| NBQX | 0,4[87] | 0,59[78] | 0,31-0,63[78][85] | 0,1[87] |
| ATPO | 38[78] | 65[78] | 110[78] | 150[78] |
| YM90K | 1,96[85] | |||
| NS1209 | 0,12[88] | 0.13[88] | 0.11[88] | 0.06[88] |
| Կինուրենաթթու | 1900[89] | |||
| LY293558 | 9,2[90] | 0,4-3,2[90][91] | 32[92] | 51[90] |
| UBP310 | >100[93] | |||
| ACET | >100[93] |
Ոչ մրցակցային անտագոնիստներ[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչների ոչ մրցակցային անտագոնիստների հիմնական դասը համարվում են 2,3-բենզոդիազեպինները (օրինակ, GYKI-53655), հիդրոֆտալազինները և տետրահիդրոիզոկինալները[94].։ Ի տարբերություն CNQX և DNQX, GYKI-53655 մնում է АМРА-ընկալիչի ակտիվ անտագոնիստ և տրանսմեմբրանային կարգավորիչ սպիտակուցների առկայության, ընդ որում անագոնիստի ակտիվությունը մեծանում է[95]։ Ապացուցված է, որ GYKI-53655 միառժամանակ կապվում է այն տեղամասերի հետ, որոնք կապում են S2-ը М4-ի և S1-ը М1-ի հետ[96]։ Վերջին տեղամասը համարվում է իոնական պոմպի բացման կրիտիկական կետը[4]։
| Անտագոնիստ | GluR1 | GluR2 | GluR3 | GluR4 |
|---|---|---|---|---|
| GYKI 52466 | 18-117[97][98] | 34[85] | 22-66[97][98] | |
| GYKI 53405 | 24[97] | 28[97] | ||
| GYKI 53655 | 6[97] | 5[97] | ||
| LY 300164 | 21[99] | 18[99] | 19[99] | 18[99] |
| CP-465,022 | 0,5[96] | 0,5[96] | 0,3[96] |
Անմրցակցային անտագոնիստներ[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչների անմրցակցային անտագոնիստները, ինչպիսիք են ֆիլանտոտոքսինները[100] կամ պոմպերի արգելակիչները, իրենց գործունեության համար պահանջում են իոնական պոմպի բացված վիճակում նախնական տեղափոխման, պոմպի մեջ սպեցիֆիկ տեղամասի հետ կապվելուց հետո, այս նյութերը մեխանիկորեն արգելափակում են իոնների ներթափանցումը[101]։ Այսպիսով, այս անտագոնիստների ազդեցությունը կախված է ուսումնասիրվող հյուսվածքի ընկալիչի նախնական բացման աստիճանից։ Իր հերթին, ընկալիչի ռեակտիվացիան՝ նրանց միացումից հետո, տեղի է ունենում միայն անտագոնիստի գործունեության միջոցով, որը կարող է առաջ բերել իոնական պոմպի բացում, այդ պատճառով ընկալիչների գործունեության վերականգնումը այդպիսի անտագոնիստների ազդեցությունից հետո, որպես կանոն, ավելի դանդաղ է, քան նախորդ դասերի անտագոնիստների մոտ։
| Անտագոնիստ | GluR1 | GluR2 | GluR3 | GluR4 |
|---|---|---|---|---|
| Արքիոտոքսին 636 | 0,35-3,4[102][103] | Н. Д.[102] | 0,23[102] | 0,43[102] |
| Տոքսին ջորո | 0,04[104] | Н. Д.[104] | 0,03[104] | |
| Ֆիլանտոտոքսին 433 | 0,8[105] | |||
| Ֆիլանտոտոքսին 343 | 2,8[103] | |||
| Ֆիլանտոտոքսին 56 | 3,3pM[106] | |||
| Ֆիլանտոտոքսին 74 | 2,8[106] | |||
| IEM-1460 | 1,6[107] | Н. Д.[108] | 1,6[107] | |
| IEM-1754 | 6,0[107] | 6,0[107] |
Ալոստերիկ մոդուլյատորներ[խմբագրել | խմբագրել կոդը]
Ալոստերիկ մոդուլյատորներ անվանում են այն նյութերին, որոնք փոփոխում են ընկալիչի ակտիվությունը՝ ինակտիվացիայի և դեսենսիտիզացիայի պրոցեսների փոփոխության միջոցով[109]։ Կապող լիգանդի դոմենի միջոցով ագոնիստի կապումը բերում է ընկալիչում լարվածության առաջացման, որոնք կարող են վերացվել երկու եղանակով՝ իոնային պոմպի բացմամբ (ռեցեպտորի ակտիվացում), կամ էլ մոլեկուլի կոնֆորմացիայի փոփոխությունը այնպես, որտեղ պոմպը բաց է, սակայն լարվածությունը բացակայում է (ընկալիչի դեսենսիտիզացիա)։ Առաջին դեպքում լիգանդ-ընկալչային համակարգի տարաբաժանումից հետո պոմպը փակվում է, իսկ ընկալիչը անցնում է չլարված վիճակի (անջատում)։ АМРА-ընկալիչի դրական մոդուլյատորների կապումը (օրինակ՝ պիրացետամ[110]) լիգանդ-կապվող դոմենի հետ բերում է ընկլիչի չլարված վիճակի փոխանցման էներգիայի բարձրացման՝ ագոնիստի հետ կապվելուց հետո։ Այսպիսով, մոդուլյատորները կասեցնում են ընկալիչի դեսենսիտիզացիան։ Որոշ մոդուլյատորներ նույնպես կարող են դանդաղեցնել կամ արագացնել ագոնիստ-ընկալիչ համակարգի տարանջատումը, այդպիսով տեղի է ունենում ինակտիվացիայի կարգավորում։
Գլխավոր պարամետրը, որոնք առանձնացնում են ալոստերիկ մոդուլյատորներին, համարվում է նրանց աշխատանքի մեխանիզմը։ Մասնավորապես, անիրացետամը դանդաղեցնում է ինակտիվացիայի պրոցեսը, սակայն չի ազդում ագոնիստների ուժի վրա, РЕРА-ն ուժեղացնում է АМРА-ընկալիչի գործունեությունը, փոքրացնում է դեսենսիտիզացիան, բայց չի ազդում ինակտիվացիայի վրա, ցիկլոտիազիդը մեծացնում է ագոնիստների խնամակցությունը[111]։ Իր հերթին, LY404187 միացությունը կայունացնում է բաց վիճակում գտնվող АМРА-ընկալիչը՝ անտագոնիստի հետ նրա միացումից հետո և չի ազդում նրա դեսենսիտիզացիա արագության վրա։ Բացի այդ, այս միացությունը, հավանաբար, թույլ է տալիս դեսենսիտիզացված ընկալիչներին անցնել բացված վիճակի կամ անմիջապես, կամ էլ միջանկյալ դեսենսիտիզացիայից և/կամ փակ կոնֆորմացիայից հետո[112]։ Որոշ միացություններ (օրինակ՝ СХ614) միառժամանակ կատարում է և դեսենսիտիզացիա, և ինակտիվացիա՝ դեռևս անհայտ ճանապարհով[113]։ Ալոստերիկ մոդուլյատորների ուժը կարող է կախված լինել ընկալիչի սպլայս տեսակներից, որոնց հետ այն փոխազդում է։ Օրինակ, ցիկլոտիազիդ գրեթե ամբողջությամբ կասեցնում է ընկալչի ֆլիպ-տեսակի դեսենսիտիզացիան, բայց ֆլոպ-տեսակի դեպքում համարվում է ընդամենը չափավոր ակտիվ նյութ[52]։
Ակտիվացիա և ինակտիվացիա[խմբագրել | խմբագրել կոդը]
Ակտիվացիայի և ինակտիվացիայի արագությունը համարվում է ընկալչի գլխավոր բնութագիրը սինապսների ֆիզիոլոգիայի, սինապտիկ ճկունության և նյարդային իմպուլսների առաջացման մեջ։ Ակտիվացիայի և ինակտիվացիայի բնութագրերը տարբերվում են կախված ընկալիչը կազմող ենթամիավորների, նրանց սպլայս-տեսակից, կարգավորիչ սպիտակուցների առկայությունից և այլ գործոններից։ Այլ գլուտամատային իոնոտրոպ ընկալիչների (NMDA-ընկալիչներ, կաինատային ընկալիչներ) հետ համեմատած АМРА-ընկալիչները բնութագրվում են արագ ակտիվացիայով, ինակտիվացիայով և դեսենսիտիզացիայով։ Սա թույլ է տալիս կարգավորել թաղանթային գծերը՝ մեծ ժամանակահատվածում, միլիվարկյանների ընթացքում փոփոխելով նյարդային ազդանշանների բնութագրերը[114]։
| Ենթամիավորներ, որոնք կազմում են ընկալիչը |
-ինակտիվացիա | -դեսենսիտիզացիա | -վերականգնում |
|---|---|---|---|
| GluR1-flip | 0,7-1,2[25][26][115][116] | 2,5-4,1[25][26][115][116][117] | 111-147[26][115][118] |
| GluR1-flop | 0,86-1,3[25][26][115][116][119] | 3,2-4,2[25][26][115][116][117][119] | 147-155[26][115][119] |
| GluR2-flipQ | 0,62-1,1[49][116] | 5,9-9,9[49][116][117] | 11,7[49] |
| GluR2-flopQ | 0,54-0,9[49][116] | 1,2-1,9[49][116][117] | 31,3[49] |
| GluR3-flip | 0,56[52] | 3,0-5,1[25][52][117][120] | 15-70[52][121] |
| GluR3-flop | 0,63-1,05[52][119] | 1,1-2,8[25][52][116][117][119][120] | 55-142[52][108][120] |
| GluR4-flip | 0,6[25] | 3,6-5,1[25][117] | 6-21[118][121] |
| GluR4-flop | 0,6[25] | 0,9[25][117] | 31-43[121] |
| GluR1-flip/GluR2-flip | 5,1[25] | 28-67[25] | |
| GluR3-flip/GluR2-flip | 4,9[25] | 15-26[25] |
АМРА-ընկալիչների դերը սինապսային ճկունության մեջ[խմբագրել | խմբագրել կոդը]
Սինապսային ճկունությունը դա սինապսի ուժգնության փոփոխումն է պատասխան իր սեփական ակտիվության կամ այլ ազդանշանների առկայության։ Երկարաժամկետ սինապսային պոտենցիացիան և սինապսային երկար ճնշումը համարվում է սինապսային ճկունության հայտնի դրսևորումներ, որոնք ավանդաբար կապում են հիշողության և մոռացության մեխանիզմների հետ։ АМРА-ընկալիչները կարևոր դեր են խաղում այս երկու պրոցեսներում։
Դերը երկարաժամկետ սինապսային պոտենցացիայում[խմբագրել | խմբագրել կոդը]

Երկարաժամկետ սինապսային պոտենցացիան դա երկու նեյրոնների միջև սինապսային փոխանցման ոժեղացումն է, որը կատարվում է սինապսի կարճատև ակտիվացումից հետո և կարող է պահպանվել, ծայրահեղ դեպքում, մինչև մի քանի ժամ։ Գլուտամատային սինապսներում երկարաժամկետ սինապսային պոտենցացիան կախված է ինչպես նախասինապսային (գլուտամատի արտազատում), այնպես էլ հետսինապսային (գլուտամատի ընկալիչների քանակի փոփոխություն) թաղանթներից։ Երկարաժամկետ պոտենցացիան համարվում է հիշողության ձևավորման և կառավարման մեխանիզմներից մեկը։ Ապացուցված է, որ АМРА-ընկալիչները կարևոր դեր են խաղում երկարաժամկետ սինապսային պոտենցացիայի առաջացման մեջ և նրանց կոնցետրացիան սինապսային հատվածում մեծանում է[122]։
Իոնական մեխանիզմ[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչների դերը երկարաժամկետ սինապսային պոտենցացիայի առաջացման մեջ կայանում է հետևյալում։ Գլուտամատը, որը արտազատվում է նախասինապսային նեյրոնից, կապվում է մի քանի ընկալիչների հետ, որոնք ունեն իոնական պոմպեր, մասնավորապես АМРА և NMDA ընկալիչների հետ։ Լիգանդի հետ կապումը բերում է АМРА-ընկալիչների պոմպերի բացում, որոնք անց են կացնում նատրիումի իոնները դեպի բջիջ, որը տանում է բջջաթաղանթի ապաբևեռացման։ Մյուս կողմից, NMDA-ընկալիչը երկարաժամկետ սինապսային պոտենցացիայի սկզբում չեն բացվում, քանի որ նրանց իոնական պոմպերը մեմբրանային պոտենցիալի նորմալ արժեքների դեպքում արգելափակված են մագնեզիումի իոններով։ Բայց АМРА-ընկալիչների միջով նատրիումի իոնների թափանցման շնորհիվ մեմբրանային պոտենցիալը իջնում է այնքան, որ դա բավարար է NMDA-ընկալիչներից մագնեզիումի իոնները անջատելու և իոնական պոմպերը բացելու համար։ Ի տարբերություն АМРА-ընկալիչների, NMDA-ընկալիչները անց են կացնում ոչ միայն նատրիումի, այլ նաև կալցիումի իոնները։ Կալցիումը, որը թափանցում է բջիջ, միջնորդում է АМРА-ընկալիչների ազդեցությունը՝ մասնավորապես, այն տանում է կալմոդուլին-կախյալ պրոտեինկինազ II (CaMKII) ֆերմենտի ֆոսֆորիլացմանը, ինչը տանում է АМРА-ընկալիչների ենթամիավորումների ֆոսֆորիլացման և մեծացնում է իոնական պոմպերի թափանցելիությունը։ АМРА-ընկալիչների պոմպերի թափանցելիության մեծացումը տանում է դեպի բջիջ նատրիումի ակտիվ ներհոսքի, այդպիսով իրականացնելով դրական հետադարձ կապը։
Կալմոդուլին-կախյալ պրոտեինկինազ II-ը ունակ է իրականացնել АМРА-ընկալիչների տեղափոխումը դեպի հետսինապսային թաղանթ՝ մի քանի ուղիներով։ Առաջին հերթին, այն ուղակիորեն ֆոսֆորիլացնում է սինապս-զուգորդված 97 սպիտակուցը (անգլ.՝ synaptic-associated protein 97, SAP97)[123], որը միոզին-VI-ի հետ միասին միանում է АМРА-ընկալիչի С-ծայրային դոմենի հետ։ Կալմոդուլին-կախյալ պրոտեինկինազ II-ի միջոցով ֆոսֆորիլացումից հետո կոմպլեքսը տեղափոխվում է նախասինապսային թաղանթ[124]։ Երկրորդ, հնարավոր ակտիվացում МАРК-կախյալ ուղով։ Այդ դեպքում կալմոդուլին-կախյալ պրոտեինկինազ II-ը ակտիվացնում է Ras սպիտակուցները, որոնք իրենց հերթին ակտիվացնում են МАРК p42/44 (միտոգեն-ակտիվացվող պրոտեինկինազներ), ինչը տանում է АМРА-ընկալիչի տեղափոխման և սինապսային թաղանթում ամրացմանը[125]։
Տրանսպորտը հետսինապսային կարծրուկով[խմբագրել | խմբագրել կոդը]
АМРА-ընկալիչի CaMKII- կամ MAPK-կախյալ ուղիներով բջջաթաղանթի հետսինապսային հատված ընկնելուց հետո, ընկալիչները շարժվում են դեպի հետսինապսային կարծրուկ։ Այդ պրոցեսի հնարավոր մեխանիզմներից մեկը համարվում է АМРА-ընկալիչի հորիզոնական տեղափոխումը հետսինապսային թաղանթից դեպի հետսինապսային կարծրուկ երկարաժամկետ պոտենցիացիայի ժամանակ[126]։ Տրանսպորտի այլ հնարավոր տարբերակը դա ընկալիչների գրավումն է ոչ սինապսային տեղամասերում և դրանց տեղափոխումը դեպի սինապս՝ բջիջների ներառուկներ[127]։ Երկարաժամկետ պոտենցիացիայի ընթացքում տեղի են ունենում այս երկու նկարագրված գործընթացները, սակայն միայն հորիզոնական տեղափոխումն է բջջապատում մեծացնում ընկալիչների կոնցետրացիան։ Ներառուկային տրանսպորտը, իր հերթին, ապահովում է АМРА-ընկալիչների ներհոսքը դեպի շուրջսինապսային տարածք, որտեղից նրանք կարող են հետագայում տեղափոխվել հետսինապսային կարծրուկ[128]։ Հայտնաբերվել են մի քանի սպիտակուցներ, որոնք ընկալիչների տեղափոխման համար խիստ կարևոր են։ Օրինակ, SAP97 սպիտակուցի ավելցուկը տանում է ավելի ակտիվ, քան սովորական պայմաններում, АМРА-ընկալիչի տեղափոխում դեպի սինապսներ[129]։ Այլ սպիտակուցներ, որոնց ակտիվությունը ազդում է АМРА-ընկալիչների տեղափոխման մեջ, միոզինն ու կալցիում-կախյալ շարժական սպիտակուցներն են[130]։
Դերը սինապսային երկար ճնշման մեջ[խմբագրել | խմբագրել կոդը]

Սինապսային երկար ճնշումը (անգլ.՝ Long-term Depression, LTD) սինապսային ակտիվացումից հետոփոքրացնում է երկու նեյրոնների միջև սինապսային փոխանակումը։ Այս պրոցեսը երկարաժամկետ սինապսային պոտենցացիայի հակադիր դրսևորումն է։ Սինապսային երկար ճնշման առաջացումը ուղեկցվում է դենդրիտներ հետսինապսային թաղանթներում АМРА-ընկալիչների քանակի նվազմամբ՝ կլատրին- և կալցինեյրին-կախյալ ուղիներով։ Դրա հետ մեկտեղ տեղի է ունենում ընկալիչների տեղափոխում այլ մեխանիզմներով, քան երկարաժամկետ պոտենցացիայի դեպքում։ АМРА-ընկալիչների էնդոցիտոզը սկսելու ազդանշանը համարվում է NMDA-ընկալիչի միջոցով արտաքին թաղանթներից կալցիումի ներթափանցումը, Са2+-ի իոնները ակտիվացնում են ֆոսֆատազաները և կալցինեյրինը։ Էնդոցիտոզի գործադրումը կախված է պոտենցիալ-կախյալ կալցիումական պոմպերից, հավանաբար, АМРА-ընկալիչի էնդոցիտոզը մակածվում է ներբջջային կալցիումի կոնցետրացիայից և կապված չէ կոնկրետ մեխանիզմից[7]։ Այն դեպքում, երբ ֆոսֆատազայի ներմուծումը չի ազդում էնդոցիտոզ ընկալիչների վրա, ապա կալցինեյրինի անտագոնիստների ավելացումը զգալի կերպով այն ճնշում է[131]։
Հետսինապսային գոտում կալցինեյրինը փախազդում է սպիտակուցային կոմպլեքսների հետ, որոնք կատարում են էնդոցիտոզ։ Այդ կոմպլեքսը իրենից ներկայացնում է կլատրինի զանգված, որը գտնվում է АМРА-ընկալիչ պարունակող թաղանթի տակ, ինչպես նաև սպիտակուցներ, որոնք իրականացնում են ընկալիչների էնդոցիտոզ (հատկապես էֆեկտիվ է այն դեպքում, եթե նրանք պարունակում են GluR2 և/կամ GluR3 ենթամիավորներ)։ Կալցինեյրինի ակտիվացիան առաջ է բերում դիամինի ակտիվացում, ընդ որում կլատրինի զանգվածը տեղափոխվում է բջջի ներս և ձևավորվում է ներբջջային ներառուկ[132]։ АМРА-ընկալիչները, որոնք անցնում են ցիտոպլազմայով, հետագայում քայքայվում են լիզոսոմներում կամ էլ կրկին անցնում են հետսինապսային գոտի՝ РІСК1 և РКС սպիտակուցների գործունեության շնորհիվ[133][134]։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ Nakagawa T. (2010). «The biochemistry, ultrastructure, and subunit assembly mechanism of AMPA receptors». Mol Neurobiol. 42: 161–84. PMID 21080238.
- ↑ Bowie D. (2008). «Ionotropic glutamate receptors & CNS disorders». CNS Neurol Disord Drug Targets. 7: 129–143. doi:10.1007/s12035-010-8149-x. PMID 18537642.
- ↑ Honore T, Lauridsen J, Krogsgaard-Larsen P (1982). «The binding of [3H]AMPA, a structural analogue of glutamic acid, to rat brain membranes». Journal of Neurochemistry. 38 (1): 173–178. doi:10.1111/j.1471-4159.1982.tb10868.x. PMID 6125564.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 4,0 4,1 4,2 4,3 Sobolevsky AI; Rosconi MP, and Gouaux E (2009). «X-ray structure, symmetry and mechanism of an AMPA-subtype glutamate receptor». Nature. 462: 745–56. doi:10.1038/nature08624.
- ↑ 5,0 5,1 Allen Brain Atlas
- ↑ Dingledine R; Borges K, Bowie D; և այլք: (1999). «The glutamate receptor ion channels». Pharmacol Rev. 51 (1): 7–61.
{{cite journal}}: Explicit use of et al. in:|author2=(օգնություն) - ↑ 7,0 7,1 Carroll RC; Beattie EC, Xia H, Luscher C, Altschuler Y, Nichol RA, Malenka RC and Zastrow M (1999). «Dynamin-dependent endocytosis of ionotropic glutamate receptors». Proc. Natl. Acad. Sci. USA. 96 (24): 14112–7. doi:10.1073/pnas.96.24.14112.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Matute C; Domercq M, Sánchez-Gómez MV (2006). «Glutamate-mediated glial injury: mechanisms and clinical importance». Glia. 53: 212–224. doi:10.1002/glia.20275.
- ↑ Baltrons MA; García A (1997). «AMPA receptors are coupled to the nitric oxide/cyclic GMP pathway in cerebellar astroglial cells». Eur J Neurosci. 9 (11): 2497–2501. doi:10.1111/j.1460-9568.1997.tb01667.x.
- ↑ Collingridge GL; Olsen RW, Peters J, and Spedding M (2009). «A nomenclature for ligand-gated ion channels». Neuropharmacology. 56 (1): 2–5. doi:10.1016/j.neuropharm.2008.06.063.
{{cite journal}}: External link in|journal= - ↑ Shi SH; Hayashi Y, Petralia RS; և այլք: (1999). «Rapid spine delivery and redistribution of AMPA receptors after synaptic NMDA receptor activation». Science. 284 (5421): 1811–6. doi:10.1016/S0166-2236(02)02270-1.
{{cite journal}}: Explicit use of et al. in:|author2=(օգնություն) - ↑ Mayer ML (2005). «Glutamate receptor ion channels». Curr Opin Neurobiol. 15 (3): 282–8. doi:10.1016/j.conb.2005.05.004.
- ↑ Song I; Huganir RL (2002). «Regulation of AMPA receptors during synaptic plasticity». Trends Neurosci. 25 (11): 578–88. doi:10.1016/S0166-2236(02)02270-1.
- ↑ Greger IH; Ziff EB, Penn AC (2007). «Molecular determinants of AMPA receptor subunit assembly». Trends Neurosci. 30 (8): 407–16. doi:10.1016/j.tins.2007.06.005.
- ↑ Liu S; Lau L, Wei J, Zhu D, Zou S, Sun HS, Fu Y, Liu F, Lu Y (2004). «Expression of Ca(2+)-permeable AMPA receptor channels primes cell death in transient forebrain ischemia». Neuron. 43 (1): 43–55. doi:10.1016/j.neuron.2004.06.017.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Mansour M; Nagarajan N, Nehring RB, Clements JD, and Rosenmund C (2001). «Heteromeric AMPA receptors assemble with a preferred subunit stoichiometry and spatial arrangement». Neuron. 32: 841–53. doi:10.1016/S0896-6273(01)00520-7.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Kim KS; Yan D, Tomita S (2010). «Assembly and stoichiometry of the AMPA receptor and transmembrane AMPA receptor regulatory protein complex». J Neurosci. 30 (3): 1064–72. doi:10.1016/S0896-6273(01)00520-7.
- ↑ 18,0 18,1 Greger IH; Khatri L, Ziff EB (2002). «RNA editing at arg607 controls AMPA receptor exit from the endoplasmic reticulum». Neuron. 34 (5): 759–72. doi:10.1016/S0896-6273(02)00693-1.
- ↑ Penn AC; Williams SR, and Greger IH (2008). «Gating motions underlie AMPA receptor secretion from the endoplasmic reticulum». EMBO J. 27 (22): 3056–68. doi:10.1038/emboj.2008.222.
- ↑ 20,0 20,1 Ayalon G; Segev E, Elgavish S, and Stern-Bach Y (2005). «Two regions in the Nterminal domain of ionotropic glutamate receptor 3 form the subunit oligomerization interfaces that control subtype-specific receptor assembly». J Biol Chem. 280 (15): 15053–60. doi:10.1074/jbc.M408413200.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 21,0 21,1 Kuusinen A; Abele R, Madden DR, and Keinänen K (1999). «Oligomerization and ligand-binding properties of the ectodomain of the alpha-amino-3-hydroxy-5- methyl-4-isoxazole propionic acid receptor subunit GluRD». J Biol Chem. 274 (41): 28937–43. doi:10.1074/jbc.274.41.28937.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Stern-Bach Y; Bettler B, Hartley M, Sheppard PO, O’Hara PJ, and Heinemann SF (1994). «Agonist selectivity of glutamate receptors is specified by two domains structurally related to bacterial amino acid-binding proteins». Neuron. 13 (6): 1345–57. doi:10.1016/0896-6273(94)90420-0.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Hansen KB; Yuan H, and Traynelis SF (2007). «Structural aspects of AMPA receptor activation, desensitization and deactivation». Curr Opin Neurobiol. 17 (3): 281–8. doi:10.1016/j.conb.2007.03.014.
- ↑ Weston МС; Schuck P, Ghosal A, Rosenmund C, and Mayer ML (2006). «Conformational restriction blocks glutamate receptor desensitization». Nat Struct Mol Biol. 13: 1120–7. doi:10.1038/nsmb1178.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 25,00 25,01 25,02 25,03 25,04 25,05 25,06 25,07 25,08 25,09 25,10 25,11 25,12 25,13 25,14 Mosbacher J; Schoepfer R, Monyer H, Burnashev N, Seeburg PH, and Ruppersberg JP (1994). «A molecular determinant for submillisecond desensitization in glutamate receptors». Science. 266 (5187): 1059–62. doi:10.1126/science.7973663.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 26,0 26,1 26,2 26,3 26,4 26,5 26,6 Partin KM; Fleck MW, and Mayer ML (1996). «AMPA receptor flip/flop mutants affecting deactivation, desensitization, and modulation by cyclothiazide, aniracetam, and thiocyanate». J Neurosci. 16 (21): 6634–47.
- ↑ Paoletti P; Perin-Dureau F, Fayyazuddin A, Le Goff A, Callebaut I, and Neyton J (2000). «Molecular organization of a zinc binding n-terminal modulatory domain in a NMDA receptor subunit». Neuron. 28 (3): 911–25. doi:10.1016/S0896-6273(00)00163-X.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Clayton A; Siebold C, Gilbert RJ, Sutton GC, Harlos K, McIlhinney RA, Jones EY, and Aricescu AR (2009). «Crystal structure of the GluR2 amino-terminal domain provides insights into the architecture and assembly of ionotropic glutamate receptors». J Mol Biol. 392 (5): 1125–32. doi:10.1016/j.jmb.2009.07.082.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Jin R; Singh SK, Gu S, Furukawa H, Sobolevsky AI, Zhou J, Jin Y, and Gouaux E (2009). «Crystal structure and association behaviour of the GluR2 amino-terminal domain». EMBO J. 28 (12): 1812–23. doi:10.1038/emboj.2009.140.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Karakas E; Simorowski N, and Furukawa H (2009). «Structure of the zinc-bound amino-terminal domain of the NMDA receptor NR2B subunit». EMBO J. 28 (24): 3910–20. doi:10.1038/emboj.2009.338.
- ↑ Kumar J; Schuck P, Jin R, and Mayer ML (2009). «The N-terminal domain of GluR6-subtype glutamate receptor ion channels». Nat Struct Mol Biol. 16 (6): 631–8. doi:10.1038/nsmb.1613.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Leuschner WD; and Hoch W (1999). «Subtype-specific assembly of alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor subunits is mediated by their N-terminal domains». J Biol Chem. 274 (24): 16907–16. doi:10.1074/jbc.274.24.16907.
- ↑ Ayalon G; and Stern-Bach Y (2001). «Functional assembly of AMPA and kainate receptors is mediated by several discrete protein-protein interactions». Neuron. 31 (1): 103–13. doi:10.1016/S0896-6273(01)00333-6.
- ↑ Meddows E; Le Bourdelles B, Grimwood S, Wafford K, Sandhu S, Whiting P, and McIlhinney RA (2001). «Identification of molecular determinants that are important in the assembly of N-methyl-D-aspartate receptors». J Biol Chem. 276 (22): 18795–803. doi:10.1074/jbc.M101382200.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Gielen M; Siegler Retchless B, Mony L, Johnson JW, and Paoletti P (2009). «Mechanism of differential control of NMDA receptor activity by NR2 subunits». Nature. 459 (7247): 703–7. doi:10.1038/nature07993.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Yuan H; Hansen KB, Vance KM, Ogden KK, and Traynelis SF (2009). «Control of NMDA receptor function by the NR2 subunit amino-terminal domain». J Neurosci. 29 (39): 12045–58. doi:10.1523/JNEUROSCI.1365-09.2009.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ O’Brien RJ; Xu D, Petralia RS, Steward O, Huganir RL, and Worley P (1999). «Synaptic clustering of AMPA receptors by the extracellular immediate-early gene product Narp». Neuron. 23 (2): 309–23. doi:10.1016/S0896-6273(00)80782-5.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Sia GM; Béïque JC, Rumbaugh G, Cho R, Worley PF, and Huganir RL (2007). «Interaction of the N-terminal domain of the AMPA receptor GluR4 subunit with the neuronal pentraxin NP1 mediates GluR4 synaptic recruitment». Neuron. 55 (1): 87–102. doi:10.1016/j.neuron.2007.06.020.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Hollmann M; Maron C, and Heinemann S (1994). «N-glycosylation site tagging suggests a three transmembrane domain topology for the glutamate receptor GluRI». Neuron. 13 (6): 1331–43. doi:10.1016/0896-6273(94)90419-7.
- ↑ Bass BL (2002). «RNA editing by adenosine deaminases that act on RNA». Annu Rev Biochem. 71: 817–46. doi:10.1146/annurev.biochem.71.110601.135501.
- ↑ Panchenko VA; Glasser CR, Partin KM, and Mayer ML (1999). «Amino acid substitutions in the pore of rat glutamate receptors at sites influencing block by polyamines». J Physiol. 520 (2): 337–57. doi:10.1111/j.1469-7793.1999.t01-1-00337.x.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Uchino S; Wada H, Honda S, Nakamura Y, Ondo Y, Uchiyama T, Tsutsumi M, Suzuki E, Hirasawa T, and Kohsaka S (2006). «Direct interaction of post-synaptic density-95/Dlg/ZO-1 domain-containing synaptic molecule Shank3 with GluR1 alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor». J Neurochem. 97 (4): 1203–14. doi:10.1111/j.1471-4159.2006.03831.x.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Serulle Y; Zhang S, Ninan I, Puzzo D, McCarthy M, Khatri L, Arancio O, and Ziff EB (2007). «A GluR1-cGKII interaction regulates AMPA receptor trafficking». Neuron. 56 (4): 670–88. doi:10.1016/j.neuron.2007.09.016.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Correia SS; Duarte CB, Faro CJ, Pires EV, and Carvalho AL (2003). «Protein kinase C gamma associates directly with the GluR4 alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptor subunit. Effect on receptor phosphorylation». J Biol Chem. 278 (8): 6307–13. doi:10.1074/jbc.M205587200.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 45,0 45,1 45,2 Banke TG; Bowie D, Lee H, Huganir RL, Schousboe A, and Traynelis SF (2000). «Control of GluR1 AMPA receptor function by cAMP-dependent protein kinase». J Neurosci. 20 (1): 89–102.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 46,0 46,1 Robert A; Irizarry SN, Hughes TE, and Howe JR (2001). «Subunit interactions and AMPA receptor desensitization». J Neurosci. 21 (15): 5574–86.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Derkach V; Barria A, and Soderling TR (1999). «Ca2+/calmodulin-kinase II enhances channel conductance of alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate type glutamate receptors». Proc Natl Acad Sci U S A. 96 (6): 3269–74. doi:10.1073/pnas.96.6.3269.
- ↑ Prieto ML; and Wollmuth LP (2010). «Gating modes in AMPA receptors». J Neurosci. 30 (12): 4449–59. doi:10.1523/JNEUROSCI.5613-09.2010.
- ↑ 49,0 49,1 49,2 49,3 49,4 49,5 49,6 Koike M; Tsukada S, Tsuzuki K, Kijima H, and Ozawa S (2000). «Regulation of kinetic properties of GluR2 AMPA receptor channels by alternative splicing». J Neurosci. 20 (6): 2166–74.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 50,0 50,1 50,2 50,3 50,4 50,5 Jin R; Banke TG, Mayer ML, Traynelis SF, and Gouaux E (2003). «Structural basis for partial agonist action at ionotropic glutamate receptors». Nat Neurosci. 6: 803–10. doi:10.1038/nn1091.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Zhang W; Cho Y, Lolis E, and Howe JR (2008). «Structural and single-channel results indicate that the rates of ligand binding domain closing and opening directly impact AMPA receptor gating». J Neurosci. 28 (4): 932–43.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 52,0 52,1 52,2 52,3 52,4 52,5 52,6 52,7 Sekiguchi M; Nishikawa K, Aoki S, and Wada K (2002). «A desensitization-selective potentiator of AMPA-type glutamate receptors». Br J Pharmacol. 136 (7): 1033–41. doi:10.1038/sj.bjp.0704804.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 53,0 53,1 Swanson GT; Kamboj SK, and Cull-Candy SG (1997). «Single-channel properties of recombinant AMPA receptors depend on RNA editing, splice variation, and subunit composition». J Neurosci. 17 (1): 58–69.
- ↑ 54,0 54,1 54,2 Tomita S; Adesnik H, Sekiguchi M, Zhang W, Wada K, Howe JR, Nicoll RA, and Bredt DS (2005). «Stargazin modulates AMPA receptor gating and trafficking by distinct domains». Nature. 435: 1052–58. doi:10.1038/nature03624.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Tomita S; Fukata M, Nicoll RA, and Bredt DS (2004). «Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses». Science. 303 (5663): 1508–11. doi:10.1126/science.1090262.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Vandenberghe W; Nicoll RA, and Bredt DS (2005). «Stargazin is an AMPA receptor auxiliary subunit». Proc Natl Acad Sci U S A. 102 (2): 485–90. doi:10.1073/pnas.0408269102.
- ↑ Milstein AD; and Nicoll (2009). «TARP modulation of synaptic AMPA receptor trafficking and gating depends on multiple intracellular domains». Proc Natl Acad Sci U S A. 106 (27): 11348–51. doi:10.1073/pnas.0905570106.
- ↑ Sager C; Terhag J, Kott S, and Hollmann M (2009). «C-terminal domains of transmembrane alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate (AMPA) receptor regulatory proteins not only facilitate trafficking but are major modulators of AMPA receptor function». J Biol Chem. 284 (47): 32413–24. doi:10.1074/jbc.M109.039891.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Chen L; Chetkovich DM, Petralia RS, Sweeney NT, Kawasaki Y, Wenthold RJ, Bredt DS, and Nicoll RA (2000). «Stargazin regulates synaptic targeting of AMPA receptors by two distinct mechanisms». Nature. 408: 936–43. doi:10.1038/35050030.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Yamazaki M; Ohno-Shosaku T, Fukaya M, Kano M, Watanabe M, and Sakimura K (2004). «A novel action of stargazin as an enhancer of AMPA receptor activity». Neurosci Res. 50 (4): 369–74. doi:10.1016/j.neures.2004.10.002.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Priel A; Kolleker A, Ayalon G, Gillor M, Osten P, and Stern-Bach Y (2005). «Stargazin reduces desensitization and slows deactivation of the AMPA-type glutamate receptors». J Neurosci. 25 (10): 2682–86. doi:10.1523/JNEUROSCI.4834-04.2005.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 62,0 62,1 Armstrong N; and Gouaux E (2000). «Mechanisms for activation and antagonism of an AMPA-sensitive glutamate receptor: crystal structures of the GluR2 ligand binding core». Neuron. 28 (1): 165–81. doi:10.1016/S0896-6273(00)00094-5.
- ↑ 63,0 63,1 63,2 63,3 63,4 63,5 63,6 Coquelle T; Christensen JK, Banke TG, Madsen U, Schousboe A, and Pickering DS (2000). «Agonist discrimination between AMPA receptor subtypes». Neuroreport. 11 (12): 2643–8.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 64,0 64,1 64,2 64,3 64,4 64,5 Donevan SD; Rogawski MA (1998). «Allosteric regulation of alpha-amino-3-hydroxy-5-methyl-4-isoxazole-propionate receptors by thiocyanate and cyclothiazide at a common modulatory site distinct from that of 2,3-benzodiazepines». Neuroscience. 87 (3): 615–29. doi:10.1016/S0306-4522(98)00109-2.
- ↑ 65,0 65,1 65,2 65,3 65,4 65,5 65,6 Banke TG; Schousboe A, and Pickering DS (1997). «Comparison of the agonist binding site of homomeric, heteromeric, and chimeric GluR1(o) and GluR3(o) AMPA receptors». J Neurosci Res. 49 (2): 176–85. doi:10.1002/(SICI)1097-4547(19970715)49:2<176::AID-JNR6>3.0.CO;2-6.
- ↑ 66,0 66,1 66,2 66,3 Dawson TL; Nicholas RA, and Dingledine R (1990). «Homomeric GluR1 excitatory amino acid receptors expressed in Xenopus oocytes». Mol Pharmacol. 38 (6): 779–84.
- ↑ Jin R; Horning M, Mayer ML, and Gouaux E (2002). «Mechanism of activation and selectivity in a ligand-gated ion channel: structural and functional studies of GluR2 and quisqualate». Biochemistry. 41 (52): 15635–43. doi:10.1021/bi020583k.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 68,0 68,1 68,2 Zhang W; Robert A, Vogensen SB, and Howe JR (2006). «The relationship between agonist potency and AMPA receptor kinetics». Biophys J. 91 (4): 1336–46. doi:10.1529/biophysj.106.084426.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Schiffer HH; Swanson GT, and Heinemann SF (1997). «Rat GluR7 and a carboxyterminal splice variant, GluR7b, are functional kainate receptor subunits with a low sensitivity to glutamate». Neuron. 19 (5): 1141–46. doi:10.1016/S0896-6273(00)80404-3.
{{cite journal}}: External link in|journal= - ↑ 70,0 70,1 70,2 70,3 Nakanishi N; Shneider NA, and Axel R (1990). «A family of glutamate receptor genes: evidence for the formation of heteromultimeric receptors with distinct channel properties». Neuron. 5 (5): 569–81. doi:10.1016/0896-6273(90)90212-X.
- ↑ 71,0 71,1 71,2 71,3 71,4 71,5 Vogensen SB; Jensen HS, Stensbøl TB, Frydenvang K, Bang-Andersen B, Johansen TN, Egebjerg J, and Krogsgaard-Larsen P (2000). «Resolution, configurational assignment, and enantiopharmacology of 2-amino-3-[3-hydroxy-5-(2-methyl-2H- tetrazol-5-yl)isoxazol-4-yl]propionic acid, a potent GluR3- and GluR4-preferring AMPA receptor agonist». Chirality. 12 (10): 705–13. doi:10.1002/1520-636X(2000)12:10<705::AID-CHIR2>3.0.CO;2-9.
{{cite journal}}: External link in|journal= - ↑ Holm MM; Lunn ML, Traynelis SF, Kastrup JS, and Egebjerg J (2005). «Structural determinants of agonist-specific kinetics at the ionotropic glutamate receptor 2». Proc Natl Acad Sci U S A. 102 (34): 12053–58. doi:10.1073/pnas.0505522102.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 73,0 73,1 73,2 73,3 Kizelsztein P; Eisenstein M, Strutz N, Hollmann M, and Teichberg VІ (2000). «Mutant Cycle Analysis of the Active and Desensitized States of an AMPA Receptor Induced by Willardiines». Biochemistry. 39 (42): 12819–27. doi:10.1021/bi000962i.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 74,0 74,1 74,2 Greenwood JR; Mewett KN, Allan RD, Martín BO, and Pickering DS (2006). «3-hydroxypyridazine 1-oxides as carboxylate bioisosteres: a new series of subtype-selective AMPA receptor agonists». Neuropharmacology. 51 (1): 52–9. doi:10.1016/j.neuropharm.2006.02.013.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 75,0 75,1 75,2 75,3 Bjerrum EJ; Kristensen AS, Pickering DS, Greenwood JR, Nielsen B, Liljefors T, Schousboe A, Bra¨uner-Osborne H, and Madsen U (2003). «Design, Synthesis, and Pharmacology of a Highly Subtype-Selective GluR1/2 Agonist, (RS)-2-Amino-3-(4-chloro-3-hydroxy-5-isoxazolyl)propionic Acid (Cl-HIBO)». J Med Chem. 46 (11): 2246–49. doi:10.1021/jm020588f.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 76,0 76,1 76,2 76,3 Campiani G; Morelli E, Nacci V, Fattorusso C, Ramunno A, Novellino E, Greenwood J, Liljefors T, Griffiths R, Sinclair C, Reavy H, Kristensen AS, Pickering DS, Schousboe A, Cagnotto A, Fumagalli E, and Mennini T (2001). «Characterization of the 1H-cyclopentapyrimidine-2,4(1H,3H)-dione derivative (S)-CPW399 as a novel, potent, and subtype-selective AMPA receptor full agonist with partial desensitization properties». J Med Chem. 44 (26): 4501–4. doi:10.1021/jm015552m.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 77,0 77,1 77,2 Stensbøl TB; Borre L, Johansen TN, Egebjerg J, Madsen U, Ebert B, and Krogsgaard-Larsen P (1999). «Resolution, absolute stereochemistry and molecular pharmacology of the enantiomers of ATPA». Eur J Pharmacol. 380 (2–3): 153–62. doi:10.1016/S0014-2999(99)00512-9.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 78,00 78,01 78,02 78,03 78,04 78,05 78,06 78,07 78,08 78,09 Strange M; Bräuner-Osborne H, and Jensen AA (2006). «Functional characterisation of homomeric ionotropic glutamate receptors GluR1-GluR6 in a fluorescence-based high throughput screening assay». Comb Chem High Throughput Screen. 9 (2): 147–58.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)(չաշխատող հղում) - ↑ 79,0 79,1 79,2 Brehm L; Greenwood JR, Hansen KB, Nielsen B, Egebjerg J, Stensbøl TB, Bräuner-Osborne H, Sløk FA, Kronborg TT, and Krogsgaard-Larsen P (2003). «(S)-2-Amino-3-(3-hydroxy-7,8-dihydro-6H-cyclohepta[d]isoxazol-4-yl)propion ic acid, a potent and selective agonist at the GluR5 subtype of ionotropic glutamate receptors. Synthesis, modeling, and molecular pharmacology». J Med Chem. 46 (8): 1350–58. doi:10.1021/jm0204441.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 80,0 80,1 80,2 80,3 Stensbøl TB; Jensen HS, Nielsen B, Johansen TN, Egebjerg J, Frydenvang K, and Krogsgaard-Larsen P (2001). «Stereochemistry and molecular pharmacology of (S)-thio-ATPA, a new potent and selective GluR5 agonist». Eur J Pharmacol. 411 (3): 245–53. doi:10.1016/S0014-2999(00)00916-X.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 81,0 81,1 81,2 81,3 Jensen AA; Christesen T, Bølcho U, Greenwood JR, Postorino G, Vogensen SB, Johansen TN, Egebjerg J, Bra¨uner-Osborne H, and Clausen RP (2007). «Functional Characterization of Tet-AMPA [Tetrazolyl-2-amino-3-(3-hydroxy-5-methyl- 4-isoxazolyl)propionic Acid] Analogues at Ionotropic Glutamate Receptors GluR1−GluR4. The Molecular Basis for the Functional Selectivity Profile of 2-Bn-Tet-AMPA». J Med Chem. 50 (17): 4177–85. doi:10.1021/jm070532r.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Szymańska Е; Pickering DS, Nielsen B, and Johansen TN (2009). «3-Substituted phenylalanines as selective AMPA- and kainate receptor ligands». Bioorg Med Chem. 17 (17): 6390–401. doi:10.1016/j.bmc.2009.07.021.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Kott S; Sager C, Tapken D, Werner M, and HollmannM (2009). «Comparative analysis of the pharmacology of GluR1 in complex with transmembrane AMPA receptor regulatory proteins gamma2, gamma3, gamma4, and gamma8». Neuroscience. 158 (1): 78–88. doi:10.1016/j.neuroscience.2007.12.047.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 84,0 84,1 Tygesen CK; Jørgensen M, and Andersen PH (1995). «The importance of two specific domains in ligand binding to the AMPA/kainate glutamate receptors GluR2 and GluR6». FEBS Lett. 363 (1–2): 184–8. doi:10.1016/0014-5793(95)00315-Z.
- ↑ 85,0 85,1 85,2 85,3 85,4 Varney MA; Rao SP, Jachec C, Deal C, Hess SD, Daggett LP, Lin F, Johnson EC, and Veliçelebi G (1998). «Pharmacological characterization of the human ionotropic glutamate receptor subtype GluR3 stably expressed in mammalian cells». J Pharmacol Exp Ther. 285 (1): 358–70.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 86,0 86,1 Andersen PH; Tygesen CK, Rasmussen JS, Søegaard-Nielsen L, Hansen A, Hansen K, Kiemer A, and Stidsen CE (1996). «Stable expression of homomeric AMPA-selective glutamate receptors in BHK cells». Eur J Pharmacol. 311 (1): 95–100. doi:10.1016/0014-2999(96)00399-8.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 87,0 87,1 Stein E; Cox JA, Seeburg PH, and Verdoorn TA (1992). «Complex pharmacological properties of recombinant alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptor subtypes». Mol Pharmacol. 42: 864–71.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 88,0 88,1 88,2 88,3 Kasper C; Pickering DS, Mirza O, Olsen L, Kristensen AS, Greenwood JR, Liljefors T, Schousboe A, Wätjen F, Gajhede M, Sigurskjold BW, and Kastrup JS (2006). «The Structure of a Mixed GluR2 Ligand-binding Core Dimer in Complex with (S)-Glutamate and the Antagonist (S)-NS1209». J Mol Biol. 357 (4): 1184–1201. doi:10.1016/j.jmb.2006.01.024.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Prescott C; Weeks AM, Staley KJ, and Partin KM (2006). «Kynurenic acid has a dual action on AMPA receptor responses». Neurosci Lett. 402 (1–2): 108–112. doi:10.1016/j.neulet.2006.03.051.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 90,0 90,1 90,2 Simmons RM; Li DL, Hoo KH, Deverill M, Ornstein PL, and Iyengar S (1998). «Kainate GluR5 receptor subtype mediates the nociceptive response to formalin in the rat». Neuropharmacology. 37 (1): 25–36. doi:10.1016/S0028-3908(97)00188-3.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Jones CK; Alt A, Ogden AM, Bleakman D, Simmons RM, Iyengar S, Dominguez E, Ornstein PL, and Shannon HE (2006). «Antiallodynic and antihyperalgesic effects of selective competitive GLUK5 (GluR5) ionotropic glutamate receptor antagonists in the capsaicin and carrageenan models in rats». J Pharmacol Exp Ther. 319 (1): 396–404. doi:10.1124/jpet.106.105601.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Bleakman D; Ogden AM, Ornstein PL, and Hoo K (1999). «Pharmacological characterization of a GluR6 kainate receptor in cultured hippocampal neurons». Eur J Pharmacol. 378 (3): 331–7. doi:10.1016/S0014-2999(99)00478-1.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 93,0 93,1 Dolman NP; More JC, Alt A, Knauss JL, Pentika¨inen OT, Glasser CR, Bleakman D, Mayer ML, Collingridge GL, and Jane DE (2007). «Synthesis and pharmacological characterization of N3-substituted willardiine derivatives: role of the substituent at the 5-position of the uracil ring in the development of highly potent and selective GLUK5 kainate receptor antagonists». J Med Chem. 50 (7): 1558–70. doi:10.1021/jm061041u.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Gitto R; Barreca ML, De Luca L, De Sarro G, Ferreri G, Quartarone S, Russo E, Constanti A, and Chimirri A (2003). «Discovery of a novel and highly potent noncompetitive AMPA receptor antagonist». J Med Chem. 46 (1): 197–200. doi:10.1021/jm0210008.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Cokić B; and Stein V (2008). «Stargazin modulates AMPA receptor antagonism». Neuropharmacology. 54 (7): 1062–70. doi:10.1016/j.neuropharm.2008.02.012.
- ↑ 96,0 96,1 96,2 96,3 Balannik V; Menniti FS, Paternain AV, Lerma J, and Stern-Bach Y (2005). «Molecular mechanism of AMPA receptor noncompetitive antagonism». Neuron. 48 (2): 279–88. doi:10.1016/j.neuron.2005.09.024.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 97,0 97,1 97,2 97,3 97,4 97,5 Bleakman D; Ballyk BA, Schoepp DD, Palmer AJ, Bath CP, Sharpe EF, Woolley ML, Bufton HR, Kamboj RK, Tarnawa I, and Lodge D (1996). «Activity of 2,3-benzodiazepines at native rat and recombinant human glutamate receptors in vitro: stereospecificity and selectivity profiles». Neuropharmacology. 35 (12): 1689–1702. doi:10.1016/S0028-3908(96)00156-6.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 98,0 98,1 Johansen TH; Chaudhary A and Verdoorn TA (1995). «Interactions among GYKI-52466, cyclothiazide, and aniracetam at recombinant AMPA and kainate receptors». Mol Pharmacol. 48 (5): 946–55.
- ↑ 99,0 99,1 99,2 99,3 Cotton JL; and Partin KM (2000). «The contributions of GluR2 to allosteric modulation of AMPA receptors». Neuropharmacology. 39 (1): 21–31. doi:10.1016/S0028-3908(99)00105-7.
- ↑ Andersen PH; Tygesen CK, Rasmussen JS, Søegaard-Nielsen L, Hansen A, Hansen K, Kiemer A, and Stidsen CE (2006). «Stable expression of homomeric AMPAselective glutamate receptors in BHK cells». Eur J Pharmacol. 311 (1): 95–100. doi:10.1016/0014-2999(96)00399-8.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Kiskin NI; Kryshtal’ OA, Tsyndrenko AIa, Volkova TM, and Grishin EV (1989). «Argiopine, argiopinines and pseudoargiopinines—blockers of the glutamate receptors in hippocampal neurons». Neirofiziologiia. 21 (6): 525–32. doi:10.1007/BF01051949.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 102,0 102,1 102,2 102,3 Herlitze S; Raditsch M, Ruppersberg JP, Jahn W, Monyer H, Schoepfer R, and Witzemann V (1993). «Argiotoxin detects molecular differences in AMPA receptor channels». Neuron. 10 (6): 1131–40. doi:10.1016/0896-6273(93)90061-U.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 103,0 103,1 Brackley PT; Bell DR, Choi SK, Nakanishi K, and Usherwood PN (1993). «Selective antagonism of native and cloned kainate and NMDA receptors by polyamine-containing toxins». J Pharmacol Exp Ther. 266 (3): 1573–80.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 104,0 104,1 104,2 Blaschke M; Keller BU, Rivosecchi R, Hollmann M, Heinemann S, and Konnerth A (1993). «A single amino acid determines the subunit-specific spider toxin block of alpha-amino-3-hydroxy-5-methylisoxazole-4-propionate/kainate receptor channels». Proc Natl Acad Sci U S A. 90 (14): 6528–32.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Washburn MS; and Dingledine R (1996). «Block of alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA) receptors by polyamines and polyamine toxins». J Pharmacol Exp Ther. 278 (2): 669–78.
- ↑ 106,0 106,1 Kromann H; Krikstolaityte S, Andersen AJ, Andersen K, Krogsgaard-Larsen P, Jaroszewski JW, Egebjerg J, and Strømgaard K (2002). «Solid-Phase Synthesis of Polyamine Toxin Analogues: Potent and Selective Antagonists of Ca2+-Permeable AMPA Receptors». J Med Chem. 45 (26): 5745–54. doi:10.1021/jm020314s.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 107,0 107,1 107,2 107,3 Magazanik LG; Buldakova SL, Samoilova MV, Gmiro VE, Mellor IR, and Usherwood PN (1997). «Block of open channels of recombinant AMPA receptors and native AMPA/kainate receptors by adamantane derivatives». J Physiol. 505 (Pt 3): 655–63.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 108,0 108,1 Schlesinger F; Tammena D, Krampfl K, and Bufler J (2005). «Two mechanisms of action of the adamantane derivative IEM-1460 at human AMPA-type glutamate receptors». Br J Pharmacol. 145 (5): 656–63. doi:10.1038/sj.bjp.0706233.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Lauterborn JC; Lynch G, Vanderklish P, Arai A, and Gall CM (2000). «Positive modulation of AMPA receptors increases neurotrophin expression by hippocampal and cortical neurons». J Neurosci. 20 (1): 8–21.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Ahmed HА; and Oswald RE (2010). «Piracetam Defines a New Binding Site for Allosteric Modulators of α-Amino-3-hydroxy-5-methyl-4-isoxazole-propionic Acid (AMPA) Receptors». J Med Chem. 53 (5): 2197–203. doi:10.1021/jm901905j.
- ↑ Arai AC; and Kessler M (2007). «Pharmacology of ampakine modulators: from AMPA receptors to synapses and behavior». Curr Drug Targets. 8 (5): 583–602.(չաշխատող հղում)
- ↑ Baumbarger PJ; Muhlhauser M, Zhai J, Yang CR, and Nisenbaum ES (2001). «Positive modulation of alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid (AMPA) receptors in prefrontal cortical pyramidal neurons by a novel allosteric potentiator». J Pharmacol Exp Ther. 298 (1): 86.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Arai AC; Kessler M, Rogers G, and Lynch G (2000). «Effects of the potent ampakine CX614 on hippocampal and recombinant AMPA receptors: interactions with cyclothiazide and GYKI 52466». Mol Pharmacol. 58 (4): 802–13.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Erreger K; Chen PE, Wyllie DJ, and Traynelis SF (2004). «Glutamate receptor gating». Crit Rev Neurobiol. 16 (3): 187–224. doi:10.1615/CritRevNeurobiol.v16.i3.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 115,0 115,1 115,2 115,3 115,4 115,5 Partin KM; Bowie D, and Mayer ML (1995). «Structural determinants of allosteric regulation in alternatively spliced AMPA receptors». Neuron. 14 (4): 833–43. doi:10.1016/0896-6273(95)90227-9.
- ↑ 116,0 116,1 116,2 116,3 116,4 116,5 116,6 116,7 116,8 Krampfl K; Schlesinger F, Wolfes H, Dengler R, and Bufler J (2001). «Functional diversity of recombinant human AMPA type glutamate receptors: possible implications for selective vulnerability of motor neurons». J Neurol Sci. 191 (1): 19–23.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 117,0 117,1 117,2 117,3 117,4 117,5 117,6 117,7 Quirk JC; Siuda ER, and Nisenbaum ES (2004). «Molecular determinants responsible for differences in desensitization kinetics of AMPA receptor splice variants». J Neurosci. 24 (50): 11416–20. doi:10.1523/JNEUROSCI.2464-04.2004.
- ↑ 118,0 118,1 Robert A; and Howe JR (2003). «How AMPA receptor desensitization depends on receptor occupancy». J Neurosci. 23 (3): 847–58.
- ↑ 119,0 119,1 119,2 119,3 119,4 Banke TG; Schousboe A, and Pickering DS (2001). «Comparison of the agonist binding site of homomeric, heteromeric, and chimeric GluR1(o) and GluR3(o) AMPA receptors». J Neurosci Res. 49 (2): 176–85. doi:10.1002/(SICI)1097-4547(19970715)49:2<176::AID-JNR6>3.0.CO;2-6.
- ↑ 120,0 120,1 120,2 Grosskreutz J; Zoerner A, Schlesinger F, Krampfl K, Dengler R, and Bufler J (2003). «Kinetic properties of human AMPA-type glutamate receptors expressed in HEK293 cells». Eur J Neurosci. 17 (6): 1173–78. doi:10.1046/j.1460-9568.2003.02531.x.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 121,0 121,1 121,2 Lomeli H; Mosbacher J, Melcher T, Ho¨ger T, Geiger JR, Kuner T, Monyer H, Higuchi M, Bach A, and Seeburg PH (1994). «Control of kinetic properties of AMPA receptor channels by nuclear RNA editing». Science. 266 (5191): 1709–13. doi:10.1126/science.7992055.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Malinow R (2003). «AMPA receptor trafficking and long-term potentiation». Philos Trans R Soc Lond B Biol Sci. 358: 707–714. doi:10.1098/rstb.2002.1233.
- ↑ Mauceri D; Cattabeni F, Di Luca M, and Gardoni, F (2004). «Calcium/calmodulin-dependent protein kinase II phosphorylation drives synapse-associated protein 97 into spines». J Biol Chem. 279 (22): 23813–21. doi:10.1074/jbc.M402796200.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Wu H; Nash JE, Zamorano P, and Garner CC (2002). «Interaction of SAP97 with minus-end-directed actin motor myosin VI. Implications for AMPA receptor trafficking». J Biol Chem. 277: 30928–34. doi:10.1074/jbc.M203735200.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Zhu JJ; Qin Y, Zhao M, Van Aelst L, and Malinow R (2002). «Ras and Rap control AMPA receptor trafficking during synaptic plasticity». Cell. 110 (4): 443–55. doi:10.1016/S0092-8674(02)00897-8.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Borgdorff AJ; and Choquet D (2002). «Regulation of AMPA receptor lateral movements». Nature. 417 (6889): 649–53. doi:10.1038/nature00780.
- ↑ Park M; Penick EC, Edwards JG, Kauer JA and Ehlers MD (2004). «Recycling endosomes supply AMPA receptors for LTP». Science. 305 (5692): 1972–5. doi:10.1126/science.1102026.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Makino H; and Malinow R (2009). «AMPA receptor incorporation into synapses during LTP: the role of lateral movement and exocytosis». Neuron. 64 (3): 381–90. doi:10.1016/j.neuron.2009.08.035.
- ↑ Howard MA; Elias GM, Elias LA, Swat W, and Nicoll RA (2010). «The role of SAP97 in synaptic glutamate receptor dynamics». Proc Natl Acad Sci U S A. 107 (8): 3805–10. doi:10.1073/pnas.0914422107.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Wang Z; Edwards JG, Riley N, Provance DW Jr, Karcher R, Li XD, Davison IG, Ikebe M, Mercer JA, Kauer JA and Ehlers MD (2008). «Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity». Cell. 135 (3): 535–48. doi:10.1016/j.cell.2008.09.057.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Beattie EC; Carroll RC, Yu X, Morishita W, Yasuda H, Zastrow M and Malenka RC (2000). «Regulation of AMPA receptor endocytosis by a mechanism shared with LTD». Nat Neurosci. 3 (12): 1291–1300. doi:10.1038/81823.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Jung N; and Haucke V (2007). «Clathrin-mediated endocytosis at synapses». Traffic. 8 (9): 1129–36. doi:10.1111/j.1600-0854.2007.00595.x.
- ↑ Lu W; and Ziff E (2005). «PICK1 interacts with ABP/GRIP to regulate AMPA Receptor Trafficking». Neuron. 47 (3): 407–21. doi:10.1016/j.neuron.2005.07.006.
- ↑ Ehlers MD (2000). «Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting». Neuron. 28 (2): 511–525. doi:10.1016/S0896-6273(00)00129-X.

