Հակադարձ տրանսկրիպտազ
| Հակադարձ տրանսկրիպտազ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
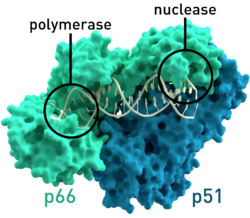 ՄԻԱՎ-ի հակադարձ տրանսկրիպտազի բյուրեղագրական կառուցվածքը։ Գույնով նշված են p51 և p66 ենթամիավորները, և ընդգծված են պոլիմերազային և նուկլեազային ակտիվ կենտրոնները։
ՄԻԱՎ-ի հակադարձ տրանսկրիպտազի բյուրեղագրական կառուցվածքը։ Գույնով նշված են p51 և p66 ենթամիավորները, և ընդգծված են պոլիմերազային և նուկլեազային ակտիվ կենտրոնները։ | |||||||||
| Տեսակ | ֆերմենտների խումբ կամ դաս | ||||||||
| Ենթադաս | ԴՆԹ-պոլիմերազ և տրանսֆերազ[1] | ||||||||
| Բնորոշիչներ | |||||||||
| ՖՀ համար | |||||||||
| CAS համար | |||||||||
| Տվյալներ | |||||||||
| IntEnz | |||||||||
| BRENDA | |||||||||
| ExPASy | |||||||||
| KEGG | |||||||||
| MetaCyc | |||||||||
| PRIAM | |||||||||
| Protein Data Bank | |||||||||
| Գենի օնտոլոգիա | |||||||||
| |||||||||
Հակադարձ տրանսկրիպտազ կամ ռեվերտազ, ֆերմենտ, որը ՌՆԹ-ի հիման վրա սինթեզում է կոմպլեմենտար ԴՆԹ (կԴՆԹ)։ Այն գործում է ՄԻԱՎ-ի և հեպատիտ B վիրուսի գենոմները կրկնապատկելու, ռետրոտրանսպոզոնների պրոլիֆերացվելու և էուկարիոտ բջիջներում թելոմերները երկարացնելու համար[2][3][4]։
Ռետրովիրուսային հակադարձ տրանսկրիպտազն ունի երեք հաջորդական կենսաքաիմիական գործառույթներ․ ՌՆԹ-կախյալ ԴՆԹ-պոլիմերազային ակտիվություն, ռինոնուկլեազային ակտիվություն և ԴՆԹ-կախյալ ԴՆԹ-պոլիմերազային ակտիվություն։ Այսպիսով, ֆերմենտը միաշղթա ՌՆԹ-ից ստանում է երկշղթա ԴՆԹ։ Ռեակցիաների նույն հաջորդականությունը կիրառվում է լաբորատորիաներում մոլեկուլային կլոնավորման, ՌՆԹ-ի սեքվենավորման, պոլիմերազային շղթայական ռեակցիայի (ՊՇՌ) և գենոմային վերլուծության մեջ։
Պատմություն[խմբագրել | խմբագրել կոդը]
Հակադարձ տրանսկրիտազները հայտնաբերել է Հաուարդ Թեմինը[5] և անջատել է Դեյվիդ Բալտիմորը[6]։ Նրանց ձեռքբերումների համար նրանք ստացել են 1975 թվի Նոբելյան մրցանակը «Ֆիզիոլոգիա կամ բժշկություն» ոլորտում։
Լավ ուսումնասիրված հակադարձ տրանսկրիպտազներ են․
- ՄԻԱՎ-1 հակադարձ տրանսկրիպտազ[7]
- M-MLV հակադարձ տրանսկրիպտազ (Մոլոնի մկան լեյկեմիայի վիրուս)[8]
- AMV հակադարձ տրանսկրիպտազ (թռչնի միելոբլաստոզի վիրուս)[8]
- Թելոմերազ հակադարձ տրանսկրիպտազ (էուկարիոտ բջիջներում ապահովում է թելոմերների կայուն երկարությունը)[9]
Գործառույթը վիրուսներում[խմբագրել | խմբագրել կոդը]

Վիրուսների այն խումբը, որն օրգագործում է հակադարձ տրանսկրիպտազը սեփական գենոմը կրկնապատկելու և հետագայում տիրոջ գենոմի մեջ ներկառուցելու համար, կոչվում են ռետրովիրուսներ, եթե նրանց գենոմը ներկայացված է ՌՆԹ-ով, և հեպադնավիրուսներ, եթե նրանց գենոմը ներկայացված է ԴՆԹ-ով։ ՌՆԹ-ից ԴՆԹ-ի սինթեզը կոչվում է հակադարձ տրանսկրիպցիա կամ ռետրոտրանսկրիպցիա։
Հակադարձ տրանսկրիպցիայի ընթացք[խմբագրել | խմբագրել կոդը]
Հակադարձ տրանսկրիպտազը միաշղթա ՌՆԹ-ից ստանում է երկշղթա ԴՆԹ։ Եթե վիրուսը չունի ԴՆԹ-կախյալ ԴՆԹ-պոլիմերազային ակտիվություն, երկշղթա ԴՆԹ-ն սինթեզվում է տիրոջ ԴՆԹ-պոլիմերազ δ-ով, որը «շփոթում» է վիրուսային ԴՆԹ-ն սեփական բջջի դեռևս պրայմեր կապած ԴՆԹ-ի հատվածի հետ, և փոխարինում է ՌՆԹ-ն ԴՆԹ-ով։
Հակադարձ տրանսկրիպցիայի սխալ գործելու հավանականությունը բարձր է, որն էլ պայմանավորում է վիրուսների դիմակայունությունը դեղամիջոցների նկատմամբ։
Հակադարձ տրանսկրիպցիան ռետրովիրուսների մոտ[խմբագրել | խմբագրել կոդը]

Ռետրովիրուսները ՌՆԹ գենոմ պարունակող հակադարձ տրանսկրիպցիա իրականացնող վիրուսներ են, որոնք իրենց կրկնապատկման ցիկլում գործածում են նաև միջանկյալ ԴՆԹ։ Ռետրովիրուսներ են մարդու իմունային անբավարաության վիրուսը (ՄԻԱՎ), մարդու T լիմֆոտրոֆ վիրուսը (HTLV)։ Երկշղթա ԴՆԹ-ն գոյանում է ցիտոզոլում[10], և այդ գործընթացի հաջորդականությունը ներկայացված է սույն բաժնի պատկերում։
Երկշղթա ԴՆԹ-ի սինթեզի պրոցեսը ներառում է շղթայի տեղափոխում, որի ժամանակ ՌՆԹ-կախյալ ԴՆԹ-պոլիմերազը սինթեզում է ԴՆԹ, որը տրանսլոկացվում է գենոմի ակցեպտորային տեղամաս, որից հետո ԴՆԹ-կախյալ ԴՆԹ-պոլիմերազը վիրուսային ԴՆԹ-ի վրա սինթեզում է երկրորդ շղթան[11]։
Ռետրովիրուսային ՌՆԹ-ի ընթերցման ուղղությունը 5' ծայրից դեպի 3' ծայրն է։ Պրոմոտերի հետ կապվող հատվածը կոչվում է պորոմոտեր կապող տեղամաս, որի 5' ծայրը կոչվում U5, իսկ 3' ծայրը՝ առաջնորդող ծայր։ Պրոմոտեր կապող տեղամասը ավելի մոտ է 5' ծայրին, սակայն հակադարձ տրանսկրիպցիան հարուցվում է 3' ծայրից 5'→3' ուղղությամբ (նոր սինթեզված ԴՆԹ-ի նկատմամբ)։ Այսպիսով, պրայմերը և հակադարձ տրանսկրիպտազը պետք է վերադասավորվեն դեպի 3' ծայր։ Այս գործընթացը իրականացնելու համար գործում են ԴՆԹ պոլիմերազը, ռիբոնուկլեազ H-ը և այլ ֆերմենտներ, տեղի է ունենում պոլինուկլեոտիդեների ապապարուրում և այլն[12][13]։
ՄԻԱՎ-ի հակադարձ տրանսկրիպտազը ունի ռիբոնուկլեազային ակտիվութուն, որով այն քայքայում է վիրուսային ՌՆԹ-ն կԴՆԹ-ի սինթեզի ընթացքում, ինչպես նաև ԴՆԹ-կախյալ ԴՆԹ-պոլիմերազային ակտիվություն, որով իմաստային (սենս) կԴՆԹ-ի շղթայի վրա սինթեզվում է հակաիմաստային (անտիսենս) շղթան։ Այսպես գոյանում է երկշղթա միջանկյալ վիրուսային ԴՆԹ-ն (վԴՆԹ)[14]։ ՄԻԱՎ-ի ՌՆԹ-ի կառուցվածքային տարրերը կարգավորում են հակադարձ տրանսկրիպցիայի ընթացքը[15]։
Բջջային օրգանիզմներում[խմբագրել | խմբագրել կոդը]
Էուկարիոտ բջիջների գենոմի ինքնակրկնապատկվող տեսամասերը, որոնք կոչվում են ռետրոտրանսպոզոններ, վերադասավորվում են գենոմի մի տեղամասից մյուսը հակադարձ տրանսկրիպցիայի միջոցով՝ կիրառելով միջանկյալ ՌՆԹ մոլեկուլ։ Ռետրոտրանսպոզոնները առկա են բույսերի և կենդանիների գենոմներում։ Թելոմերազը մարդու և շատ այլ էուկարիոտների մոտ առկա մեկ այլ հակադարձ տրանսկրիպտազ է, որն ունի իր սեփական ՌՆԹ-ն։ Վերջինս կիրառվում է որպես կաղապար ԴՆԹ-ի կրկնապատման համար[16]։
Հակադարձ տրանսկրիպտազի առկայությունը պրոկարիոտներում ուսումնասիրվել է դեռևս 1971 թվականին (Բելյանսկին և գործընկերները) Ֆրանսիայում և մի քանի տարի անց ԽՍՀՄ-ում (Ռոմաշչենկո 1977[17])։ Դրանք կոդավորովում են բակտերիալ գենոմի հատուկ հաջորդականություններով՝ ռետրոններով, որոնք կիրառվում են բազմապատճեն միաշղթա ԴՆԹ-ի սինթեզի մեջ։ ԴՆԹ-ի սինթեզը սկսվում է պրայմերով, որը բակտերիաներում սինթեզվում է կրկնապատկման ժամանակ[18]։
Վալերիան Դոլյան պնդում է, որ վիրուսները, իրենց բազմազանության շնորհիվ, շատ կարևոր ներդրում են ունեցել բջջային կյանքի ձևավորման մեջ, և հակադարձ տրանսկրիպտազը կենտրոնական դեր է կատարել[19]։
Կառուցվածք[խմբագրել | խմբագրել կոդը]
Հակադարձ տրանսկրիպտազը, ինչպես այլ վիրուսային նուկլեինաթթուների պոլիմերզները, նման է աջ ձեռքի[20][21]։ Բացի պոլիմերազից, հակադարձ տրանսկրիպտազն ունի նաև ռիբոնուկլեազ H, որը քայքայելով ՌՆԹ կաղապարը՝ հնարավոր է դարձնում ԴՆԹ-ի մյուս շղթայի սինթեզը[22]։ Քայքայման որոշ ֆրագմենտներ պրայմերի դեր են կատարում ԴՆԹ-պոլիմերազի համար (կա՛մ հակադարձ տրանսկրիպտազի, կա՛մ տեր բջջի)[20]։
Կրկնապատկման ճշտություն[խմբագրել | խմբագրել կոդը]
Ռետրովիրուսի կենսական ցիկլում գործում են կրկնապատկման երեք տարբեր համակարգեր։ Առաջինը վիրուսային ՌՆԹ-ից կոմպլեմենտար ԴՆԹ-ի սինթեզն է հակադարձ տրանսկրիպտազով։ Երկրորդն արդեն իսկ տեր բջջի գենոմում ինտեգրված վիրուսային ԴՆԹ-ի կրկնապատկումն է տիրոջ ԴՆԹ-պոլիմերազով։ Երրորդը նախավիրուսային ԴՆԹ-ի տրանսկրիպցիան է ՌՆԹ պոլիմերազ II-ով և ՌՆԹ մոլեկուլի ստացումն է։ Այս ՌՆԹ-ն հետագայում «փաթեթավորվելու» է վիրիոններում։ Կրկնապատկման փուլերից մեկում կամ մի քանիսում հնարավոր է մուտացիաների առաջացումը[23]։
Հակադարձ տրանսկրիպտազն ունի սխալ գործելու բարձր հավանականություն, քանի որ, ի տարբերություն այլ ԴՆԹ-պոլիմերազների, այն չունի սրբագրման հատկություն։ Սա հանգեցնում է մուտացիաների ավելի արագ կուտակման համեմատած կրկնապատման սրբագրվող փուլերի։ Promega-ի արտադրության կոմերցիոն օգտագործման հակադարձ տրանսկրիպտազների համար նշվում է սխալի հաճախականությունը, որը հավասար է 1:17,000-ի AMV-ի հակադարձ տրանսկրիպտազի և 1:30,000-ի M-MLV-ի հակադարձ տրանսկրիպտազի համար[24]։
Միանուկլեոտիդային պոլիմորֆիզմներ գոյացնելուց բացի հակադարձ տրանսկրիպտազները դերակատարում ունեն հիբրիդային տրանսկրիպտների սինթեզի, էքզոնների նոր կոմբինացիաների ստեղծման և արհեստական հակաիմաստային (անտիսենս) տրանսկրիպտների սինթեզի մեջ[25][26]։ Ենթադրվում է, որ հակադարձ տրանսկրիպտազի կաղապարի փոփոխման հատկությունը, որը հնարավոր է ուսումնասիրել միայն in vivo պայմաններում, հանդիսանում է մոդելային օրգանիզմների գենոմում հազարավոր չանոտացված տրանսկրիպտների հայտնաբերման պատճառը[27]։
Կաղապարի փոփոխություն[խմբագրել | խմբագրել կոդը]
Ռետրովիրուսային յուրաքանչյուր մասնիկում տեղակայված են երկու ՌՆԹ գենոմներ, սակայն վարակումից հետո յուրաքանչյուր մասնիկ գոյացնում է միայն մեկ նախավիրուս (պրովիրուս)[28]։ Վարակումից հետո հակադարձ տրանսկրիպցիան ուղեկցվում է հակադարձ տրանսկիրպտազի կաղապարների փոփոխությամբ (ռեկոմբինացիա)[28]՝ մի գենոմից մյուսը։ Գոյություն ունեն երկու մոդելներ, որոնք բացատրում են այս երևույքը։ Առաջինը՝ հարկադրված ընտրության մոդելը, ենթադրում է, որ հակադարձ տրանսկրիպտազը փոխում է իր կաղապարը, երբ այն հանդիպում է խոչընդոտի, հետևաբար գենոմի անբողջականության պահպանման համար ռեկոմբինացիան պարտադիր է։ Երկրորդը՝ դինամիկ ընտրության մոդելը, ենթադրում է, որ կաղապարի փոփոխությունը տեղի է ունենում, երբ ռիբոնուկլեազային ակտիվության արագությունը չի համապատասխանում պոլիմերազային ակտիվության արագությանը, հետևաբար ռեկոմբինացիան տեղի է ունենում պատահականորեն և չի գործում ի պատասխան գենոմային վնասների։ Ռոսոնի և գործընկեների ուսումնասիրությունները հիմավորել է այս երկու մոդելները[28]։ Յուրաքանչյուր ռեպլիկացիոն ցիկլի ընթացքում գենոմի փոփոխությունը տեղի է ունենում 5-14 անգամ[29]։ Կաղապարի փոփոխությունը (ռեկոմբինացիան) անհրաժեշտ է գենոմի ամբողջականությունը պահպանելու համար և կարծես «փրկում» է վնասված գենոմը՝ նորոգելով այն[28][30]։
Կիրառումներ[խմբագրել | խմբագրել կոդը]

Հակավիրուսային դեղամիջոցներ[խմբագրել | խմբագրել կոդը]
Քանի որ ՄԻԱՎ-ը կրկնապատկում է իր գենոմը հակադարձ տրանսկրիպտազով և այդպես բազմանում ՝ գոյացնելով վիրուսային նոր մասնիկներ, ստեղծվել են յուրահատուկ դեղամիջոցներ, որոնք ընտրողաբար արգելակում են հակադարձ տրանսկրիցիան։ Այս դեղամիջոցները կոչվում են հակադարձ տրանսկրիպտազի արգելակիչներ, որոնցից են նուկլեոզիդների և նուկլեոտիդների անալոգ զիդովուդինը (առևտրային անվանումը Ռետրովիր), լամիվուդինը (առևտրային անվանումը Էպիվիր) և տենոֆովիրը (առևտրային անվանումը Վիրեադ), ինչպես նաև ոչ նուկլեոզիդային արգելակիչ նևիրապինը (առևտրային անվանումը Վիրամուն)։
Մոլեկուլային կենսաբանություն[խմբագրել | խմբագրել կոդը]
Հակադարձ տրանսկրիպտազը հնարավորություն է տալիս պոլիմերազային շղթայական ռեակցիան կիրառել ՌՆԹ-ի համար (հակադարձ տրանսկրիպտազի կիրառումով պոլիմերազային շղթայական ռեակցիա՝ ՀՏ-ՊՇՌ/RT-PCR)։ Դասական ՊՇՌ-ն կիրառվում է միայն ԴՆԹ-ի դեպքում, սակայն հակադարձ տրանսկրիպտազի օգնությամբ ՌՆԹ-ն տրանսկրիպտվում է ԴՆԹ-ի, այսպիսով հնարավոր դարձնելով ՌՆԹ մոլեկուլների ՊՇՌ անալիզը։ իՌՆԹ-ից կԴՆԹ-ի դարանների ստեղծման գործում նույնպես կիրառվում է հակադարձ տրանսկրիպտազը։ Շուկայում հակադարձ տրանսկրիպտազի հայտնվելը նպաստել է մոլեկուլային կենսաբանության զարգացմանը, հատկապես ՌՆԹ-ի կլոնավորման, սեքվենավորման և բնութագրման համար։
Տես նաև[խմբագրել | խմբագրել կոդը]
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ ftp://ftp.expasy.org/databases/enzyme/enzyme.dat
- ↑ Crick F (1970 թ․ օգոստոս). «Central dogma of molecular biology». Nature. 227 (5258): 561–3. Bibcode:1970Natur.227..561C. doi:10.1038/227561a0. PMID 4913914. S2CID 4164029.
- ↑ Sarkar S (1996). The Philosophy and History of Molecular Biology: New Perspectives. Dordrecht: Kluwer Academic Publishers. էջեր 187–232.
- ↑ Danchin É, Pocheville A, Rey O, Pujol B, Blanchet S (2019). «Epigenetically facilitated mutational assimilation: epigenetics as a hub within the inclusive evolutionary synthesis». Biological Reviews. 94 (1): 259–282. doi:10.1111/brv.12453. PMC 6378602. S2CID 67861162.
- ↑ Temin HM, Mizutani S (1970 թ․ հունիս). «RNA-dependent DNA polymerase in virions of Rous sarcoma virus». Nature. 226 (5252): 1211–3. doi:10.1038/2261211a0. PMID 4316301. S2CID 4187764.
- ↑ Baltimore D (1970 թ․ հունիս). «RNA-dependent DNA polymerase in virions of RNA tumour viruses». Nature. 226 (5252): 1209–11. doi:10.1038/2261209a0. PMID 4316300. S2CID 4222378.
- ↑ Ferris AL, Hizi A, Showalter SD, Pichuantes S, Babe L, Craik CS, Hughes SH (1990 թ․ ապրիլ). «Immunologic and proteolytic analysis of HIV-1 reverse transcriptase structure» (PDF). Virology. 175 (2): 456–64. doi:10.1016/0042-6822(90)90430-y. PMID 1691562.
- ↑ 8,0 8,1 Konishi A, Yasukawa K, Inouye K (2012 թ․ հուլիս). «Improving the thermal stability of avian myeloblastosis virus reverse transcriptase α-subunit by site-directed mutagenesis» (PDF). Biotechnology Letters. 34 (7): 1209–15. doi:10.1007/s10529-012-0904-9. hdl:2433/157247. PMID 22426840. S2CID 207096569.
- ↑ Autexier C, Lue NF (2006 թ․ հունիս). «The structure and function of telomerase reverse transcriptase». Annual Review of Biochemistry. 75 (1): 493–517. doi:10.1146/annurev.biochem.75.103004.142412. PMID 16756500.
- ↑ Bio-Medicine.org - Retrovirus Արխիվացված 2021-04-28 Wayback Machine Retrieved on 17 Feb, 2009
- ↑ Telesnitsky A, Goff SP (1993). «Strong-stop strand transfer during reverse transcription». In Skalka MA, Goff SP (eds.). Reverse transcriptase (1st ed.). New York: Cold Spring Harbor. էջ 49. ISBN 978-0-87969-382-4.
- ↑ Bernstein A, Weiss R, Tooze J (1985). «RNA tumor viruses». Molecular Biology of Tumor Viruses (2nd ed.). Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory.
- ↑ Moelling K, Broecker F (2015 թ․ ապրիլ). «The reverse transcriptase-RNase H: from viruses to antiviral defense». Annals of the New York Academy of Sciences. 1341 (1): 126–35. Bibcode:2015NYASA1341..126M. doi:10.1111/nyas.12668. PMID 25703292. S2CID 42378727.
- ↑ Kaiser GE (2008 թ․ հունվար). «The Life Cycle of HIV». Doc Kaiser's Microbiology Home Page. Community College of Baltimore Count. Արխիվացված է օրիգինալից 2010 թ․ հուլիսի 26-ին.
- ↑ Krupkin M, Jackson LN, Ha B, Puglisi EV (2020 թ․ դեկտեմբեր). «Advances in understanding the initiation of HIV-1 reverse transcription». Curr Opin Struct Biol. 65: 175–183. doi:10.1016/j.sbi.2020.07.005. PMC 9973426. PMID 32916568. S2CID 221636459.
- ↑ Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A (2004). Molecular cell biology. New York: W.H. Freeman and CO. ISBN 978-0-7167-4366-8.
- ↑ Romashchenko AG, և այլք: (1977). «Otdelenie ot preparatov DNK-polimeraz I RNK-zavisimoy DNK-polimeraz; oshistka i svoystva fermenta». Proceedings of the USSR Academy of Sciences. 233: 734–737.
- ↑ Hurwitz J, Leis JP (1972 թ․ հունվար). «RNA-dependent DNA polymerase activity of RNA tumor viruses. I. Directing influence of DNA in the reaction». Journal of Virology. 9 (1): 116–29. doi:10.1128/JVI.9.1.116-129.1972. PMC 356270. PMID 4333538.
- ↑ Arnold C (2014 թ․ հուլիսի 17). «Could Giant Viruses Be the Origin of Life on Earth?». National Geographic. Վերցված է 2016 թ․ մայիսի 29-ին.
- ↑ 20,0 20,1 Sarafianos SG, Marchand B, Das K, Himmel DM, Parniak MA, Hughes SH, Arnold E (2009 թ․ հունվար). «Structure and function of HIV-1 reverse transcriptase: molecular mechanisms of polymerization and inhibition». Journal of Molecular Biology. 385 (3): 693–713. doi:10.1016/j.jmb.2008.10.071. PMC 2881421. PMID 19022262.
- ↑ Hansen JL, Long AM, Schultz SC (1997 թ․ օգոստոս). «Structure of the RNA-dependent RNA polymerase of poliovirus». Structure. 5 (8): 1109–22. doi:10.1016/S0969-2126(97)00261-X. PMID 9309225.
- ↑ Schultz SJ, Champoux JJ (2008 թ․ հունիս). «RNase H activity: structure, specificity, and function in reverse transcription». Virus Research. 134 (1–2): 86–103. doi:10.1016/j.virusres.2007.12.007. PMC 2464458. PMID 18261820.
- ↑ Bbenek K, Kunkel AT (1993). «The fidelity of retroviral reverse transcriptases». In Skalka MA, Goff PS (eds.). Reverse transcriptase. New York: Cold Spring Harbor Laboratory Press. էջ 85. ISBN 978-0-87969-382-4.
- ↑ «Promega kit instruction manual» (PDF). 1999. Արխիվացված է օրիգինալից (PDF) 2006 թ․ նոյեմբերի 21-ին.
- ↑ Houseley J, Tollervey D (2010 թ․ օգոստոս). «Apparent non-canonical trans-splicing is generated by reverse transcriptase in vitro». PLOS ONE. 5 (8): e12271. Bibcode:2010PLoSO...512271H. doi:10.1371/journal.pone.0012271. PMC 2923612. PMID 20805885.
- ↑ Zeng XC, Wang SX (2002 թ․ հունիս). «Evidence that BmTXK beta-BmKCT cDNA from Chinese scorpion Buthus martensii Karsch is an artifact generated in the reverse transcription process». FEBS Letters. 520 (1–3): 183–4, author reply 185. doi:10.1016/S0014-5793(02)02812-0. PMID 12044895. S2CID 24619868.
- ↑ van Bakel H, Nislow C, Blencowe BJ, Hughes TR (2011). «Response to "The Reality of Pervasive Transcription"». PLOS Biology. 9 (7): e1001102. doi:10.1371/journal.pbio.1001102. PMC 3134445.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 28,0 28,1 28,2 28,3 Rawson JM, Nikolaitchik OA, Keele BF, Pathak VK, Hu WS (2018 թ․ նոյեմբեր). «Recombination is required for efficient HIV-1 replication and the maintenance of viral genome integrity». Nucleic Acids Research. 46 (20): 10535–10545. doi:10.1093/nar/gky910. PMC 6237782. PMID 30307534.
- ↑ Cromer D, Grimm AJ, Schlub TE, Mak J, Davenport MP (2016 թ․ հունվար). «Estimating the in-vivo HIV template switching and recombination rate». AIDS. 30 (2): 185–92. doi:10.1097/QAD.0000000000000936. PMID 26691546. S2CID 20086739.
- ↑ Hu WS, Temin HM (1990 թ․ նոյեմբեր). «Retroviral recombination and reverse transcription». Science. New York, N.Y. 250 (4985): 1227–33. Bibcode:1990Sci...250.1227H. doi:10.1126/science.1700865. PMID 1700865.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- RNA+Transcriptase at the U.S. National Library of Medicine Medical Subject Headings (MeSH)
- animation of reverse transcriptase action and three reverse transcriptase inhibitors
- Molecule of the month Արխիվացված 2020-04-09 Wayback Machine (September 2002) at the RCSB PDB
- HIV Replication 3D Medical Animation. (Nov 2008). Video by Boehringer Ingelheim.
- Goodsell DS. «Molecule of the Month: Reverse Transcriptase (Sep 2002)». Research Collaboratory for Structural Bioinformatics (RCSB) Protein Data Bank (PDB). Արխիվացված է օրիգինալից 2015 թ․ հոկտեմբերի 19-ին. Վերցված է 2013 թ․ հունվարի 13-ին.
- Overview of all the structural information available in the PDB for UniProt: P03366 (Human immunodeficiency virus Reverse transcriptase) at the PDBe-KB.
- TWiV 904: 50 years of reverse transcriptase Vincent Racaniello travels to Cold Spring Harbor Laboratory to speak with David Baltimore, John Coffin (scientist), and Harold Varmus about the discovery in 1970 of retroviral reverse transcriptase and its impact on life sciences research.
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Հակադարձ տրանսկրիպտազ» հոդվածին։ |
| ||||||
