Ացետոն
| Ացետոն | |
|---|---|
 | |
 | |
 | |
| Քիմիական բանաձև | C₃H₆O |
| Ֆիզիկական հատկություններ | |
| Մոլային զանգված | 9,6E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 0,7902 գ/սմ³[2] գ/սմ³ |
| Մակերեսային լարվածություն | (20 °C)։ 23,7 մ Ն/մ |
| Իոնիզացման էներգիա | 1,6E−18 ջոուլ և 1,6E−18 ջոուլ[3] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | −140 ℉, −95 °C[4], −94 °C[5] և −94,8 °C[3] °C |
| Եռման ջերմաստիճան | 133 ℉, 56 °C[4] և 56,05 °C[3] °C |
| Այրման ջերմաստիճան | 0 ℉ |
| Ինքնաբռնկման ջերմաստիճան | 465 °C[6] |
| Կրիտիկական ճնշում | 46.385 մթն. |
| Գոյացան էնթալպիա | −247,7 կՋ/մոլ |
| Հալման էնթալպիա | 5,69 կՋ/մոլ կՋ/մոլ |
| Եռման էնթալպիա | 29,1 կՋ/մոլ |
| Գոլորշու ճնշում | 23 998 Պասկալ |
| Քիմիական հատկություններ | |
| pKa | 19,16 ± 0,04[7] |
| Բեկման ցուցիչ | 1,3588 |
| Դիպոլ մոմենտ | 9,6E−30 Կլ·մ[3] |
| Դասակարգում | |
| CAS համար | 67-64-1 |
| PubChem | 180 |
| EINECS համար | 200-662-2 |
| SMILES | CC(=O)C |
| ЕС | 200-662-2 |
| RTECS | AL3150000 |
| ChEBI | 175 |
| IDLH | 5950 mg/m³ |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |

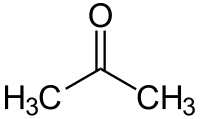
Ացետոն (դիմեթիլ կետոն, պրոպանոն-2)[8], օրգանական միացություն, որն ունի CH3—C(O)—CH3 բանաձևը, հագեցած կետոնների պարզագույն ներկայացուցիչը։
Իր անվանումն ացետոնը ստացել է լատիներեն acetum (քացախ) բառից։ Դա պայմանավորված է նրանով, որ ացետոնը հնում ստանում էին ացետատներից, որից հետո, ացետոնից ստանում էին սառցային քացախաթթու։
Հայտնագործում[խմբագրել | խմբագրել կոդը]
Պարզագույն, միևնույն ժամանակ կարևորագույն կետոններից մեկը՝ ացետոնը, առաջին անգամ հայտնաբերվել է 1595 թվականին գերմանացի գիտնական Անդրեաս Լիբիավուսի կողմից՝ կապարի ացետատի չոր թորման արդյունքում։ Սակայն ճիշտ պարզաբանել քիմիական հատկություները և դասակարգել հաջողվեց միայն 1832 թվականին Ժան-Բատիստ Դյումային և Յուստուս ֆոն Լիբիխին։ Մինչև 1914 թվականը ացետոնը ստանում էին փայտի կոկսացմամբ, սակայն մեծացած պահանջարքի պատճառով մշակվեցին ստացման նոր մեթոդներ։
Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Ացետոնը անգույն, շարժուն, հեշտ ցնդող հեղուկ է, բնութագրական սուր հոտով։ Ցանկացած հարաբերությամբ խառնվում է ջրի, էթիլ սպիրտի, մեթիլ սպիրտի, բենզոլի, դիէթիլ եթերի, և շատ այլ էստերների հետ և այլն։
Հիմնական թերմոդինամիկական բնոոթագրեր[9]
- մակերևութային ակտիվություն՝ (20 °C)։ 23,7 մՆ/մ
- առաջացման ստանդարտ էնթալպիան ΔH (298 Կ)՝ −247,7 կՋ/մոլ
- առաջացման ստանդարտ էնդրոպիան S (298 Կ)՝ 200 Ջ/մոլ·Կ
- ստանդարտ մոլյար ջերմունակություն՝ 125 Ջ/մոլ·Կ
- հալման էնթալպիան ΔHհալ՝ 5,69 կՋ/մոլ
- եռման էնթալպիան ΔHեռ՝ 29,1 կՋ/մոլ
- այրման ջերմաքանակը Qp՝ 1829,4 կՋ/մոլ
- կրիտիկական ճնշում՝ 4,7 ՄՊա
- կրիտիկական խտություն՝ 0,273 գ/սմ3
Թերմոքիմիական բնութագրեր
- օդում բռնկման ջերմաստիճանը[10]՝ −17,778 °C (-18 °C)
- օդում ինքնաբռնկման ջերմաստիճանը՝ 465 °C
- պայթյունավտանգ կոնցենտրացիաների սահմանները՝ 2,6-12,8 %
Օպտիկական հատկություններ
- բեկման ցուցիչը՝ ( D-նատրիումի գծի համար)։
- 1,3591՝ (20 °C)
- 1,3588՝ (25 °C)
- դիսոցման աստիճանը՝ pKa = 20 (20 °C, ջուր)
- դիէլեկտրիկ թափանցելիությունը՝ (20 °C)։ 20,9
- մոլեկուլի դիպոլ մոմոնտը՝ (20 °C)։ 2,84 Դեբայ
Քիմիական հատկություններ
Ացետոնը հանդիսանում է առավել ակտիվ կետոններից, և տալիս է բիսուլֆիդային միացություն։
Հիմքերի ազդեցության տակ, մտնում է ալդոլ կոնդեսացիայի մեջ՝ առաջացնելով դիացետո սպիրտ։
վերականգնումը ցինկով մինչև պինակոին
բարձր ջերմաստիճանում (700 °C) առաջանում է կետեն
հեշտությամբ կապում է ցիանոջրածին առաջացնելով ացետոն ցիանհիդրին
Ացետոնում ջրածնի ատոմները տեղակալվում են հալոգենների ատոմներով։ Քլորի և յոդի ազդեցությամբ հիմնային միջավայրում առաջացնում է քլորոֆորմ և յոդֆորմ։
Ստացում[խմբագրել | խմբագրել կոդը]
Ացետոնի համաշխարհային արտադրությունը հասնում է 6,9 տոննա տարեկան (2012 թ. տվյալներով) և շարունակում է աճել, արդյունաբերությունում ստացվում է ուղղակի ճանապարհով կամ անուղղակի պրոպենից։
Կումոլային եղանակ
Ացետոնի հիմնական մասը ստանում են կումոլային եղանակով երբ ացետոնը հանդիսանում է բենզոլի և ֆենոլի հետ միասին պրոդուկտ։
Ստացումը իզոպրոպիլենից
Պրոպենի օքսիդացումից
Կիրառում[խմբագրել | խմբագրել կոդը]
Հանդիսանում է բազմաթիվ կարևոր քիմիական միացությունների սիթեզի համար. քացախաթթվի անհիդրիդի, կետենի, դիացետոնային սպիրտի, մեզիտիլի օքսիդի, մեթիլիզոբութիլկետոն, մեթիլմետակրիլատ, դիֆենիլպրոպոն և այլն։ Օրինակ՝
Վերջինի լայն կիրառություն ունի պոլիկարբոնատների, պոլիուրիտանների և էպօքսիդային խեժերի սինթեզում։ Հանդիսանում է նաև բևեռային լուծիչ, զգալիորեն տարբերվում է անվտանգության տեսանկյունից՝ բենզինից, սկիպիդարից և կերոսինից։ Մասնավորապես օգտագործվում է։
- լաքերի արտադրությունում
- պայթուցիկ նյութերի արտադրությունում
- դեանյութերի սինթեզ
- սոսինձներում որպես լուծիչ
- տարբեր արտադրական պրոցեսներում, որպես լվացող միջոց
- գործիքների լվացնելու միջոց
Առանց ացետոնի հնարավոր չէ պատկերացնել, ացետիլենի տեղափողությունը անհնար է պատկերացնել, հայտնի է, որ մաքուր ացետիլենը պայթյունավտանգ է։ Դրա համար էլ օգտագործվում է, պարզ տարաներ մեջը լցված ացետոն։ 1 լիտր ացետոնում լուծվում է մինչև 250 լիտր ացետիլեն։ Օգտագործվում է նաև բազմաթիվ բուսական միջոցների էքստրակցիայի համար։
Լաբորատոր կիրառումը
Օրգանական քիմիայում կիրառվում է, որպես ապրոտոն պոլյար լուծիչ ալկիլացման ռեակցիաների համար։
Ալյումինի ալկոհոլատի ներկայությամբ սպիրտների օքսիդցման համար
Օգտագործվում է սառցե բաղնիքների պատրաստման համար ՛՛չոր սառույցի՛՛ և հեղուկ ամոնյակի հետ միախառնելիս (մինչև −78 °C)։ Լաբորատորիայում օգտագործում են ամանները լվանալու, շուտ չորացնելու համար շնորհիվ ցածր գնի, քիչ տոկսիկության և հեշտ ցնդելու հետևանքով։ Լաբորատոր պայմաններում մաքրելու համար ացետոնը թորում են նոսր կալիումի պերմանգանատի լուծույթի ներկայությամբ։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 acetone
- ↑ 2,0 2,1 http://hbcponline.com/faces/contents/InteractiveTable.xhtml
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 4,0 4,1 4,2 4,3 ACETONE
- ↑ 5,0 5,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng0087.html
- ↑ Chiang Y., Kresge A. J., Tang Y. S., Wirz J. The pKa and keto-enol equilibrium constant of acetone in aqueous solution // J. Am. Chem. Soc. / P. J. Stang — ACS, 1984. — Vol. 106, Iss. 2. — P. 460—462. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA00314A055
- ↑ Химическая энциклопедия. — М: Советская энциклопедия, 1988. — Т. 1. — С. 230. — 625 с.
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник: Справ. изд. / Под ред. Потехина А. А., Ефимова А. И.. — Издание 3-е, переработанное и дополненное. — Л.:: Химия, 1991. — С. 328-329. — 432 с. — ISBN 5-7245-0703-X.
- ↑ Lewis R.J. Sax's Dangerous Properties of Industrial Materials. — 11ed.. — Wiley-interscience, 2004. — С. 22-23
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ացետոն» հոդվածին։ |
| ||||||||||||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 2, էջ 159)։ |














