Պարարտ բջիջ
| Պարարտ բջիջ | |
|---|---|
 | |
| Տեսակ | բջջի տեսակ |
| Ենթադաս | differentiated hemal cell?[1] |
| MeSH | A11.329.427 և A15.382.652 |
| Foundational Model of Anatomy | 66784 |
| Terminologia Histologica | H2.00.03.0.01010 |
Պարարտ բջիջ (ինչպես նաև մաստոցիտ կամ լաբրոցիտ[2]), շարակցական հյուսվածքի հիմնական բջիջ, որը պարունակում է հիստանմինով և հեպարինով հատիկներ։ Այն գրանուլոցիտ է, որն առաջանում է արյունաստեղծման միելոիդ ծլից և հանդիսանում է ինչպես իմուն, այդպես էլ նեյրոիմուն համակարգերի բաղադրիչ։ Պարարտ բջիջները հայտնաբերվել են Պոլ Էրլիխի կողմից 1877 թվականին[3]։ Չնայած պարարտ բջիջները հայտնի են որպես ալերգիայի և անաֆիլաքսիայի միջնորդ, այս բջիջներն ունեն նաև կարևոր պաշտպանիչ գործառույթ՝ մասնակցելով վերքերի լավացմանը, անգիոգենեզին, իմուն պաշտպանությանը, պաթոգենների դեմ պաշտպանությանը, ինչպես նաև ուռուցքների անոթավորման խթանման մեջ[3][4]։
Պարարտ բջիջները շատ նման են բազոֆիլներին թե՛ իրենց տեսքով, թե՛ իրենց գործառույթով։ Բազոֆիլները լեյկոցիտների տարատեսակ են։ Ժամանակին կար կարծիք, որ պարարտ բջիջներնը նույն բազոֆիլներն են՝ տեղակայված որևէ հյուսվածքում, սակայն դա այդպես չէ։ Բազոֆիլները և պարարտ բջիջները առաջանում են տարբեր հեմոպոետիկ ծլերից, ինչի պատճառով էլ դրանք նույնը չեն կարող լինել[5]։
Կառուցվածք
[խմբագրել | խմբագրել կոդը]

Պարարտ բջիջները շատ նման են բազոֆիլ գրանուլոցիտների (լեյկոցիտի ենթատեսակ)։ Երկուսն էլ հատիկավոր բջիջներ են, որոնք պարունակում են հիստամին և հեպարին՝ հակամակարդիչ։ Կորիզային տարբերությունները կայանում են նրանում, որ բազոֆիլների կորիզը մասնատված է, իսկ պարարտ բջիջներինը՝ կլոր։ Իմունոգլոբուլին E(IgE) -ի Fc ֆրագմենտը կապվում է ինչպես բազոֆիլներին, այդես էլ պարարտ բջիջներին, և երբ E(IgE)-ն կապվում է անտիգենի հետ, հիստամինը և այլ բորբոքային միջնորդները այդ բջիջներից ձերբազատվում են[6]։ Այս նմանությունները պատճառ էին հանդիսացել սխալ ենթադրության, որ պարարտ բջիջները հյուսվածքներում «տեղակայված» բազոֆիլներն են։ Բացի դրանից, նրանք երկուսն էլ ունեն նույն անտիգենը՝ CD34[7]:
Բազոֆիլները հեռանում են ոսկրածուծից արդեն իսկ հասուն վիճակում, իսկ պարարտ բջիջները՝ տհաս վիճակում, և հասունանում են արդեն իսկ հյուսվածքներում։ Տեղը, որտեղ հանգրվանում է պարարտ բջիջը, հավանաբար, որոշում է իր հետագա առանձնահատկությունները[7]։
Կրծողերի մոտ պարարտ բջիջները բաժանված են երկու տեսակների՝ շարակցահյուսվածքային տիպի պարարտ բջիջներ և լորձային տիպի պարարտ բջիջներ։ Վերջիններիս ակտիվությունը պայմանավորված է T-լիմֆոցիտներով[8]։
Պարարտ բջիջները տեղակայված են գրեթե բոլոր հյուսվածքներում, առավելապես՝ անոթների, նյարդերի և ավշային անոթների հարևանությամբ[9]։ Ինչպես նաև նրանք հիմնականում տեղակայված են այն մասերում, որոնք պատնեշ են հանդիսանում արտաքին և ներքին միջավայրերի միջև, օրինակ՝ մաշկը, կոկորդի լորձաթաղանթը, մարսողական ուղիները, կոնյունկտիվան և քիթը[7]։
Գործառույթներ
[խմբագրել | խմբագրել կոդը]
Պարարտ բջիջները կարևոր դեր են խաղում բորբոքման մեջ։ Ակտիվանալաով պարարտ բջիջները կարող են ընտրողաբար դեգրանուլացվել (հատվածային դեգրանուլյացիա) կամ դեգրանուլացվել կտրուկ և ամբողջությամբ (անաֆիլակտիկ դեգրանուլյացիա)։ Դեգրանուլյացիայի արդյունքում «միջնորդանյութերը» ներքին պահեստներից դուրս են գալիս արտաքին միկրոմիջավայր[3][10]։ Պարարտ բջիջները կարող են դեգրանուլացվել իմուն մեխանիզմով, արտաքին ֆիզիկական ներգործությամբ՝ DAMPs ընկալիչների միջոցով, մանրէային պաթոգենների՝ PAMPs ընկալիչներով, ինչպես նաև տարատեսակ միացություններով, որոնք կապվում են G- կախյալ սպիակուցների հետ (օր՝ մորֆինը՝ օպիումային ընկալիչներով) կամ իոնային անցուղիների հետ[3][10]։ Կոմպլեմենտի սպիտակուցները նույնպես կարող են ակտիվացնել պարարտ բջիջները[7]։
Պարարտ բջիջների միջնորդանյութեր
[խմբագրել | խմբագրել կոդը]Յուրահատուկ ազդակներից պարարտ բջիջների գրանուլները ձերբազատում են։ Իրենք ներառում են հետևյալ միացությունները[7][10][11]։
- Սերինային պրոտեազներ, ինչպիսին են տրիպտազը և քիմազը
- Հիստամին (2-5պիկոգրամ յուրաքանչյուրում)
- Սերոտոնին
- Պրոտեոգլիկաններ, առավելապես՝ հեպարին( որպես հակամակարդիչ) և խոնդրիոտիդին սուլֆատ պրոտեոգլիկաններ։
- Ադենոզին եռֆոսֆատ (ԱԵՖ)
- Լիզոսոմալ էնզիմներ
- β-հեքսիզամինիդազ
- β-գլյուկուրոնիդազ
- Արիլսուլֆատազներ
- տեղում սինթեզվող լիպիդային մեդիատորներ (էյկոզանոիդներ)։
- Թրոմբոքսան
- Պրոսդատլանդին D2
- Լեյկոտրիեն C4
- Թրոմբոցիտների ակտիվացման գործոն
- ցիտոկիններ
- ՈւՆԳ-α
- Հասարակ ֆիբրոբլաստների աճի գործոն
- Ինտերլեյկին-4
- Ցողունային բջիջների գործոն
- Քեմոկիններ, ինչպիսին են՝ էոզինոֆիլ քեմոտատկիկ գործոնը
- Թթվածնի ագրեսիվ ձևեր
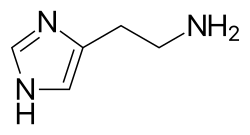
Հիստամինը լայնացնում է հետմազանոթային երակները, ակտիվացնում է էնդոթելիումը և մեծացնում արյունատար անոթների թափանցելիությունը։ Սա հանգեցնում է տեղային էդեմայի (այտուցի), ջերմության բարձրացմանը, կարմրությանը և բորբոքային բջիջների ներգրավվմանը դեպի այդ տարածք։ Այն նաև ապաբևեռացնում է նյարդային վերջավորությունները (առաջացնելով քոր կամ ցավ)։ Հիստամինի արտազատման մաշկային նշաններն են «բոցավառման և բշտիկի» ռեակցիան։ Մոծակի խայթոցից անմիջապես հետո առաջացած բշտիկն ու կարմրությունը այս ռեակցիայի լավ օրինակն են, որը տեղի է ունենում ալերգենով պարարտ բջիջը թիրախավորման ժամանակ[7]։
Պարարտ բջիջների այլ ֆիզիոլոգիական գործառույթները շատ ավելի քիչ են ուսումնասիրվել։ Դրանք ի վիճակի են արտադրել կարևոր ցիտոկինների և այլ բորբոքային միջնորդների լայն տեսականի, ինչպիսիք են TNF-α։ Դրանք ունեն բազում «պատկերների թարգմանման ընկալիչներ», որոնք մասնակցում են լայն ոլորտի անտիգեններ ճանաչելու համար։
Պարարտ բջիջները կրում են բազում քանակության կենսաակտիվ քիմիկատներ։ Իրենց հատիկները կարող են տրանսգրանուլյացիայի ժամանակ ներթափանցել նյարդեր՝ պարարտ բջիջների պսևդոպոդիաների միջոցով[12]։
Նյարդային համակարգում
[խմբագրել | խմբագրել կոդը]Ի տարբերություն իմունային համակարգի այլ արյունաստեղծ բջիջների՝ պարարտ բջիջները նաև հանդիպում են մարդու ուղեղում, որտեղ նրանք փոխազդում են նեյրոիմունային համակարգի հետ։ Ուղեղի մեջ պարարտ բջիջները տեղակայված են մի շարք կառույցներում, որոնք միջնորդում են ներքին օրգանների զգայական (օրինակ ՝ ցավ) կամ նեյրոէնդոկրին գործառույթները։ Որոշները տեղակայված են արյուն–ուղեղային պատնեշի երկայնքով, ինչպես նաև գտվում են են հիպոֆիզի ցողունում, էպիֆիզում, կարծր ուղեղաթաղանքում՝ մենինգիեալ նոցիցեպտորների մոտ։ Պարարտ բջիջները մարմնում և կենտրոնական նյարդային համակարգում կատարում են նույն գործառույթները, ինչպիսիք են՝ ալերգիկ ռեակցիաների առաջացումը կամ կարգավորումը, բնածին և հարմարվողական իմունիտետը, աուտոիմունիտետը և բորբոքումները։
Աղիներում
[խմբագրել | խմբագրել կոդը]Աղեստամոքսային համակարգում պարարտ բջիջները տեղակայված են լորձաթաղանթում՝ անմիջապես զգայական նյարթաթելերի հարևանությամբ[13][14][15]։ Երբ պարարտ բջիջներն ապահատիկավորվում են, իրենք ձեռբազատում են միջնորդանյութեր, որոնք ակտիվացնում, սենսիբիլիզացնում և ուժեղացնում են նոցիցեպտորների էքսպրեսսիան (TRPV1): Վիսցերալ աֆֆերենտ նեյրոնների վրա, թիրախավորելով ընկալիչները (HRH1, HRH2, HRH3, PAR2, 5-HT3),իրենք կարող են առաջացնել նեյրոգեն բորբոքում։ Այս ամենի պատճառով առաջանում է վիսցերալ գերզգայունություն և աղիների մոտորիկայի խանգարում (խանգարված գալարակծկումներ)[10][15]։
Ֆիզիոլոգիա
[խմբագրել | խմբագրել կոդը]
Մեծ աֆինություն ունեղող IgE-ш ընկալչի կառուցվածքը, FcεR1
[խմբագրել | խմբագրել կոդը]FceR1-ը բարձրաֆինային IgE ընկալիչ է, որը գտվում է պարատ բջիջների մակերեսին։ FceR1-ը տետրամեր է, որը բաղկացած է մեկ ալֆա (α) շղթայից, մեկ բետա (β) շղթայից և երկու նույնական դիսուլֆիդային գամմա (γ) շղթաներից։ IgE-ի համար միացման կայքը ձևավորվում է α շղթայի արտաբջջային հատվածում, որը պարունակում է Ig-ին համանման երկու տիրույթ։ Մեկ տրանսմեմբրանային տիրույթը պարունակում է ասպարտաթթվի մնացորդ, իսկ մյուսը ՝ կարճ ցիտոպլազմային պոչ[16]։ Ցիտոպլազմատիկ հատվածում β-շղթան պարունակում է մեկ իմունորեցեպտոր՝ թիրոզինայինակտիվացմամբ մոտիվ՝ ITAM։ Յուրաքանչյուր γ շղթա ցիտոպլազմային շրջանում ունի մեկ ITAM: Ընկալիչից ազդանշանային կասկադը սկսվում է այն ժամանակ, երբ β և γ-շղթաների ITAMs-ի թիրոզինային հատվածները ֆոսֆորիլացվում են։ Այս ազդանշանը անհրաժեշտ է պարարտ բջիջների ակտիվացման համար։ 2-րդ տիպի օգնական T բջիջները (Th2) և բջիջների շատ այլ տեսակներ զուրկ են β շղթայից, ուստի ազդանշանների փոխանցումը միջնորդվում է միայն γ շղթայով[16]։
Գերզգայունության ռեակցիա
[խմբագրել | խմբագրել կոդը]Ալերգեններով միջնորդված FcεR1 խաչաձև ազդանշանումը շատ նման է նմանատիպ ազդանշանմանը լիմֆոցիտներում։ Lyn-թիրոզին կինազը կապված է FcεR1-ի β շղթայի ցիտոպլազմատիկ հատվածի հետ․ Անտիգենները, կապվելով FcεR1 մոլեկուլների հետ խթանում է, որ Lyn-թիրոզին կինազը ֆիսֆորիլացնի ցիտոպլազմայում գտնվող FcεR1 β շղթան։ Ֆոսֆորիլացումից հետո Syk-թիրոզին կինազը ը միանում է γ շղթաների վրա տեղակայված ITAMs-ին։ Սա առաջացնում է Syk-թիրոզին կինազի ակտիվացում ՝ ֆոսֆորիլացնելով իրեն։ Syk-ը գործում է որպես ազդանշան, որը մեծացնում է կինազի ակտիվությունը ՝ շնորհիվ այն բանի, որ այն թիրախավորում է բազմաթիվ սպիտակուցներ և ակտիվացնում իրենց։ Այս անտիգենի կողմից խթանված ֆոսֆորիլացումը առաջացնում է այլ սպիտակուցների ակտիվացում FcεR1-ի միջնորդությամբ ազդանշանային կասկադի խթանմամբ[17]։
Դեգրանուլյացիա և միաձուլում
[խմբագրել | խմբագրել կոդը]Syk-ի ֆոսֆորիլացման փուլում ակտիվացված կարևոր ադապտերային սպիտակուցը՝ T բջիջների ակտիվացման հղիչն է (LAT): LAT-ը կարող է փոփոխվել ֆոսֆորիլացման միջոցով՝ նոր կապման կայքեր ստեղծելու համար։ Գամմա ֆոսֆոլիպազ C-ն (PLCy) ֆոսֆորիլացվում է LAT-ին կապվելուց հետո, այնուհետև օգտագործվում է ֆոսֆատիդիլինոզիտոլբիսֆոսֆատի քայքայումը կատալիզացնելու համար՝ առաջացնելով ինոզիտոլտրիսֆոսֆատ (IP3) և դիացիգլիցերոլ (DAG): IP3-ը բարձրացնում է կալցիումի մակարդակը, իսկ DAG-ն ակտիվացնում է պրոտեին կինազ C (PKC): Դա PKC-ի առաջացման միակ միջոցը չէ։ Թիրոզին կինազ FYN-ը ֆոսֆորիլացնում է Grb2 կապված կապող սպիտակուց 2 (Gab2), որը կապվում է PKC ակտիվացնող ֆոսֆոինոզիտիդ-3-կինազի հետ։ PKC-ն հանգեցնում է միոզինի թեթև շղթայի ֆոսֆորիլացման հատիկների շարժուման ակտիվացմանը, ինչը հանգեցնում է ակտին-միոզինի կամպլեքսների քայքայմանը՝ թույլ տալով, որ հատիկները շփվեն պլազմային թաղանթի հետ։ Պարարտ բջիջների հատիկներն այդքանից կարող են միաձուլվել պլազմատիկ թաղանթի հետ։ Rab3 գուանոզին տրիֆոսֆատազները և Rab-կ կինազները և ֆիսֆատազները կարգավորում են հատիկների և թաղանթների միաձուլումը հանգիստ պարարտ բջիջներում։
Պարարտ բջջի MRGPRX2 ընկալիչ
[խմբագրել | խմբագրել կոդը]Մարդկանց պարարտ բջիջները պարունակում են G-սպիտակոից կախյալ MRGPRX2 ընկալիչ, որը ունի մեծ նշանակություն պաթոգեն-կախյալ մոլեկուլային պատկերների (PAMPs) ճանաչման մեջ, ինչպես նաև հակաբակտերիալ ազդեցության խթանման գործում։ MRGPRX2-ը ունակ է կապվել կոմպետնտությունը խթանող պեպտիդի հետ (CSP), քվորում զգայուն մոլեկուլի հետ (QSM)․ որոնք սինթեզվում են գրամ-գրական բակտերիաների կողմից[18]։ Դա բերում է G-սպիտակուղ կախյալ եղանակով պարարտ բջիջների ակտիվացմանը։ Ինչի արդյունքում արտաքին միջավայր է դուրսբերվում հակամանրէային միջնորդներ (ԹԱՁ,ՈՒՆԳ-α, ԹԱԳ), ինչի արդյունքում խթանցում են այլ իմուն բջիջները և բերում բակտերիաների ընկճմանը կամ մահվանը։ Բացի դրանից այդ ընկալիչները կարող են խթանվել նույնիսկ գրամ-բացասական մանրէների ազդանշաններով։ Դրա ակնհայտ օրինակ է բարտոնելլա հիվանդությունը, որի ժամանակ մարդկանց մոտ նկատվում է տիպիկ ախտաբանություն, որը նկատվում է պարարտ բջիջների ակտիվացման համախտանիշի ժամանակ։ Դա առաջանում է քվորում զգայուն մոլեկուլի անհայտ մոլեկուլի միջոցով (գուցե հենց բազալ հիստամինի՞)։
Դեղաբանական միջոցով հնարավոր է թիրախավորել MRGPRX2-ընկալիչը, դա իրականացվում է 48/80 բակտերիալ բաղադրիչի ագոնիստների օգագործմամբ[19]։ Այս հիվանդները հակված են սննդի անհանդուրժողականության, որը պայմանավորված է այլ, IgE-անկախ ալերգանման ռեակցիայի առաջացման պատճառով, որն առաջանում է MRGPRX2- ընկալիչների դրդման պատճառով։ Այս հիվանդների մոտ կա նաև մաշկի ցիկլային պաթոլոգիա և դերմոգրաֆիզմ, որոնք առաջանում են ամեն անգամ, երբ բակտերիան դուրս է գալիս ներբջջային տարածությունից՝ արտաբջջային։
Էնզիմներ
[խմբագրել | խմբագրել կոդը]| Enzyme | Function |
|---|---|
| Lyn-թիրոզին կինազ | Ֆոսֆորւլացնում ցիտոպլազմի FcεR1 β և γ շղթաների ITAMS-էրը։ Ինչի արդյունքում ֆոսֆորիլացնելով ակտիվանում է Syk թիրոզին կինազը |
| Syk-թիրոզին կինազ | Թիրախավորում է տարբեր սպիտակուցներ և ակտիվացնում իրենց |
| Ֆոսֆոլիպազ C | Կատալիզում է ֆոսֆատիֆիլինոզիտոլ 4,5-երկֆոսֆատը |
| Ինոզիտոլ եռֆոսֆատ | Բարզրացնում է կալցիումի մակարդակը |
| Դիացիլգլիցեռոլ | Ակտիվացնում է պրոտեինկինազ C |
| FYN | Ֆոսֆորիլացնում է GAB2 |
| GAB2 | Կապվում է ֆոսֆոինոզիտիդ-3-կինազի հետ |
| Ֆոսֆոինիզիտիդ-3-կինազ | Ակտիվացնում է պրոտեինկինազ C |
| Պրոտեին կինազ C | Ակտիվացնում է միոզինային թեթև շղթաների գրանուլների շարժումը, ինչի արդյունքում քանդվում է ակտին-միոզինային կոմպլեքսը |
| Rab-կախյալ կինազներ և ֆոսֆոլիպազներ | Կարգավորում է գրանուլների և մեմբրանների միաձուլումը հանգիստ պարարտ բջիջներում |
Կլինիկական կարևորությունը
[խմբագրել | խմբագրել կոդը]Մակաբուծային վարակներ
[խմբագրել | խմբագրել կոդը]Պարարտ բջիջներն ակտիվանում են ախտաբանական մակաբույծների կողմից, որոնցից են՝ հելմինթները և պրոտոզոաները։ Ակտիվացումը IgE- խթանված է։
Պարարտ բջիջների ակտիվացման հիվանդություններ
[խմբագրել | խմբագրել կոդը]Պարարտ բջիջների ակտիվաղման հիվանդություններ (MCAD) իմուն հիվանդությունների խումբ, որոնք կաված չեն ախտաբանական վարակների հետ, սակայն ներառում են նույն ախտանիշները Պարարտ բջիջների դեգրանուլյացիայի պատճառով։ Սակայ տարբերվում են իրենք ախտաֆիզիոլոգիայով, բուժման եղանակով և յուրահատուկ ախտանիշներով[20][21]։ Այս հիվանդությունների դասակարգումը սահմանվել է 2010թ․ին[20][21]։
Գերզգայունության հիվանդություն
[խմբագրել | խմբագրել կոդը]Ալերգենները կապվում են IgE-ի հետ, ինչը խթանում է պարարտ բջիջների ապահատիկավորումը[20]։ Չնայած հնարավոր է IgE անկախ ապահատիկավորում ՝«ալերգանման»։ Դա իրագորվոծվում է պարարտ բջիջների MRGPRX2 - կողմից ( մկանաապալարիչներով, օպիոիդներով, իկատիբանտներով և ֆլուրոքվինոլոններով)[22]։
Մաշկի և լորձաթաղանթների գերզգայունության ռեակցիաների մեծ մասը խթաված են պարարտ բջիջներով։ Իրենք կենտրոնական դեր ունեն ասթմայի, էկզեմայի, ալերգիկ ռինիտների, ալերգիկ շաղքապենաբորբերի և քոսի զարգացման մեջ։ Հակահիստամինային դեղերով բուժման ժամանակ արգելակվում է հիստամինի ազդեցությունը նյարդային վերջավորությունների վա։ Կրոմոգլիկատների հիմքով դեղերը (նատրիումի կրոմոգլիկատ, նեդոկրոմիլ) պաշարում են կալցիումական անցուղիները, որոնք անհրաժեշտ են պապարտ բջիջների ապահատիկավորման համար։ Ինչի արդյունքում կայունացնում են իրենց և կանխում հիստամինի ձերբազատումը։ Լեյկոտրիենների անտագոնիստները (մոնտելուկաստ, զաֆիրլուկաստ) պաշաչում են լեյկոտրիենների ազդեցությունը և գնալով ավելի հաճախ են օգևտագորվծում գերզգայունության ռեակցնաիների բուժման ժամանակ[7]։
Նատրիումի ֆտորիդի ազդեցության ներքո, կալցիում կախյալ մեծանիզմով տեղի է ունենում պարարտ բջիջներից հիստամինի ձերբազառում։ Արտազառման գորշնթացը կարելի է բաժանել երկու քայլի՝ ֆտորիդային ակտիվացում և կալցիում կախյալ արտազատում։ ֆտորիդային ակտիվացման փուլը ւրագորվում է ցիկլիկ ադենոզին մոնոֆոսֆատ (ցԱՄՊ)-ով միջնորդված։ Նկատվել է, որ կատեխոլամինների ազդեցությունը չի ազդում է ֆտորիդային հիստամինային ձերբազատուման վրա։ Բացի դրանից բացահայտվել է, որ հիստամինի ձերբազատման երկրորդ փուլը հնարավոր է ընկճել թեոֆիլինով[23]։ Անոթալայնացումը պայմանավորված է ինչպես H1 այնպես էլ H2 ընկալիչների խթամամբ[24]։ Հիստամինի ձերբազատումը խթանում է հիստամին (H2) զգայուն ադելիատ ցիկլազ կախյալ պարիետալ բջիջները, ինչի արդյունքում մեծանում է ներբջջային ցԱՄՊ-ի մակարդակը և ակտիվանում է H+ իոնների տրանսպորտը[25]։
Անաֆիլաքսիա
[խմբագրել | խմբագրել կոդը]Անաֆիլաքսիան ( ուժեղ համակարգային ռեակցիա որոշակի ալերգենների հանդեպ, օր՝ ընդեղեն, մեղվի խայթ, դեղեր) ընդհանուր օրգանիզմով գնացող դեգրանուլյացիայի ռեակցիա է, որը առաջացնում է անոթալայնացում և, եթե այն սուր է, կարող է առաջացնել կյանքին սպառնացող շոկ։ Արտազատվող գլխավոր անոթալայնիչը հիստամինն է[24]։
Աուտոիմուն ռեակցիաներ
[խմբագրել | խմբագրել կոդը]Պարարտ բջիջները կարող են մասնակցել աուտոիմուն բորբոքային հոդերն ախտահարող հիվանոդությունների զարգացմանը։ Իրենք մասնակցում են ջլերում բորբոքային բջիջների ներգրավմանը (օր՝ռևմատոիդ արթրիտ), կուտակումը կարող է լինել նաև մաշկում (օր՝ բուլյոզ պեմֆիգոիդ)։ Պարարտ բջիջների գործունեությունը կախված է հակամարմիններից և կոմպլեմենտի բաղադրիչներից[26]։
Մաստոցիտոզ և կլոնալ հիվանդություններ
[խմբագրել | խմբագրել կոդը]Մաստոցիտոզը հազվադեպ կլոնալ գիվանդություն է, որի ժամանակ նկատվում է չափից ավել պարարտ բջիջների ավելացում, ինչպես նաև այլ CD34+ պարարդ բջիջբերի նախորդների ավելացում[27]։ Մուտացիան կապված է c-Kit-ի հետ[20]։
Նեոպլաստիկ հիվանդություններ
[խմբագրել | խմբագրել կոդը]Մաստոցիտոմաները, կամ նույն պարարտ բջիջների ուռուցքները սինթեզում և ձերբազատում են չափից շատ քանակության գրանուլներ[20][21]։ Իրենք ավելի հաճախ հանդիպում են շների և կատուների մոտ[28]։ Այլ նեոպլաստիկ հիվանդությունները, որոնք կապված են օարարտ բջիջների հետ, ներառում են՝ պարարտբջջային սառկոման և պարարտբջջային լեյկեմիան։
Պարարտ բջիջների ակտիվացման համախտանիշ
[խմբագրել | խմբագրել կոդը]Պարարտ բջիջների ակտիվացման համախտանիշը իդիոպաթիկ իմուն հիվանդություն է, որի ժամանակ նկատվում է չափից ավել արտահակտված դեգրանուլյացիա։ Ախտանիշներով նման է այն հիվանդությունների, որոնց ժամանակ նույնպես դեգրանուլյացիա է խթանվում[20][21]։ Ախտորոշումն իրականացվում է դիտարկելով բուժման հանդեպ զգայունթյունը․ապտանիշները, տարբերակիչ ախտորոշումը և բիոմարկերների հայտնաբերումը, որոնք առաջանում են դեգրանուլյացիայի ժամանակ[20][21]։
Պատմություն
[խմբագրել | խմբագրել կոդը]Կայմ բջիջները առաջին անգամ նկարագրվել են Փոլ Էրլիխի կողմից 1878 թվականին իր դոկտորական թեզի մեջ՝ հիմնվելով դրանց յուրահատուկ ներկման բնութագրերի և խոշոր հատիկների վրա։ Այս հատիկները նաև նրան հանգեցրին այն սխալ համոզմունքին, որ դրանք գոյություն ունեն շրջապատող հյուսվածքը սնուցելու համար, ուստի նա նրանց անվանեց Mastzellen: Նրանք այժմ համարվում են իմունային համակարգի մաս։
Հետազոտություններ
[խմբագրել | խմբագրել կոդը]Աուտիզմ
[խմբագրել | խմբագրել կոդը]Որոշ հետազոտություններ առաջարկում են տեսակետ, որտեղ աուտիստիկ սպեկտրի հիվանդություն (ԱՍՀ) ունեցող երեխաների մոտ առկա են ալեգանման խնդիրներ, որոնք արտահայտվում են առանց արյան շիճուկում IgE-ի ավելացման, ինչպես նաև քրոնիկ եղնջաղան։ Դա պայմանավորված է պարարտ բջիջների ոչ ալերգիկ ակտվացումով, որը կարող է լինել արտաքին միջավայրի խթանների ազդեցության ներքո։ Այս պարարտ բջիջների ակտիվացումը կարող է ուղեղում առաջացնել բորբոքում ինչպես նաև նյարդային համակարգի զարգացման խնդիրներ[29]։
Հյուսվածաբանական ներկում
[խմբագրել | խմբագրել կոդը]Տոլուիդին կապույտ՝ ամենահիմնական ներկերից մեկն է, որը ներկում է թթու մուկոպոլիսախարիդները ինչպես նաև գլիկոզամինոգլիկանները։ Այդ բաղադրիչները պարարտ բջիջների հատիկների մաս են[30]։
Բիսմարկ շականակագույն՝ ներկում է պարարտ բջիջների հատիկները շականակագույն[31]։
Մակերեսային մառկերներ․ պարարտ բջիջների մակերեսային մառկերները քննարվել են Հենեբերգի կողմից[32], որն ասում էր, որ պարարտ բջիջների որոշ մաշը կարող է դասվել ցողունային բջիջների՝ քանի որ իրենք կրում են CD34 հակածինը։ Դասական պարարտ բջիջը ունի բարձր խնամակցությամբ IgE, CD117 (c-Kit), CD203c (պարարտ բջիջների հիմնական պոպլույացիայի համար) ընկալիչներ։ Մոլեկուլների ակտիվացման ընթացքում իրենց սինթոզվող միացությունները կարող են փոխվել[33]։
Այլ օրգանիզմներ
[խմբագրել | խմբագրել կոդը]Պարարտ բջիջները և էնտերոքրոմաֆինային բջիջները կրծողների ստամոքսում սերոտոնինի հիմնական աղբյուրն են[34]։
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ անատոմիայի հիմնարար մոդել
- ↑ «labrocytes». Memidex. Արխիվացված է օրիգինալից 2018 թ․ նոյեմբերի 6-ին. Վերցված է 2011 թ․ փետրվարի 19-ին.
- ↑ 3,0 3,1 3,2 3,3 da Silva EZ, Jamur MC, Oliver C (2014). «Mast cell function: a new vision of an old cell». J. Histochem. Cytochem. 62 (10): 698–738. doi:10.1369/0022155414545334. PMC 4230976. PMID 25062998. «Mast cells can recognize pathogens through different mechanisms including direct binding of pathogens or their components to PAMP receptors on the mast cell surface, binding of antibody or complement-coated bacteria to complement or immunoglobulin receptors, or recognition of endogenous peptides produced by infected or injured cells (Hofmann and Abraham 2009). The pattern of expression of these receptors varies considerably among different mast cell subtypes. TLRs (1–7 and 9), NLRs, RLRs, and receptors for complement are accountable for most mast cell innate responses»
- ↑ Polyzoidis S, Koletsa T, Panagiotidou S, Ashkan K, Theoharides TC (2015). «Mast cells in meningiomas and brain inflammation». J Neuroinflammation. 12 (1): 170. doi:10.1186/s12974-015-0388-3. PMC 4573939. PMID 26377554. «MCs originate from a bone marrow progenitor and subsequently develop different phenotype characteristics locally in tissues. Their range of functions is wide and includes participation in allergic reactions, innate and adaptive immunity, inflammation, and autoimmunity [34]. In the human brain, MCs can be located in various areas, such as the pituitary stalk, the pineal gland, the area postrema, the choroid plexus, thalamus, hypothalamus, and the median eminence [35]. In the meninges, they are found within the dural layer in association with vessels and terminals of meningeal nociceptors [36]. MCs have a distinct feature compared to other hematopoietic cells in that they reside in the brain [37]. MCs contain numerous granules and secrete an abundance of prestored mediators such as corticotropin-releasing hormone (CRH), neurotensin (NT), substance P (SP), tryptase, chymase, vasoactive intestinal peptide (VIP), vascular endothelial growth factor (VEGF), TNF, prostaglandins, leukotrienes, and varieties of chemokines and cytokines some of which are known to disrupt the integrity of the blood-brain barrier (BBB) [38–40].
[The] key role of MCs in inflammation [34] and in the disruption of the BBB [41–43] suggests areas of importance for novel therapy research. Increasing evidence also indicates that MCs participate in neuroinflammation directly [44–46] and through microglia stimulation [47], contributing to the pathogenesis of such conditions such as headaches, [48] autism [49], and chronic fatigue syndrome [50]. In fact, a recent review indicated that peripheral inflammatory stimuli can cause microglia activation [51], thus possibly involving MCs outside the brain.»{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Franco CB, Chen CC, Drukker M, Weissman IL, Galli SJ (2010). «Distinguishing mast cell and granulocyte differentiation at the single-cell level». Cell Stem Cell. 6 (4): 361–8. doi:10.1016/j.stem.2010.02.013. PMC 2852254. PMID 20362540.
- ↑ Marieb EN, Hoehn K (2004). Human Anatomy and Physiology (6th ed.). San Francisco: Pearson Benjamin Cummings. էջ 805. ISBN 978-0-321-20413-4.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 Prussin C, Metcalfe DD (February 2003). «4. IgE, mast cells, basophils, and eosinophils». The Journal of Allergy and Clinical Immunology. 111 (2 Suppl): S486–94. doi:10.1067/mai.2003.120. PMC 2847274. PMID 12592295.
- ↑ Denburg JA (1998). Allergy and allergic diseases: the new mechanisms and therapeutics. Totowa, NJ: Humana Press. ISBN 978-0-89603-404-4.
- ↑ Pal, Sarit; Gasheva, Olga Y.; Zawieja, David C.; Meininger, Cynthia J.; Gashev, Anatoliy A. (March 2020). «Histamine-mediated autocrine signaling in mesenteric perilymphatic mast cells». American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 318 (3): R590-604. doi:10.1152/ajpregu.00255.2019. PMC 7099465. PMID 31913658.
- ↑ 10,0 10,1 10,2 10,3 Moon TC, Befus AD, Kulka M (2014). «Mast cell mediators: their differential release and the secretory pathways involved». Front Immunol. 5: 569. doi:10.3389/fimmu.2014.00569. PMC 4231949. PMID 25452755. «Two types of degranulation have been described for MC: piecemeal degranulation (PMD) and anaphylactic degranulation (AND) (Figures 1 and 2). Both PMD and AND occur in vivo, ex vivo, and in vitro in MC in human (78–82), mouse (83), and rat (84). PMD is selective release of portions of the granule contents, without granule-to-granule and/or granule-to-plasma membrane fusions. ... In contrast to PMD, AND is the explosive release of granule contents or entire granules to the outside of cells after granule-to-granule and/or granule-to-plasma membrane fusions (Figures 1 and 2). Ultrastructural studies show that AND starts with granule swelling and matrix alteration after appropriate stimulation (e.g., FcεRI-crosslinking).»
Figure 1: Mediator release from mast cells Արխիվացված 29 Ապրիլ 2018 Wayback Machine
Figure 2: Model of genesis of mast cell secretory granules Արխիվացված 29 Ապրիլ 2018 Wayback Machine
Figure 3: Lipid body biogenesis Արխիվացված 29 Ապրիլ 2018 Wayback Machine
Table 2: Stimuli-selective mediator release from mast cells Արխիվացված 29 Ապրիլ 2018 Wayback Machine - ↑ Ashmole I, Bradding P (May 2013). «Ion channels regulating mast cell biology». Clin. Exp. Allergy. 43 (5): 491–502. doi:10.1111/cea.12043. PMID 23600539. S2CID 1127584. «P2X receptors are ligand-gated non-selective cation channels that are activated by extracellular ATP. ... Increased local ATP concentrations are likely to be present around mast cells in inflamed tissues due to its release through cell injury or death and platelet activation [40]. Furthermore, mast cells themselves store ATP within secretory granules, which is released upon activation [41]. There is therefore the potential for significant Ca2+ influx into mast cells through P2X receptors. Members of the P2X family differ in both the ATP concentration they require for activation and the degree to which they desensitise following agonist activation [37, 38]. This opens up the possibility that by expressing a number of different P2X receptors mast cells may be able to tailor their response to ATP in a concentration dependent manner [37].»
- ↑ Wilhelm M, Silver R, Silverman AJ (November 2005). «Central nervous system neurons acquire mast cell products via transgranulation». The European Journal of Neuroscience. 22 (9): 2238–48. doi:10.1111/j.1460-9568.2005.04429.x. PMC 3281766. PMID 16262662.
- ↑ Wouters MM, Vicario M, Santos J (2015). «The role of mast cells in functional GI disorders». Gut. 65 (1): 155–168. doi:10.1136/gutjnl-2015-309151. PMID 26194403. «Functional gastrointestinal disorders (FGIDs) are characterized by chronic complaints arising from disorganized brain-gut interactions leading to dysmotility and hypersensitivity. The two most prevalent FGIDs, affecting up to 16–26% of worldwide population, are functional dyspepsia and irritable bowel syndrome. ... It is well established that mast cell activation can generate epithelial and neuro-muscular dysfunction and promote visceral hypersensitivity and altered motility patterns in FGIDs, postoperative ileus, food allergy and inflammatory bowel disease.
▸ Mast cells play a central pathophysiological role in IBS and possibly in functional dyspepsia, although not well defined.
▸ Increased mast cell activation is a common finding in the mucosa of patients with functional GI disorders. ...
▸ Treatment with mast cell stabilisers offers a reasonably safe and promising option for the management of those patients with IBS non-responding to conventional approaches, though future studies are warranted to evaluate efficacy and indications.» - ↑ Carabotti M, Scirocco A, Maselli MA, Severi C (2015). «The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems». Ann Gastroenterol. 28 (2): 203–209. PMC 4367209. PMID 25830558.
- ↑ 15,0 15,1 Budzyński J, Kłopocka M (2014). «Brain-gut axis in the pathogenesis of Helicobacter pylori infection». World J. Gastroenterol. 20 (18): 5212–25. doi:10.3748/wjg.v20.i18.5212. PMC 4017036. PMID 24833851. «In digestive tissue, H. pylori can alter signaling in the brain-gut axis by mast cells, the main brain-gut axis effector»
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 16,0 16,1 Kinet JP (1999). «The high-affinity IgE receptor (FcεRI): from physiology to pathology». Annual Review of Immunology. 17: 931–72. doi:10.1146/annurev.immunol.17.1.931. PMID 10358778.
- ↑ Li W, Deanin GG, Margolis B, Schlessinger J, Oliver JM (July 1992). «FcεR1-mediated tyrosine phosphorylation of multiple proteins, including phospholipase Cγ1 and the receptor βγ2 complex, in RBL-2H3 rat basophilic leukemia cells». Molecular and Cellular Biology. 12 (7): 3176–82. doi:10.1128/MCB.12.7.3176. PMC 364532. PMID 1535686.
- ↑ Pundir, Priyanka; Liu, Rui; Vasavda, Chirag; Serhan, Nadine; Limjunyawong, Nathachit; Yee, Rebecca; Zhan, Yingzhuan; Dong, Xintong; Wu, Xueqing; Zhang, Ying; Snyder, Solomon H; Gaudenzio, Nicolas; Vidal, Jorge E; Dong, Xinzhong (July 2019). «A Connective Tissue Mast-Cell-Specific ReceptorDetects Bacterial Quorum-Sensing Moleculesand Mediates Antibacterial Immunity». Cell Host & Microbe. 26 (1): 114–122. doi:10.1016/j.chom.2019.06.003. PMC 6649664. PMID 31278040. Վերցված է 2021 թ․ հուլիսի 7-ին.
- ↑ Tatemoto, Kazuhiko; Nozaki, Yuko; Tsuda, Ryoko; Konno, Shinobu; Tomura, Keiko; Furuno, Masahiro; Ogasawara, Hiroyuki; Edamura, Koji; Takagi, Hideo; Iwamura, Hiroyuki; Noguchi, Masato; Naito, Takayuki (2006). «Immunoglobulin E-independent activation of mast cell is mediated by Mrg receptors». Biochemical and Biophysical Research Communications. 349 (4): 1322–1328. doi:10.1016/j.bbrc.2006.08.177. PMID 16979137. Վերցված է 2021 թ․ հուլիսի 7-ին.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 20,6 Frieri M (2018). «Mast Cell Activation Syndrome». Clin Rev Allergy Immunol. 54 (3): 353–365. doi:10.1007/s12016-015-8487-6. PMID 25944644. S2CID 5723622. «Table 1
Classification of diseases associated with mast cell activation from Akin et al. [14]
1. Primary
a. Anaphylaxis with an associated clonal mast cell disorder
b. Monoclonal mast cell activation syndrome (MMAS), see text for explanation
2. Secondary
a. Allergic disorders
b. Mast cell activation associated with chronic inflammatory or neoplastic disorders
c. Physical urticarias (requires a primary stimulation)
d. Chronic autoimmune urticaria
3. Idiopathic (When mast cell degranulation has been documented; may be either primary or secondary. Angioedema may be associated with hereditary or acquired angioedema where it may be mast cell independent and result from kinin generation)
a. Anaphylaxis
b. Angioedema
c. Urticaria
d. Mast cell activation syndrome (MCAS)...
Recurrent idiopathic anaphylaxis presents with allergic signs and symptoms—hives and angioedema which is a distinguishing feature—eliminates identifiable allergic etiologies, considers mastocytosis and carcinoid syndrome, and is treated with H1 and H2 antihistamines, epinephrine, and steroids [21, 22].» - ↑ 21,0 21,1 21,2 21,3 21,4 Akin C, Valent P, Metcalfe DD (2010). «Mast cell activation syndrome: Proposed diagnostic criteria». J. Allergy Clin. Immunol. 126 (6): 1099–104.e4. doi:10.1016/j.jaci.2010.08.035. PMC 3753019. PMID 21035176.
- ↑ Kumar M, Duraisamy K, Chow BK (May 2021). «Unlocking the Non-IgE Mediated Pseudo-Allergic Reaction Puzzle with Mas-Related G-Protein Coupled Receptor Member X2 (MRGPRX2)». Cells. 10 (5): 1033. doi:10.3390/cells10051033. PMC 8146469. PMID 33925682.
- ↑ Alm PE (April 1983). «Sodium fluoride evoked histamine release from mast cells. A study of cyclic AMP levels and effects of catecholamines». Agents and Actions. 13 (2–3): 132–7. doi:10.1007/bf01967316. PMID 6191542. S2CID 6977280.
- ↑ 24,0 24,1 Dachman WD, Bedarida G, Blaschke TF, Hoffman BB (March 1994). «Histamine-induced venodilation in human beings involves both H1 and H2 receptor subtypes». The Journal of Allergy and Clinical Immunology. 93 (3): 606–14. doi:10.1016/S0091-6749(94)70072-9. PMID 8151062.
- ↑ Machen TE, Rutten MJ, Ekblad EB (February 1982). «Histamine, cAMP, and activation of piglet gastric mucosa». The American Journal of Physiology. 242 (2): G79–84. doi:10.1152/ajpgi.1982.242.2.G79. PMID 6175225.
- ↑ Lee DM, Friend DS, Gurish MF, Benoist C, Mathis D, Brenner MB (September 2002). «Mast cells: a cellular link between autoantibodies and inflammatory arthritis». Science. 297 (5587): 1689–92. Bibcode:2002Sci...297.1689L. doi:10.1126/science.1073176. PMID 12215644. S2CID 38504601.
- ↑ Horny HP, Sotlar K, Valent P (2007). «Mastocytosis: state of the art». Pathobiology. 74 (2): 121–32. doi:10.1159/000101711. PMID 17587883.
- ↑ «Cutaneous Mast Cell Tumors». The Merck Veterinary Manual. 2006. Արխիվացված օրիգինալից 2007 թ․ մայիսի 23-ին. Վերցված է 2007 թ․ հուլիսի 8-ին.
- ↑ Theoharides TC, Angelidou A, Alysandratos KD, և այլք: (January 2012). «Mast cell activation and autism». Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1822 (1): 34–41. doi:10.1016/j.bbadis.2010.12.017. PMID 21193035.
- ↑ Blumenkrantz N, Asboe-Hansen G (May 1975). «A selective stain for mast cells». The Histochemical Journal. 7 (3): 277–82. doi:10.1007/BF01003596. PMID 47855. S2CID 32711203.
- ↑ Tomov, N.; Dimitrov, N. (2017). «Modified bismarck brown staining for demonstration of soft tissue mast cells» (PDF). Trakia Journal of Sciences. 15 (3): 195–197. doi:10.15547/tjs.2017.03.001.
- ↑ Heneberg P (November 2011). «Mast cells and basophils: trojan horses of conventional lin- stem/progenitor cell isolates». Current Pharmaceutical Design. 17 (34): 3753–71. doi:10.2174/138161211798357881. PMID 22103846.
- ↑ Lebduska P, Korb J, Tůmová M, Heneberg P, Dráber P (December 2007). «Topography of signaling molecules as detected by electron microscopy on plasma membrane sheets isolated from non-adherent mast cells». Journal of Immunological Methods. 328 (1–2): 139–51. doi:10.1016/j.jim.2007.08.015. PMID 17900607.
- ↑ Fujimiya, Mineko; Inui, Akio (2000). «Peptidergic regulation of gastrointestinal motility in rodents». Peptides. Elsevier BV. 21 (10): 1565–1582. doi:10.1016/s0196-9781(00)00313-2. ISSN 0196-9781. PMID 11068106. S2CID 45185196.
