Մասնակից:Նառա Աբաղյան/Ավազարկղ գենային թերապիա
Գենային թերապիան բժշկական տեխնոլոգիա է, որի նպատակն է արտադրել թերապևտիկ էֆեկտ՝ գենային արտահայտման մանիպուլյացիայի միջոցով կամ կենդանի բջիջների կենսաբանական հատկությունները փոխելու միջոցով[1][2][3]:
Մարդու ԴՆԹ-ի փոփոխման առաջին փորձը կատարվել է 1980 թվականին Մարտին Քլայնի կողմից, սակայն մարդկանց միջուկային գենի առաջին հաջող փոխանցումը, որը հաստատվել է Առողջապահության ազգային ինստիտուտի կողմից, կատարվել է 1989 թվականի մայիսին[4]: Գենի փոխանցման առաջին թերապևտիկ օգտագործումը, ինչպես նաև մարդու ԴՆԹ-ի առաջին ուղղակի ներդրումը միջուկային գենոմում իրականացվել է ֆրանս Անդերսոնի կողմից 1990 թվականի սեպտեմբերին սկսված փորձարկումներում: 1989 թվականից մինչև 2018 թվականի դեկտեմբերն անցկացվել են ավելի քան 2900 կլինիկական փորձարկումներ՝ ավելի քան դրանց կեսը I փուլում[5]: 2003 թվականին Gendicine-ը դարձավ առաջին գենային թերապիան, որը ստացավ կարգավորող հաստատում: Այդ ժամանակվանից ի վեր հաստատվել են գենային թերապիայի հետագա դեղամիջոցներ, ինչպիսիք են՝ Glybera (2012), Strimvelis (2016), Kymriah (2017), Luxturna (2017), Onpattro (2018), Zolgensma (2019), Abecma (2021), Adstiladrin, Roctavian and Hemgenix (բոլորը 2022 թ.): Այս մոտեցումներից շատերն օգտագործում են ադենո ասոցացված վիրուսներ (AAVs) և lentiviruses՝ համապատասխանաբար in vivo և ex vivo գեների ներդրման համար: AAV-ները բնութագրվում են վիրուսային կապսիդի կայունացմամբ, ցածր իմունոգենությամբ, ինչպես բաժանվող, այնպես էլ չբաժանվող բջիջները փոխակերպելու ունակությամբ, տեղանքը հատուկ ինտեգրելու և in-vivo բուժման մեջ երկարաժամկետ արտահայտման հասնելու ներուժով[6]: ASO/siRNA մոտեցումները, ինչպիսիք են Alnylam-ի և Ionis Pharmaceuticals-ի կողմից իրականացված մոտեցումները, պահանջում են ոչ վիրուսային առաքման համակարգեր և օգտագործում են այլընտրանքային մեխանիզմներ լյարդի բջիջներ GalNAc փոխադրողների միջոցով թրաֆիկինգի համար:
Ոչ բոլոր բժշկական ընթացակարգերը, որոնք փոփոխություններ են մտցնում հիվանդի գենետիկական կառուցվածքի մեջ, կարող են համարվել գենային թերապիա: Պարզվել է, որ ոսկրածուծի փոխպատվաստումը և ընդհանրապես օրգանների փոխպատվաստումը հիվանդների մեջ օտար ԴՆԹ են ներմուծում[7]:
Նախապատմություն
[խմբագրել | խմբագրել կոդը]Գենային թերապիան առաջին անգամ հայեցակարգվեց 1960-ականներին, երբ սկսեց ուսումնասիրվել կաթնասունների բջիջներին նոր գենետիկական գործառույթներ ավելացնելու իրագործելիությունը: Դրա համար փորձարկվել են մի քանի մեթոդներ, այդ թվում՝ միկրոպիպետով գեների ներարկումն ուղղակիորեն կենդանի կաթնասունի բջիջի մեջ և բջիջները ենթարկվում ԴՆԹ-ի նստվածքի, որը պարունակում է ցանկալի գեներ: Գիտնականները տեսություն են ներկայացրել, որ վիրուսը կարող է օգտագործվել նաև որպես փոխադրամիջոց կամ վեկտոր՝ նոր գեներ բջիջներ փոխանցելու համար:
Առաջին գիտնականներից մեկը, ով զեկուցել է ֆունկցիոնալ ԴՆԹ-ի հաջող ուղղակի ներգրավման մասին կաթնասունների բջիջում, կենսաքիմիկոս դոկտոր Լորեն Մարկվարտ Քրաուսն էր (6 սեպտեմբերի 1922թ. – 1 հուլիսի 2016թ.)[8]: ԱՄՆ-ի Թենեսի նահանգի Թենեսիի համալսարանում: 1961 թվականին նրան հաջողվել է գենետիկորեն փոխել ոսկրածուծի բջիջների հեմոգլոբինը, որը վերցվել է հիվանդ բջջային անեմիայով հիվանդից: Նա դա արեց՝ ինկուբացնելով հիվանդի բջիջները հյուսվածքային կուլտուրայում ԴՆԹ-ով, որը արդյունահանվել էր նորմալ հեմոգլոբինով դոնորից: 1968 թվականին ԱՄՆ-ի Առողջապահության ազգային ինստիտուտի (NIH) Բեթեսդա նահանգի հետազոտողներ Թեոդոր Ֆրիդմանը, Ջեյ Զիգմիլլերը և Ջոն Սուբակ-Շարփը հաջողությամբ շտկեցին Լեշ-Նիհան համախտանիշի հետ կապված գենետիկական արատները՝ ավելացնելով օտարերկրյա Հիվանդությամբ տառապող հիվանդներից հավաքված մշակված բջիջների ԴՆԹ[9]:
Գենային թերապիայի առաջին, անհաջող փորձը (ինչպես նաև մարդկանց մեջ օտար գեների բժշկական փոխանցման առաջին դեպքը, չհաշված օրգանների փոխպատվաստումը) կատարել է գենետիկ Մարտին Քլայնը Կալիֆոռնիայի համալսարանից, Լոս Անջելես, Կալիֆորնիա, ԱՄՆ: հուլիսի 10-ին, 1980 թ.[10][11]: Քլայնը պնդում էր, որ իր հիվանդների գեներից մեկը վեց ամիս անց ակտիվ է եղել, թեև նա երբեք չի հրապարակել այս տվյալները և չի ստուգել դրանք[12]:
1980-ականների ընթացքում կենդանիների վրա լայնածավալ հետազոտություններից և մարդկանց վրա բակտերիալ գեների պիտակավորման փորձարկումից հետո, առաջին գենային թերապիան, որը լայնորեն ընդունված էր որպես հաջող, ցուցադրվեց 1990 թվականի սեպտեմբերի 14-ին սկսված փորձարկումներում, երբ Ashanthi DeSilva-ն բուժվում էր ADA-SCID-ի համար[13]:
Առաջին սոմատիկ բուժումը, որն առաջացրել է մշտական գենետիկական փոփոխություն, սկսվել է 1993 թվականին[14]: Նպատակն էր բուժել գլխուղեղի չարորակ ուռուցքները՝ օգտագործելով ռեկոմբինանտ ԴՆԹ՝ ուռուցքային բջիջները դեղամիջոցի նկատմամբ զգայուն դարձնելու գենի միջոցով, որն իր հերթին կհանգեցնի ուռուցքային բջիջների մահվան[15]:
Պոլիմերները կա՛մ վերածվում են սպիտակուցների, կա՛մ խանգարում են թիրախային գեների արտահայտմանը, կա՛մ հնարավոր է ուղղում գենետիկ մուտացիաները: Ամենատարածված ձևն օգտագործում է ԴՆԹ, որը կոդավորում է ֆունկցիոնալ, բուժական գենը՝ փոխարինելու մուտացված գենը: Պոլիմերային մոլեկուլը փաթեթավորված է «վեկտորի» մեջ, որը մոլեկուլը տեղափոխում է բջիջների ներսում:Կաղապար:Հարկավոր է բժշկական մեջբերում
Վաղ կլինիկական ձախողումները հանգեցրին գենային թերապիայի հեռացմանը: 2006 թվականից ի վեր կլինիկական հաջողությունները կրկին գրավեցին հետազոտողների ուշադրությունը, թեև 2014 թվականի դրությամբ դա դեռ հիմնականում փորձարարական տեխնիկա էր[16]: Դրանք ներառում են ցանցաթաղանթի հիվանդությունների բուժում Լեբերի բնածին ամաուրոզը[17][18][19][20] և քորոիդեմիա[21], X-կապակցված SCID[22], ADA-SCID[23][24], ադրենոլեյկոդիստրոֆիա[25], քրոնիկ լիմֆոցիտային լեյկոզ(CLL)[26], սուր լիմֆոցիտային լեյկոզ(ALL)[27], բազմակի միելոմա[28], հեմոֆիլիա,[24] և Պարկինսոնի հիվանդություն[29]: 2013 թվականից մինչև 2014 թվականի ապրիլն ընկած ժամանակահատվածում ամերիկյան ընկերությունները ոլորտում ներդրել են ավելի քան 600 միլիոն դոլար[30]:
Առաջին կոմերցիոն գենային թերապիան՝ Gendicine-ը, հաստատվել է Չինաստանում 2003 թվականին՝ որոշ քաղցկեղի բուժման համար[31]: I2011 թվականին Neovasculgen-ը գրանցվել է Ռուսաստանում որպես առաջին դասի գենային թերապիայի դեղամիջոց՝ ծայրամասային զարկերակների հիվանդության, ներառյալ վերջույթների կրիտիկական իշեմիայի բուժման համար[32] 2012 թվականին Glybera-ն՝ հազվագյուտ ժառանգական խանգարման՝ լիպոպրոտեին լիպազի անբավարարության բուժումը, դարձավ առաջին բուժումը, որը հաստատվել է կլինիկական օգտագործման համար Եվրոպայում կամ Միացյալ Նահանգներում՝ Եվրոպական հանձնաժողովի կողմից դրա հաստատումից հետո[16][33]:
Բակտերիաների, բջիջների և փոքր կենդանիների գենետիկական ինժեներիայի վաղ զարգացումներից հետո գիտնականները սկսեցին մտածել, թե ինչպես կիրառել այն բժշկության մեջ: Դիտարկվել է երկու հիմնական մոտեցում՝ թերի գեների փոխարինում կամ խախտում[34]: Գիտնականները կենտրոնացել են միայնակ գենային արատներով առաջացած հիվանդությունների վրա, ինչպիսիք են կիստոզային ֆիբրոզը, հեմոֆիլիան, մկանային դիստրոֆիան, թալասեմիան և մանգաղ բջջային անեմիան: Գլիբերան բուժում է նման հիվանդություններից մեկը, որն առաջացել է լիպոպրոտեին լիպազի թերության պատճառով[33]:
ԴՆԹ-ն պետք է իրականացվի, հասնի վնասված բջիջներին, մտնի բջիջ և կա՛մ արտահայտի, կա՛մ խանգարի սպիտակուցը.[35] Բազմաթիվ առաքման տեխնիկա են ուսումնասիրվել: Սկզբնական մոտեցումը ԴՆԹ-ն ներառում էր մշակված վիրուսի մեջ՝ ԴՆԹ-ն քրոմոսոմ փոխանցելու համար.[36][37] Ուսումնասիրվել են նաև մերկ ԴՆԹ-ի մոտեցումները, հատկապես պատվաստանյութի մշակման համատեքստում:[38]
Ընդհանուր առմամբ, ջանքերը կենտրոնացած են գենի տնօրինման վրա, որն առաջացնում է անհրաժեշտ սպիտակուցի արտահայտում: Բոլորովին վերջերս, նուկլեազի ֆունկցիայի ավելի մեծ ըմբռնումը հանգեցրել է ԴՆԹ-ի ավելի անմիջական խմբագրման՝ օգտագործելով այնպիսի մեթոդներ, ինչպիսիք են ցինկի մատների նուկլեազները և CRISPR-ը: Վեկտորը գեները ներառում է քրոմոսոմների մեջ: Այնուհետև արտահայտված նուկլեազները նոկաուտ են անում և փոխարինում քրոմոսոմի գեներին: 2014 թվականի դրությամբ այս մոտեցումները ներառում են հիվանդներից բջիջների հեռացում, քրոմոսոմի խմբագրում և վերափոխված բջիջները հիվանդներին վերադարձնում[39]:
Գենային խմբագրումը մարդու գենոմը փոխելու պոտենցիալ մոտեցում է գենետիկ հիվանդությունները բուժելու համար[40], վիրուսային հիվանդություններ[41], և քաղցկեղ[42][43]: 2020 թվականի դրությամբ այս մոտեցումներն ուսումնասիրվում են կլինիկական փորձարկումներում[44][45]:
Դասակարգում
[խմբագրել | խմբագրել կոդը]Սահմանման լայնությունը
[խմբագրել | խմբագրել կոդը]1986 թվականին Բժշկության ինստիտուտում կայացած հանդիպման ժամանակ գենային թերապիան սահմանվեց որպես գենի ավելացում կամ փոխարինում թիրախային բջիջների տիպում: Նույն թվականին FDA-ն հայտարարեց, որ իրավասու է հաստատել «գենային թերապիան»՝ առանց տերմինը սահմանելու: FDA-ն 1993 թվականին ավելացրել է ցանկացած բուժման շատ լայն սահմանում, որը «կփոփոխի կամ շահարկի գենետիկական նյութի արտահայտումը կամ կփոխի կենդանի բջիջների կենսաբանական հատկությունները»: 2018 թվականին սա կրճատվեց որպես «արտադրանքներ, որոնք միջնորդում են իրենց ազդեցությունը փոխանցված գենետիկական նյութի տառադարձմամբ կամ թարգմանությամբ կամ հատուկ փոփոխելով ընդունող (մարդու) գենետիկական հաջորդականությունը»[46]:
Գրելով 2018 թվականին, Journal of Law and the Biosciences ամսագրում, Շերկովը և այլք. պնդում էր գենային թերապիայի ավելի նեղ սահմանումը, քան FDA-ն՝ հաշվի առնելով նոր տեխնոլոգիան, որը բաղկացած կլինի ցանկացած բուժումից, որը միտումնավոր և մշտապես փոփոխում է բջջի գենոմը, գենոմի սահմանմամբ՝ ներառյալ միջուկից դուրս էպիզոմները, բայց բացառելով փոփոխությունները, որոնք պայմանավորված են էպիզոմների կորստի պատճառով: ժամանակի ընթացքում: Այս սահմանումը կբացառի նաև բջիջների ներմուծումը, որոնք բխում են ոչ թե հիվանդից, այլ ներառում են ex vivo մոտեցումները և կախված չեն լինի օգտագործվող վեկտորից:[46]
COVID-19 համաճարակի ժամանակ որոշ գիտնականներ պնդում էին, որ COVID-ի համար mRNA պատվաստանյութերը գենային թերապիա չեն, որպեսզի կանխեն սխալ տեղեկատվության տարածումը, որ պատվաստանյութը կարող է փոխել ԴՆԹ-ն, այլ գիտնականներ պնդում էին, որ պատվաստանյութերը գենային թերապիա են, քանի որ դրանք գենետիկ նյութ են ներմուծում: մի բջիջ[47] Փաստերի ստուգումներ, օրինակ՝ «Ամբողջ փաստ»[48]: Reuters,[49] PolitiFact,[50] and FactCheck.org[51] ասաց, որ պատվաստանյութերը գենային թերապիա անվանելը ճիշտ չէ: Փոդքասթի հաղորդավար Ջո Ռոգանը քննադատության ենթարկվեց mRNA պատվաստանյութերը գենային թերապիա անվանելու համար, ինչպես դա արեց բրիտանացի քաղաքական գործիչ Էնդրյու Բրիջենը, իսկ փաստերի ստուգիչ Full Fact-ը կոչ էր անում Բրիջենին հեռացնել պահպանողական կուսակցությունից այս և այլ հայտարարությունների համար[52][53]:
Ներկա կամ ավելացված գեներ
[խմբագրել | խմբագրել կոդը]Գենային թերապիան ներառում է բջիջին տարբեր նուկլեինաթթուներ ավելացնելու բազմաթիվ ձևեր: Գենի ավելացումը բջիջին ավելացնում է սպիտակուցի նոր կոդավորման գեն: Գենի ավելացման ձևերից մեկը գենային փոխարինող թերապիան է, որը բուժում է մոնոգեն ռեցեսիվ խանգարումների համար, երբ մեկ գենը գործունակ չէ, ավելացվում է լրացուցիչ ֆունկցիոնալ գեն: Բազմաթիվ գեներով կամ գերիշխող գենով առաջացած հիվանդությունների դեպքում գեների լռեցման կամ գեների խմբագրման մոտեցումներն ավելի նպատակահարմար են, սակայն գեների ավելացումը՝ գեների ավելացման մի ձև, որտեղ ավելացվում է նոր գեն, կարող է բարելավել բջիջների գործառույթը՝ առանց փոփոխելու խանգարում առաջացնող գեները[54]:
Բջիջների տեսակները
[խմբագրել | խմբագրել կոդը]Գենային թերապիան կարելի է դասակարգել երկու տեսակի՝ ըստ այն բջիջների տեսակի, որոնց վրա ազդում է.
Սոմատիկ բջջային գենային թերապիայի (SCGT) դեպքում թերապևտիկ գեները տեղափոխվում են ցանկացած այլ բջիջ, բացի սեռական բջիջներից, սեռական բջիջներից, գամետոցիտներից կամ չտարբերակված ցողունային բջիջներից: Ցանկացած նման փոփոխություն ազդում է միայն առանձին հիվանդի վրա և չի ժառանգվում սերունդների կողմից: Սոմատիկ գենային թերապիան ներկայացնում է հիմնական և կլինիկական հետազոտություններ, որոնցում թերապևտիկ ԴՆԹ-ն (կամ ինտեգրված գենոմում, կամ որպես արտաքին էպիզոմ կամ պլազմիդ) օգտագործվում է հիվանդության բուժման համար[55]: SCGT-ի օգտագործմամբ ավելի քան 600 կլինիկական փորձարկումներ են ընթանումԿաղապար:When in the US. Մեծամասնությունը կենտրոնանում է ծանր գենետիկ խանգարումների վրա, ներառյալ իմունային անբավարարությունները, հեմոֆիլիան, թալասեմիան և կիստիկ ֆիբրոզը: Նման մեկ գենային խանգարումները լավ թեկնածուներ են սոմատիկ բջջային թերապիայի համար: Գենետիկական խանգարումների ամբողջական շտկում կամ բազմաթիվ գեների փոխարինում դեռևս հնարավոր չէ։ Փորձարկումներից միայն մի քանիսն են առաջադեմ փուլում[56]:
Բողբոջային գենային թերապիայի (GGT) դեպքում սեռական բջիջները (սպերմատոզոիդներ կամ ձվաբջիջներ) փոփոխվում են՝ իրենց գենոմներում ֆունկցիոնալ գեների ներմուծմամբ: Սեռական բջիջի փոփոխումը հանգեցնում է նրան, որ օրգանիզմի բոլոր բջիջները պարունակեն փոփոխված գենը: Հետևաբար, փոփոխությունը ժառանգական է և փոխանցվում է հետագա սերունդներին: Ավստրալիա, Կանադա, Գերմանիա, Իսրայել, Շվեյցարիա և Նիդեռլանդներ[57] արգելել GGT-ի կիրառումը մարդկանց մեջ՝ տեխնիկական և էթիկական պատճառներով, ներառյալ ապագա սերունդների համար հնարավոր ռիսկերի մասին անբավարար գիտելիքները[57] և ավելի բարձր ռիսկեր՝ ընդդեմ SCGT[58]: ԱՄՆ-ը չունի դաշնային հսկողություն, որը հատուկ վերաբերում է մարդու գենետիկ մոդիֆիկացմանը (ընդհանուր առմամբ թերապիայի համար FDA կանոնակարգերից դուրս)[57][59][60][61]:
In vivo ընդդեմ ex vivo թերապիաների
[խմբագրել | խմբագրել կոդը]
In vivo գենային թերապիայի ժամանակ հիվանդին ներմուծվում է վեկտոր (սովորաբար՝ վիրուս), որն այնուհետև հասնում է ցանկալի կենսաբանական էֆեկտին՝ գենետիկ նյութը (օրինակ՝ բացակայող սպիտակուցի համար) փոխանցելով հիվանդի բջիջներին: Ex vivo գենային թերապիաներում, ինչպիսիք են CAR-T թերապևտիկները, հիվանդի սեփական բջիջները (ավտոլոգ) կամ առողջ դոնորային բջիջները (ալոգեն) փոփոխվում են մարմնից դուրս (հետևաբար, ex vivo)՝ օգտագործելով վեկտոր՝ որոշակի սպիտակուց արտահայտելու համար, օրինակ՝ քիմերային հակագենի ընկալիչ[62]:
In vivo գենային թերապիան համարվում է ավելի պարզ, քանի որ այն չի պահանջում միտոտիկ բջիջների հավաքում: Այնուամենայնիվ, ex vivo գենային թերապիան ավելի լավ է հանդուրժվում և ավելի քիչ կապված է իմունային ծանր արձագանքների հետ[63]: Ջեսսի Գելսինջերի մահը համակարգային բորբոքային ռեակցիայի պատճառով ադենովիրուսային վեկտորային բուժման փորձարկումների ժամանակ հանգեցրեց գենային թերապիայի փորձարկումների ժամանակավոր դադարեցմանը Միացյալ Նահանգներում[64]: 2021 թվականի դրությամբ in vivo և ex vivo թերապևտիկները երկուսն էլ համարվում են անվտանգ[65]:
Գենային խմբագրում
[խմբագրել | խմբագրել կոդը]
Գենային թերապիայի հայեցակարգը գենետիկ խնդիրն իր սկզբնաղբյուրում ամրագրելն է: Եթե, օրինակ, որոշակի գենի մուտացիան առաջացնում է դիսֆունկցիոնալ սպիտակուցի արտադրություն, որը հանգեցնում է (սովորաբար ռեցեսիվ) ժառանգական հիվանդության, գենային թերապիան կարող է օգտագործվել այս գենի պատճենը փոխանցելու համար, որը չի պարունակում վնասակար մուտացիա և դրանով իսկ առաջացնում է. ֆունկցիոնալ սպիտակուց: Այս ռազմավարությունը կոչվում է գենային փոխարինող թերապիա և կարող է օգտագործվել ցանցաթաղանթի ժառանգական հիվանդությունների բուժման համար[17][66]:
Թեև գենային փոխարինող թերապիայի հայեցակարգը հիմնականում հարմար է ռեցեսիվ հիվանդությունների համար, առաջարկվել են նոր ռազմավարություններ, որոնք կարող են նաև բուժել ժառանգականության գերիշխող օրինակով պայմանները:
- CRISPR գեների խմբագրման ներդրումը նոր դռներ է բացել գենային թերապիայի մեջ դրա կիրառման և օգտագործման համար, քանի որ գենի մաքուր փոխարինման փոխարեն այն հնարավորություն է տալիս շտկել կոնկրետ գենետիկ արատը[40]: Բժշկական խոչընդոտների լուծումները, ինչպիսիք են մարդու իմունային անբավարարության վիրուսի (ՄԻԱՎ) թաքնված ռեզերվուարների վերացումը և մանգաղ բջջային հիվանդություն առաջացնող մուտացիայի շտկումը, ապագայում կարող են հասանելի լինել որպես թերապևտիկ տարբերակ[67][68][69]:
- Պրոթեզային գենային թերապիան նպատակ ունի թույլ տալ մարմնի բջիջներին ստանձնել այն գործառույթները, որոնք նրանք ֆիզիոլոգիապես չեն իրականացնում: Օրինակներից մեկը, այսպես կոչված, տեսողության վերականգնման գենային թերապիան է, որի նպատակն է վերականգնել տեսողությունը ցանցաթաղանթի վերջին փուլի հիվանդություններով հիվանդների մոտ[70][71]: Ցանցաթաղանթի վերջին փուլի հիվանդությունների դեպքում ֆոտոընկալիչները, որպես ցանցաթաղանթի լուսազգայուն առաջնային բջիջներ, անդառնալիորեն կորչում են: Պրոթեզային գենային թերապիայի միջոցով լուսազգայուն սպիտակուցները փոխանցվում են ցանցաթաղանթի մնացած բջիջներին՝ դրանք լուսազգայուն դարձնելու և դրանով իսկ հնարավորություն տալով նրանց ուղեղին տեսողական տեղեկատվություն հաղորդել:
In vivo-ում, CRISPR-ի օգտագործմամբ գեների խմբագրման համակարգերը օգտագործվել են մկների հետ հետազոտությունների ժամանակ քաղցկեղը բուժելու համար և արդյունավետ են եղել ուռուցքները նվազեցնելու համար[72]: In vitro CRISPR համակարգը օգտագործվել է HPV քաղցկեղի ուռուցքների բուժման համար: Ադենո-ասոցիացված վիրուսը, Lentivirus-ի վրա հիմնված վեկտորները պետք է ներկայացնեն գենոմը CRISPR համակարգի համար[72]:
Վեկտորներ
[խմբագրել | խմբագրել կոդը]ԴՆԹ-ի առաքումը բջիջներ կարող է իրականացվել բազմաթիվ մեթոդներով: Երկու հիմնական դասերն են՝ ռեկոմբինանտ վիրուսները (երբեմն կոչվում են կենսաբանական նանոմասնիկներ կամ վիրուսային վեկտորներ) և մերկ ԴՆԹ կամ ԴՆԹ համալիրներ (ոչ վիրուսային մեթոդներ)[73]:
Վիրուսներ
[խմբագրել | խմբագրել կոդը]
Վերարտադրվելու համար վիրուսներն իրենց գենետիկական նյութը ներմուծում են հյուրընկալող բջիջ՝ խաբելով հյուրընկալողի բջջային մեխանիզմին՝ այն օգտագործել որպես վիրուսային սպիտակուցների նախագիծ[54]: Ռետրովիրուսները ավելի հեռուն են գնում՝ իրենց գենետիկ նյութը պատճենելով հյուրընկալող բջջի միջուկային գենոմում: Գիտնականները դա օգտագործում են՝ վիրուսի գենետիկ նյութի մի մասը փոխարինելով բուժական ԴՆԹ-ով կամ ՌՆԹ-ով[54][74]: Ինչպես վիրուսներում առկա գենետիկական նյութը (ԴՆԹ կամ ՌՆԹ), այնպես էլ թերապևտիկ գենետիկական նյութը կարող է նախագծվել այնպես, որ ծառայի որպես ժամանակավոր նախագիծ, որը բնականաբար քայքայվում է, ինչպես ոչ ինտեգրատիվ վեկտորներում, կամ մտնելու հյուրընկալողի միջուկը՝ դառնալով հյուրընկալողի մշտական մասը։ միջուկային ԴՆԹ վարակված բջիջներում[54]:
Մարդու գենային թերապիայի համար օգտագործվել են մի շարք վիրուսներ, այդ թվում՝ վիրուսներ, ինչպիսիք են lentivirus, adenoviruses, herpes simplex, vaccinia և adeno-associated virus[5]:
Ադենովիրուսային վիրուսային վեկտորները (Ad) ժամանակավորապես փոփոխում են բջջի գենետիկական արտահայտությունը գենետիկ նյութով, որը ինտեգրված չէ ընդունող բջջի ԴՆԹ-ում[75]: 2017 թվականի դրությամբ նման վեկտորներն օգտագործվել են գենային թերապիայի փորձարկումների 20%-ում[74]: Adenovirus vectors are mostly used in cancer treatments and novel genetic vaccines such as the Էբոլայի դեմ պատվաստանյութ, ՄԻԱՎ-ի և SARS-CoV-2-ի կամ քաղցկեղի դեմ պատվաստանյութերի կլինիկական փորձարկումներում օգտագործվող պատվաստանյութեր[75]:
Լենտիվիրուսային վեկտորները, որոնք հիմնված են ռետրովիրուսի վրա, կարող են փոփոխել բջջի միջուկային գենոմը՝ գենը մշտապես արտահայտելու համար, թեև վեկտորները կարող են փոփոխվել՝ ինտեգրումը կանխելու համար[54]: Ռետրովիրուսները օգտագործվել են փորձարկումների 18%-ում մինչև 2018թ.[74]: Libmeldy-ն ex vivo ցողունային բջիջների բուժում է մետախրոմատիկ լեյկոդիստրոֆիայի համար, որն օգտագործում է լենտիվիրուսային վեկտոր և հաստատվել է եվրոպական բժշկական գործակալության կողմից 2020 թվականին[76]։
Ադենո ասոցացված վիրուսը (AAV) վիրուս է, որն ունակ չէ փոխանցվել բջիջների միջև, քանի դեռ բջիջը չի վարակվել մեկ այլ վիրուսով՝ օգնական վիրուսով: Ադենովիրուսը և հերպեսի վիրուսները գործում են որպես AAV-ի օգնական վիրուսներ: AAV-ը երկար ժամանակ պահպանվում է բջջի միջուկային գենոմից դուրս գտնվող բջջի ներսում՝ հիմնականում որպես էպիզոմներ կազմակերպված կոնկատեմերների ձևավորման միջոցով[77]: AAV վեկտորներից ստացված գենետիկական նյութը ցածր հաճախականությամբ ինտեգրվում է ընդունող բջջի միջուկային գենոմում և, հավանաբար, միջնորդավորված հյուրընկալող բջջի ԴՆԹ-մոդիֆիկացնող ֆերմենտներով[78]: Կենդանական մոդելները ցույց են տալիս, որ AAV գենետիկական նյութի ինտեգրումը հյուրընկալող բջջի միջուկային գենոմում կարող է առաջացնել հեպատոցելուլյար քաղցկեղ՝ լյարդի քաղցկեղի մի ձև[78]:
Ոչ վիրուսային
[խմբագրել | խմբագրել կոդը]Ոչ վիրուսային վեկտորներ գենային թերապիայի համար[79] ներկայացնում են որոշակի առավելություններ վիրուսային մեթոդների նկատմամբ, ինչպիսիք են լայնածավալ արտադրությունը և հյուրընկալողի ցածր իմունոգենությունը: Այնուամենայնիվ, ոչ վիրուսային մեթոդներն ի սկզբանե հանգեցրել են տրանսֆեկցիայի և գեների արտահայտման ավելի ցածր մակարդակների և այդպիսով ավելի ցածր թերապևտիկ արդյունավետության: Ավելի նոր տեխնոլոգիաները խոստանում են լուծել այս խնդիրները՝ բջիջներին հատուկ թիրախավորման և ենթաբջջային թրաֆիքինգի վերահսկման գալուստով:
Ոչ վիրուսային գենային թերապիայի մեթոդները ներառում են մերկ ԴՆԹ-ի ներարկում, էլեկտրոպորացիա, գենային ատրճանակ, սոնոպորացիա, մագնիտոֆեկցիա, օլիգոնուկլեոտիդների, լիպոլեքսների, դենդրիմերների և անօրգանական նանոմասնիկների օգտագործումը: Այս թերապևտիկ միջոցները կարող են կիրառվել ուղղակիորեն կամ փայտամածի հարստացման միջոցով:
Ավելի վերջին մոտեցումները, ինչպիսիք են Ligandal-ի նման ընկերությունները, առաջարկում են գենային թերապիայի տարբեր եղանակների, ներառյալ ՌՆԹ, ԴՆԹ և գեների խմբագրման գործիքներ, ինչպիսիք են CRISPR-ը, ստեղծելու բջիջներին հատուկ թիրախավորման տեխնոլոգիաներ: Այլ ընկերություններ, ինչպիսիք են Arbutus Biopharma-ն և Arcturus Therapeutics-ը, առաջարկում են ոչ վիրուսային, ոչ բջիջներին ուղղված մոտեցումներ, որոնք հիմնականում դրսևորում են լյարդի տրոֆիզմ: Վերջին տարիներին այնպիսի ստարտափներ, ինչպիսիք են Sixfold Bio-ն, GenEdit-ը և Spotlight Therapeutics-ը, սկսել են լուծել ոչ վիրուսային գեների առաքման խնդիրը: Ոչ վիրուսային տեխնիկան առաջարկում է կրկնակի չափաբաժինների և գենետիկական բեռների ավելի հարմարեցվածության հնարավորություն, ինչը ապագայում ավելի հավանական է, որ կտիրի վիրուսների վրա հիմնված առաքման համակարգերին:
Ընկերություններ, ինչպիսիք են Editas Medicine, Intellia Therapeutics, CRISPR Therapeutics, Casebia, Cellectis, Precision Biosciences, bluebird bio, Excision BioTherapeutics և Sangamo, մշակել են ոչ վիրուսային գեների խմբագրման տեխնիկա, սակայն հաճախ դեռևս օգտագործում են վիրուսներ՝ գենային ներդիրի նյութը փոխանցելու համար: առաջնորդվող նուկլեազներ. Այս ընկերությունները կենտրոնանում են գեների խմբագրման վրա և դեռևս բախվում են առաքման լուրջ խոչընդոտների:
BioNTech-ը, Moderna Therapeutics-ը և CureVac-ը կենտրոնանում են mRNA բեռների առաքման վրա, որոնք անպայմանորեն ոչ վիրուսային առաքման խնդիրներ են:
Alnylam-ը, Dicerna Pharmaceuticals-ը և Ionis Pharmaceuticals-ը կենտրոնանում են siRNA-ի (հակազգայական օլիգոնուկլեոտիդների) առաքման վրա՝ գեների ճնշելու համար, ինչը նաև պահանջում է ոչ վիրուսային առաքման համակարգեր:
Ակադեմիական համատեքստում մի շարք լաբորատորիաներ աշխատում են PEGylated մասնիկների առաքման վրա, որոնք ձևավորում են շիճուկ սպիտակուցի կորոններ և հիմնականում ցուցադրում են LDL ընկալիչների միջնորդավորված կլանումը բջիջներում in vivo[80]։
Բուժում
[խմբագրել | խմբագրել կոդը]Քաղցկեղ
[խմբագրել | խմբագրել կոդը]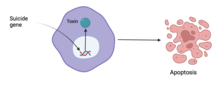
Քաղցկեղի բուժման փորձեր են եղել՝ օգտագործելով գենային թերապիա։ 2017 թվականի դրությամբ գենային թերապիայի փորձարկումների 65%-ը վերաբերում էր քաղցկեղի բուժմանը[74]։
Ադենովիրուսային վեկտորները օգտակար են քաղցկեղի որոշ գենային թերապիաների համար, քանի որ ադենովիրուսը կարող է ժամանակավոր կերպով գենետիկ նյութ ներդնել բջջի մեջ՝ առանց բջջի միջուկային գենոմը մշտապես փոփոխելու: Այս վեկտորները կարող են օգտագործվել քաղցկեղին անտիգեններ ավելացնելու համար, որոնք առաջացնում են իմունային պատասխան կամ խոչընդոտում են անգիոգենեզին՝ արտահայտելով որոշակի սպիտակուցներ[81]։ Ադենովիրուսային վեկտորն օգտագործվում է Gendicine և Oncorine առևտրային արտադրանքներում[81]։ Մեկ այլ առևտրային արտադրանք՝ Rexin G-ն, օգտագործում է ռետրովիրուսի վրա հիմնված վեկտոր և ընտրողաբար կապվում է ընկալիչների հետ, որոնք ավելի շատ արտահայտված են ուռուցքներում[81]։
Մոտեցումներից մեկը՝ ինքնասպանության գենային թերապիան, գործում է՝ ներմուծելով գեներ, որոնք կոդավորում են ֆերմենտները, որոնք կհանգեցնեն քաղցկեղի բջիջների մահվան: Մեկ այլ մոտեցում է օնկոլիտիկ վիրուսների օգտագործումը, ինչպիսին է Oncorine-ը,[82] որոնք վիրուսներ են, որոնք ընտրողաբար վերարտադրվում են քաղցկեղային բջիջներում՝ թողնելով անփոփոխ մնացած բջիջները[83][84]։
mRNA-ն առաջարկվել է որպես քաղցկեղի գենային թերապիայի ոչ վիրուսային վեկտոր, որը ժամանակավորապես կփոխի քաղցկեղային բջիջի ֆունկցիան՝ ստեղծելով հակագեններ կամ սպանել քաղցկեղային բջիջները, և մի քանի փորձարկումներ են եղել[85]։
Գենետիկ հիվանդություններ
[խմբագրել | խմբագրել կոդը]Առաջարկվել են գենային թերապիայի մոտեցումներ՝ անսարք գենը առողջ գենով փոխարինելու համար և ուսումնասիրվում են որոշ գենետիկ հիվանդությունների բուժման համար: 2017 թվականի դրությամբ գենային թերապիայի կլինիկական փորձարկումների 11.1%-ը ուղղված է եղել մոնոգեն հիվանդություններին[74]։
Հիվանդությունները, ինչպիսիք են մանգաղ բջջային հիվանդությունը, որոնք առաջանում են աուտոսոմային ռեցեսիվ խանգարումներով, որոնց դեպքում մարդու նորմալ ֆենոտիպը կամ բջջային ֆունկցիան կարող է վերականգնվել հիվանդություն ունեցող բջիջներում մուտացիայի ենթարկված գենի նորմալ պատճենով, կարող են լավ թեկնածու լինել գենային թերապիայի համար: բուժում.[86][87] Մանգաղ բջջային հիվանդության գենային թերապիայի հետ կապված ռիսկերն ու օգուտները հայտնի չեն[87]։
Աչքի մեջ կիրառվել է գենային թերապիա։ Աչքը հատկապես հարմար է ադենո ասոցացված վիրուսի վեկտորների համար: Luxturna-ն հաստատված գենային թերապիա է Լեբերի ժառանգական օպտիկական նյարդաբանության բուժման համար[88]։ Glybera-ն՝ գենետիկական վիճակով առաջացած պանկրեատիտի բուժումը, և Zolgensma-ն՝ ողնաշարի մկանային ատրոֆիայի բուժման համար, երկուսն էլ օգտագործում են ադենո ասոցացված վիրուսային վեկտոր[78]։
Վարակիչ հիվանդություններ
[խմբագրել | խմբագրել կոդը]2017 թվականի դրությամբ գենետիկ թերապիայի փորձարկումների 7%-ը ուղղված է եղել վարակիչ հիվանդություններին: Փորձարկումների 69,2%-ը ուղղված է եղել ՄԻԱՎ-ին, 11%-ը՝ հեպատիտ B-ին կամ C-ին, և 7,1%-ը մալարիային[74]:
Անբարենպաստ ազդեցությունները, հակացուցումները և օգտագործման խոչընդոտները
[խմբագրել | խմբագրել կոդը]Որոշ չլուծված խնդիրներ ներառում են.
[խմբագրել | խմբագրել կոդը]- Թիրախից դուրս ազդեցություններ – Գենոմի անցանկալի, հավանական վնասակար փոփոխությունների հնարավորությունը մեծ խոչընդոտ է հանդիսանում այս տեխնոլոգիայի համատարած ներդրման համար[89]։ gRNA-ների և Cas enzymes-ի առանձնահատկությունների բարելավումները ներկայացնում են այս խնդրի կենսունակ լուծումները, ինչպես նաև CRISPR-ի առաքման մեթոդի կատարելագործումը[90]։ Հավանական է, որ տարբեր հիվանդություններ կշահեն առաքման տարբեր մեթոդներից:
- Կարճատև բնույթ. Մինչ գենային թերապիան կարող է դառնալ հիվանդության մշտական բուժում, թիրախային բջիջներ ներմուծված բուժական ԴՆԹ-ն պետք է մնա ֆունկցիոնալ, իսկ բուժիչ ԴՆԹ պարունակող բջիջները պետք է կայուն լինեն: Միջուկային գենոմում բուժական ԴՆԹ-ի ինտեգրման հետ կապված խնդիրները և շատ բջիջների արագ բաժանվող բնույթը խանգարում են երկարաժամկետ օգուտների հասնելուն: Հիվանդները պահանջում են բազմաթիվ բուժում:
- Իմունային պատասխան – Ամեն անգամ, երբ օտար առարկան ներթափանցվում է մարդու հյուսվածքների մեջ, իմունային համակարգը խթանվում է զավթիչի վրա հարձակվելու համար: Հնարավոր է խթանել իմունային համակարգը այնպես, որ նվազեցնի գենային թերապիայի արդյունավետությունը: Իմունային համակարգի ուժեղացված արձագանքը վիրուսներին, որոնք նախկինում տեսել է, նվազեցնում է կրկնակի բուժման արդյունավետությունը:
- Վիրուսային վեկտորների հետ կապված խնդիրներ – Վիրուսային վեկտորները կրում են թունավորության, բորբոքային պատասխանների, ինչպես նաև գեների վերահսկման և թիրախավորման հետ կապված խնդիրներ:
- Բազմագենային խանգարումներ – Որոշ հաճախ հանդիպող խանգարումներ, ինչպիսիք են սրտի հիվանդությունը, արյան բարձր ճնշումը, Ալցհեյմերի հիվանդությունը, արթրիտը և շաքարախտը, ազդում են բազմաթիվ գեների տատանումներից, որոնք բարդացնում են գենային թերապիան:
- Որոշ թերապիաներ կարող են խախտել Վայսմանի արգելքը (սոմայի և սաղմնային գծի միջև)՝ պաշտպանելով ամորձիները, պոտենցիալ փոփոխելով բողբոջային գիծը, խախտելով այն երկրների կանոնակարգերը, որոնք արգելում են վերջիններիս պրակտիկան[91]։
- Ներդիրային մուտագենեզ. Եթե ԴՆԹ-ն ինտեգրված է գենոմի զգայուն կետում, օրինակ՝ ուռուցքը ճնշող գենում, թերապիան կարող է առաջացնել ուռուցք: Սա տեղի է ունեցել կլինիկական փորձարկումների ժամանակ X-կապակցված ծանր համակցված իմունային անբավարարությամբ (X-SCID) հիվանդների համար, որոնցում արյունաստեղծ ցողունային բջիջները փոխակերպվել են ուղղիչ տրանսգենով՝ օգտագործելով ռետրովիրուս, և դա հանգեցրել է T բջջային լեյկեմիայի զարգացմանը 20 հիվանդներից 3-ում[92][93]։ Հնարավոր լուծումներից մեկն այն է, որ ինտեգրվող ԴՆԹ-ին ֆունկցիոնալ ուռուցքը ճնշող գեն ավելացնելն է: Սա կարող է խնդրահարույց լինել, քանի որ որքան երկար է ԴՆԹ-ն, այնքան դժվար է այն ինտեգրվել բջջային գենոմներին[94]։ CRISPR տեխնոլոգիան թույլ է տալիս հետազոտողներին շատ ավելի ճշգրիտ գենոմի փոփոխություններ կատարել ճշգրիտ վայրերում[95]:
- Արժեքը – Alipogene tiparvovec-ը կամ Glybera-ն, օրինակ, մեկ հիվանդի համար 1,6 միլիոն դոլար արժողությամբ, 2013 թվականին հայտարարվել է աշխարհի ամենաթանկ դեղամիջոցը[96][97]:
Մահվան դեպքեր | մահացություններ
[խմբագրել | խմբագրել կոդը]Երեք հիվանդների մահ է գրանցվել գենային թերապիայի փորձարկումների արդյունքում՝ ոլորտը դնելով խիստ հսկողության տակ: Առաջինը Ջեսսի Գելսինջերն էր, ով մահացավ 1999 թվականին իմունային մերժման պատասխանի պատճառով[98][99] X-SCID մեկ հիվանդ մահացել է լեյկոզից 2003 թվականին[13]: 2007 թվականին ռևմատոիդ արթրիտով հիվանդը մահացել է վարակից. Հետագա հետաքննությունը եզրակացրեց, որ մահը կապված չէ գենային թերապիայի հետ[100]:
Կանոնակարգեր
[խմբագրել | խմբագրել կոդը]Գենետիկական մոդիֆիկացիան ընդգրկող կանոնակարգերը մարդու կողմից ներգրավված կենսաբժշկական հետազոտությունների ընդհանուր ուղեցույցների մասն են կազմում:
Հելսինկյան հռչակագիրը (Մարդկային սուբյեկտների մասնակցությամբ բժշկական հետազոտությունների էթիկական սկզբունքները) փոփոխվել է Համաշխարհային բժշկական ասոցիացիայի Գլխավոր ասամբլեայի կողմից 2008 թվականին: Այս փաստաթուղթը տրամադրում է սկզբունքներ, որոնք բժիշկներն ու հետազոտողները պետք է հաշվի առնեն մարդկանց որպես հետազոտության առարկա ներգրավելիս: 2001թ.-ին Մարդու գենոմի կազմակերպության (HUGO) կողմից նախաձեռնված գենային թերապիայի հետազոտության մասին հայտարարությունը, որը իրավական հիմք է տալիս բոլոր երկրների համար: HUGO-ի փաստաթուղթն ընդգծում է մարդու ազատությունը և մարդու իրավունքներին հավատարիմ մնալը և առաջարկություններ է առաջարկում սոմատիկ գենային թերապիայի համար, ներառյալ նման հետազոտությունների վերաբերյալ հանրային մտահոգությունների ճանաչման կարևորությունը:.[101]
Միացյալ Նահանգներ
[խմբագրել | խմբագրել կոդը]Ոչ մի դաշնային օրենսդրություն չի սահմանում արձանագրություններ կամ սահմանափակումներ մարդու գենետիկական ինժեներիայի վերաբերյալ: Այս թեման կարգավորվում է տեղական և դաշնային գործակալությունների համընկնող կանոնակարգերով, ներառյալ Առողջապահության և մարդկային ծառայությունների դեպարտամենտը, FDA-ն և NIH-ի Ռեկոմբինանտ ԴՆԹ-ի խորհրդատվական կոմիտեն: Հետազոտողները, ովքեր փնտրում են դաշնային միջոցներ՝ հետազոտական նոր դեղամիջոցի կիրառման համար (սովորաբար մարդու սոմատիկ գենետիկական ճարտարագիտության դեպքում), պետք է ենթարկվեն մարդկային սուբյեկտների պաշտպանության միջազգային և դաշնային ուղեցույցներին[102]:
NIH-ը ծառայում է որպես գենային թերապիայի հիմնական կարգավորող դաշնային ֆինանսավորմամբ հետազոտությունների համար: Մասնավոր ֆինանսավորվող հետազոտություններին խորհուրդ է տրվում հետևել այս կանոնակարգերին: NIH-ը ֆինանսավորում է հետազոտությունների համար, որոնք զարգացնում կամ ընդլայնում են գենետիկական ինժեներիայի տեխնիկան և գնահատելու ընթացիկ հետազոտությունների էթիկան և որակը: NIH-ը պահպանում է մարդու գենետիկական ինժեներիայի հետազոտության արձանագրությունների պարտադիր գրանցամատյան, որը ներառում է դաշնային կողմից ֆինանսավորվող բոլոր նախագծերը[103]:
NIH խորհրդատվական կոմիտեն հրապարակեց մի շարք ուղեցույցներ գենային մանիպուլյացիայի վերաբերյալ:[104] Ուղեցույցները քննարկում են լաբորատորիայի անվտանգությունը, ինչպես նաև մարդկանց փորձարկման առարկաները և տարբեր փորձարարական տեսակներ, որոնք ներառում են գենետիկ փոփոխություններ: Մի քանի բաժիններ հատուկ վերաբերում են մարդու գենետիկական ճարտարագիտությանը, ներառյալ III-C-1 բաժինը: Այս բաժինը նկարագրում է վերանայման պահանջվող գործընթացները և այլ ասպեկտներ, երբ հավանություն է տրվում՝ սկսելու կլինիկական հետազոտություն, որը ներառում է գենետիկական փոխանցում մարդու հիվանդի մեջ[105]: Գենային թերապիայի կլինիկական փորձարկման արձանագրությունը պետք է հաստատվի NIH-ի Ռեկոմբինանտ ԴՆԹ-ի խորհրդատվական կոմիտեի կողմից՝ նախքան կլինիկական փորձարկումների սկիզբը. սա տարբերվում է ցանկացած այլ տեսակի կլինիկական փորձարկումից[104]:
Ինչպես այլ տեսակի դեղերի դեպքում, FDA-ն կարգավորում է գենային թերապիայի արտադրանքի որակն ու անվտանգությունը և վերահսկում է, թե ինչպես են այդ արտադրանքները կլինիկականորեն օգտագործվում: Մարդու գենոմի թերապևտիկ փոփոխությունը ենթակա է նույն կարգավորող պահանջների, ինչ ցանկացած այլ բժշկական բուժում: Մարդկային առարկաների հետ կապված հետազոտությունները, ինչպիսիք են կլինիկական փորձարկումները, պետք է վերանայվեն և հաստատվեն FDA-ի և Ինստիտուցիոնալ վերանայման խորհրդի կողմից[106][107]:
Գենային դոպինգ
[խմբագրել | խմբագրել կոդը]Մարզիկները կարող են որդեգրել գենային թերապիայի տեխնոլոգիաներ՝ իրենց կատարողականությունը բարելավելու համար[108]: Հայտնի չէ, որ գենային դոպինգ է լինում, սակայն բազմաթիվ գենային թերապիաները կարող են նման ազդեցություն ունենալ: Kayser et al. պնդում են, որ գենային դոպինգը կարող է հավասարեցնել խաղադաշտը, եթե բոլոր մարզիկները հավասար հասանելիություն ստանան: Քննադատները պնդում են, որ ցանկացած թերապևտիկ միջամտություն ոչ թերապևտիկ/բարելավման նպատակներով վնասում է բժշկության և սպորտի էթիկական հիմքերը.[109]
Գենետիկական ուժեղացում
[խմբագրել | խմբագրել կոդը]Գենետիկական ճարտարագիտությունը կարող է օգտագործվել հիվանդությունները բուժելու համար, բայց նաև փոխելու ֆիզիկական տեսքը, նյութափոխանակությունը և նույնիսկ բարելավելու ֆիզիկական կարողությունները և մտավոր ունակությունները, ինչպիսիք են հիշողությունը և ինտելեկտը: Էթիկական պնդումները բակտերիալ ինժեներիայի վերաբերյալ ներառում են համոզմունքներ, որ յուրաքանչյուր պտուղ իրավունք ունի մնալ գենետիկորեն չձևափոխված, որ ծնողներն իրավունք ունեն գենետիկորեն ձևափոխել իրենց սերունդներին, և որ յուրաքանչյուր երեխա իրավունք ունի ծնվել առանց կանխարգելելի հիվանդությունների[110][111][112]: Ծնողների համար գենետիկական ճարտարագիտությունը կարող է դիտվել որպես երեխայի բարելավման ևս մեկ տեխնիկա՝ ավելացնելու դիետան, վարժությունը, կրթությունը, մարզումները, կոսմետիկան և պլաստիկ վիրաբուժությունը[113][114]: Մեկ այլ տեսաբան պնդում է, որ բարոյական մտահոգությունները սահմանափակում են, բայց չեն արգելում բողբոջային ճարտարագիտությունը[115]:
Bioethics ամսագրի 2020թ.-ի համարը նվիրված էր մարդկանց մեջ գենետիկական ինժեներիայի հետ կապված բարոյական խնդիրներին[116]:
Կարգավորման հնարավոր սխեմաները ներառում են ամբողջական արգելք, տրամադրում բոլորին կամ մասնագիտական ինքնակարգավորում: Ամերիկյան բժշկական ասոցիացիայի էթիկայի և դատական հարցերի խորհուրդը հայտարարեց, որ «հատկանիշները բարելավելու գենետիկական միջամտությունները պետք է թույլատրելի համարվեն միայն խիստ սահմանափակ իրավիճակներում. 1) հստակ և իմաստալից օգուտներ պտղի կամ երեխայի համար. բնութագրերը կամ գծերը, և (3) գենետիկ տեխնոլոգիային հավասար հասանելիություն՝ անկախ եկամուտից կամ այլ սոցիալ-տնտեսական բնութագրերից[117]:
Դեռևս 1990 թվականին կենսատեխնոլոգիայի պատմության մեջ եղել են գիտնականներ, որոնք դեմ են եղել այս նոր գործիքների միջոցով մարդու բողբոջային գիծը փոփոխելու փորձերին[118], և նման մտահոգությունները շարունակվել են տեխնոլոգիայի առաջընթացի հետ մեկտեղ[119][120]: CRISPR-ի նման նոր տեխնիկայի հայտնվելով, 2015թ. մարտին մի խումբ գիտնականներ կոչ արեցին համաշխարհային մորատորիում սահմանել գեների խմբագրման տեխնոլոգիաների կլինիկական օգտագործման համար՝ մարդու գենոմը ժառանգաբար փոխանցելու համար[121][122][123][124]: 2015 թվականի ապրիլին հետազոտողները հակասությունների տեղիք տվեցին, երբ նրանք զեկուցեցին CRISPR-ի միջոցով ոչ կենսունակ մարդկային սաղմերի ԴՆԹ-ի խմբագրման հիմնական հետազոտության արդյունքների մասին[125][126]: Ամերիկյան գիտությունների ազգային ակադեմիայի և բժշկության ազգային ակադեմիայի հանձնաժողովը որակյալ աջակցություն է ցուցաբերել մարդու գենոմի խմբագրմանը 2017թ.[127][128] երբ պատասխաններ են գտնվել անվտանգության և արդյունավետության խնդիրների վերաբերյալ, «բայց միայն խիստ հսկողության տակ գտնվող լուրջ պայմանների համար»[129]:
Թարգմանություն
[խմբագրել | խմբագրել կոդը]Tisagenlecleucel-ը B-բջիջների սուր լիմֆոբլաստիկ լեյկեմիայի համար ընդունվող բջիջների փոխանցման թերապիա է: Քաղցկեղով հիվանդ մարդուց T բջիջները հեռացվում են, գենետիկորեն մշակվում՝ ստեղծելու հատուկ T-բջիջների ընկալիչ (քիմերիկ T բջիջների ընկալիչ կամ «CAR-T»), որը արձագանքում է քաղցկեղին և հետ է ուղարկվում մարդուն: T բջիջները նախագծված են, որպեսզի թիրախավորեն CD19 կոչվող սպիտակուցը, որը տարածված է B բջիջների վրա: Սա գենային թերապիայի առաջին ձևն է, որը հաստատվել է ԱՄՆ-ում: Հոկտեմբերին նմանատիպ թերապիա, որը կոչվում է axicabtagene ciloleucel, հաստատվել է ոչ Հոջկինի լիմֆոմայի համար:.[130]
Հոկտեմբերին կենսաֆիզիկոս և բիոհաքեր Ջոսիա Զեյները հայտարարեց, որ կատարել է մարդու գենոմի առաջին in-vivo խմբագրումը ինքնուրույն թերապիայի տեսքով[131][132]։
Նոյեմբերի 13-ին բժիշկ գիտնականները, ովքեր աշխատում էին Sangamo Therapeutics-ի հետ, որի կենտրոնակայանը գտնվում է Ռիչմոնդում, Կալիֆորնիա, հայտարարեցին մարդու գեների խմբագրման առաջին թերապիայի մասին[133][134]։ Բուժումը, որը նախատեսված է Հանթերի համախտանիշ առաջացնող թերի գենի առողջ տարբերակն ընդմիշտ ներդնելու համար, տրվել է 44-ամյա Բրայան Մադոյին և հանդիսանում է աշխարհում առաջին հետազոտության մի մասը, որը մշտապես փոփոխում է ԴՆԹ-ն մարդու մարմնի ներսում[135]։ Ավելի ուշ հաստատվեց գենի ներդրման հաջողությունը[136][137]։ Կլինիկական փորձարկումները Sangamo-ի կողմից, որոնք ներառում են գեների խմբագրում ցինկի մատների նուկլեազի (ZFN) օգտագործմամբ, շարունակվում են[138]։
Դեկտեմբերին հրապարակվեցին արյան մակարդման VIII գործոնով ադենո ասոցացված վիրուսի օգտագործման արդյունքները հեմոֆիլիա A-ով ինը հիվանդների բուժման համար: Բարձր դոզայի ռեժիմով յոթ հիվանդներից վեցը բարձրացրել են արյան մակարդման VIII մակարդակը մինչև նորմալ մակարդակ: Ցածր և միջին չափաբաժինների ռեժիմները ոչ մի ազդեցություն չեն ունեցել հիվանդի արյան մակարդման մակարդակի վրա[139][140]։
Դեկտեմբերին FDA-ն հաստատեց Luxturna-ն՝ առաջին in vivo գենային թերապիան Լեբերի բնածին ամաուրոզի պատճառով կուրության բուժման համար: Այս բուժման արժեքը Կաղապար:US$ է երկու աչքերի համար[141][142]։
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ Kaji EH, Leiden JM (February 2001). «Gene and stem cell therapies». JAMA. 285 (5): 545–550. doi:10.1001/jama.285.5.545. PMID 11176856.
- ↑ Ermak G (2015). Emerging Medical Technologies. World Scientific. ISBN 978-981-4675-81-9.
- ↑ Research, Center for Biologics Evaluation and (2020-12-09). «What is Gene Therapy?». FDA (անգլերեն).
- ↑ Rosenberg SA, Aebersold P, Cornetta K, Kasid A, Morgan RA, Moen R, և այլք: (August 1990). «Gene transfer into humans--immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction». The New England Journal of Medicine. 323 (9): 570–578. doi:10.1056/NEJM199008303230904. PMID 2381442.
- ↑ 5,0 5,1 «Gene Therapy Clinical Trials Worldwide Database». The Journal of Gene Medicine. Wiley. June 2016. Արխիվացված է օրիգինալից 31 July 2020-ին.
- ↑ Gorell E, Nguyen N, Lane A, Siprashvili Z (April 2014). «Gene therapy for skin diseases». Cold Spring Harbor Perspectives in Medicine. 4 (4): a015149. doi:10.1101/cshperspect.a015149. PMC 3968787. PMID 24692191.
- ↑ Zimmer C (16 September 2013). «DNA Double Take». The New York Times. Արխիվացված օրիգինալից 2 January 2022-ին.
- ↑ «Lorraine Kraus Obituary». The Commercial Appeal. Վերցված է 7 July 2023-ին.
- ↑ «Gene therapy». WhatIsBiotechnology.org. The Biotechnology and Medicine Education Trust (Biotechmet). Վերցված է 7 July 2023-ին.
- ↑ U.S. Congress, Office of Technology Assessment (December 1984). Human gene therapy – A background paper. DIANE Publishing. ISBN 978-1-4289-2371-3.
- ↑ Sun M (October 1982). «Martin Cline loses appeal on NIH grant». Science. 218 (4567): 37. Bibcode:1982Sci...218...37S. doi:10.1126/science.7123214. PMID 7123214.
- ↑ Lowenstein PR (2008). «Gene Therapy for Neurological Disorders: New Therapies or Human Experimentation?». In Burley J, Harris J (eds.). A Companion to Genethics. John Wiley & Sons. ISBN 978-0-470-75637-9.
- ↑ 13,0 13,1 Sheridan C (February 2011). «Gene therapy finds its niche». Nature Biotechnology. 29 (2): 121–128. doi:10.1038/nbt.1769. PMID 21301435. S2CID 5063701.
- ↑ O'Malley BW, Ledley FD (October 1993). «Somatic gene therapy. Methods for the present and future». Arch Otolaryngol Head Neck Surg. 119 (10): 1100–7. doi:10.1001/archotol.1993.01880220044007. PMID 8398061.
- ↑ Oldfield EH, Ram Z, Culver KW, Blaese RM, DeVroom HL, Anderson WF (February 1993). «Gene therapy for the treatment of brain tumors using intra-tumoral transduction with the thymidine kinase gene and intravenous ganciclovir». Human Gene Therapy. 4 (1): 39–69. doi:10.1089/hum.1993.4.1-39. PMID 8384892.
- ↑ 16,0 16,1 Richards S (6 November 2012). «Gene Therapy Arrives in Europe». The Scientist.
- ↑ 17,0 17,1 Maguire AM, Simonelli F, Pierce EA, Pugh EN, Mingozzi F, Bennicelli J, և այլք: (May 2008). «Safety and efficacy of gene transfer for Leber's congenital amaurosis». The New England Journal of Medicine. 358 (21): 2240–2248. doi:10.1056/NEJMoa0802315. PMC 2829748. PMID 18441370.
- ↑ Simonelli F, Maguire AM, Testa F, Pierce EA, Mingozzi F, Bennicelli JL, և այլք: (March 2010). «Gene therapy for Leber's congenital amaurosis is safe and effective through 1.5 years after vector administration». Molecular Therapy. 18 (3): 643–650. doi:10.1038/mt.2009.277. PMC 2839440. PMID 19953081.
- ↑ Cideciyan AV, Hauswirth WW, Aleman TS, Kaushal S, Schwartz SB, Boye SL, Windsor EA, Conlon TJ, Sumaroka A, Roman AJ, Byrne BJ, Jacobson SG (August 2009). «Vision 1 year after gene therapy for Leber's congenital amaurosis». The New England Journal of Medicine. 361 (7): 725–727. doi:10.1056/NEJMc0903652. PMC 2847775. PMID 19675341.
- ↑ Bainbridge JW, Smith AJ, Barker SS, Robbie S, Henderson R, Balaggan K, և այլք: (May 2008). «Effect of gene therapy on visual function in Leber's congenital amaurosis». The New England Journal of Medicine. 358 (21): 2231–2239. doi:10.1056/NEJMoa0802268. hdl:10261/271174. PMID 18441371.
- ↑ Ghosh P (28 April 2016). «Gene therapy reverses sight loss and is long-lasting». BBC News Online. Վերցված է 29 April 2016-ին.
- ↑ Fischer A, Hacein-Bey-Abina S, Cavazzana-Calvo M (June 2010). «20 years of gene therapy for SCID». Nature Immunology. 11 (6): 457–460. doi:10.1038/ni0610-457. PMID 20485269. S2CID 11300348.
- ↑ Ferrua F, Brigida I, Aiuti A (December 2010). «Update on gene therapy for adenosine deaminase-deficient severe combined immunodeficiency». Current Opinion in Allergy and Clinical Immunology. 10 (6): 551–556. doi:10.1097/ACI.0b013e32833fea85. PMID 20966749. S2CID 205435278.
- ↑ 24,0 24,1 Geddes L (30 October 2013). «'Bubble kid' success puts gene therapy back on track». New Scientist. Վերցված է 2 January 2022-ին.
- ↑ Cartier N, Aubourg P (July 2010). «Hematopoietic stem cell transplantation and hematopoietic stem cell gene therapy in X-linked adrenoleukodystrophy». Brain Pathology. 20 (4): 857–862. doi:10.1111/j.1750-3639.2010.00394.x. PMC 8094635. PMID 20626747. S2CID 24182017.
- ↑ Ledford H (2011). «Cell therapy fights leukaemia». Nature. doi:10.1038/news.2011.472.
- ↑ Coghlan A (26 March 2013). «Gene therapy cures leukaemia in eight days». The New Scientist. Վերցված է 15 April 2013-ին.
- ↑ Coghlan A (11 December 2013). «Souped-up immune cells force leukaemia into remission». New Scientist. Վերցված է 15 April 2013-ին.
- ↑ LeWitt PA, Rezai AR, Leehey MA, Ojemann SG, Flaherty AW, Eskandar EN, և այլք: (April 2011). «AAV2-GAD gene therapy for advanced Parkinson's disease: a double-blind, sham-surgery controlled, randomised trial». The Lancet. Neurology. 10 (4): 309–319. doi:10.1016/S1474-4422(11)70039-4. PMID 21419704. S2CID 37154043.
- ↑ Herper M (26 March 2014). «Gene Therapy's Big Comeback». Forbes. Վերցված է 28 April 2014-ին.
- ↑ Pearson S, Jia H, Kandachi K (January 2004). «China approves first gene therapy». Nature Biotechnology. 22 (1): 3–4. doi:10.1038/nbt0104-3. PMC 7097065. PMID 14704685.
- ↑ «Gene Therapy for PAD Approved». 6 December 2011. Վերցված է 5 August 2015-ին.
- ↑ 33,0 33,1 Gallagher J (2 November 2012). «Gene therapy: Glybera approved by European Commission». BBC News. Վերցված է 15 December 2012-ին.
- ↑ «What is gene therapy?». Genetics Home Reference. 28 March 2016. Արխիվացված է օրիգինալից 6 April 2016-ին. Վերցված է 2 January 2022-ին.
- ↑ «How does gene therapy work?». Genomics Home Reference. U.S. National Library of Medicine.
- ↑ Pezzoli D, Chiesa R, De Nardo L, Candiani G (September 2012). «We still have a long way to go to effectively deliver genes!». Journal of Applied Biomaterials & Functional Materials. 10 (2): 82–91. doi:10.5301/JABFM.2012.9707. PMID 23015375. S2CID 6283455.
- ↑ Vannucci L, Lai M, Chiuppesi F, Ceccherini-Nelli L, Pistello M (January 2013). «Viral vectors: a look back and ahead on gene transfer technology». The New Microbiologica. 36 (1): 1–22. PMID 23435812.
- ↑ Gothelf A, Gehl J (November 2012). «What you always needed to know about electroporation based DNA vaccines». Human Vaccines & Immunotherapeutics. 8 (11): 1694–1702. doi:10.4161/hv.22062. PMC 3601144. PMID 23111168.
- ↑ Urnov FD, Rebar EJ, Holmes MC, Zhang HS, Gregory PD (September 2010). «Genome editing with engineered zinc finger nucleases». Nature Reviews Genetics. 11 (9): 636–646. doi:10.1038/nrg2842. PMID 20717154. S2CID 205484701.
- ↑ 40,0 40,1 Bak RO, Gomez-Ospina N, Porteus MH (August 2018). «Gene Editing on Center Stage». Trends in Genetics. 34 (8): 600–611. doi:10.1016/j.tig.2018.05.004. PMID 29908711. S2CID 49269023.
- ↑ Stone D, Niyonzima N, Jerome KR (September 2016). «Genome editing and the next generation of antiviral therapy». Human Genetics. 135 (9): 1071–82. doi:10.1007/s00439-016-1686-2. PMC 5002242. PMID 27272125.
- ↑ Cross D, Burmester JK (September 2006). «Gene therapy for cancer treatment: past, present and future». Clinical Medicine & Research. 4 (3): 218–27. doi:10.3121/cmr.4.3.218. PMC 1570487. PMID 16988102.
- ↑ Maeder ML, Gersbach CA (March 2016). «Genome-editing Technologies for Gene and Cell Therapy». Molecular Therapy. 24 (3): 430–46. doi:10.1038/mt.2016.10. PMC 4786923. PMID 26755333.
- ↑ «Tests suggest scientists achieved 1st 'in body' gene editing». AP NEWS. 7 February 2019. Վերցված է 17 November 2020-ին.
- ↑ «First CRISPR therapy dosed». Nature Biotechnology. 38 (4): 382. 1 April 2020. doi:10.1038/s41587-020-0493-4. ISSN 1546-1696. PMID 32265555. S2CID 215406440.
- ↑ 46,0 46,1 Sherkow JS, Zettler PJ, Greely HT (December 2018). «Is it 'gene therapy'?». Journal of Law and the Biosciences. 5 (3): 786–793. doi:10.1093/jlb/lsy020. PMC 6534757. PMID 31143463.
- ↑ Asaleh A, Zhou J, Rahmanian N (November 2022). «Letter to the Editor: A Lesson for the Future-How Semantic Ambiguity Led to the Spread of Anti-Scientific Attitudes About COVID-19 mRNA Vaccines». Human Gene Therapy. 33 (21–22): 1213–1216. doi:10.1089/hum.2022.29223.aas (inactive 31 January 2024). PMID 36375123.
{{cite journal}}: CS1 սպաս․ DOI inactive as of Հունվար 2024 (link) - ↑ «Andrew Bridgen wrong to call mRNA vaccines gene therapy». Full Fact (անգլերեն). 2023-01-12. Վերցված է 2023-02-19-ին.
- ↑ «Fact Check-mRNA vaccines are distinct from gene therapy, which alters recipient's genes». Reuters (անգլերեն). 2021-08-10. Վերցված է 2023-02-19-ին.
- ↑ «Joe Rogan falsely says mRNA vaccines are 'gene therapy'». PolitiFact (ամերիկյան անգլերեն). Վերցված է 2023-02-19-ին.
- ↑ Spencer SH (2022-06-28). «Website Peddles Old, Debunked Falsehood About COVID-19 mRNA Vaccines». FactCheck.org (ամերիկյան անգլերեն). Վերցված է 2023-02-19-ին.
- ↑ «These experts say Joe Rogan is 'extraordinarily dangerous' to society – here's why». The Independent (անգլերեն). 2022-02-02. Վերցված է 2023-02-19-ին.
- ↑ «Andrew Bridgen MP's false claims put lives at risk». Full Fact (անգլերեն). 2023-01-11. Վերցված է 2023-02-19-ին.
- ↑ 54,0 54,1 54,2 54,3 54,4 Nóbrega C, Mendonça L, Matos CA (2020). A handbook of gene and cell therapy. Cham: Springer. ISBN 978-3-030-41333-0. OCLC 1163431307.
- ↑ Williams DA, Orkin SH (April 1986). «Somatic gene therapy. Current status and future prospects». The Journal of Clinical Investigation. 77 (4): 1053–6. doi:10.1172/JCI112403. PMC 424438. PMID 3514670.
- ↑ Mavilio F, Ferrari G (July 2008). «Genetic modification of somatic stem cells. The progress, problems and prospects of a new therapeutic technology». EMBO Reports. 9 (Suppl 1): S64–69. doi:10.1038/embor.2008.81. PMC 3327547. PMID 18578029.
- ↑ 57,0 57,1 57,2 «International Law». The Genetics and Public Policy Center, Johns Hopkins University Berman Institute of Bioethics. 2010. Արխիվացված է օրիգինալից 2 September 2014-ին.
- ↑ Strachnan T, Read AP (2004). Human Molecular Genetics (3rd ed.). Garland Publishing. էջ 616. ISBN 978-0-8153-4184-0.
- ↑ Hanna K (2006). «Germline Gene Transfer». National Human Genome Research Institute.
- ↑ «Human Cloning and Genetic Modification». Association of Reproductive Health Officials. 2013. Արխիվացված է օրիգինալից 18 June 2013-ին.
- ↑ «Gene Therapy». ama-assn.org. 4 April 2014. Արխիվացված է օրիգինալից 15 March 2015-ին. Վերցված է 22 March 2015-ին.
- ↑ «Gene & Cell Therapy FAQs | ASGCT - American Society of Gene & Cell Therapy | ASGCT - American Society of Gene & Cell Therapy». asgct.org. Վերցված է 23 July 2021-ին.
- ↑ «Evaluation of the Clinical Success of Ex Vivo and In Vivo Gene Therapy». Journal of Young Investigators. January 2009. Վերցված է 23 July 2021-ին.
- ↑ «Challenges In Gene Therapy». learn.genetics.utah.edu. Վերցված է 23 July 2021-ին.
- ↑ Mullard A (June 2020). «Gene-editing pipeline takes off». Nature Reviews. Drug Discovery. 19 (6): 367–372. doi:10.1038/d41573-020-00096-y. PMID 32415249. S2CID 218657910.
- ↑ MacLaren RE, Groppe M, Barnard AR, Cottriall CL, Tolmachova T, Seymour L, Clark KR, During MJ, Cremers FP, Black GC, Lotery AJ, Downes SM, Webster AR, Seabra MC (March 2014). «Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial». Lancet. 383 (9923): 1129–1137. doi:10.1016/S0140-6736(13)62117-0. PMC 4171740. PMID 24439297.
- ↑ Dever DP, Bak RO, Reinisch A, Camarena J, Washington G, Nicolas CE, և այլք: (November 2016). «CRISPR/Cas9 β-globin gene targeting in human haematopoietic stem cells». Nature. 539 (7629): 384–389. Bibcode:2016Natur.539..384D. doi:10.1038/nature20134. PMC 5898607. PMID 27820943.
- ↑ Gupta RM, Musunuru K (October 2014). «Expanding the genetic editing tool kit: ZFNs, TALENs, and CRISPR-Cas9». The Journal of Clinical Investigation. 124 (10): 4154–61. doi:10.1172/JCI72992. PMC 4191047. PMID 25271723.
- ↑ Sanches-da-Silva GN, Medeiros LF, Lima FM (21 August 2019). «The Potential Use of the CRISPR-Cas System for HIV-1 Gene Therapy». International Journal of Genomics. 2019: 8458263. doi:10.1155/2019/8458263. PMC 6721108. PMID 31531340.
- ↑ Patent: US7824869B2
- ↑ Bi A, Cui J, Ma YP, Olshevskaya E, Pu M, Dizhoor AM, Pan ZH (April 2006). «Ectopic expression of a microbial-type rhodopsin restores visual responses in mice with photoreceptor degeneration». Neuron. 50 (1): 23–33. doi:10.1016/j.neuron.2006.02.026. PMC 1459045. PMID 16600853.
- ↑ 72,0 72,1 Song, Xiangrong; Liu, Chao; Wang, Ning; Huang, Hai; He, Siyan; Gong, Changyang; Wei, Yuquan (2021-01-01). «Delivery of CRISPR/Cas systems for cancer gene therapy and immunotherapy». Advanced Drug Delivery Reviews. Delivery of Biomacromolecules for Therapeutic Genome Editing (անգլերեն). 168: 158–180. doi:10.1016/j.addr.2020.04.010. ISSN 0169-409X. PMID 32360576. S2CID 218493473.
- ↑ Nayerossadat N, Maedeh T, Ali PA (2012). «Viral and nonviral delivery systems for gene delivery». Advanced Biomedical Research. 1 (1): 27. doi:10.4103/2277-9175.98152. PMC 3507026. PMID 23210086.
- ↑ 74,0 74,1 74,2 74,3 74,4 74,5 Ginn SL, Amaya AK, Alexander IE, Edelstein M, Abedi MR (May 2018). «Gene therapy clinical trials worldwide to 2017: An update». The Journal of Gene Medicine. 20 (5): e3015. doi:10.1002/jgm.3015. PMID 29575374. S2CID 4966300.
- ↑ 75,0 75,1 Bulcha JT, Wang Y, Ma H, Tai PW, Gao G (February 2021). «Viral vector platforms within the gene therapy landscape». Signal Transduction and Targeted Therapy. 6 (1): 53. doi:10.1038/s41392-021-00487-6. PMC 7868676. PMID 33558455.
- ↑ Jensen, Thomas Leth; Gøtzsche, Casper René; Woldbye, David P. D. (2021). «Current and Future Prospects for Gene Therapy for Rare Genetic Diseases Affecting the Brain and Spinal Cord». Frontiers in Molecular Neuroscience. 14: 695937. doi:10.3389/fnmol.2021.695937. ISSN 1662-5099. PMC 8527017. PMID 34690692.
- ↑ Manini A, Abati E, Nuredini A, Corti S, Comi GP (2022). «Adeno-Associated Virus (AAV)-Mediated Gene Therapy for Duchenne Muscular Dystrophy: The Issue of Transgene Persistence». Frontiers in Neurology. 12: 814174. doi:10.3389/fneur.2021.814174. PMC 8797140. PMID 35095747.
- ↑ 78,0 78,1 78,2 Sabatino DE, Bushman FD, Chandler RJ, Crystal RG, Davidson BL, Dolmetsch R, և այլք: (August 2022). «Evaluating the state of the science for adeno-associated virus integration: An integrated perspective». Molecular Therapy (English). 30 (8): 2646–2663. doi:10.1016/j.ymthe.2022.06.004. PMC 9372310. PMID 35690906.
{{cite journal}}: CS1 սպաս․ չճանաչված լեզու (link) - ↑ Yin H, Kanasty RL, Eltoukhy AA, Vegas AJ, Dorkin JR, Anderson DG (August 2014). «Non-viral vectors for gene-based therapy». Nature Reviews. Genetics. 15 (8): 541–555. doi:10.1038/nrg3763. PMID 25022906. S2CID 15273455.
- ↑ Bertrand N, Grenier P, Mahmoudi M, Lima EM, Appel EA, Dormont F, և այլք: (October 2017). «Mechanistic understanding of in vivo protein corona formation on polymeric nanoparticles and impact on pharmacokinetics». Nature Communications. 8 (1): 777. Bibcode:2017NatCo...8..777B. doi:10.1038/s41467-017-00600-w. PMC 5626760. PMID 28974673.
- ↑ 81,0 81,1 81,2 Goswami R, Subramanian G, Silayeva L, Newkirk I, Doctor D, Chawla K, և այլք: (2019-04-24). «Gene Therapy Leaves a Vicious Cycle». Frontiers in Oncology. 9: 297. doi:10.3389/fonc.2019.00297. PMC 6491712. PMID 31069169.
- ↑ Wirth T, Parker N, Ylä-Herttuala S (August 2013). «History of gene therapy». Gene. 525 (2): 162–169. doi:10.1016/j.gene.2013.03.137. PMID 23618815.
- ↑ Singh V, Khan N, Jayandharan GR (May 2022). «Vector engineering, strategies and targets in cancer gene therapy». Cancer Gene Therapy. 29 (5): 402–417. doi:10.1038/s41417-021-00331-7. PMID 33859378. S2CID 233258994.
- ↑ Anguela XM, High KA (January 2019). «Entering the Modern Era of Gene Therapy». Annual Review of Medicine. 70 (1): 273–288. doi:10.1146/annurev-med-012017-043332. PMID 30477394. S2CID 53750215.
- ↑ Wang Y, Zhang R, Tang L, Yang L (February 2022). «Nonviral Delivery Systems of mRNA Vaccines for Cancer Gene Therapy». Pharmaceutics. 14 (3): 512. doi:10.3390/pharmaceutics14030512. PMC 8949480. PMID 35335891.
- ↑ Monga I, Qureshi A, Thakur N, Gupta AK, Kumar M (September 2017). «ASPsiRNA: A Resource of ASP-siRNAs Having Therapeutic Potential for Human Genetic Disorders and Algorithm for Prediction of Their Inhibitory Efficacy». G3. 7 (9): 2931–2943. doi:10.1534/g3.117.044024. PMC 5592921. PMID 28696921.
- ↑ 87,0 87,1 Olowoyeye A, Okwundu CI (November 2020). «Gene therapy for sickle cell disease». The Cochrane Database of Systematic Reviews. 2020 (11): CD007652. doi:10.1002/14651858.CD007652.pub7. PMC 8275984. PMID 33251574.
- ↑ Chen W, Hu Y, Ju D (August 2020). «Gene therapy for neurodegenerative disorders: advances, insights and prospects». Acta Pharmaceutica Sinica B. 10 (8): 1347–1359. doi:10.1016/j.apsb.2020.01.015. PMC 7488363. PMID 32963936.
- ↑ Guo, Congting; Ma, Xiaoteng; Gao, Fei; Guo, Yuxuan (2023-03-09). «Off-target effects in CRISPR/Cas9 gene editing». Frontiers in Bioengineering and Biotechnology. 11: 1143157. doi:10.3389/fbioe.2023.1143157. ISSN 2296-4185. PMC 10034092. PMID 36970624.
- ↑ Wu, Shao-Shuai; Li, Qing-Cui; Yin, Chang-Qing; Xue, Wen; Song, Chun-Qing (2020-03-15). «Advances in CRISPR/Cas-based Gene Therapy in Human Genetic Diseases». Theranostics. 10 (10): 4374–4382. doi:10.7150/thno.43360. ISSN 1838-7640. PMC 7150498. PMID 32292501.
- ↑ Korthof G. «The implications of Steele's soma-to-germline feedback for human gene therapy».
- ↑ Woods NB, Bottero V, Schmidt M, von Kalle C, Verma IM (April 2006). «Gene therapy: therapeutic gene causing lymphoma». Nature. 440 (7088): 1123. Bibcode:2006Natur.440.1123W. doi:10.1038/4401123a. PMID 16641981. S2CID 4372110.
- ↑ Thrasher AJ, Gaspar HB, Baum C, Modlich U, Schambach A, Candotti F, և այլք: (September 2006). «Gene therapy: X-SCID transgene leukaemogenicity». Nature. 443 (7109): E5-6, discussion E6-7. Bibcode:2006Natur.443E...5T. doi:10.1038/nature05219. PMID 16988659. S2CID 4301764.
- ↑ Bak RO, Porteus MH (July 2017). «CRISPR-Mediated Integration of Large Gene Cassettes Using AAV Donor Vectors». Cell Reports. 20 (3): 750–756. doi:10.1016/j.celrep.2017.06.064. PMC 5568673. PMID 28723575.
- ↑ Rojahn SY (11 February 2014). «Genome Surgery». MIT Technology Review. Արխիվացված է օրիգինալից 15 February 2014-ին. Վերցված է 17 February 2014-ին.
- ↑ «Gene therapy needs a hero to live up to the hype». New Scientist. 30 October 2013. Վերցված է 2 January 2022-ին.
- ↑ Crasto AM (7 July 2013). «Glybera – The Most Expensive Drug in the world & First Approved Gene Therapy in the West». All About Drugs. Վերցված է 2 November 2013-ին.
- ↑ «Gene Therapy». Oak Ridge National Laboratory. 20 December 2012. Արխիվացված է օրիգինալից 20 December 2012-ին. Վերցված է 2 January 2022-ին.
- ↑ Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP, և այլք: (September 2003). «Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient patient following adenoviral gene transfer». Molecular Genetics and Metabolism. 80 (1–2): 148–58. doi:10.1016/j.ymgme.2003.08.016. PMID 14567964.
- ↑ Frank KM, Hogarth DK, Miller JL, Mandal S, Mease PJ, Samulski RJ, և այլք: (July 2009). «Investigation of the cause of death in a gene-therapy trial». The New England Journal of Medicine. 361 (2): 161–9. doi:10.1056/NEJMoa0801066. PMID 19587341.
- ↑ HUGO Ethics Committee (April 2001). «Statement on Gene Therapy Research» (PDF). Human Genome Organization. Արխիվացված է օրիգինալից (PDF) 7 September 2008-ին.
- ↑ Isasi RM, Nguyen TM, Knoppers BM (October 2006). «National Regulatory Frameworks Regarding Human Genetic Modification Technologies (Somatic and Germline Modification)» (PDF). Genetics & Public Policy Center. Արխիվացված է օրիգինալից (PDF) 17 September 2014-ին.
- ↑ «Home - NIH Genetic Testing Registry (GTR) - NCBI». www.ncbi.nlm.nih.gov. Վերցված է 2 May 2022-ին.
- ↑ 104,0 104,1 «NIH Guidelines for Research Involving Recombinant or Synthetic Nucleic Acid Molecules». U.S. National Institutes of Health. April 2016. Արխիվացված է օրիգինալից 28 May 2016-ին.
- ↑ «Read the Belmont Report». HHS.gov. 15 January 2018. Վերցված է 2 January 2022-ին.
- ↑ U.S. Food and Drug Administration (14 October 1993). «Application of Current Statutory Authorities to Human Somatic Cell Therapy Products and Gene Therapy Products» (PDF). Federal Register. 58 (197). Արխիվացված (PDF) օրիգինալից 21 June 2009-ին.
- ↑ «Guidance for Industry: Guidance for Human Somatic Cell Therapy and Gene Therapy». fda.gov. 9 July 2009. Արխիվացված է օրիգինալից 9 July 2009-ին. Վերցված է 2 January 2022-ին.
- ↑ «WADA Gene Doping». WADA. Արխիվացված է օրիգինալից 21 November 2009-ին. Վերցված է 27 September 2013-ին.
- ↑ Kayser B, Mauron A, Miah A (March 2007). «Current anti-doping policy: a critical appraisal». BMC Medical Ethics. 8: 2. doi:10.1186/1472-6939-8-2. PMC 1851967. PMID 17394662.
- ↑ Powell R, Buchanan A (February 2011). «Breaking evolution's chains: the prospect of deliberate genetic modification in humans». The Journal of Medicine and Philosophy. 36 (1): 6–27. doi:10.1093/jmp/jhq057. PMID 21228084.
- ↑ Baylis F, Robert JS (2004). «The inevitability of genetic enhancement technologies». Bioethics. 18 (1): 1–26. doi:10.1111/j.1467-8519.2004.00376.x. PMID 15168695.
- ↑ Evans J (2002). Playing God?: Human Genetic Engineering and the Rationalization of Public Bioethical Debate. University of Chicago Press. ISBN 978-0-226-22262-2.
- ↑ «The Center for Health Ethics - University of Missouri School of Medicine - Gene Therapy and Genetic Engineering». ethics.missouri.edu. 3 December 2013. Արխիվացված է օրիգինալից 3 December 2013-ին. Վերցված է 2 January 2022-ին.
- ↑ Roco MC, Bainbridge WS (2002). «Converging Technologies for Improving Human Performance: Integrating From the Nanoscale». Journal of Nanoparticle Research. 4 (4): 281–295. Bibcode:2002JNR.....4..281R. doi:10.1023/A:1021152023349. S2CID 136290217.
- ↑ Allhoff F (March 2005). «Germ-line genetic enhancement and Rawlsian primary goods» (PDF). Kennedy Institute of Ethics Journal. 15 (1): 39–56. CiteSeerX 10.1.1.566.171. doi:10.1353/ken.2005.0007. PMID 15881795. S2CID 14432440. Արխիվացված (PDF) օրիգինալից 30 January 2012-ին.
- ↑ Ranisch R (January 2020). «Special Issue:Human Germline Editing». Bioethics. 34 (1): 1–143.
- ↑ «Ethical issues related to prenatal genetic testing. The Council on Ethical and Judicial Affairs, American Medical Association». Archives of Family Medicine. 3 (7): 633–642. July 1994. doi:10.1001/archfami.3.7.633. PMID 7921302.
- ↑ «The Declaration of Inuyama: Human Genome Mapping, Genetic Screening and Gene Therapy». Council for International Organizations of Medical Sciences. Արխիվացված է օրիգինալից 5 August 2001-ին.
- ↑ Smith KR, Chan S, Harris J (October 2012). «Human germline genetic modification: scientific and bioethical perspectives». Archives of Medical Research. 43 (7): 491–513. doi:10.1016/j.arcmed.2012.09.003. PMID 23072719.
- ↑ Reardon S (14 February 2017). «US science advisers outline path to genetically modified babies». Nature. doi:10.1038/nature.2017.21474.
- ↑ Wade N (19 March 2015). «Scientists Seek Ban on Method of Editing the Human Genome». The New York Times. Արխիվացված օրիգինալից 2 January 2022-ին. Վերցված է 20 March 2015-ին.
- ↑ Pollack A (3 March 2015). «A Powerful New Way to Edit DNA». The New York Times. Արխիվացված օրիգինալից 2 January 2022-ին. Վերցված է 20 March 2015-ին.
- ↑ Baltimore D, Berg P, Botchan M, Carroll D, Charo RA, Church G, և այլք: (April 2015). «Biotechnology. A prudent path forward for genomic engineering and germline gene modification». Science. 348 (6230): 36–38. Bibcode:2015Sci...348...36B. doi:10.1126/science.aab1028. PMC 4394183. PMID 25791083.
- ↑ Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (March 2015). «Don't edit the human germ line». Nature. 519 (7544): 410–411. Bibcode:2015Natur.519..410L. doi:10.1038/519410a. PMID 25810189.
- ↑ Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, և այլք: (May 2015). «CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes». Protein & Cell. 6 (5): 363–372. doi:10.1007/s13238-015-0153-5. PMC 4417674. PMID 25894090.
- ↑ Kolata G (23 April 2015). «Chinese Scientists Edit Genes of Human Embryos, Raising Concerns». The New York Times. Արխիվացված օրիգինալից 2 January 2022-ին. Վերցված է 24 April 2015-ին.
- ↑ Harmon A (14 February 2017). «Human Gene Editing Receives Science Panel's Support». The New York Times. ISSN 0362-4331. Արխիվացված օրիգինալից 2 January 2022-ին. Վերցված է 17 February 2017-ին.
- ↑ Committee on Human Gene Editing: Scientific, Medical, and Ethical Considerations . «Human Genome Editing: Science, Ethics, and Governance». nationalacademies.org. National Academy of Sciences; National Academy of Medicine. Վերցված է 21 February 2017-ին.
- ↑ «Scientists OK genetically engineering babies». New York Post. Reuters. 14 February 2017. Վերցված է 17 February 2017-ին.
- ↑ «FDA approves axicabtagene ciloleucel for large B-cell lymphoma». U.S. Food and Drug Administration (FDA). Վերցված է 5 January 2018-ին.
- ↑ Zayner J (6 October 2017). «DIY Human CRISPR Myostatin Knock-Out». Youtube. Արխիվացված է օրիգինալից 11 November 2017-ին. Վերցված է 20 May 2020-ին.
- ↑ Zayner J. «The First Attempt At Human CRISPR Gene Editing». Վերցված է 20 May 2020-ին.
- ↑ «AP Exclusive: US scientists try 1st gene editing in the body». AP NEWS. 15 November 2017. Վերցված է 17 November 2020-ին.
- ↑ Kaiser J (November 2017). «A human has been injected with gene-editing tools to cure his disabling disease. Here's what you need to know». Science. doi:10.1126/science.aar5098.
- ↑ Zhang S (15 November 2017). «The First Man to Have His Genes Edited Inside His Body». The Atlantic. Վերցված է 17 November 2020-ին.
- ↑ Ledford H (5 September 2018). «First test of in-body gene editing shows promise». Nature. doi:10.1038/d41586-018-06195-6. S2CID 92840885.
- ↑ Marchione M (7 February 2019). «Tests suggest scientists achieved 1st 'in body' gene editing». AP News. Վերցված է 7 February 2019-ին.
- ↑ Staff (2 February 2019). «Ascending Dose Study of Genome Editing by the Zinc Finger Nuclease (ZFN) Therapeutic SB-913 in Subjects With MPS II». ClinicalTrials.gov. U.S. National Library of Medicine. Վերցված է 7 February 2019-ին.
- ↑ Rangarajan S, Walsh L, Lester W, Perry D, Madan B, Laffan M, և այլք: (December 2017). «AAV5-Factor VIII Gene Transfer in Severe Hemophilia A». The New England Journal of Medicine. 377 (26): 2519–2530. doi:10.1056/nejmoa1708483. hdl:10044/1/57163. PMID 29224506.
- ↑ van den Berg HM (December 2017). «A Cure for Hemophilia within Reach». The New England Journal of Medicine. 377 (26): 2592–2593. doi:10.1056/nejme1713888. PMID 29224412.
- ↑ Herper M (2 January 2018). «Spark Therapeutics Sets Price Of Blindness-Treating Gene Therapy At $850,000». Forbes. Վերցված է 4 January 2018-ին.
- ↑ Sheridan K (19 December 2017). «The FDA approved a gene therapy to treat blindness in a groundbreaking moment for DNA-based medicine». Newsweek. Վերցված է 20 December 2017-ին.
Հետագա ընթերցում
[խմբագրել | խմբագրել կոդը]- «Gene Therapy: An Overview of Approved and Pipeline Technologies» (PDF). CADTH (171). March 2018. Արխիվացված (PDF) օրիգինալից 19 October 2018-ին.
- Baum C, Düllmann J, Li Z, Fehse B, Meyer J, Williams DA, von Kalle C (March 2003). «Side effects of retroviral gene transfer into hematopoietic stem cells». Blood. 101 (6): 2099–2114. doi:10.1182/blood-2002-07-2314. PMID 12511419. S2CID 8489829.
- Daley J (January 2020). «Gene Therapy Arrives: After false starts, drugs that manipulate the code of life are finally changing lives». Scientific American. 322 (1).
- Gardlík R, Pálffy R, Hodosy J, Lukács J, Turna J, Celec P (April 2005). «Vectors and delivery systems in gene therapy». Medical Science Monitor. 11 (4): RA110–121. PMID 15795707.
- Horn PA, Morris JC, Neff T, Kiem HP (September 2004). «Stem cell gene transfer – efficacy and safety in large animal studies». Molecular Therapy. 10 (3): 417–431. doi:10.1016/j.ymthe.2004.05.017. PMID 15336643.
- Parambi DG, Alharbi KS, Kumar R, Harilal S, Batiha GE, Cruz-Martins N, Magdy O, Musa A, Panda DS, Mathew B (October 2021). «Gene Therapy Approach with an Emphasis on Growth Factors: Theoretical and Clinical Outcomes in Neurodegenerative Diseases». Molecular Neurobiology. 59 (1): 191–233. doi:10.1007/s12035-021-02555-y. PMC 8518903. PMID 34655056.
- Salmons B, Günzburg WH (April 1993). «Targeting of retroviral vectors for gene therapy». Human Gene Therapy. 4 (2): 129–141. doi:10.1089/hum.1993.4.2-129. PMID 8494923.
- Staff (18 November 2005). «Gene Therapy». Human Genome Project Information. Oak Ridge National Laboratory. Արխիվացված է օրիգինալից (FAQ) 27 April 2006-ին. Վերցված է 28 May 2006-ին.
- Tinkov S, Bekeredjian R, Winter G, Coester C (20 November 2000). «Polyplex-conjugated microbubbles for enhanced ultrasound targeted gene therapy» (PDF). Georgia World Congress Center, Atlanta, GA: 2008 AAPS Annual Meeting and Exposition. Արխիվացված է օրիգինալից (PDF) 7 July 2012-ին. Վերցված է 26 January 2009-ին.
- Wang H, Shayakhmetov DM, Leege T, Harkey M, Li Q, Papayannopoulou T, Stamatoyannopolous G, Lieber A (September 2005). «A capsid-modified helper-dependent adenovirus vector containing the beta-globin locus control region displays a nonrandom integration pattern and allows stable, erythroid-specific gene expression». Journal of Virology. 79 (17): 10999–11013. doi:10.1128/JVI.79.17.10999-11013.2005. PMC 1193620. PMID 16103151.
External links
[խմբագրել | խմբագրել կոդը]
Կաղապար:Genetic engineering
Կաղապար:Emerging technologies
Կաղապար:Biotechnology
Կաղապար:Longevity


