Վիքիպեդիայից՝ ազատ հանրագիտարանից
Նատրիումի հեքսաֆտորոալյումինատ Ընդհանուր տեղեկություններ Դասական անվանակարգում նատրիումի հեքսաֆտորոալյումինատ(III) Ավանդական անվանում ալյումին-նատրիումի ֆտորիդ Քիմիական բանաձև AlF₆Na₃ Ֆիզիկական հատկություններ Ագրեգատային վիճակ պինդ Մոլային զանգված 3,5E−25 կիլոգրամ [1] մոլ Խտություն 2,9 ± 0,01 գ/սմ³ [2] Հալման ջերմաստիճան 1832 ± 1 ℉ [2] Գոյացան էնթալպիա −3312 կՋ/մոլ Գոլորշու ճնշում 0 ± 1 mm Hg [2] Քիմիական հատկություններ Բեկման ցուցիչ 1,3389 Դասակարգում CAS համար 13775-53-6 PubChem 16693908 EINECS համար 237-410-6 SMILES F[Al-3](F)(F)(F)(F)F.[Na+].[Na+].[Na+] ЕС 237-410-6 RTECS WA9625000 ChEBI 11431435, 140411 IDLH 250 ± 10 mg/m³ [2] Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա)
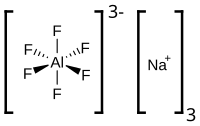
Նատրիումի հեքսաֆտորոալյումինատ(III) , անօրգանական նյութ, ֆտորաջրածնի , ալյումինի և նատրիումի խառև աղն է՝ Na3 [AlF6 ] քիմիական բանաձևով։ Անգույն բյուրեղները վատ են լուծվում ջրում ։
Բնության մեջ հազվադեպ է հանդիպում կրիոլիտ մետաղը , որը պատկանում է ֆտորիդների խմբին, քիմիական բաղադրությունը Na3 [AlF6 ]
Ստացվում է նատրիումի ֆտորիդի և ալյումինի ֆտորիդի խիտ լուծույթների փոխազդեցությունից.
։
3
N
a
F
+
A
l
F
3
→
N
a
3
[
A
l
F
6
]
↓
{\displaystyle {\mathsf {3NaF+AlF_{3}\ {\xrightarrow {\ }}\ Na_{3}[AlF_{6}]\downarrow }}}
Պլավիկյան թթվի ազդեցությամբ նատրիումի հիդրօքսիդի և նատրիումի ֆտորիդի փոխազդեցությունից.
։
3
N
a
F
+
A
l
(
O
H
)
3
→
3
H
2
O
+
N
a
3
[
A
l
F
6
]
↓
{\displaystyle {\mathsf {3NaF+Al(OH)_{3}\ {\xrightarrow {\ }}\ 3H_{2}O+Na_{3}[AlF_{6}]\downarrow }}}
Փոխանակային ռեակցիաներով.
։
A
l
F
3
+
3
N
H
4
F
+
3
N
a
N
O
3
→
3
N
H
4
N
O
3
+
N
a
3
[
A
l
F
6
]
↓
{\displaystyle {\mathsf {AlF_{3}+3NH_{4}F+3NaNO_{3}\ {\xrightarrow {\ }}\ 3NH_{4}NO_{3}+Na_{3}[AlF_{6}]\downarrow }}}
։
A
l
2
(
S
O
4
)
3
+
12
N
a
F
→
3
N
a
2
S
O
4
+
2
N
a
3
[
A
l
F
6
]
↓
{\displaystyle {\mathsf {Al_{2}(SO_{4})_{3}+12NaF\ {\xrightarrow {\ }}\ 3Na_{2}SO_{4}+2Na_{3}[AlF_{6}]\downarrow }}}
Դիսոցվում է.
։
N
a
3
[
A
l
F
6
]
←
→
1000
o
C
3
N
a
+
+
[
A
l
F
6
]
3
−
{\displaystyle {\mathsf {Na_{3}[AlF_{6}]\ {\stackrel {\xrightarrow {1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ \ }]{}}}\ 3Na^{+}+[AlF_{6}]^{3-}}}}
Հետագա տաքացման ընթացքում սկսում է քայքայվել
։
[
A
l
F
6
]
3
−
←
→
>
1000
o
C
[
A
l
F
4
]
−
+
2
F
−
{\displaystyle {\mathsf {[AlF_{6}]^{3-}\ {\stackrel {\xrightarrow {>1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ \ \ }]{}}}\ [AlF_{4}]^{-}+2F^{-}}}}
Փոխազդում է կոնցենտրիկ թթուների հետ.
։
2
N
a
3
[
A
l
F
6
]
+
9
H
2
S
O
4
→
6
N
a
H
S
O
4
+
A
l
2
(
S
O
4
)
3
+
12
H
F
↑
{\displaystyle {\mathsf {2Na_{3}[AlF_{6}]+9H_{2}SO_{4}\ {\xrightarrow {\ }}\ 6NaHSO_{4}+Al_{2}(SO_{4})_{3}+12HF\uparrow }}}
և հիմքերի հետ
։
N
a
3
[
A
l
F
6
]
+
4
N
a
O
H
→
N
a
[
A
l
(
O
H
)
4
]
+
6
N
a
F
{\displaystyle {\mathsf {Na_{3}[AlF_{6}]+4NaOH\ {\xrightarrow {\ }}\ Na[Al(OH)_{4}]+6NaF}}}
Лидин Р.А. и др. Химические свойства неорганических веществ։ Учеб. пособие для вузов.-3-е изд., испр.-М.։ Химия, 2000.-480 с.
Химическая энциклопедия / Редкол.։ Кнунянц И.Л. и др..-М.։ Советская энциклопедия, 1988.-Т. 1.-623 с.
Справочник химика / Редкол.։ Никольский Б.П. и др.-2-е изд., испр.-М.-Л.։ Химия, 1966.-Т. 1.-1072 с.
Рипан Р., Четяну И. Неорганическая химия. Химия металлов.-М.։ Мир, 1971.-Т. 1.-561 с. (LiAlO
2 ) • (NaAlO
2 ) • (Ca[AlH
4 ]
2 ) • (LiAlH
4 ) • Ալյումինասիլիկատներ • (AlSb) • (AlAsO
4 ) • (AlAs) • (Al(CH
3 COO)
3 ) • (AlBr
3 ) • ((NH
3 )
3 [AlF
6 ]) •
Նատրիումի հեքսաֆտորալյումինատ (Na
3 [AlF
6 ]) • (AlH
3 ) • (Al(OH)
3 ) • (AlB
2 ) • (AlB
12 ) • (AlI
3 ) • (Al
4 C
3 ) • (AlO(OH)) • (Al
2 (MoO
4 )
3 ) • (AlO) • (AlF) • (AlCl) • (Al(NO
3 )
3 ) • (AlN) •
Ալյումինի օքսիդ (Al
2 O
3 ) • (AlON) • (Al
2 Se
3 ) • (Al
2 O
3 ·SiO
2 ) • (Al
2 (SO
4 )
3 ) • (NH
4 Al(SO
4 )
2 ) • (KAl(SO
4 )
2 ) • (NaAl(SO
4 )
2 ) • (RbAl(SO
4 )
2 ) • (TlAl(SO
4 )
2 ) • (CsAl(SO
4 )
2 ) • (Al
2 S
3 ) • (Na[AlH
4 ]) • (K[AlH
4 ]) • (Cs[AlH
4 ]) • (Al(C
4 H
9 )
3 ) • (Al(CH
3 )
3 ) • (Al(C
6 H
5 )
3 ) • (AlF
3 ) • (Al(C
2 H
5 )
3 ) • (AlPO
4 ) • (AlP) • (Al(ClO
3 )
3 ) •
Ալյումինի հիդրօքսիդ (AlCl
3 )


![{\displaystyle {\mathsf {3NaF+AlF_{3}\ {\xrightarrow {\ }}\ Na_{3}[AlF_{6}]\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47222f3775ae98acd95a62708b793d5886234082)
![{\displaystyle {\mathsf {3NaF+Al(OH)_{3}\ {\xrightarrow {\ }}\ 3H_{2}O+Na_{3}[AlF_{6}]\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/deaf9ecd70c553c8fe145f3d1183dc1c9d8c3f49)
![{\displaystyle {\mathsf {AlF_{3}+3NH_{4}F+3NaNO_{3}\ {\xrightarrow {\ }}\ 3NH_{4}NO_{3}+Na_{3}[AlF_{6}]\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8af53965eb74d88501bb1047b3e308d0a3a86b59)
![{\displaystyle {\mathsf {Al_{2}(SO_{4})_{3}+12NaF\ {\xrightarrow {\ }}\ 3Na_{2}SO_{4}+2Na_{3}[AlF_{6}]\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b26d17db80c49168782d462da43339217a8ffc0)
![{\displaystyle {\mathsf {Na_{3}[AlF_{6}]\ {\stackrel {\xrightarrow {1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ \ }]{}}}\ 3Na^{+}+[AlF_{6}]^{3-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a81f2e5a00e293166511bb86ab5103912565a03f)
![{\displaystyle {\mathsf {[AlF_{6}]^{3-}\ {\stackrel {\xrightarrow {>1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ \ \ }]{}}}\ [AlF_{4}]^{-}+2F^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcf621cad4b9e84ae775afe4611e64e9846baad4)
![{\displaystyle {\mathsf {2Na_{3}[AlF_{6}]+9H_{2}SO_{4}\ {\xrightarrow {\ }}\ 6NaHSO_{4}+Al_{2}(SO_{4})_{3}+12HF\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e0f8553a4c7bf942de75bb51ff7a129e9207e05)
![{\displaystyle {\mathsf {Na_{3}[AlF_{6}]+4NaOH\ {\xrightarrow {\ }}\ Na[Al(OH)_{4}]+6NaF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f6e3c1b2e17299c2153d9ea6e7ddd03ecfae4af)