Կալիումի սուլֆիդ
| Կալիումի սուլֆիդ | |
|---|---|
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | կալիումի սուլֆիդ |
| Ավանդական անվանում | կալիումի մոնոսուլֆիդ |
| Քիմիական բանաձև | K₂S |
| Մոլային զանգված | 1,8E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,74 գ/սմ³[2] գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 471; 948 °C °C |
| Մոլյար ջերմատարողություն | 76,15 Ջ/(մոլ•Կ) Ջ/(մոլ•Կ) |
| Գոյացան էնթալպիա | −380,7 կՋ/մոլ[3] կՋ/մոլ |
| Քիմիական հատկություններ | |
| Լուծելիությունը այլ նյութեր-ում | լոծվում է էթանոլում և գլիցերինում գ/100 մլ |
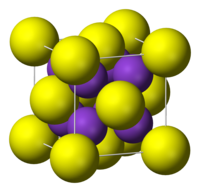
| Բյուրեղային կառուցվածք | Խորանարդային համակարգ[2] |
| Դասակարգում | |
| CAS համար | 1312-73-8 |
| PubChem | 162263 |
| EINECS համար | 215-197-0 |
| SMILES | [S-2].[K+].[K+] |
| ЕС | 215-197-0 |
| RTECS | TT6000000 |
| ChEBI | 142491 |
| Թունավորություն | |
| NFPA 704 |   |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Կալիումի սուլֆիդ, անօրգանական քիմիական միացություն՝ կալիումի և ծծմբի միջև։ Իրենից ներկայացնում է միացություն՝ K2S քիմիական բանաձևով։
Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Կալիումի սուլֆիդը իրենից ներկայացնում է խորանարդաձև բյուրեղացանց ունեցող անգույն բյուրեղ (a=0,739 նմ, Z=4)։ Լավ լուծվում է ջրում՝ հիդրոլիզի միջոցով։ Լուծվում է նաև սպիրտներում և գլիցերինում։ Առաջացնում է դի- և պետնահիդրատներ։
Ստացումը[խմբագրել | խմբագրել կոդը]
- Առաջանում է ծծմբի և կալիումի անմիջական փոխազդեցությունից.
- Առաջանում է կալիումի սուլֆատից՝ ջրածնով վերականգնելով.
- կամ ածխածնով.
- Առաջանում է կալիումի սուլֆիտի ջերմային քայքայումից.
Քիմիական հատկություններ[խմբագրել | խմբագրել կոդը]
- Օդում դանդաղ օքսիդանում է.
- Այրվում է.
- Փոխազդում է թթուների հետ.
- Փոխազդում է կոնցենտրիկ թթուների հետ.
- Փոխազդում է ծծմբի հետ՝ պոլիսուլֆիդներ առաջացնելով.
կալիումի համար n=6։
- Փոխազդում է ծծմբաջրածնի հետ.
Կիրառությունը[խմբագրել | խմբագրել կոդը]
Կալիումի սուլֆինդը կիրառվում է լուսազգայուն էմուլսիայի արտադրության մեջ։ Կիրառվում է որպես հայտանյութ մետաղների սուլֆիդները հայտնաբերելու համար։
Պիրոտեխնիկական գործում[խմբագրել | խմբագրել կոդը]
Կալիումի սուլֆիդը առաջանում է վառոդի փոշին այրելով, որը օգտագործում են պիրոտեխնիկական էֆեկտներ ստանալու համար։
Գրականություն[խմբագրել | խմբագրել կոդը]
- Справочник химика / Редкол.։ Никольский Б.П. и др.. — 3-е изд., испр. — Л.։ Химия, 1971. — Т. 2. — 1168 с.
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 Potassium sulfide
- ↑ 2,0 2,1 2,2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 4—80. — ISBN 978-1-4987-5428-6
- ↑ 3,0 3,1 CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 5—33. — ISBN 978-1-4987-5428-6










