Կալիումի սուլֆատ
| Կալիումի սուլֆատ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | կալիումի սուլֆատ |
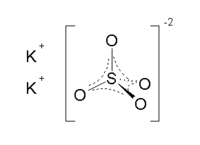
| Քիմիական բանաձև | K₂SO₄ |
| Մոլային զանգված | 2,9E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 2,66 գ/սմ³ գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 1069 °C °C |
| Եռման ջերմաստիճան | 1689 °C °C |
| Բռնկման ջերմաստիճան | չի այրվում °C |
| Մոլյար ջերմատարողություն | 131,4 °C Ջ/(մոլ•Կ) |
| Գոյացան էնթալպիա | −1437,7 կՋ/մոլ կՋ/մոլ |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | (20 °C) 11.1 գ/100մլ
(25 °C) 12 գ/100մլ (100 °C) 24 գ/100 մլ |
| Լուծելիությունը մյուս նյութեր-ում | թույլ լուծելի գլիցերինում, անլուծելի ացետոնում, սպիրտում, CS2 գ/100 մլ |
| Կառուցվածք | |
| Բյուրեղային կառուցվածք | ռոմբիկ |
| Դասակարգում | |
| CAS համար | 7778-80-5 |
| PubChem | 24507 |
| EINECS համար | 231-915-5 |
| SMILES | [O-]S(=O)(=O)[O-].[K+].[K+] |
| ЕС | 231-915-5 |
| RTECS | TT5900000 |
| ChEBI | 22915 |
| Թունավորություն | |
| ՄԲ50 | 6600 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Կալիումի սուլֆատը ծծմբական թթվի կալիումական աղ է։ Քիմիական բանաձևը K2SO4 է։ Անգույն բյուրեղ է, խտությունը՝ 2660 կգ/մ3, հալման ջերմաստիճանը՝ 1074 °C։ 100 գ ջրում 20 °C-ում լուծվում է 11, 1 գ կալիումի սուլֆատ, 100 °C-ում՝ 24, 1 գ։ Մտնում է կալիումի բնական աղերի բաղադրության մեջ, օրինակ, շյոնիտի՝ K2SO4 • MgSO4 • 6H2O, որոնցից էլ ստացվում է։
Ստացումը[խմբագրել | խմբագրել կոդը]
Արդյունաբերության մեջ[խմբագրել | խմբագրել կոդը]
Ստացվում է KCl և տարբեր սուլֆատների միջև փոխանակման ռեակցիաների հետևանքով, ինչի արդյունքում կալիումի սուլֆատը անջանտվում է աղտոտված վիճակում։
2KCl + MgSO4 ⇄ K2SO4 · MgSO4 + MgCl2 K2SO4 · MgSO4 + 2KCl ⇄ 2K2SO4 + MgCl2 2KCl + Na2SO4 ⇄ K2SO4 + 2NaCl 2KCl + CaSO4 · 2H2O ⇄ K2SO4 + CaCl2 + 2H2O 2KCl + FeSO4 ⇄ K2SO4 + FeCl2
Լաբորատորիայում[խմբագրել | խմբագրել կոդը]
Լաբորատոր պայմաններում կալիումի սուլֆատը ստացվում է
- կալիումի օքսիդից
K2O + H2SO4 → K2SO4 + H2O
- դուրս մղելով թույլ և անկայուն թթուներից
K2CO3 + H2SO4 → K2SO4 + CO2 ↑ + H2O
- ալկալիներից և լուծված թթուներից
2KOH + H2SO4 → K2SO4 + 2H2O
- կալիումի հիդրոսուլֆատից
2KHSO4 + KOH → K2SO4 + H2O
Կիրառություն[խմբագրել | խմբագրել կոդը]
Կիրառվում է պաղլեղներ և պոտաշ ստանալու համար, գյուղատնտեսության մեջ՝ որպես խտացրած կալիումական պարարտանյութ։ Կալիումի սուլֆատը ելանյութ է կալիումի այլ միացություններ ստանալու համար։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 5, էջ 176)։ |
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Կալիումի սուլֆատ» հոդվածին։ |
| ||||||||||
