Լայնովեր-Բերգի դիագրամ
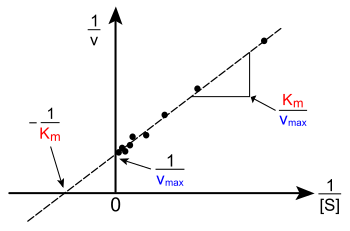
Լայնովեր-Բերգի դիագրամ (կամ կրկնակի հակադարձ դիագրամ), կենսաքիմիայում ֆերմենտատիվ ռեակցիաների կինետիկայի նկարագրական դիագրամներից մեկը։ Այն առաջարկել են Հանս Լայնովերը և Դին Բերգը 1934 թվականին[1]։
Կինետիկական բնութագիր
[խմբագրել | խմբագրել կոդը]Լայնովեր-Բերգի դիագրամը հանդիսանում է լավ գրաֆիկական եղանակ Միխաելիս-Մենթենի հավասարման հաստատունների որոշման համար։
որտեղ V - ռեակցիայի արագությունն է, Km՝ Միխաելիսի հաստատունը, Vmax՝ ռեակցիայի առավելագույն արագությունը, իսկ [S]՝ սուբստրատի կոնցենտրացիան։
Կիրառություն
[խմբագրել | խմբագրել կոդը]
Լայնովեր-Բերգի դիագրամը շատ հաճախ կիրառվում է ֆերմենտատիվ ռեակցիաների կինետիկայում հաստատունների որոշման համար։ Այդ հաստատուններից են՝ Km և Vmax։ Այս դիագրամի y առանցքը հատողի x=0 կետում թվային արժեքը հավասար է Vmax հակադարձ արժեքին, իսկ x առանցքը հատողի արժեքը y=0 կետում հավասար է −1/Km։ Այն նաև օգտակար տեղեկություններ է հաղորդում ֆերմենտի արգելակման մասին։
Կրկնակի հակադարձ դիագրամը աղավաղում է տվյալների սխալանքը և այդ պատճառով այն արդյունավետ չէ ֆերմենտի կինետիկական բնութագրերի որոշման համար[2][3]։
Լայնովեր-Բերգի դիագրամը հնարավորություն է տալիս պարզելու ֆերմենտի արգելակման ձևը (մրցակցային, ոչ մրցակցային և հակամրցակցային)։ Մրցակցային արգելակիչները ունեն նույն y առանցքի հատման կետը, ինչ ունի ոչ արգելակող ֆերմենտը, քանի որ Vmax չի փոխվում, սակայն այդ ուղիղների կազմած անկյունները տարբերվում են։ Ոչ մրցակցային արգելակիչները ունեն նույն x առանցքի հատման կետը, ինչ ունի ոչ արգելակող ֆերմենտը, քանի որ Km չի փոխվում, սակայն այդ ուղիղները ունեն y առանցքի հետ հատման տարբեր կետեր։ Հակամրցակցային արգելակիչները ունեն y և x առանցքների տարբեր հատման կետեր։
Խնդիրներ
[խմբագրել | խմբագրել կոդը]Լայնովեր-Բերգի դիագրամը հակված է սխալի, քանի որ y առանցքը ռեակցիայի արագության հակադարձ մեծությունն է, և որևէ փոքր սխալի մեծացումը բերում է ավելի մեծ սխալի[4]։
Տես նաև
[խմբագրել | խմբագրել կոդը]Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ Lineweaver, H and Burk, D. (1934). «The Determination of Enzyme Dissociation Constants». Journal of the American Chemical Society. 56 (3): 658–666. doi:10.1021/ja01318a036.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Hayakawa, K.; Guo, L.; Terentyeva, E.A.; Li, X.K.; Kimura, H.; Hirano, M.; Yoshikawa, K.; Nagamine, T.; և այլք: (2006). «Determination of specific activities and kinetic constants of biotinidase and lipoamidase in LEW rat and Lactobacillus casei (Shirota)». J Chromatogr B Analyt Technol Biomed Life Sci. 844 (2): 240–50. doi:10.1016/j.jchromb.2006.07.006. PMID 16876490.
- ↑ Greco, W. R. and Hakala, M. T., (1979). «Evaluation of methods for estimating the dissociation constant of tight binding enzyme inhibitors,» (PDF). J. Biol. Chem. 254 (23): 12104–12109. PMID 500698. Արխիվացված է օրիգինալից (PDF) 2009 թ․ մարտի 20-ին. Վերցված է 2015 թ․ փետրվարի 1-ին.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) CS1 սպաս․ հավելյալ կետադրություն (link) - ↑ Dowd, John E.; Riggs, Douglas S. (1965). «A Comparison of Estimates of Michaelis–Menten Kinetic Constants from Various Linear Transformations». J. Biol. Chem. 240 (2): 863–869.
Արտաքին հղումներ
[խմբագրել | խմբագրել կոդը]- NIH Արխիվացված 2011-08-09 Wayback Machine

![{\displaystyle V={\frac {V_{\max }[S]}{K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fa5b35e10661c7592ae5bc59429f1033a4acbf8)
![{\displaystyle {1 \over V}={{K_{m}+[S]} \over V_{\max }[S]}={K_{m} \over V_{\max }}{1 \over [S]}+{1 \over V_{\max }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/262e1440a8ad30a692b153178eabbf6e7f45d48f)