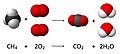
Քիմիական ռեակցիաներ

Քիմիական երևույթները (քիմիական ռեակցիաներ կամ փոխարկումներ) լինում են 4 տեսակի`
- միացման
- քայքայման
- տեղակալման
- փոխանակման
Միացման են կոչվում այն ռեակցիաները, որոնց ժամանակ 2 պարզ կամ բարդ նյութեր միանալով առաջացնում են 1 բարդ նյութ։ Քայքայման են կոչվում այն ռեակցիաները, որոնց ժամանակ 1 բարդ նյութը քայքայվում է և առաջանում է երկու կամ մի քանի պարզ նյութեր։ Տեղակալման ռեակցիաներն ընթանում են պարզ և բարդ նյութերի միջև, որոնց դեպքում պարզ նյութի ատոմները տեղակալվում են բարդ նյութի ատոմներից մեկով։ Փոխանակման ռեակցիաները ընթանում են 2 բարդ նյութերի միջև, որոնք փոխանակվում են իրենց ատոմներով։ Ռեակցիայի ընթանալու պայմաններն են` ջերմության անջատում, նստվածքի առաջացում, գազի անջատում, գույնի փոփոխություն, հոտի առաջացում և այլն։
Ընդհանուր մանրամասներ[խմբագրել | խմբագրել կոդը]
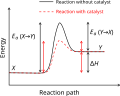
Ի տարբերություն միջուկային ռեակցիաների՝ քիմիական ռեակցիայի հետևանքով քիմիական տարրերը չեն փոխարկվում, անփոփոխ են մնում նաև նրանց ատոմների թիվը և իզոտոպային բաղադրությունը՝ իրականանում է զանգվածի պահպանման օրենքը։ Քիմիական ռեակցիաները սխեմատիկորեն պատկերում են քիմիական հավասարումներով[1]։ Քիմիական ռեակցիաների ընթանալու համար անհրաժեշտ է, որ ելանյութերի մասնիկները (ատոմները, մոլեկուլները և այլն) ունենան ռեակցիայի էներգետիկ արգելքը հաղթահարելու համար բավարար էներգիա, և որ ելանյութերը լինեն խառնված կամ հպվեն իրար։ Քիմիական ռեակցիաին բնորոշող կարևոր մեծություններ են ռեակցիայի ջերմային էֆեկտը, արագության և հավասարակշռության հաստատունները, ակտիվացման էներգիան, վերջնանյութերի ելքը, ելանյութերի փոխարկման աստիճանը կարող են ընթանալ ինքնաբերաբար կամ արտաքին ազդակների՝ ջերմության, լույսի, էլեկտրական հոսանքի, իոնացնող ճառագայթների, կատալիզատորների, ճնշման և այլն ներգործությամբ։ Մի շարք ռեակցիաներ ընթանում են միայն արտաքինից էներգիա ստանալու դեպքում, մյուսները՝ էներգիայի աղբյուր են։ Քիմիական ռեակցիաների բարդ երևույթներ են, նրանցից յուրաքանչյուրը, սովորաբար, կազմված է բազմաթիվ փուլերից, որոնց համախումբը կոչվում է Քիմիական ռեակցիայի մեխանիզմ։ Բոլոր ռեակցիաները դարձելի են և ընթանում են մինչև հավասարակշռություն քիմիականի ստեղծումը, որից հետո անփոփոխ են մնում ռեակցիային մասնակցող բոլոր նյութերի կոնցենտրացիաները։ Հավասարակշռային և նրան մոտ վիճակներում համակարգի վարքը նկարագրվում է քիմիական թերմոդինամիկայի առնչություններով։ Մոլեկուլային մակարդակով Քիմիական ռեակցիաները հետազոտելու համար օգտագործվում են քվանտաքիմիական պատկերացումները։ Թերմոդինամիկայում քիմիական ռեակցիաները դասակարգվում են ըստ ջերմային էֆեկտի, ֆազերի թվի (համասեռ, տարասեռ), քիմիական կինետիկայում հաշվի է առնվում ուղիղ և հակադարձ ռեակցիաների արագությունները, ռեակցիայի՝ միմյանցով պայմանավորված փուլերի թիվը, մոլեկուլայնությունը, կարգը և այլն։ Առանձնացվում են գործնականորեն ոչ դարձելի ռեակցիաները[2][3]։ Կախված տարրական ակտին մասնակցող մասնիկների բնույթից՝ տարբերում են իոնական, ռադիկալային, մոլեկուլային, լուսաքիմիական և այլ քիմիական ռեակցիաներ։ Անօրգանական քիմիայում քիմիական ռեակցիաները դասակարգում են ըստ ռեակցիային մասնակցող նյութերի տեսակի և փոխազդեցության բնույթի՝ միացման–քայքայման, հիդրոլիզի, չեզոքացման, կոմպլեքսագոյացման, օքսիդավերականգնման և այլ ռեակցիաներ[4]։ Օրգանական քիմիայում տարբերում են հետերոլիտային (քիմիական կապը խզվելիս էլեկտրոնային զույգը մնում է ատոմներից մեկի մոտ) և հոմոլիտային (էլեկւորոնային զույգը կիսվում է, առաջանում են ռադիկալներ) ռեակցիաներ։ Հետերոլիտային ռեակցիաները լինում են նուկլեոֆիլային և էլեկտրոֆիլային։ Հաճախ քիմիական ռեակցիաները դասակարգում են ըստ առաջացող կամ անհայտացող ֆունկցիոնալ խմբերի (նիտրման, սուլֆացման, դեկարբօքսիլման և այլ ռեակ– ցիաներ)։ Առանձին խմբեր են կազմում պոլիմերման, իզոմերման, վերախմբավորման և այլ ռեակցիաները, որոնց հետևանքով չեն փոխվում նյութերի բաղադրությունները։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "chemical reaction".
- ↑ Friedman, Leonard J.; Friedman, Samantha J. (2008). The History of the Contact Sulfuric Acid Process (PDF). Boca Raton, Florida: Acid Engineering & Consulting, Inc.
- ↑ Stranges, Anthony N. (2000). «Germany's synthetic fuel industry, 1935–1940». In Lesch, John E. (ed.). The German Chemical Industry in the Twentieth Century. Kluwer Academic Publishers. էջ 170. ISBN 978-0-7923-6487-0.
- ↑ Brock, pp. 34–55
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից։ |