Նատրիումի արսենատ
Արտաքին տեսք
| Նատրիումի արսենատ | |
|---|---|
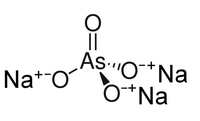 | |
| Քիմիական բանաձև | AsNa₃O₄ |
| Մոլային զանգված | 3,5E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 2,835 գ/սմ³ գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | բյուրեղահիդրատ 86,3 °C °C |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | 19,115,5; 23,430 գ/100 մլ |
| Դասակարգում | |
| CAS համար | 13464-38-5 |
| PubChem | 47275 |
| EINECS համար | 236-682-3 |
| SMILES | [O-][As](=O)([O-])[O-].[Na+].[Na+].[Na+] |
| ЕС | 236-682-3 |
| RTECS | CG1100000 |
| ChEBI | 43027 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Նատրիումի արսենատ, անօրգանական միացություն, ալկալիական մետաղ նատրիումի աղի և արսենական թթվի աղը՝ Na3AsO4 բանաձևով, անգույն բյուրեղներ, ջրում լուծելի, առաջացնում են բյուրեղահիդրատ։
Ստացումը
[խմբագրել | խմբագրել կոդը]- Արսենի լուծումը նատրիումի հիդրօքսիդի լուծույթի մեջ օքսիդիչների առկայությամբ․
- Արսենի օքսիդի (III) հալեցումը ալկալու և նատրիումի նիտրատի հետ․
- Արսենի օքսիդի (V) լուծումը ալկալու խիտ լուծույթի մեջ․
- Նատրիումի մետաարսենատի քայքայում․
- կամ դրա օքսիդացում․
Ֆիզիկական հատկություններ
[խմբագրել | խմբագրել կոդը]Նատրիումի արսենատը առաջացնում է անգույն բյուրեղներ։
Լավ լուծվում է ջրում անիոնի մասնակի հիդրոլիզմամբ
Առաջացնում է Na3AsO4•12H2O բյուրեղահիդրատը, որը լուծվում է իր բյուրեղաջրում 86,3°С ջերմաստիճանում։
Քիմիական հատկությունները
[խմբագրել | խմբագրել կոդը]- Բյուրեղահիդրատը տաքացնելիս ջուրը դուրս է գալիս․
- Ջրային լուծույթներում կլանում է ածխաթթու գազը․
- Արսենական թթվի հետ սառեցումից առաջացնում է թթու աղի բյուրեղահիդրատ․
- Տեղակալման ռեակցիայի մեջ է մտնում․
- Հանդիսանում է թույլ օքսիդիչ․
Գրականություն
[խմբագրել | խմբագրել կոդը]- Справочник химика / Редкол.։ Никольский Б.П. и др.. — 3-е изд., испр. — Л.։ Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ։ Учеб. пособие для вузов. — 3-е изд., испр. — М.։ Химия, 2000. — 480 с.










