Ակտին
| Ակտին | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Տեսակ | սպիտակուցների ընտանիք | ||||||||
| Ենթադաս | motor protein?, ATPase?, microfilament proteins? և muscle proteins? | ||||||||
| Կազմված է | Actin, conserved site?[2] և Actin/actin-like conserved site?[2] | ||||||||
| Բնորոշիչներ | |||||||||
| Նշան | Actin | ||||||||
| Pfam | |||||||||
| InterPro | |||||||||
| PROSITE | |||||||||
| SCOP | |||||||||
| SUPERFAMILY | |||||||||
| |||||||||
Ակտին, գլոբուլային բազմաֆունկցիոնալ սպիտակուց, որը մասնակցում է միկրոֆիլամենտների (մանրաթելիկներ) առաջացմանը։ Այն հայտնաբերվում է համարյա բոլոր էուկարիոտային բջիջներում (միակ հայտնի բացառությունը նեմատոդների սպերմատոզոիդներն են), որոնցում նրա խտաստիճանը կարող է հասնել 100 μM-ի և ավել։ Ակտին սպիտակուցի զանգվածը 42 կԴա է։ Այն հանդիսանում է բջիջների երկու տեսակի ֆիլամենտների կառուցվածքային մոնոմերը. միկրոֆիլամենտների, որոնք բջջակմախքի գլխավոր բաղադրիչներից մեկն է և մկանների կծկողական համակարգի թելիկների։
Ակտինը կարող ե հանդես գալ ազատ մոնոմերի՝ G-ակտինի (գլոբուլային) ձևով կամ էլ որպես F-ակտին (filamentous՝ ֆիլամենտ, թելիկ)` միկրոֆիլամենտի մի մաս։ Վերոհիշյալ ձևերը կարևոր են բջջային տարբեր գործընթացների, մասնավորապես` շարժման և բջիջների կիսման ժամանակ բջիջների կծկման համար։
Ակտինը մասնակցում է տարբեր բջջային գործընթացներին, ներառյալ՝ մկանների կծկմանը, բջիջների շարժմանը, բջիջների կիսմանը, բշտերի և օրգանոիդների շարժմանը, բջիջների ազդանշանմանը, բջիջների միացումների իրագործմանն ու բջիջների ձևի պահպանմանը։ Այս գործըթնացներից շատերն իրագործվում են ակտինի և բջջաթաղանթի ակտիվ և սերտ փոխազդեցությամբ[3]։
Ողնաշարավորների մոտ հանդիպում են ակտինի երեք հիմնական իզոֆորմեր՝ ալֆա, բետտա և գամմա: Ալֆա ակտինը հանդիպում է մկանային հյուսվածքում և հանդիսանում է կծկման համակարգի հիմնականը տարրերից մեկը։ Բետտա և գամմա ակտինները հանդիպում են բջիջների մեծամասնության մոտ՝ որպես բջջակմախքի մի մաս և ներբջջային շարժման միջնորդ։ Կարծիք կա, որ ակտինով կազմված կառուցվածքների բազմազանությունը, որը հնարավորություն է տալիս կատարել բազմաթիվ ֆունկցիաներ, կարգավորվում է թելիկների ուղղությամբ տրոպոմիոզինի կապվելով[4]։
Միկրոֆիլամենտներ ձևավորելու բջիջների շարժուն ընդունակության շնորհիվ նրանց ներսում ձևավորվում է խիտ «ծառ», որի շնրոհիվ նրանք կարողանում են արագորեն ձևափոխվել՝ արտաքին կամ օրգանիզմի ներքին միջավայրի ազդակներին ի պատասխան։ Օրինակ՝ մեծացնել բջջաթաղանթի աբսորբցիան կամ բջիջների ադհեզիան հյուսվածքների ձևավորման ժամանակ։ Տարբեր ֆերմենտներ և օրգանոիդներ (օրինակ՝ թավիկները) կարող են կապվել վերոհիշյալ ցանցին, որպեսզի կարգավորեն բջջաթաղանթի ձևափոխումը էնդոցիտոզի կամ ցիտոկինեզի ժամանակ։ Ակտինը կարող է մասնակցել շարժմանը թե ինքնուրույն, թե այլ մոլեկուլային շարժիչների հետ։ Ակտինն ապահովում է բշտիկների և օրգանոիդների ներբջջային տեղափոխումը, մկանների կծկումը, բջիջների գաղթը (միգրացիան), թավիկների և մտրակիկների շարժումը և այլն։ Նրանք մեծ դեր են խաղում նաև էմբրիոգենեզում, վերքերի բուժման և ուռուցքային բջիջների վնասազերծման գործընթացներում։
Ակտինի էվոլյուցիան զարգացումը կարելի է դիտարկել պրոկարիոտների ուսումնասիրմամբ, որոնք ունեն ակտինին համարժեք սպիտակուցներ[5][6]։ Վերջապես, ակտինը կարևոր դեր ունի գեների էքսպրեսիայի կարգավորման գործում։
Ակտինի կամ նրա հետ ասոցացված այլ սպիտակուցների սինթեզի համար պատասխանատու գեների մուտացիաների դեպքում կարող են առաջանալ տարաբնույթ հիվանդություններ։ Ակտինի արտադրությունը կարևոր գործոն է նաև մի շարք ախտածին մանրէների կողմից առաջացող վարակիչ հիվանդությունների առաջացման գործընթացում։ Ակտինի գենի մուտացիան կարող է առաջացնել մկանային հիվանդություններ, սրտի չափսերի փոփոխություն, ինչպես նաև խլություն։ Բջջակմախքի ձևափոխումները կարող են կապված լինել նաև ներբջջային բակտերիաների և վիրուսների ախտածնության հետ[7]։
Պատմություն[խմբագրել | խմբագրել կոդը]

Ակտինն առաջին փորձնական եղանակով անգամ հետազոտվել է 1887 թվականին Ուիլյամ Դոբինսոն Հալլիբարթոնի կողմից, որը մկաններից ստացավ միոզին սպիտակուցին կպած մի սպիտակուց և անվանեց միոզին-ֆերմենտ[8]։ Սակայն, Հալլիբարթոնն անկարող եղավ կատարելագործել իր հայտնաբերումը, այդ պատճառով ակտինի հայտնագործումը վերագրվում է Բրունո Ֆերենց Ստրաուբին` Հունգարիայի Սեգեդա համալսարանի Ալբերտ Սենթ-Գեորգիի լաբորատորիայում աշխատող երիտասարդ կենսաքիմիկոքսին։
1942 թվականին Ստրաուբը կատարելագործեց մկանների սպիտակուցների անջատման տեխնիկան, որը նրան հնարավորություն տվեց մեկուսացնել բավականաչափ քանակությամբ մաքուր ակտին։ Ստրաուբի մեթոդը համարյա նույնն է, ինչը ներկայումս օգտագործում են լաբորատորիաներում։ Սենթ-Գեորգին մինչ այդ նկարագրել էր մկանների մզվածքից ստացված միոզինի առավել մածուցիկ ձևը` որպես «ակտիվ» միոզին, իսկ Ստրաուբսի հայտնագործությունցի հետո այն անվանվեց ակտին։
ԱԵՖ-ի ավելացումը միոզինի և ակտինի (ակտոմիոզինի) խառնուրդի մեջ առաջացնում է մածուցիկության նվազում։ Երկրորդ համաշխարհային պատերազմի ռազմական գործողությունները խանգարեցին Ստրաուբին և Սենթ-Գեորգիին հրատարակել իրենց հայտնագործությունը արևմտյան գիտական ամսագրերում։ Ուստի, ակտինի մասին տեղեկատվությունը արևմուտքին հայտնի դարձավ միայն 1945 թվականին, երբ վերոհիշյալ գիտնականների հոդվածը տպագրվեց Acta Physiologica Scandinavica-ի հավելվածում[9]։ Ստրաուբը շարունակեց իր ուսումնասիրություններն ակտինի ուղղությամբ և 1950 թվականին հայտարարեց, որ ակտինն ունի կապված ԱԵՖ[10], ինչպես նաև այն, որ ակտինի պոլիմերացման միջոցով միկրոֆիլամենտների առաջացման ընթացքում ԱԵՖ-ը հիդրոլիզվում է մինչև ԱԿՖ և անօրգանական ֆոսֆատի (ինչը շարունակում է կապված մնալ միկրոֆիլամենտի հետ)։ Ստրաուբը ենթադրեց, որ ԱԵՖ-կապված ակտինի ձևափոխումը ԱԿՖ-կապված ակտինի մասնակցում է մկանների կծկմանը։ Իրականում, սա ճիշտ է միայն հարթ մկանների համար և փորձնականորեն ապացուցվեց միան 2001 թվականին[10][11]։
Ակտինի ամինաթթվային հաջորդականությունը հաստատվեց 1973 թվականին Մ. Էլզինգայի և նրա աշխատակիցների կողմից[12]։ G-ակտինի բյուրեղային կառուցվածքը բացահայտվեց 1990 թվականին Կաբշի (Kabsch) և գործընկերների կողմից[13]։ Նույն տարում Հոլմեսի և նրա աշխատակիցների կողմից տրվեց F-ակտինի կառուցվածքային մոդելը, որը տարբեր պրոտեիններով հետ կո-բյուրեղացման փորձերի արդյունք էր[14]։ Տարբեր պրոտեիններով կո-բյուրեղացման փորձերը կրկնվեցին մինչև 2001 թվականը, երբ մեկուսացված սպիտակուցը բյուրեղացվեց ԱԿՖ-ի մասնակցությամբ։ Սակայն, ռենտգենյան ճառագայթներով F-ակտինի կառուցվածքից դեռ հստակ տվյալներ չկային։ F-ակտինի բյուրեղացումը հնարավոր է ռոդամինի օգտագործման շնորհիվ, որը խոչընդոտում է բյուրեղացումը ցիստեին ամինաթթվի շրջափակման միջոցով[1]։ Քրիստին Օրիոլ-Աուդիթը (Christine Oriol-Audit) մահացավ ակտինի՝ առաջին անգամ բյուրեղացնելու տարում, իսկ նա այն գիտնականն էր, ով 1977 թվականին ստացավ բյուրեղային ակտին առանց ակտին կապող պրոտեինի օգտագործման[15]։ Սակայն, ստացված բյուրեղների քանակը դեռ բավականին քիչ էր։
2008 թվականին Սովեյսի (Sawaya) թիմը, հիմնվելով տարբեր տեղերում կապվող բյուրեղային ակտինի դիմերների վրա, ստացավ ակտինի թելիկների առավել ճշտգրիտ մոդելը[16]։ Այդ մոդելը հետագայում կատարելագործվեց Սովեյսի և Լորենցի կողմից։ Սառցաէլեկտրոնային (կրիոէլոկտրոնային) մանրադիտակի և սինխրոտոն ճառագայթային հետազոտություններով հաջողվել է ավելի հստակեցնել ակտինային թելիկների առաջացման ընթացքում կատարվող փոփոխություններն ու փոխազդեցությունները[17][18]։
Կառուցվածք[խմբագրել | խմբագրել կոդը]
Ակտինի ամինաթթվային հաջորդականությունը ամենակայուններից մեկն է սպիտակուցների մեջ, քանի որ էվուլյացիայի ընթացքում այն շատ քիչ է փոխվել (մոտ 20 %)[5]։ Ակտինը ֆերմենտ է, որը դանդաղորեն հիդրոլիզում է ԱԵՖ-ը։ Սակայն, ԱԵՖ-ը հարկավոր է նաև նրա կառուցվածքային միավորման պահպանման համար։ Ակտինի յուրօրինակ կառուցվածքը ձևավորվում է յուրահատուկ ֆոլդինգային (սպիտակուցի առաջնային կառուցվածքից երրորդային կառուցվածքի առաջացում) գործընթացի արդյունքում։ Ակտինը կարող է առավել շատ փոխազդեցություններ առաջացնել, քան մյուս սպիտակուցները, ինչի շնորհիվ նրանք կատարում են խիստ բազմազան ֆունկցիաներ բջջի կյանքի տարբեր գործընթացներում[5]։ Միոզինը սպիտակուցներից մեկն է, որը կապվում է ակտինին և մասնակցում մկաննրեի կծկմանը։ Ակտինի հետ գործող մեկ այլ սպիտակուց է վիլլինը, որը կարող է ակտինին խմբավորել հանգույցներով կամ, միջավայրում կալցիումի իոնների խտաստիճանից կախված, բաժանել թելիկները։
Ակտինը էուկարիոտների մոտ ամենաշատ հանդիպող սպիտակուցներից է և հայտնաբերվում է ողջ ցիտոպլազմայում։ Մկանաթելերում ակտինը կազմում է ամբողջ սպիտակուցների զանգվածի 20 %-ը, իսկ մյուս բջիջներում՝ 1-5 %-ը։ Չնայած այս հանգամանքին, մեկ տեսակի ակտին չէ, որ կա, իսկ նրանց սինթեզի համար պատասխանատու է գեների ընտանիքը (բույսերում այդ ընտանիքը ներառում է ավելի քան 60 տարրեր, իսկ մարդկանց մոտ՝ 30-ից ավել)[5][19]։ Սա նշանակում է, որ յուրաքանչյուր անհատի գենային ինֆորմացիան պարունակում է կառուցվածքներ, որոնք առաջացնում են ակտինի տարատեսակներ (իզոֆորմեր), որոնք էլ իրենց հերթին կատարում են տարբեր ֆունկցիաներ։ Սա, իր հերթին, նշանակում է, որ էուկարիոտ օրգանիզմներն ունեն տարբեր գեներ, որոնց գործունեության հետևանքով առաջանում է.
- α-ակտին, որը հայտնաբերվում է կծկողական կառուցվածքներում,
- β-ակտին, որը հայտնաբերվում է խոշորացող բջիջների եզրերում,
- γ-ակտին, որը հայտնաբերվում է սթրես-թելերում (ակտինային թելեր, որոնք գտնվում են ոչ կծկողական բջիջներում)[20]։
Բակտերիաների մոտ հայտնաբերվել է ակտինի համարժեք (հոմոլոգ) MreB սպիտակուց, որը կարող է պոլիմերացվել և առաջացնել միկրոֆիլամենտներ[5][18], իսկ արքեաների մոտ ակտինի համարժեքը Ta0583 սպիտակուցն է, որն ավելի նման է էուկարիոտների ակտինին[21]։
Բջջային ակտինն ւոնի երկու ձև. մոնոմերային գնդաձև (գլոբուլային) G-ակտին և պոլիմերային թելիկներ՝ F-ակտին: Ընդ որում, վերջինս կազմված է բազմաթիվ G-ակտիններից։ F-ակտինը կարող համարվել որպես միկրոֆիլամենտ (միկրոթելիկ)։ F-ակտինի երկու զուգահեռ թելիկները պետք է պտտվեն 166 աստիճան անկյան տակ, որպեսզի նրանցից յուրաքանչյուրը ճիշտ հայտնվի մյուսի վերևում։ Սրա արդյունքում առաջանում է միկրոֆիլամենտների երկակի պարույր, որը հայտնաբերվում է բջջակմախքում։ Միկրոֆիլամենտներն ունեն մոտավորապես 7 նմ տրամագիծ, իսկ պտույտը կրկնվում է ամեն 37 նմ-ը մեկ։ Ակտինի յուրաքանչյուր մոլեկուլ միացված է ԱԵՖ-ի կամ ԱԿՖ-ի մոլեկուլի հետ, որն էլ իր հերթին միացված է մագնեզիումի իոններին։ Ակտինի ամենատարածված ձևերն են ԱԵՖ-G-ակտինն ու ԱԿՖ-F-ակտինը[22][23]։
G-ակտին[խմբագրել | խմբագրել կոդը]
Սկանավորող էլեկտրոնային մանրադիտակով նկատվում է, որ G-ակտինն ունի գնդաձև կառուցվածք։ Սակայն, ռենտգենյան ճառագայթային բյուրեղագրաֆիան ցույց է տալիս, որ այս գնդիկներից յուրաքանչյուրը կազմված է ճեղքով բաժանված երկու մասերից։ Այստեղ գտնվում է այսպես կոչված ԱԵՖազային ծալքը, որտեղ գտնվում է ֆերմենտային կատալիզի հատվածը։ Այն, կապվելով ԱԵՖ-ի և մագնեզիումի իոնների հետ, հիդրոլիզում է և առաջացնում ԱԿՖ ու ֆոսֆատ։ Նման ծալք հայտնաբերվել է նաև այլ սպիտակուցներում, որոնք փոխազդում են եռֆոսֆատային տարբեր նուկլեոտիդների հետ (օրինակ՝ էներգիական փոխանակությանը մասնակցող հեքսոկինազ, կամ սպիտակուցների ծալմանը մասնակցող Hsp70)[24]: G-ակտինը գործում է, եթե իր ճեղքում պարունակում է կամ ԱԵՖ, կամ ԱԿՖ, ընդ որում, ԱԵՖ պարունակող ձևերը գերակշռում են այն բջիջներում, որտեղ ակտինը հանդիպում է ազատ ձևով[22]։

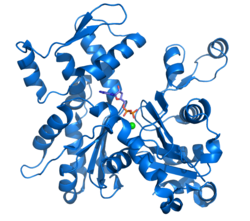
Ռենդգենակառուցվածքային հետազոտմամբ բացահայտված ակտինի մոդելը, որը ստացվել է Կաբշի (Kabsch) կողմից ճագարների միջաձիգ զոլավոր մկանների ուսումնասիրման արդյունքում, կառուցվածքային հետազոտություններում ամենաշատ օգտագործվողն է, քանի որ առաջինն է ստացվել։ Կաբշի կողմից բյուրեղացված G-ակտինն ուներ մոտավորապես 67x40x37 Å մեծություն, իսկ մոլեկուլային զանգվածը՝ 41,785 Դա էր, իզոէլեկտրիկ կետը՝ 4.8, pH = 7 միջավայրում էլեկտրական լիցքը՝ -7[12][25]:
Առաջնային կառուցվածք[խմբագրել | խմբագրել կոդը]
1973 թվականին Էլզինգան և աշխատակիցներն առաջինը որոշեցին ակտինի այս տեսակի ամբողջական ամինաթթվային հաջորդականությունը, իսկ հետագայում նույն մարդիկ ավելի կատարելագործեցին նախկին կառուցվածքային մոդելը։ Ակտինը պարունակում է 374 ամինաթթվային մնացորդներ։ Սրա N-ծայրը խիստ թթվային է և սկսվում է ացետիլացված ասպարտատով։ C-ծայրը հիմնային է և ձևավորվում է ֆենիլալանինով C-terminus is alkaline and is formed by a phenylalanine preceded by a cysteine, Երկու ծայրերն էլ շատ մոտ են I-ենթադոմենին։ Անոմալային Nτ-մեթիլհիստիդինը տեղակայված է 73-րդ դիրքում[25]։
Երրորդային կառուցվածք և դոմեններ[խմբագրել | խմբագրել կոդը]
Երրորդային կառուցվածքը ձևավորվում է երկու՝ մեծ և փոքր դոմեններով։ Սրանք բաժանված են ճեղքով, որի կենտրոնում գտնվում է ԱԵՖ-ԱԿՖ+ֆոսֆատ կապող կենտրոնը։ Դրանից ներքև կա այսպես կոչված խորը ակոս (բացվածք): Չնայած անուններին, սրանք ունեն նույն խորությունը[12]։
Ուսումնասիրությունները վկայում են, որ մոլեկուլի ձախ կողմում գտնվում է մեծ, իսկ աջ կողմում՝ փոքր դոմենը։ Այս դիրքով փոքր դոմենը բաժանված է երկու մասի. ենթադոմեն I (ունի ստորին տեղադրվածություն, պարունակում է ամինաթթվային 1-32, 70-144 և 338-374 մնացորդները) և ենթադոմեն II (ունի վերջին տեղադրվածություն, պարունակում է ամինաթթվային 33-69 մնացորդներ)։ Մեծ դոմենը նույնպես բաժանված է երկու մասի. ենթադոմեն III (ունի ստորին տեղադրվածություն, պարունակում է ամինաթթվային 145-180 և 270-337 մնացորդներ) և ենթադոմեն IV (ունի վերին տեղադրվածություն, պարունակում է ամինաթթվային 181-269 մնացորդներ)։ I և III ենթադոմենների ազդման տեղամասերը կոչվում են «փշոտ», իսկ II և IV ենթադոմենների ազդման տեղամասերը` «սրածայր» վերջավորություններ։ Այս անվանումները մատնանշում են այն փաստը, որ ենթադոմեն II-ի փոքր զանգվածի շնորհիվ ակտինը բևեռացված է։ Որոշ հեղինակներ ենթադոմեններն անվանում են համապատասխանաբար՝ Ia, Ib, IIa և IIb:
Այլ կարևոր կառուցվածքններ[խմբագրել | խմբագրել կոդը]
Բետա-շերտը (beta sheet, սպիտակուցի երկրորդային կառուցվածքի ձև) ամենանշանակալի կառուցվածքներից մեկն է։ Այն երկու դոմեններում էլ առկա է, ինչը հիմք է տալիս ենթադրել, որ պրոտեինն առաջացել է գենի կրկնօրինակումից[13]։
- Ադենոզին նուկլեոտիդ կապող հատվածը տեղակայված է I և III դոմեններին կապված երկու բետա հերակալների (հերկալի նմանվող սպիտակուցային կառուցվածքային տարր) միջև։
- Երկարժեք կատիոն կապող հատվածը տեղակայված է ներքևի մասում։ In vivo պայմաններում այն հաճախ ձևավորվում է Mg2+-ով կամ Ca2+-ով, մինչ դեռ in vitro պայմաններում այն ձևավորվում է լիզին-18-ով և նուկլեոտիդների α- ու β-ֆոսֆատների երկու թթվածիններով։ Կալցիումը կոորդինացված է ջրի վեց մոլեկուլներով, որոնք պահպանվում են ասպարտաթթու-11, ասպարտաթթու-154, և գլուտամին-137 ամինաթթուներով։ Նուկլեոտիդների հետ սրանք առաջացնում են համալիր, որը սահմանափակում է 137 և 144 մնացորդների միջև տեղակայված այսպես կոչված «առանցք» (hinge) հատվածի տեղաշարժը։ Սա պահպանում է սպիտակուցի բնական ձևը, մինչև որ սրա հեռացումը ձևափոխում (դենատուրացիա) է ակտինի մոնոմերը։ Այս հատվածը նաև կարևոր է նրանով, որ այն որոշում է սպիտակուցի ճեղքի բաց կամ փակ վիճակը[1]։
- Հայտնի է, որ կան նվազագույնը երեք այլ կենտրոններ, որոնք ունեն ավելի ցածր խնամակցություն էլեկտրոնի նկատմամբ, և այլ կենտրոններ ևս, որոնք ունեց ցածր խնամակցություն երկարժեք կատիոնների նկատմամբ։ Ենթադրվում է, որ այդ երեք կենտրոնները մասնակցում են ակտինի պոլիմերացմանը։
- II ենթադոմենում կա «D-ծունկ» կոչվող կառուցվածքային մաս, որը կապվում է դեզօքսինուկլեազ I-ին և գտնվում է հիստիդին-40 և գլիցին-48 մնացորդների միջև։ Դոմինգեսն (Domínguez) ու համահեղինակները ենթադրում են, որ պոլիմերացման գլխավոր գործոնը հավանաբար նուկլեոտիդի հետ կապի կենտրոնից դեպի այս դոմեն ձևափոխման տարածումն է, ինչը փոխվում է ծնկաձև տեսքից պարորաձևի։ Սակայն, այս տեսությունը մեժվել է այլ հետազոտողների կողմից[1][26]։
F-ակտին[խմբագրել | խմբագրել կոդը]


Դասական պատկերացմամբ F-ակտինն ունի թելանման տեսք, կազմված ժամացույցի սլաքի ուղղությամբ (կամ աջ կողմով) պտտվող պարուրաձև թելիկից, որը առանցքի ուղղությամբ պտտվում է 166° անկյան տակ։ axial translation of 27.5 Å, կամ ժամացույցի սլաքին հակառակ ուղղությամբ (ձախ կողմով) with a cross over spacing of 350-380 Å, with each actin surrounded by four more.[27] Պետք է նշել, որ այնքան էլ ճիշտ չէ խոսել այնպիսի շարժունակ մոլեկուլի կառուցվածքի մասին, ինչպիսին ակտինային թելիկն է։ Իրականում խոսքն առանձին կառուցվածքային վիճակների մասին է։ Որոշ պրոտեիններ (օրինակ՝ կոֆիլինը) կարող են մեծացնել պտտման անկյունը, սակայն սա կրկին պետք է մեկնաբանվի որպես կառուցվածքային տարբեր վիճակների առաջացում։ Սա կարող է մեծ նշանակություն ունենա պոլիմերացման ժամանակ[28]։
Թելիկների հաստության և պտտման շառավղի վերաբերյալ կան տարբեր կարծիքներ. մինչ սկզբնական մոդելներն առաջարկում էին 25 Å, ժամանակակից ռենտգենյան հետազոտությունները փաստում են 23.7 Å երկարություն։ Այս ուսումնասիրությունները վկայեցին մոնոմերների միջև փոխազդեցության ճշտգրիտ կետերը։ Նրանցից որոշները ձևավորվում են նույն շղթայի միավորներում՝ մի մոնոմերի փշոտ ծայրի և հաջորդի սրածայր վերջավորության միջև։
F-ակտինային պոլիմերն ունի կառուցվածքային բևեռացում, քանի որ միկրոֆիլամենտների ենթամիավորներն ունեն նույն ուղղվածությունը։ ԱԿՖ կապող հատվածը կոչվում է "(-) վերջավորություն", իսկ նրա հակառակ ծայրը՝ "(+) վերջավորություն[20]։ Միկրոֆիլամենտի ծայրը, որը չունի ցցված միոզին, կոչվում է սլաքի ծայր (- ծայր), իսկ մյուս ծայրը` փշոտ ծայր (+ ծայր)[29]։ S1 ֆրագմենտը կազմված է միոզին II-ի գլխիկով և վզիկով։ Ֆիզիոլոգիական տարբեր վիճակներում ԱԵՖ-ի ներկայությամբ G-ակտինը վերածվում է F-ակտինի[30]։
Մկաններում տեղակայված պարուրաձև F-ակտինի թելերի վրա գտնվում են բազմաթիվ տրոպոմիոզիններ, որոնք 40 նանոմետր երկարությամբ սպիտակուցներ են։ Թուլացած մկաններում տրոպոմիոզինը շրջափակում է ակտինի ակտիվ տարածքները և դրանով խոչընդոտում ակտին-միոզին փոխազդեցությունն ու մկանի կծկումը։ Տրոպոմիոզինին ամրացված են մեկ այլ սպիտակուցի՝ տրոպոնինի մոլեկուլները, որոնք ունեն երեք պոլիմերներ՝ տրոպոնին I, տրոպոնին T և տրոպոնին C[31]:
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 1,2 1,3 1,4 Կաղապար:PDB; Otterbein LR, Graceffa P, Dominguez R (2001 թ․ հուլիս). «The crystal structure of uncomplexed actin in the ADP state». Science. 293 (5530): 708–11. doi:10.1126/science.1059700. PMID 11474115.
- ↑ 2,0 2,1 InterPro Release 71.0 — 71.0 — 2018.
- ↑ Doherty GJ, McMahon HT (2008). «Mediation, modulation, and consequences of membrane-cytoskeleton interactions». Annual Review of Biophysics. 37 (1): 65–95. doi:10.1146/annurev.biophys.37.032807.125912. PMID 18573073.
- ↑ Vindin H, Gunning P (2013 թ․ օգոստոս). «Cytoskeletal tropomyosins: choreographers of actin filament functional diversity». Journal of Muscle Research and Cell Motility. 34 (3–4): 261–74. doi:10.1007/s10974-013-9355-8. PMID 23904035.
- ↑ 5,0 5,1 5,2 5,3 5,4 Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (2015 թ․ հունիս). «The evolution of compositionally and functionally distinct actin filaments». Journal of Cell Science. 128 (11): 2009–19. doi:10.1242/jcs.165563. PMID 25788699.
- ↑ Ghoshdastider U, Jiang S, Popp D, Robinson RC. «In search of the primordial actin filament». Proc Natl Acad Sci U S A. 112 (30): 9150–1. doi:10.1073/pnas.1511568112. PMID 26178194.
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). «Chapter 16: The cytoskeleton». Molecular biology of the cell. New York: Garland Science. էջեր 907–982. ISBN 0-8153-3218-1.
- ↑ Halliburton WD (1887 թ․ օգոստոս). «On Muscle-Plasma». The Journal of Physiology. 8 (3–4): 133–202. PMC 1485127. PMID 16991477.
- ↑ Szent-Gyorgyi A (1945). «Studies on muscle». Acta Physiol Scandinav. 9 (Suppl): 25.
- ↑ 10,0 10,1 Straub FB, Feuer G (1989). «Adenosinetriphosphate. The functional group of actin. 1950». Biochimica Et Biophysica Acta. 1000: 180–95. doi:10.1016/0006-3002(50)90052-7. PMID 2673365.
- ↑ Bárány M, Barron JT, Gu L, Bárány K (2001 թ․ դեկտեմբեր). «Exchange of the actin-bound nucleotide in intact arterial smooth muscle». The Journal of Biological Chemistry. 276 (51): 48398–403. doi:10.1074/jbc.M106227200. PMID 11602582.
- ↑ 12,0 12,1 12,2 Elzinga M, Collins JH, Kuehl WM, Adelstein RS (1973 թ․ սեպտեմբեր). «Complete amino-acid sequence of actin of rabbit skeletal muscle». Proceedings of the National Academy of Sciences of the United States of America. 70 (9): 2687–91. doi:10.1073/pnas.70.9.2687. PMC 427084. PMID 4517681.
- ↑ 13,0 13,1 Kabsch W, Mannherz HG, Suck D, Pai EF, Holmes KC (1990 թ․ սեպտեմբեր). «Atomic structure of the actin:DNase I complex». Nature. 347 (6288): 37–44. doi:10.1038/347037a0. PMID 2395459.
- ↑ 14,0 14,1 Holmes KC, Popp D, Gebhard W, Kabsch W (1990 թ․ սեպտեմբեր). «Atomic model of the actin filament». Nature. 347 (6288): 44–9. doi:10.1038/347044a0. PMID 2395461.
- ↑ Oriol C, Dubord C, Landon F (1977 թ․ հունվար). «Crystallization of native striated-muscle actin». FEBS Letters. 73 (1): 89–91. doi:10.1016/0014-5793(77)80022-7. PMID 320040.
- ↑ Sawaya MR, Kudryashov DS, Pashkov I, Adisetiyo H, Reisler E, Yeates TO (2008 թ․ ապրիլ). «Multiple crystal structures of actin dimers and their implications for interactions in the actin filament». Acta Crystallographica. Section D, Biological Crystallography. 64 (Pt 4): 454–65. doi:10.1107/S0907444908003351. PMC 2631129. PMID 18391412.
- ↑ Narita A, Takeda S, Yamashita A, Maéda Y (2006 թ․ նոյեմբեր). «Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study». The EMBO Journal. 25 (23): 5626–33. doi:10.1038/sj.emboj.7601395. PMC 1679762. PMID 17110933.
- ↑ 18,0 18,1 Oda T, Iwasa M, Aihara T, Maéda Y, Narita A (2009 թ․ հունվար). «The nature of the globular- to fibrous-actin transition». Nature. 457 (7228): 441–5. doi:10.1038/nature07685. PMID 19158791.
- ↑ Ponte P, Gunning P, Blau H, Kedes L (1983 թ․ հոկտեմբեր). «Human actin genes are single copy for alpha-skeletal and alpha-cardiac actin but multicopy for beta- and gamma-cytoskeletal genes: 3' untranslated regions are isotype specific but are conserved in evolution». Molecular and Cellular Biology. 3 (10): 1783–91. doi:10.1128/MCB.3.10.1783. PMC 370040. PMID 6646124.
- ↑ 20,0 20,1 Scott MP, Lodish HF, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, Amon A (2012). Molecular Cell Biology. San Francisco: W. H. Freeman. ISBN 1-4292-3413-X.
- ↑ Hara F, Yamashiro K, Nemoto N, Ohta Y, Yokobori S, Yasunaga T, Hisanaga S, Yamagishi A (2007 թ․ մարտ). «An actin homolog of the archaeon Thermoplasma acidophilum that retains the ancient characteristics of eukaryotic actin». Journal of Bacteriology. 189 (5): 2039–45. doi:10.1128/JB.01454-06. PMC 1855749. PMID 17189356.
- ↑ 22,0 22,1 Graceffa P, Dominguez R (2003 թ․ սեպտեմբեր). «Crystal structure of monomeric actin in the ATP state. Structural basis of nucleotide-dependent actin dynamics». The Journal of Biological Chemistry. 278 (36): 34172–80. doi:10.1074/jbc.M303689200. PMID 12813032.
- ↑ Reisler E (1993 թ․ փետրվար). «Actin molecular structure and function». Current Opinion in Cell Biology. 5 (1): 41–7. doi:10.1016/S0955-0674(05)80006-7. PMID 8448029.
- ↑ «cd00012: ACTIN». Conserved Domain Database. U.S. National Center for Biotechnology Information (NCBI).
- ↑ 25,0 25,1 Collins JH, Elzinga M (1975 թ․ օգոստոս). «The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence». The Journal of Biological Chemistry. 250 (15): 5915–20. PMID 1150665.
- ↑ Rould MA, Wan Q, Joel PB, Lowey S, Trybus KM (2006 թ․ հոկտեմբեր). «Crystal structures of expressed non-polymerizable monomeric actin in the ADP and ATP states». The Journal of Biological Chemistry. 281 (42): 31909–19. doi:10.1074/jbc.M601973200. PMID 16920713.
- ↑ Devlin TM (2006). Bioquimica. Barcelona: Reverté. ISBN 84-291-7208-4.
- ↑ Reisler E, Egelman EH (2007 թ․ դեկտեմբեր). «Actin structure and function: what we still do not understand». The Journal of Biological Chemistry. 282 (50): 36133–7. doi:10.1074/jbc.R700030200. PMID 17965017.
- ↑ Begg DA, Rodewald R, Rebhun LI (1978 թ․ դեկտեմբեր). «The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments». The Journal of Cell Biology. 79 (3): 846–52. doi:10.1083/jcb.79.3.846. PMC 2110270. PMID 569662.
- ↑ Geneser F (1981). Histologi. Munksgaard. էջ 105. ISBN 87-16-08418-7.
- ↑ Hall JE, Guyton AC (2006). Textbook of medical physiology. St. Louis, Mo: Elsevier Saunders. էջ 76. ISBN 0-7216-0240-1.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ակտին» հոդվածին։ |
| ||||||
