Ազոտի օքսիդներ
Ազոտի օքսիդներ, անօրգանական միացություններ են, ազոտի և թթվածնի միացությամբ։ Թթվածնի հետ ազոտն առաջացնում է 6 կայուն միացություն։ Ազոտի բոլոր օքսիդները սովորական պայմաններում գազեր են բացի N2O5 անգույն բյուրեղական նյութ է։
Օքսիդների ցանկ[խմբագրել | խմբագրել կոդը]
Հայտնի են ազոտի 10 օքսիդներ։
-
Ազոտի ենթօքսիդ, N2O -
Ազոտի մոնօքսիդ, NO -
Երկազոտային դիօքսիդ, N2O3 -
Երկազոտայի տետրաօքսիդ N2O4 -
Ազոտական անհիդրիտ, N2O5 -
Եռնիտրոամին, N(NO2)3
Հայտնաբերվելեն նաև ազոտի երկօքսիդի դիմերը (NO2)2 և 4 քիչ կայուն միացությունները՝ նիտրոզիլամիդ NON3, նիտրիլազիդ NO2N3, եռնիտրիամիդ N(NO2)3 և նիտրատի ռադիկալը՝ NO3. ։
N2O[խմբագրել | խմբագրել կոդը]
Բարձր ջերմաստիճանում առաջացնում է ազոտ և թթվածին։ Բարձր կոնցենտրացիայի դեպքում N2O ազդում է նյարդային համակարգի վրա («ուրախացնող գազ»)։ Բժշկության մեջ օգտագործում են N2O, որպես թույլ անզգայացնող միջոց։ N2O անվանում են նաև ազոտային օքսիդ։ Ազոտային օքսիդը երբեմն օգտագործում են ներքին այրման շարժիչների բարելավամ և տաքացման համար։
NO[խմբագրել | խմբագրել կոդը]
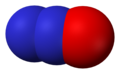
Ազոտի օքսիդը NO (ազոտի մոնօքսիդ), անգույն գազ է, ջրում քիչ լուծվող։ Չի փոխազդում ջրի, թթուների, ալկալիների հետ։ Ազոտի (II) օքսիդը միացություններում շատ ռեակցունակ է, կարող է ռեակցիայի մեջ մտնել մի շարք աղերի, հալոգենների, օրգանական միացությունների հետ։ Սովարական ջերմաստիճանում NO փոխազդում է թթվածնի հետ առաջացնելով NO2։ NO օքսիդը ստանում են ամոնիակի կատալիտիկ օքսիդացումով, ազոտական թթվի արտադրությունում։
N2O3(III)[խմբագրել | խմբագրել կոդը]
N2O3 օքսիդը (ազոտի անհիդրիդ), մուգ կապույտ հեղուկ է, փոխազդում է ջրի հետ առաջացնելով ազոտային թթու HNO2։
NO2(IV)[խմբագրել | խմբագրել կոդը]
NO2 ազոտի օքսիդը (ազոտի երկօքսիդ), գորշ, թունավոր, օդից ծանր, հեշտ հեղուկացող գազ է։ Սենյակային ջերմաստիճանում NO2 խառնուրդը խառնվում է անգույն դիմերի N2O4 հետ, մոտավորապես 1։1 հարաբերությամբ։ Փոխազդում է ջրի հետ.
և նատրիումի հիդրօքսիդի հետ.
Ուժեղ օքսիդիչ է։ Շատ նյութեր (ածուխ, ծծումբ, ֆոսֆոր, օրգանական միացություններ) կարող են այրվել NO2 օքսիդում։ Այս օքսիդը օքսիդացնում է SO2 օքսիդը մինչև SO3 օքսիդի, այս ռեակցիայի արդյունքում ստացվում է ծծմբային թթու։ Այս օքսիդը կարող է նյարդայնացնել շնչառական ուղիները, իսկ բարձր կոնցենտրացիայի դեպքում առաջանում է թոքային էմբոլյա։
N2O5(V)[խմբագրել | խմբագրել կոդը]
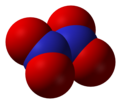
N2O5 ազոտի օքսիդը, անգույն, բյուրեղային պինդ նյութ է, հեշտությամբ կարող է փոխազդում է NO2 և О2 նյութերի հետ։ Ուժեղ օքսիդացնող է։ Ջրում հեշտությամբ լուծվում է առաջանելով ազոտական թթու HNO3։
N(NO2)3[խմբագրել | խմբագրել կոդը]
Ստացվել է վերջերս։ Ուսումնասիրվել է միայն սպեկտրալ եղանակը։
| Ազոտի օքսիդներ | Փորձառական բանաձևը | Անվանումը |
| +5 | N2O5 | Ազոտական անհիդրիտ |
| +4 | NO2 (*) Կապված է դիպերի հետ[2] N2O4 |
Երկազոտայի տետրաօքսիդ Ազոտի պերօքսիդ |
| +3 | N2O3 | Երկազոտային դիօքսիդ |
| +2 | NO | Ազոտի մոնօքսւդ |
| +1 | N2O | Ազոտի ենթօքսիդ (Ազոտային օքսիդ) |
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
Գրականություն[խմբագրել | խմբագրել կոդը]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 124)։ |
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ազոտի օքսիդներ» հոդվածին։ |
| ||||||