Լիգանդի կոնային անկյուն
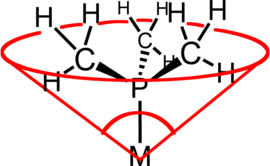
Կոորդինացիոն քիմիայում լիգանդի կոնային անկյունը (θ) անցումային մետաղի կոորդինացիոն կոմպլեքսում լիգանդի ստերիկ մեծության չափն է։ Այն սահմանվում է պինդ անկյուն, որը ձևավորվում է մետաղի հետ կոնի գագաթին և լիգանդի ատոմների վան դեր Վալսյան գնդերի ամենաեզրին կոնի հիմքի պարագծին։ Երրորդային ֆոսֆինի լիգանդները սովորաբար դասակարգվում են այս պարամետրով, սակայն մեթոդը կարող է կիրառվել ցանկացած լիգանդի նկատմամբ։ Կոնային անկյուն տերմինն առաջին անգամ ներմուծել է DuPont-ի հետազոտող քիմիկոս Չադվիկ Ա. Տոլմանը։ Տոլմանը ի սկզբանե մշակել է նիկելի կոմպլեքսներում ֆոսֆինի լիգանդների մեթոդը՝ դրանք որոշելով ճշգրիտ ֆիզիկական մոդելների չափումներից[1][2][3]
Անհամաչափ ձևեր[խմբագրել | խմբագրել կոդը]
Կոնային անկյուն հասկացությունը ամենահեշտ nերկայացվում է համաչափ լիգանդներով, օրինակ. PR3. Սակայն մոտեցումը կատարելագործվել է՝ ներառելով PRR′R″ տիպի ավելի քիչ համաչափ լիգանդներ, ինչպես նաև դիֆոսֆիններ։ Նման ասիմետրիկ դեպքերում փոխարինող անկյունների կիսանկյունները՝ θi2, միջինացվում են, այնուհետև կրկնապատկվում են՝ գտնելու ընդհանուր կոնի անկյունը՝ θ: Դիֆոսֆինների դեպքում հիմքի θi2-ը մոտավոր է որպես կելատի անկյան կեսը՝ ենթադրելով համապատասխանաբար մեթիլեն, էթիլեն և պրոպիլեն հիմք ունեցող դիֆոսֆինների անկյունը 74°, 85° և 90° է։ Մանցի կոնային անկյունը հաճախ ավելի հեշտ է հաշվարկել, քան Տոլմանի կոնային անկյունը[4]։
| Լիգանդ | Անկյուն (°) |
|---|---|
| PH3 | 87[1] |
| PF3 | 104[1] |
| P(OCH3)3 | 107[1] |
| dmpe | 107 |
| depe | 115 |
| P(CH3)3 | 118[1] |
| dppm | 121 |
| dppe | 125 |
| dppp | 127 |
| P(CH2CH3)3 | 132[1] |
| dcpe | 142 |
| P(C6H5)3 | 145[1] |
| P(cyclo-C6H11)3 | 179[1] |
| P(t-Bu)3 | 182[1] |
| P(C6F5)3 | 184[1] |
| P(C6H4-2-CH3)3 | 194[1] |
| P(2,4,6-Me3C6H2)3 | 212 |
Տարբերակներ[խմբագրել | խմբագրել կոդը]
Տոլմանի կոնային անկյան մեթոդը ենթադրում է կապի էմպիրիկ տվյալները և սահմանում է պարագիծը որպես իդեալականացված ազատ պտտվող փոխարինողի առավելագույն հնարավոր սահմանագիծ։ Մետաղ-լիգանդ կապի երկարությունը Տոլմանի մոդելում էմպիրիկորեն որոշվել է քառաեդրային նիկելի կոմպլքսների բյուրեղային կառուցվածքներից։ Ի հակադրություն, պինդ անկյուն հասկացությունը էմպիրիկ պինդ վիճակի բյուրեղային կառուցվածքներից ստանում է կապի երկարությունը և պարագիծը[5][6]։ Յուրաքանչյուր համակարգ ունի առավելություններ։
Եթե լիգանդի երկրաչափությունը հայտնի է, կա՛մ բյուրեղագրության, կա՛մ հաշվարկների միջոցով, կարելի է հաշվարկել կոնի ճշգրիտ անկյունը (θ)[7][8][9]: Երկրաչափության վերաբերյալ ենթադրություններ չեն արվում՝ ի տարբերություն Տոլմանի մեթոդի։
Կիրառություն[խմբագրել | խմբագրել կոդը]
Կոնային անկյուն հասկացությունը գործնական նշանակություն ունի համասեռ կատալիզում, քանի որ լիգանդի չափը ազդում է կցված մետաղական կենտրոնի ռեակտիվության վրա։ Օրինակ[10], հիդրոֆորմիլացման կատալիզատորների ընտրողականության վրա մեծ ազդեցություն ունի կոլիգանդների չափը։ Չնայած միավալենտ լինելուն, որոշ ֆոսֆիններ բավականաչափ մեծ են, որպեսզի զբաղեցնեն մետաղական կենտրոնի կոորդինացիոն տարածքի կեսից ավելին։ Վերջին հետազոտությունները պարզել են, որ այլ նկարագրիչներ, ինչպիսիք են թաղված ծավալի տոկոսը, ավելի ճշգրիտ են, քան կոնային անկյունը, ֆոսֆինային լիգանդի(ների) համապատասխան ստերիկ ազդեցությունը մետաղական կենտրոնի հետ կապված լինելու դեպքում[11]։
Ծանոթագրություներ[խմբագրել | խմբագրել կոդը]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 Tolman, Chadwick A. (1970 թ․ մայիսի 1). «Phosphorus ligand exchange equilibriums on zerovalent nickel. Dominant role for steric effects». J. Am. Chem. Soc. 92 (10): 2956–2965. doi:10.1021/ja00713a007.
- ↑ Tolman, C. A.; Seidel, W. C.; Gosser, L. W. (1974 թ․ հունվարի 1). «Formation of three-coordinate nickel(0) complexes by phosphorus ligand dissociation from NiL4». J. Am. Chem. Soc. 96 (1): 53–60. doi:10.1021/ja00808a009.
- ↑ Tolman, C. A. (1977). «Steric Effects of Phosphorus Ligands in Organometallic Chemistry and Homogeneous Catalysis». Chem. Rev. 77 (3): 313–48. doi:10.1021/cr60307a002.
- ↑ Manz, T. A.; Phomphrai, K.; Medvedev, G.; Krishnamurthy, B. B.; Sharma, S.; Haq, J.; Novstrup, K. A.; Thomson, K. T.; Delgass, W. N.; Caruthers, J. M.; Abu-Omar, M. M. (2007). «Structure−Activity Correlation in Titanium Single-Site Olefin Polymerization Catalysts Containing Mixed Cyclopentadienyl/Aryloxide Ligation». J. Am. Chem. Soc. 129 (13): 3776–3777. doi:10.1021/ja0640849. PMID 17348648.
- ↑ Immirzi, A.; Musco, A. (1977). «A method to measure the size of phosphorus ligands in coordination complexes». Inorg. Chim. Acta. 25: L41–L42. doi:10.1016/S0020-1693(00)95635-4.(չաշխատող հղում)
- ↑ Niksch, Tobias; Görls, Helmar; Weigand, Wolfgang (2009). «The Extension of the Solid-Angle Concept to Bidentate Ligands». Eur. J. Inorg. Chem. 2010 (1): 95–105. doi:10.1002/ejic.200900825.
- ↑ «AaronTools». aarontools.readthedocs.io. Վերցված է 2023 թ․ մայիսի 30-ին.
- ↑ Bilbrey, Jenna A.; Kazez, Arianna H.; Locklin, J.; Allen, Wesley D. (2013). «Exact ligand cone angles». Journal of Computational Chemistry. 34 (14): 1189–1197. doi:10.1002/jcc.23217. PMID 23408559. S2CID 23864226.
- ↑ Petitjean, Michel (2015). «Analytical Algorithms for Ligand Cone Angles Calculations. Application to Triphenylphosphine Palladium Complexes». Comptes Rendus Chimie. 18 (6): 678–684. doi:10.1016/j.crci.2015.04.004.
- ↑ Evans, D.; Osborn, J. A.; Wilkinson, G. (1968). «Hydroformylation of Alkenes by Use of Rhodium Complex Catalyst». Journal of the Chemical Society. 33 (21): 3133–3142. doi:10.1039/J19680003133.
- ↑ Newman-Stonebraker, Samuel H.; Smith, Sleight R.; Borowski, Julia E.; Peters, Ellyn; Gensch, Tobias; Johnson, Heather C.; Sigman, Matthew S.; Doyle, Abigail G. (2021). «Univariate classification of phosphine ligation state and reactivity in cross-coupling catalysis». Science. 374 (6565): 301–308. Bibcode:2021Sci...374..301N. doi:10.1126/science.abj4213. PMID 34648340. S2CID 238991361.

