Մրջնաթթու
| Մրջնաթթու | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | մրջնաթթու |
| Ավանդական անվանում | մեթանաթթու |
| Քիմիական բանաձև | CH₂O₂ |
| Ռացիոնալ բանաձև | CH2O2 |
| Մոլային զանգված | 7,6E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,22 ± 0,01 գ/սմ³[2] գ/սմ³ |
| Դինամիկ մածուցիկություն | 0,16 պուազեյլ Պա/վ |
| Իոնիզացման էներգիա | 11,05 ± 0,01 Էլեկտրոն-վոլտ[2] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 8,25 °C, 8 °C[3] և 8,3 °C[4] °C |
| Եռման ջերմաստիճան | 100,7 °C և 101 °C[4] °C |
| Այրման ջերմաստիճան | 122 ± 1 ℉[2] |
| Ինքնաբռնկման ջերմաստիճան | 520 °C |
| Եռյակ կետ | 281,40 K (8,25 °C), 2,2 ԿՊա |
| Կրիտիկական ճնշում | 588 K (315 °C), 5,81 ՄՊա մթն. |
| Մոլյար ջերմատարողություն | 98,74 Ջ/(մոլ•Կ) |
| Գոյացան էնթալպիա | −234,8 կՋ/մոլ |
| Գոլորշու ճնշում | 35 ± 1 mm Hg[2] |
| Քիմիական հատկություններ | |
| pKa | 3,81 ± 0,01[5] |
| Բեկման ցուցիչ | 1,3714 |
| Դիպոլ մոմենտ | 4,7E−30 Կլ·մ[4] |
| Դասակարգում | |
| CAS համար | 64-18-6 |
| PubChem | 284 |
| EINECS համար | 200-579-1 |
| SMILES | C(=O)O |
| ЕС | 200-579-1 |
| RTECS | LQ4900000 |
| ChEBI | 278 |
| IDLH | 56,4 ± 0,1 mg/m³[2] |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Մրջնաթթու (միջազգային անվանումը՝ մեթանաթթու), սահմանային թթուների հոմոլոգիական շարքի առաջին անդամն է, պարզագույն միահիմն կարբոնաթթու։ Գրանցված է որպես սննդամթերքի հավելում՝ E236 նշանակությամբ։
Բանաձևը՝ ։
Անվանում[խմբագրել | խմբագրել կոդը]
Մրջնաթթուն իր անունը ստացել է այն պատճառով, որ առաջին անգամ հայտնաբերվել է մրջյուններում (17-րդ դարում), օրինակ Formica rufa կարմիր անտառային մրջյունի գեղձի արտաթորանքում։ Մրջնաթթուն պարունակվում է մրջյունների խայթիչ արտաթորանքներում, եղինծում և եղևնու փշատերևում։ Այստեղից էլ առաջացել է նրա լատին․՝ acidium formicum անվանումը, դրա համար էլ մրջնաթթվի աղերն անվանում են ֆորմիատներ։
Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Սուր հոտով, անգույն հեղուկ է, խտությունը՝ 1212,6 կգ/մ³, հալման ջերմաստիճանը՝ 8,25 °C, եռմանը՝ 100,7 °C։ Անսահմանափակ քանակով լուծվում է ջրում և սպիրտում։ Ջրի հետ առաջացնում է ազեոտրոպ խառնուրդ (77,4% մրջնաթթու, եռման ջերմաստիճանը՝ 107,2 °C)։ Ամենաուժեղ ճարպաթթուն է, մաշկի վրա առաջացնում է այրվածք։ Ունի կարբոնաթթուներին բնորոշ քիմիական հատկություններ։ Մրջնաթթվի աղերը և էսթերները կոչվում են ֆորմիատներ։ Վերականգնիչ է, տալիս է «արծաթահայելու» ռեակցիան։
| Գոլորշի ճնշումը | 120 մմ ս. ս. (50 °C-ում) |
| Էնթալպիայի ձևավորում ΔH | −409,19 կՋ/մոլ (հեղ.) (298 К-ում) |
| Գիբբսի ստանդարդ էներգիայի ձևավորումը G | −346 կՋ/մոլ (հեղ.) (298 К-ում) |
| Նորմալ Էնտրոպիայի ձևավորումը S | 128,95 Ջ/մոլ·K (հեղ.) (298 К-ում) |
| Ստանդարտ մոլային ջերմունակություն Cp | 98,74 Ջ/մոլ·K (հեղ) (298 К-ում) |
| Հալման էնթալպիա ΔHհալ | 12,72 կՋ/մոլ |
| եռման էնթալպիա ΔHեռ | 22,24 կՋ/մոլ |
| Այրման ջերմություն -ΔH°298 (վերջանյութ CO2, H2O) | 254,58 կՋ/մոլ |
| ω(H2CO2) | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 22 | 26 | 30 |
| ρ, գ/սմ³ | 1,0020 | 1,0045 | 1,0094 | 1,0142 | 1,0197 | 1,0247 | 1,0297 | 1,0346 | 1,0394 | 1,0442 | 1,0538 | 1,0634 | 1,0730 |
| 15 | 20 | 30 | |
| σ, Ն/մ | 3,813×10−2 | 3,758×10−2 | 3,648×10−2 |
| Ճնշում, կՊա (մմ ս. ս.) | 0,133(1) | 0,667(5) | 1,333(10) | 2,666(20) | 5,333(40) |
| Tкип, °C | −20,0 | −5,0 | +2,1 | 10,3 | 24,0 |
| Ճնշումը, կՊա (մմ ս. ս.) | 7,999(60) | 13,333(100) | 26,66(200) | 53,33(400) | 101,32(760) |
| Tкип, °C | 32,4 | 43,8 | 61,4 | 80,3 | 100,7 |

| Մոլայի թիվ H2O 1 մոլ HCOOH | m, մոլ HCOOH 1 կգ-ում H2O | -ΔHm, կՋ/մոլ |
|---|---|---|
| 1 | 55,51 | 0,83 |
| 2 | 27,75 | 0,87 |
| 3 | 18,50 | 0,79 |
| 4 | 13,88 | 0,71 |
| 5 | 11,10 | 0,67 |
| 6 | 9,25 | 0,62 |
| 8 | 6,94 | 0,58 |
| 10 | 5,55 | 0,56 |
| 15 | 3,70 | 0,55 |
| 20 | 2,78 | 0,55 |
| 30 | 1,85 | 0,56 |
| 40 | 1,39 | 0,57 |
| 50 | 1,11 | 0,60 |
| 75 | 0,740 | 0,65 |
| 100 | 0,555 | 0,66 |
| ∞ | 0,0000 | 0,71 |
Ստացում[խմբագրել | խմբագրել կոդը]
Արդյունաբերության մեջ մրջնաթթուն ստացվում է բարձր ճնշման և ջերմաստիճանի պայմաններում ածխածնի (II) օքսիդի ու կալիումի հիդրօքսիդի փոխազդեցությամբ։ Ստանում են նաև մեթանի կատալիտիկ օքսիդացմամբ, Н20 + С0 սինթեզով և հիմնականում NaOH-ի և CO-ի փոխազդեցությամբ (120- 150°С, 6-8 մթն, առաջանում է նատրիումի ֆորմիատ, որից մրջնաթթու անջատվում են ծծմբական թթվով).
- Կալիումի ֆորմիատից ազատ թթուն դուրս է մղվում ավելի ուժեղ հանքային թթվով.
- Մեթանի կատալիտիկ օքսիդացումով.
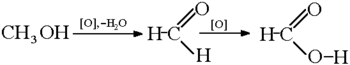
Քիմիական հատկություններ[խմբագրել | խմբագրել կոդը]
Ի տարբերություն մյուս կարբոնաթթուների, միջին ուժեղության թթու է, որը պայմանավորված է կարբօքսիլային խմբին միացած ջրածնի ատոմի փոքր էլեկտրադրական ինդուկցիայով։ Մրջնաթթուն մտնում է կարբոնաթթուներին բնորոշ ռեակցիաների մեջ, միաժամանակ օժտված է որոշ յուրահատկություններով, որոնք պայմանավորված են ածխաջրածնային ռադիկալի բացակայությամբ։ Մրջնաթթուն հեշտությամբ օքսիդանում է առաջացնելով ածխաթթու գազ և ջուր.
Սննդարդյունաբերության մեջ մրջնաթթվի այդ հատկությունը օգտագործում են նիկել կատալիզատորի ստացման համար, որը, մասնավորապես կիրառվում է ճարպերի հիդրոգենման ժամանակ.
Սուլեմայի լուծույթը տաքացնելիս, որը թթվեցրած է մրջնաթթվի լուծույթով, սկզբում սուլեման վերականգնվելով վերածվում է կալոմելի, ապա մետաղական սնդիկի՝
Մրջնաթթվի սնդիկային աղերը տաքացնելիս սնդիկը վերականգնվում է մինչև ազատ մետաղ, իսկ ածխածնի կեսը օքսիդանալով առաջացնում է ածխաթթու գազ՝
Խիտ ծծմբական թթվով ազդելիս մրջնաթթուն քայքայվում է ածխածնի մոնօքսիդի[6] և ջրի՝
Կիրառություն[խմբագրել | խմբագրել կոդը]
Սննդարդյունաբերության մեջ մրջնաթթվի այդ հատկությունը օգտագործում են նիկել կատալիզատորի ստացման համար, որը, մասնավորապես կիրառվում է ճարպերի հիդրոգենման ժամանակ։
Մրջնաթթու կիրառվում է օրգանական սինթեզում, արծնիչային ներկման, կաշվի վերամշակման, մրգահյութերի պահածոյացման, սարքավորումների ախտահանման համար[7]։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 formic acid
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 http://www.cdc.gov/niosh/npg/npgd0296.html
- ↑ 3,0 3,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ 4,0 4,1 4,2 4,3 4,4 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Flash P. Small Scale Determination of the pKa Values for Organic Acids // J. Chem. Educ. — ACS, 1994. — Vol. 71, Iss. 1. — P. A6. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED071PA6
- ↑ Разложение муравьиной кислоты — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Красильников А. П. Справочник по антисептике. — Минск, 1995.
Գրականություն[խմբագրել | խմբագրել կոդը]
- Օրգանական քիմիայի դասընթաց, Բ. Ա. Պավլով, Ա. Պ. Տերենտև
- Ameisensäure, Formiate, Diglykol-bis–chlorformiat. VCH, Weinh, ISBN 3-527-28529-6.
- Ausgewählte C-H-O Radikale. Ameisensäure. Essigsäure. Oxalsäure (Gmelin Handbook of Inorganic and Organometallic Chemistry - 8th edition ELEM C TL C LFG 4). Springer Verlag, ISBN 3-540-93283-6.
- Gundula Jänsch-Kaiser und Dieter Behrens։ Ameisensäure und Erdalkalihydroxide. DECHEMA Gesellschaft für Chemische Technik und Biotechnologie e.V., ISBN 3-926959-00-2.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- Carbon monoxide as reagent in the formylation of aromatic compounds Արխիվացված 2005-05-01 Wayback Machine.
- International Chemical Safety Card 0485.
- NIOSH Pocket Guide to Chemical Hazards.
- ChemSub Online (Formic acid).
- Formic Acid Use in Beekeeping: Handbook and Manual of Treatments.
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Մրջնաթթու» հոդվածին։ |
| ||||||||||
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 8, էջ 67)։ |









