«Գլիցերին»–ի խմբագրումների տարբերություն
չ Մաքրում եմ կաղապարներում կրկնվող արգումենտ(ներ)ը՝ օգտագործելով findargdups գործիքը |
|||
| Տող 25. | Տող 25. | ||
| էլ. դիմ գործակից = |
| էլ. դիմ գործակից = |
||
| ձայնի արագություն = |
| ձայնի արագություն = |
||
| մոլային զանգված = |
|||
| խտություն = |
|||
| հալման ջերմ. = |
|||
| եռման ջերմ. = |
|||
| բռնկման ջերմ. = |
| բռնկման ջերմ. = |
||
| ջերմատարողություն = |
| ջերմատարողություն = |
||
| ձևավորման էնթալպիա = |
|||
| լուծելիություն = |
|||
<!-- Ջերմային հատկություններ --> |
<!-- Ջերմային հատկություններ --> |
||
| հալման ջերմ. = 18 |
| հալման ջերմ. = 18 |
||
| Տող 39. | Տող 33. | ||
| եռման ջերմ. = 290 |
| եռման ջերմ. = 290 |
||
| եռման ջերմ. բն. = |
| եռման ջերմ. բն. = |
||
| տրոհման ջերմ. = |
|||
| տրոհման ջերմ. = |
| տրոհման ջերմ. = |
||
| ֆազային անցումներ = |
| ֆազային անցումներ = |
||
| այրման ջերմ. = |
| այրման ջերմ. = |
||
| բյուրեղացման ջերմ. = |
| բյուրեղացման ջերմ. = |
||
| բռնկման ջերմ. = |
|||
| ինքնաայրման ջերմ. = |
| ինքնաայրման ջերմ. = |
||
| գազի ճնշում = |
| գազի ճնշում = |
||
| Տող 60. | Տող 52. | ||
| ջերմահաղորդականություն = |
| ջերմահաղորդականություն = |
||
| կրիտիկական խտություն = |
| կրիտիկական խտություն = |
||
| ջերմատարողություն = |
|||
| կրիտիկական ճնշում = |
| կրիտիկական ճնշում = |
||
| եռակի կետ = |
| եռակի կետ = |
||
<!-- Քիմիական հատկություններ --> |
<!-- Քիմիական հատկություններ --> |
||
| թթվի չեզոք. հաստ. = |
| թթվի չեզոք. հաստ. = |
||
| լուծելիություն = |
|||
| լուծելիություն = |
| լուծելիություն = |
||
| լուծելիություն1 = |
| լուծելիություն1 = |
||
20:59, 18 Հունիսի 2015-ի տարբերակ
| Գլիցերին | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Պրոպանտրիոլ-1,2,3 |
| Ավանդական անվանում | Գլիցերին |
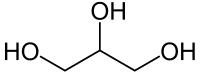
| Քիմիական բանաձև | HOCH2-CH(OH)-CH2OH |
| Ռացիոնալ բանաձև | C3H5(OH)3 |
| Ֆիզիկական հատկություններ | |
| Մոլային զանգված | 92,1 գ/մոլ |
| Խտություն | 1,261 գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 18 °C |
| Կազմալուծման ջերմաստիճան | 554 ± 1 ℉[1] |
| Եռման ջերմաստիճան | 290 °C |
| Այրման ջերմաստիճան | 320 ± 1 ℉[1] և 160 °C |
| Գոլորշու ճնշում | 0,003 ± 0,001 mm Hg[1] |
| Օպտիկական հատկություններ | |
| Բեկման ցուցիչ | 1,4729 |
| Դասակարգում | |
| CAS համար | 56-81-5 |
| PubChem | 753 |
| EINECS համար | 200-289-5 |
| SMILES | OCC(O)CO |
| ЕС | 200-289-5 |
| RTECS | MA8050000 |
| ChEBI | 733 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Գլիցերին, (1,2,3-տրիօքսիպրոպան, պրոպանտրիոլ-1,2,3), եռատոմ սպիրտների պարզ ներկայացուցիչ։ Իրենից ներկայացնում է մածուցիկ, թափանցիկ հեղուկ։
Ֆիզիկական հատկություններ
Գլիցերինը անգույն, մածուցիկ, շատ հիգրոսկոպիկ հեղուկ է։ Ունի քաղցր համ, այստեղից էլ ստացել է իր անվանումը(գլիկոս-քաղցր)։
Քիմիական հատկություններ
Գլիցերինը ունի տիպիկ բազմատոմ սպիրտներին բնորոշ քիմիական հատկություններ։ Գլիցերինի փոխազդեցությունը հալոգենաջրածինների կամ ֆոսֆորի հալոգենիդների հետ ընթանում է մոնո- և դիհալոգենացմամաբ։ Գլիցերինը փոխազդում է կարբոնաթթուների և հանքային թթուների հետ։ Օրինակ ազոտական թթվի հետ փոխազդելիս, գլիցերինն առաջացնում է եռնիտրատ-նիտրոգլիցերին(ստացել է Ասկանյո Սոբրերոն, 1847 թվականին), օգտագործվում է մեր ժամանակներում անծուխ վառոդ ստանալու նպատակով։ Գլիցերինը դեհիդրատացնելիս այն վեր է ածվում թունավոր ակրոլեինի.
- HOCH2-CH(OH)-CH2OH H2C=CH-CHO + 2 H2O
Այն օքսիդանում է մինչև գլիցերինային ալդեհիդ CH2OHCHOHCHO, դիհիդրօքսիացետոն CH2OHCOCH2OH կամ գլիցերինաթթու CH2OHCHOHCOOH։ Գլիցերինի և բարձրագույն կարբոնաթթուների եթերները՝ ճարպերը հանդիսանում են շատ կարևոր միացություններ մարդու համար, կարևոր կենսաբանական դեր են խաղում նաև ֆոսֆոլիպիդները։
Ստացում
Գլիցերին առաջին անգամ ստացել է Շելեն 1779 թվականին, ճարպերի օճառացմամբ։ Գլիցերինի հիմնական մասը ստանում են ճարպերի օճառացումից։ Գլիցերինի ստացման սինթետիկ եղանակների հիմնական մասը հիմնված է պրոպիլենի օգտագործման վրա։ 450-500 °C ջերմաստիճաններում պրոպիլենի քլորացումից ստանում են ալիլքլորիդ, HClO-ի հետ միանալիս առաջանում են քլորհիդրիններ, օրինակ՝ CH2ClCHOHCH2Cl, որը ալկալիով մշակելիս առաջանում է գլիցերին։ Գլիցերին կարելի է ստանալ նաև օսլայի հիդրոլիզի միջոցով, առաջացած մոնոսախարիդների հիդրատացմամբ կամ շաքարների սպիրտային խմորումից։

Գլիցերինի ածանցյալներ
Գլիցերիդներ
Եռգլիցերիդները հանդիսանում են գլիցերինի ածանցյալներ։ Եռգլիցերիդները հանդիսանում են կարևոր բաղադրիչ՝ կենդանի օրգանիզմներում նյութափոխանակության գործընթացներում։
Ճարպեր և յուղեր
Ճարպերը և յուղերը հիդրոֆոբ միացություններ են, ջրում անլուծելի, այնպես ինչպես գլիցերինի մոլեկուլում հիդրօքսիլ խմբերը փոխարինված են ճարպաթթուների մնացորդներով։
Կիրառություն
Գլիցերինի կիրառության ոլորտները շատ բազմազան են։ Օգտագործվում է սննդային հավելանյութերում, լվացող և կոսմետիկ միջոցներում, պլաստմասսաների արտադրությունում, ներկանյութերի արտադրությունում, էլեկտրատեխնիկայում, ռադիոտեխնիկայում և այլն։ Համարակալված է որպես սննդային հավելում [2]։ Գլիցերինը օգտագործվում է նաև դինամիտի ստացման համար։
Կայքեր
Ռուսերեն և անգլերեն լեզուներով.
Անգլերեն լեզվով.
- What is Glycerin?
- Glossary for the Modern Soap Maker
- Glycerol soap
- Absolute alcohol using glycerol
- Computational Chemistry Wiki
- Health.gov dietary guidelines
Ծանոթագրություններ
| ||||||||||||||||||||||||||||||

