«Մրջնաթթու»–ի խմբագրումների տարբերություն
No edit summary |
չ կետադրություն, փոխարինվեց: : → ։ (10) |
||
| Տող 108. | Տող 108. | ||
}} |
}} |
||
'''Մրջնաթթու''' (միջազգային անվանումը՝ '''մեթանաթթու'''), սահմանային [[թթուներ]]ի հոմոլոգիական շարքի առաջին անդամն է, պարզագույն միահիմն [[Կարբոնաթթուներ|կարբոնաթթու]]։ Գրանցված է որպես սննդամթերքի հավելում՝ '''E236''' |
'''Մրջնաթթու''' (միջազգային անվանումը՝ '''մեթանաթթու'''), սահմանային [[թթուներ]]ի հոմոլոգիական շարքի առաջին անդամն է, պարզագույն միահիմն [[Կարբոնաթթուներ|կարբոնաթթու]]։ Գրանցված է որպես սննդամթերքի հավելում՝ '''E236''' նշանակությամբ։ |
||
Բանաձևը՝ <math> {HCOOH}</math> |
Բանաձևը՝ <math> {HCOOH}</math>։ |
||
== Անվանում == |
== Անվանում == |
||
Մրջնաթթուն իր անունը ստացել է այն պատճառով, որ առաջին անգամ հայտնաբերվել է [[մրջյուններ]]ում ([[17-րդ դար]]ում), օրինակ ''Formica rufa'' կարմիր անտառային մրջյունի գեղձի |
Մրջնաթթուն իր անունը ստացել է այն պատճառով, որ առաջին անգամ հայտնաբերվել է [[մրջյուններ]]ում ([[17-րդ դար]]ում), օրինակ ''Formica rufa'' կարմիր անտառային մրջյունի գեղձի արտաթորանքում։ Մրջնաթթուն պարունակվում է մրջյունների խայթիչ արտաթորանքներում, եղինծում և եղևնու փշատերևում։ Այստեղից էլ առաջացել է նրա {{lang-lat|acidium formicum}} անվանումը, դրա համար էլ մրջնաթթվի աղերն անվանում են ֆորմիատներ։ |
||
== Ֆիզիկական հատկություններ == |
== Ֆիզիկական հատկություններ == |
||
Սուր հոտով, անգույն հեղուկ է, [[խտություն]]ը՝ 1212,6 կգ/մ³, հալման ջերմաստիճանը՝ 8,25 °C, եռմանը՝ 100,7 °C։ Անսահմանափակ քանակով լուծվում է ջրում և [[սպիրտ]]ում։ Ջրի հետ առաջացնում է ազեոտրոպ խառնուրդ (77,4% մրջնաթթու, եռման ջերմաստիճանը՝ 107,2 °C)։ Ամենաուժեղ [[Ճարպաթթուներ|ճարպաթթուն]] է, մաշկի վրա առաջացնում է այրվածք։ Ունի կարբոնաթթուներին բնորոշ քիմիական հատկություններ։ Մրջնաթթվի [[աղեր]]ը և էսթերները կոչվում են ֆորմիատներ։ Վերականգնիչ է, տալիս է «արծաթահայելու» ռեակցիան։ |
Սուր հոտով, անգույն հեղուկ է, [[խտություն]]ը՝ 1212,6 կգ/մ³, հալման ջերմաստիճանը՝ 8,25 °C, եռմանը՝ 100,7 °C։ Անսահմանափակ քանակով լուծվում է ջրում և [[սպիրտ]]ում։ Ջրի հետ առաջացնում է ազեոտրոպ խառնուրդ (77,4% մրջնաթթու, եռման ջերմաստիճանը՝ 107,2 °C)։ Ամենաուժեղ [[Ճարպաթթուներ|ճարպաթթուն]] է, մաշկի վրա առաջացնում է այրվածք։ Ունի կարբոնաթթուներին բնորոշ քիմիական հատկություններ։ Մրջնաթթվի [[աղեր]]ը և էսթերները կոչվում են ֆորմիատներ։ Վերականգնիչ է, տալիս է «արծաթահայելու» ռեակցիան։ |
||
{| border="1" cellspacing="0" cellpadding="1" |
{| border="1" cellspacing="0" cellpadding="1" |
||
|+Մրջնաթթվի հատկությունները |
|+Մրջնաթթվի հատկությունները |
||
|Գոլորշի ճնշումը||120 մմ ս. ս. (50 |
|Գոլորշի ճնշումը||120 մմ ս. ս. (50 °C-ում) |
||
|- |
|- |
||
|Էնթալպիայի ձևավորում ΔH||−409,19 կՋ/մոլ (հեղ.) (298 К-ում) |
|Էնթալպիայի ձևավորում ΔH||−409,19 կՋ/մոլ (հեղ.) (298 К-ում) |
||
| Տող 136. | Տող 136. | ||
|Այրման ջերմություն -ΔH°<sub>298</sub> (վերջանյութ CO<sub>2</sub>, H<sub>2</sub>O)||254,58 կՋ/մոլ |
|Այրման ջերմություն -ΔH°<sub>298</sub> (վերջանյութ CO<sub>2</sub>, H<sub>2</sub>O)||254,58 կՋ/մոլ |
||
|} |
|} |
||
<br /> |
|||
{| border="1" cellspacing="0" cellpadding="1" |
{| border="1" cellspacing="0" cellpadding="1" |
||
|+Մրջնաթթվի խտությունը ջրային լուծույթներում 20 |
|+Մրջնաթթվի խտությունը ջրային լուծույթներում 20 °C ջերմաստիճանում |
||
|'''ω(H<sub>2</sub>CO<sub>2</sub>)'''||1||2||4||6||8||10||12||14||16||18||22||26||30 |
|'''ω(H<sub>2</sub>CO<sub>2</sub>)'''||1||2||4||6||8||10||12||14||16||18||22||26||30 |
||
|- |
|- |
||
|'''ρ, գ/սմ³'''||1,0020||1,0045||1,0094||1,0142||1,0197||1,0247||1,0297||1,0346||1,0394||1,0442||1,0538||1,0634||1,0730 |
|'''ρ, գ/սմ³'''||1,0020||1,0045||1,0094||1,0142||1,0197||1,0247||1,0297||1,0346||1,0394||1,0442||1,0538||1,0634||1,0730 |
||
|} |
|} |
||
<br /> |
|||
{| border="1" cellspacing="0" cellpadding="1" |
{| border="1" cellspacing="0" cellpadding="1" |
||
| Տող 152. | Տող 150. | ||
|'''σ, Ն/մ'''||3,813{{e|−2}}||3,758{{e|−2}}||3,648{{e|−2}} |
|'''σ, Ն/մ'''||3,813{{e|−2}}||3,758{{e|−2}}||3,648{{e|−2}} |
||
|} |
|} |
||
<br /> |
|||
{| border="1" cellspacing="0" cellpadding="1" |
{| border="1" cellspacing="0" cellpadding="1" |
||
| Տող 167. | Տող 164. | ||
[[Պատկեր:Formic acid 85 percent.jpg|մինի|Մրջնաթթու]] |
[[Պատկեր:Formic acid 85 percent.jpg|մինի|Մրջնաթթու]] |
||
{| border="1" cellspacing="0" cellpadding="1" |
{| border="1" cellspacing="0" cellpadding="1" |
||
|+ Լուծույթների ինտեգրալ ջերմությունը 25 |
|+ Լուծույթների ինտեգրալ ջերմությունը 25 °C-ում |
||
!Մոլայի թիվ H<sub>2</sub>O 1 մոլ HCOOH!!m, մոլ HCOOH 1 կգ-ում H<sub>2</sub>O!!-ΔH<sub>m</sub>, կՋ/մոլ |
!Մոլայի թիվ H<sub>2</sub>O 1 մոլ HCOOH!!m, մոլ HCOOH 1 կգ-ում H<sub>2</sub>O!!-ΔH<sub>m</sub>, կՋ/մոլ |
||
|- |
|- |
||
| Տող 204. | Տող 201. | ||
== Ստացում == |
== Ստացում == |
||
Արդյունաբերության մեջ մրջնաթթուն ստացվում է բարձր ճնշման և ջերմաստիճանի պայմաններում ածխածնի (II) օքսիդի ու [[կալիումի հիդրօքսիդ]]ի |
Արդյունաբերության մեջ մրջնաթթուն ստացվում է բարձր ճնշման և ջերմաստիճանի պայմաններում ածխածնի (II) օքսիդի ու [[կալիումի հիդրօքսիդ]]ի փոխազդեցությամբ։ Ստանում են նաև [[մեթան]]ի կատալիտիկ օքսիդացմամբ, Н<sub>2</sub>0 + С0 [[սինթեզ]]ով և հիմնականում NaOH-ի և CO-ի փոխազդեցությամբ (120- 150°С, 6-8 մթն, առաջանում է [[նատրիում]]ի ֆորմիատ, որից մրջնաթթու անջատվում են ծծմբական թթվով). |
||
<center><math>\mathrm{KOH + CO \longrightarrow HCOOK}</math> ''կալիումի ֆորմիատ''</center> |
<center><math>\mathrm{KOH + CO \longrightarrow HCOOK}</math> ''կալիումի ֆորմիատ''</center> |
||
| Տող 217. | Տող 214. | ||
== Քիմիական հատկություններ == |
== Քիմիական հատկություններ == |
||
Ի տարբերություն մյուս [[կարբոնաթթուներ]]ի, միջին ուժեղության թթու է, որը պայմանավորված է կարբօքսիլային խմբին միացած ջրածնի ատոմի փոքր էլեկտրադրական |
Ի տարբերություն մյուս [[կարբոնաթթուներ]]ի, միջին ուժեղության թթու է, որը պայմանավորված է կարբօքսիլային խմբին միացած ջրածնի ատոմի փոքր էլեկտրադրական ինդուկցիայով։ Մրջնաթթուն մտնում է կարբոնաթթուներին բնորոշ ռեակցիաների մեջ, միաժամանակ օժտված է որոշ յուրահատկություններով, որոնք պայմանավորված են ածխաջրածնային ռադիկալի բացակայությամբ։ Մրջնաթթուն հեշտությամբ օքսիդանում է առաջացնելով [[ածխաթթու գազ]] և [[ջուր]]. |
||
<center><math>\mathrm{2 \ HCOOH + O_2 \longrightarrow 2 \ CO_2 + 2 \ H_2O}</math></center> |
<center><math>\mathrm{2 \ HCOOH + O_2 \longrightarrow 2 \ CO_2 + 2 \ H_2O}</math></center> |
||
| Տող 238. | Տող 235. | ||
== Կիրառություն == |
== Կիրառություն == |
||
Սննդարդյունաբերության մեջ մրջնաթթվի այդ հատկությունը օգտագործում են նիկել [[կատալիզատոր]]ի ստացման համար, որը, մասնավորապես կիրառվում է [[ճարպեր]]ի հիդրոգենման |
Սննդարդյունաբերության մեջ մրջնաթթվի այդ հատկությունը օգտագործում են նիկել [[կատալիզատոր]]ի ստացման համար, որը, մասնավորապես կիրառվում է [[ճարպեր]]ի հիդրոգենման ժամանակ։ |
||
Մրջնաթթու կիրառվում է օրգանական սինթեզում, արծնիչային ներկման, [[Կաշի|կաշվի]] վերամշակման, մրգահյութերի պահածոյացման, սարքավորումների ախտահանման համար<ref>{{ռուսերեն գիրք|автор=Красильников А. П.|заглавие=Справочник по антисептике|место=Минск|год=1995}}</ref>։ |
Մրջնաթթու կիրառվում է օրգանական սինթեզում, արծնիչային ներկման, [[Կաշի|կաշվի]] վերամշակման, մրգահյութերի պահածոյացման, սարքավորումների ախտահանման համար<ref>{{ռուսերեն գիրք|автор=Красильников А. П.|заглавие=Справочник по антисептике|место=Минск|год=1995}}</ref>։ |
||
| Տող 249. | Տող 246. | ||
* ''Ameisensäure, Formiate, Diglykol-bis–chlorformiat''. [[Wiley-VCH Verlag|VCH]], Weinh, ISBN 3-527-28529-6. |
* ''Ameisensäure, Formiate, Diglykol-bis–chlorformiat''. [[Wiley-VCH Verlag|VCH]], Weinh, ISBN 3-527-28529-6. |
||
* ''Ausgewählte C-H-O Radikale. Ameisensäure. Essigsäure. Oxalsäure (Gmelin Handbook of Inorganic and Organometallic Chemistry - 8th edition ELEM C TL C LFG 4)''. Springer Verlag, ISBN 3-540-93283-6. |
* ''Ausgewählte C-H-O Radikale. Ameisensäure. Essigsäure. Oxalsäure (Gmelin Handbook of Inorganic and Organometallic Chemistry - 8th edition ELEM C TL C LFG 4)''. Springer Verlag, ISBN 3-540-93283-6. |
||
* Gundula Jänsch-Kaiser und Dieter |
* Gundula Jänsch-Kaiser und Dieter Behrens։ ''Ameisensäure und Erdalkalihydroxide''. DECHEMA Gesellschaft für Chemische Technik und Biotechnologie e.V., ISBN 3-926959-00-2. |
||
== Արտաքին հղումներ == |
== Արտաքին հղումներ == |
||
17:41, 18 փետրվարի 2015-ի տարբերակ
| Մրջնաթթու | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Մրջնաթթու |
| Ավանդական անվանում | Մեթանաթթու |
| Քիմիական բանաձև | HCOOH |
| Ռացիոնալ բանաձև | CH2O2 |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | Հեղուկ |
| Մոլային զանգված | 7,6E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,22 ± 0,01 գ/սմ³[2] գ/սմ³ |
| Դինամիկ մածուցիկություն | 0,16 Պա/վ |
| Իոնիզացման էներգիա | 11,05 ± 0,01 Էլեկտրոն-վոլտ[2] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 8,25 °C |
| Եռման ջերմաստիճան | 100,7 °C |
| Այրման ջերմաստիճան | 122 ± 1 ℉[2] |
| Ինքնաբռնկման ջերմաստիճան | 520 °C |
| Եռյակ կետ | 281,40 K (8,25 °C), 2,2 ԿՊա |
| Կրիտիկական ճնշում | 588 K (315 °C), 5,81 ՄՊա մթն. |
| Մոլյար ջերմատարողություն | 98,74 Ջ/(մոլ•Կ) |
| Գոյացան էնթալպիա | −234,8 կՋ/մոլ |
| Գոլորշու ճնշում | 35 ± 1 mm Hg[2] |
| Քիմիական հատկություններ | |
| pKa | 3,75 |
| Օպտիկական հատկություններ | |
| Բեկման ցուցիչ | 1,3714 |
| Կառուցվածք | |
| Դիպոլ մոմենտ | 1,41 (գազ) |
| Դասակարգում | |
| CAS համար | 64-18-6 |
| PubChem | 284 |
| EINECS համար | 200-579-1 |
| SMILES | O=CO |
| ЕС | 200-579-1 |
| RTECS | LQ4900000 |
| ChEBI | 278 |
| IDLH | 56,4 ± 0,1 mg/m³[2] |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Մրջնաթթու (միջազգային անվանումը՝ մեթանաթթու), սահմանային թթուների հոմոլոգիական շարքի առաջին անդամն է, պարզագույն միահիմն կարբոնաթթու։ Գրանցված է որպես սննդամթերքի հավելում՝ E236 նշանակությամբ։
Բանաձևը՝ ։
Անվանում
Մրջնաթթուն իր անունը ստացել է այն պատճառով, որ առաջին անգամ հայտնաբերվել է մրջյուններում (17-րդ դարում), օրինակ Formica rufa կարմիր անտառային մրջյունի գեղձի արտաթորանքում։ Մրջնաթթուն պարունակվում է մրջյունների խայթիչ արտաթորանքներում, եղինծում և եղևնու փշատերևում։ Այստեղից էլ առաջացել է նրա լատին․՝ acidium formicum անվանումը, դրա համար էլ մրջնաթթվի աղերն անվանում են ֆորմիատներ։
Ֆիզիկական հատկություններ
Սուր հոտով, անգույն հեղուկ է, խտությունը՝ 1212,6 կգ/մ³, հալման ջերմաստիճանը՝ 8,25 °C, եռմանը՝ 100,7 °C։ Անսահմանափակ քանակով լուծվում է ջրում և սպիրտում։ Ջրի հետ առաջացնում է ազեոտրոպ խառնուրդ (77,4% մրջնաթթու, եռման ջերմաստիճանը՝ 107,2 °C)։ Ամենաուժեղ ճարպաթթուն է, մաշկի վրա առաջացնում է այրվածք։ Ունի կարբոնաթթուներին բնորոշ քիմիական հատկություններ։ Մրջնաթթվի աղերը և էսթերները կոչվում են ֆորմիատներ։ Վերականգնիչ է, տալիս է «արծաթահայելու» ռեակցիան։
| Գոլորշի ճնշումը | 120 մմ ս. ս. (50 °C-ում) |
| Էնթալպիայի ձևավորում ΔH | −409,19 կՋ/մոլ (հեղ.) (298 К-ում) |
| Գիբբսի ստանդարդ էներգիայի ձևավորումը G | −346 կՋ/մոլ (հեղ.) (298 К-ում) |
| Նորմալ Էնտրոպիայի ձևավորումը S | 128,95 Ջ/մոլ·K (հեղ.) (298 К-ում) |
| Ստանդարտ մոլային ջերմունակություն Cp | 98,74 Ջ/մոլ·K (հեղ) (298 К-ում) |
| Հալման էնթալպիա ΔHհալ | 12,72 կՋ/մոլ |
| եռման էնթալպիա ΔHեռ | 22,24 կՋ/մոլ |
| Այրման ջերմություն -ΔH°298 (վերջանյութ CO2, H2O) | 254,58 կՋ/մոլ |
| ω(H2CO2) | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 22 | 26 | 30 |
| ρ, գ/սմ³ | 1,0020 | 1,0045 | 1,0094 | 1,0142 | 1,0197 | 1,0247 | 1,0297 | 1,0346 | 1,0394 | 1,0442 | 1,0538 | 1,0634 | 1,0730 |
| 15 | 20 | 30 | |
| σ, Ն/մ | 3,813×10−2 | 3,758×10−2 | 3,648×10−2 |
| Ճնշում, կՊա (մմ ս. ս.) | 0,133(1) | 0,667(5) | 1,333(10) | 2,666(20) | 5,333(40) |
| Tкип, °C | −20,0 | −5,0 | +2,1 | 10,3 | 24,0 |
| Ճնշումը, կՊա (մմ ս. ս.) | 7,999(60) | 13,333(100) | 26,66(200) | 53,33(400) | 101,32(760) |
| Tкип, °C | 32,4 | 43,8 | 61,4 | 80,3 | 100,7 |

| Մոլայի թիվ H2O 1 մոլ HCOOH | m, մոլ HCOOH 1 կգ-ում H2O | -ΔHm, կՋ/մոլ |
|---|---|---|
| 1 | 55,51 | 0,83 |
| 2 | 27,75 | 0,87 |
| 3 | 18,50 | 0,79 |
| 4 | 13,88 | 0,71 |
| 5 | 11,10 | 0,67 |
| 6 | 9,25 | 0,62 |
| 8 | 6,94 | 0,58 |
| 10 | 5,55 | 0,56 |
| 15 | 3,70 | 0,55 |
| 20 | 2,78 | 0,55 |
| 30 | 1,85 | 0,56 |
| 40 | 1,39 | 0,57 |
| 50 | 1,11 | 0,60 |
| 75 | 0,740 | 0,65 |
| 100 | 0,555 | 0,66 |
| ∞ | 0,0000 | 0,71 |
Ստացում
Արդյունաբերության մեջ մրջնաթթուն ստացվում է բարձր ճնշման և ջերմաստիճանի պայմաններում ածխածնի (II) օքսիդի ու կալիումի հիդրօքսիդի փոխազդեցությամբ։ Ստանում են նաև մեթանի կատալիտիկ օքսիդացմամբ, Н20 + С0 սինթեզով և հիմնականում NaOH-ի և CO-ի փոխազդեցությամբ (120- 150°С, 6-8 մթն, առաջանում է նատրիումի ֆորմիատ, որից մրջնաթթու անջատվում են ծծմբական թթվով).
- Կալիումի ֆորմիատից ազատ թթուն դուրս է մղվում ավելի ուժեղ հանքային թթվով.
- Մեթանի կատալիտիկ օքսիդացումով.
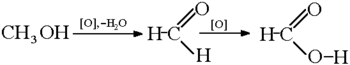
Քիմիական հատկություններ
Ի տարբերություն մյուս կարբոնաթթուների, միջին ուժեղության թթու է, որը պայմանավորված է կարբօքսիլային խմբին միացած ջրածնի ատոմի փոքր էլեկտրադրական ինդուկցիայով։ Մրջնաթթուն մտնում է կարբոնաթթուներին բնորոշ ռեակցիաների մեջ, միաժամանակ օժտված է որոշ յուրահատկություններով, որոնք պայմանավորված են ածխաջրածնային ռադիկալի բացակայությամբ։ Մրջնաթթուն հեշտությամբ օքսիդանում է առաջացնելով ածխաթթու գազ և ջուր.
Սննդարդյունաբերության մեջ մրջնաթթվի այդ հատկությունը օգտագործում են նիկել կատալիզատորի ստացման համար, որը, մասնավորապես կիրառվում է ճարպերի հիդրոգենման ժամանակ.
Սուլեմայի լուծույթը տաքացնելիս, որը թթվեցրած է մրջնաթթվի լուծույթով, սկզբում սուլեման վերականգնվելով վերածվում է կալոմելի, ապա մետաղական սնդիկի՝
Մրջնաթթվի սնդիկային աղերը տաքացնելիս սնդիկը վերականգնվում է մինչև ազատ մետաղ, իսկ ածխածնի կեսը օքսիդանալով առաջացնում է ածխաթթու գազ՝
Խիտ ծծմբական թթվով ազդելիս մրջնաթթուն քայքայվում է ածխածնի մոնօքսիդի[3] և ջրի՝
Կիրառություն
Սննդարդյունաբերության մեջ մրջնաթթվի այդ հատկությունը օգտագործում են նիկել կատալիզատորի ստացման համար, որը, մասնավորապես կիրառվում է ճարպերի հիդրոգենման ժամանակ։
Մրջնաթթու կիրառվում է օրգանական սինթեզում, արծնիչային ներկման, կաշվի վերամշակման, մրգահյութերի պահածոյացման, սարքավորումների ախտահանման համար[4]։
Ծանոթագրություններ
- ↑ 1,0 1,1 formic acid
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 http://www.cdc.gov/niosh/npg/npgd0296.html
- ↑ Разложение муравьиной кислоты — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Красильников А. П. Справочник по антисептике. — Минск, 1995.
Գրականություն
- Օրգանական քիմիայի դասընթաց, Բ. Ա. Պավլով, Ա. Պ. Տերենտև
- Ameisensäure, Formiate, Diglykol-bis–chlorformiat. VCH, Weinh, ISBN 3-527-28529-6.
- Ausgewählte C-H-O Radikale. Ameisensäure. Essigsäure. Oxalsäure (Gmelin Handbook of Inorganic and Organometallic Chemistry - 8th edition ELEM C TL C LFG 4). Springer Verlag, ISBN 3-540-93283-6.
- Gundula Jänsch-Kaiser und Dieter Behrens։ Ameisensäure und Erdalkalihydroxide. DECHEMA Gesellschaft für Chemische Technik und Biotechnologie e.V., ISBN 3-926959-00-2.
Արտաքին հղումներ
- Carbon monoxide as reagent in the formylation of aromatic compounds.
- International Chemical Safety Card 0485.
- NIOSH Pocket Guide to Chemical Hazards.
- ChemSub Online (Formic acid).
- Formic Acid Use in Beekeeping: Handbook and Manual of Treatments.
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից։ |









