Տամոքսիֆեն
| Տամոքսիֆեն | |
|---|---|
 | |
| Տեսակ | քիմիական երևույթի տեսակ |
| Կիրառում | կրծքագեղձի քաղցկեղ |
| Գործածության եղանակ | ներքին ընդունում |
| Ազդեցության մեխանիզմ | էստրոգենային ընկալիչների ընտրողական կարգավորում |
| Զանգված | 6,2E−25 կիլոգրամ[1] |
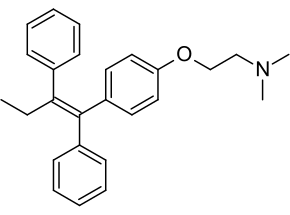
| Քիմիական բանաձև | C₂₆H₂₉NO[1] |
Տամոքսիֆեն (վաճառքային՝ Նոլվադեքս), էստրոգենային ընկալիչների (ԷԸ) ընտրողական (սելեկտիվ) կարգավորիչ է, որն օգտագործվում է կանանց մոտ կրծքագեղձի քաղցկեղը կանխելու և կանանց և տղամարդկանց կրծքագեղձի քաղցկեղը բուժելու համար[2]։ Տրիֆենիլէթիլենային միացությունների խմբի անդամ է[3]։ Կարող է արդյունավետ լինել նաև քաղցկեղի այլ տեսակների բուժման համար։ Տամոքսիֆենը կրծքագեղձի քաղցկեղի դեպքում սովորաբար ընդունվում է ամեն օր հինգ տարի շարունակ ներքին ընդունման (պերօրալ) ճանապարհով[4]։ Օգտագործվել է ՄակՔյուն-Օլբրայթ համախտանիշի բուժման համար։ Լուրջ կողմնակի ազդեցությունները ներառում են արգանդի քաղցկեղի, ինսուլտի, տեսողության հետ կապված խնդիրների և թոքային էմբոլիայի ռիսկի փոքր-ինչ բարձրացումը։ Ընդհանուր կողմնակի ազդեցությունները ներառում են անկանոն դաշտանային ցիկլը, քաշի կորուստը և ջերմահորդանքները։ Այն կարող է վնասել երեխային հղիության կամ կրծքով կերակրման ժամանակ ընդունելու դեպքում[4]։ Տամոքսիֆենն ի սկզբանե ստեղծվել է 1962 թվականին քիմիկոս Դորա Ռիչարդսոնի կողմից[5][6]։ Այն Առողջապահության համաշխարհային կազմակերպության հիմնական դեղերի ցանկում է[7]։ 2020 թվականին այն ԱՄՆ-ում 317-րդ ամենատարածված դեղամիջոցն էր՝ ավելի քան 900 հազար դուրսգրումով[8][9]:
Պատմություն[խմբագրել | խմբագրել կոդը]
1950-ականների վերջերին դեղագործական ընկերությունները ակտիվորեն ուսումնասիրում էին հակաէստրոգենային միացությունների նորահայտ դասը՝ հակաբեղմնավորիչ հաբեր մշակելու նպատակով։ Արթուր Լ Ուոլփոլը վերարտադրողաբան-հորմոնաբան էր, ով ղեկավարում էր նման թիմ «Alderley Park» հետազոտական լաբորատորիաներում[6]։ Այդտեղ է 1962 թվականին քիմիկոս Դորա Ռիչարդսոնն առաջին անգամ սինթեզել տամոքսիֆենը, որն այն ժամանակ հայտնի էր որպես ICI-46,474, երբ նա փորձում էր ստեղծել տրիֆենիլէթիլենային ածանցյալներ հակաբեղմնավորիչ հաբերի նախագծման համար[10]։ Ուոլփոլի թիմը բաղկացած էր Դորա Ռիչարդսոնից և Գ.Ա. Սնոուից, ով աշխատել է նախագծի քիմիական բաժնի վրա, Գ.Է. Պագետից և Ջ.Կ.Ուոլլիից, ով հիմնականում կենտրոնացել է կենսաբանական հատվածի վրա[5]։ Այս միացությունն ի սկզբանե ստեղծվել է որպես էստրոգենի արգելակիչ, սակայն դրա փոխարեն խթանել է ձվազատումը դեղորայքի փորձարկման փուլում[5]։ Ուոլփոլը և նրա գործընկերները դեղորայքի արտոնագիր են ներկայացրել 1962 թվականին, սակայն բազմիցս մերժվել են ԱՄՆ-ում մինչև 1980-ականները[11]։ Տամոքսիֆենն, ի վերջո, հաստատվեց որպես անպտղության բուժման միջոց, սակայն ոչ որպես հակաբեղմնավորիչ։ Էստրոգենի և կրծքագեղձի քաղցկեղի միջև կապը հայտնի էր երկար տարիներ, բայց քաղցկեղի բուժումն այն ժամանակ առաջնահերթություն չէր։ Միայն այն ժամանակ, երբ Ուոլփոլը սպառնաց հեռանալ իր պաշտոնից, թույլ տրվեց նրա թիմին փորձարկել դեղորայքը կրծքագեղձի քաղցկեղի բուժման համար։ Առանց Ուոլփոլի ջանքերի՝ պաշտպանելու և աջակցելու իր թիմի աշխատանքը, տամոքսիֆենը կարող էր մնալ անտեսված կամ չուսումնասիրված։ Տամոքսիֆենը հակաանգիոգենային ուղեցույցի երեք դեղամիջոցներից մեկն է, որը մշակվել է Հարվարդի բժշկական դպրոցի մանկական հիվանդանոցի հետազոտող Ջուդա Ֆոլկմանի կողմից։ Նա 1970-ականներին հայտնաբերել է, որ անգիոգենեզը՝ նոր արյունատար անոթների աճը, էական դեր է խաղում քաղցկեղի առաջացման գործում։ Նրա հայտնաբերումից հետո քաղցկեղի հետազոտության բոլորովին նոր ոլորտ է ձևավորվել։ Անգիոգենեզի ինհիբիտորների կլինիկական փորձարկումները սկսվել են 1992 թվականից՝ օգտագործելով բազմաթիվ տարբեր դեղամիջոցներ։ Հարվարդի հետազոտողները մշակել են հատուկ ուղեցույց Նավի անունով ոսկե ռետրիվերի համար, ով քաղցկեղից բուժվեց ցելեկոքսիբից, դոքսիցիկլինից և տամոքսիֆենից ստացված կոկտեյլը ստանալուց հետո. բուժումը հետագայում հայտնի դարձավ որպես Նավի ուղեցույց։ Ավելին, ցույց է տրվել, որ միայն տամոքսիֆենով բուժումն ունի հակաանգիոգենային ազդեցություն քաղցկեղի կենդանական մոդելներում, որոնք, առնվազն մասամբ, անկախ են տամոքսիֆենի ԷԸ-ի ներհակորդային ազդեցությունից[12]։
Ֆարմակոլոգիա[խմբագրել | խմբագրել կոդը]
Ֆարմակոդինամիկա[խմբագրել | խմբագրել կոդը]

Տամոքսիֆենը էստրոգենային ընկալիչների ընտրողական կարգավորիչ է կամ մասնակի ագոնիստ։ Այն, կախված թիրախ հյուսվածքներից, ունի խառը էստրոգենային և հակաէստրոգենային ակտիվություն։ Օրինակ, տամոքսիֆենը հիմնականում հակաէստրոգենային ազդեցություն ունի կրծքագեղձերում, առավելապես էստրոգենային ազդեցություն՝ արգանդում և լյարդում։ Կրծքագեղձի հյուսվածքում տամոքսիֆենը հանդես է գալիս որպես ԷԸ անտագոնիստ՝ արգելակելով էստրոգենին արձագանքող գեների տրանսկրիպցիան[14]։ Տամոքսիֆենը կանխում է ոսկրային զանգվածի կորուստը՝ գործելով որպես ԷԸ ագոնիստ ոսկրային բջիջներում. արգելակելով օստեոկլաստները, այն կանխում է օստեոպորոզը[15][16]։ Երբ տամոքսիֆենը շրջանառության մեջ դրվեց որպես դեղամիջոց, ենթադրվում էր, որ կգործի որպես ԷԸ անտագոնիստ բոլոր հյուսվածքներում, ներառյալ ոսկրերը, և, հետևաբար, մտավախություն կար, որ այն կնպաստի օստեոպորոզին։ Շատ զարմանալի էր, որ կլինիկորեն նկատվեց հակառակ ազդեցությունը։ Այսպիսով, հյուսվածքների վրա ընտրողական ազդեցությունն ուղղակիորեն հանգեցրեց ընտրողական կարգավորիչ լինելու հայեցակարգի ձևավորմանը[17]։ Տամոքսիֆենը երկարատև ազդեցություն ունի[18]։ Այն ունի հարաբերականորեն փոքր աֆինություն ԷԸ նկատմամբ և փոխարենը այնպիսի ակտիվ մետաբոլիտների նախադեղ է, ինչպիսիք են էնդոքսիֆենը (4-հիդրօքսի-N-դեսմեթիլթամոքսիֆեն) և աֆիմոքսիֆենը (4-հիդրօքսիտամոքսիֆեն)[19]։ Այս մետաբոլիտները 30-ից 100 անգամ ավելի մեծ աֆինություն ունեն ԷԸ-ի նկատմամբ, քան տամոքսիֆենը[20][21]։ Էնդոքսիֆենի և աֆիմոքսիֆենի հակաէստրոգենային ակտիվությունները շատ նման են[19]։ Այնուամենայնիվ, էնդոքսիֆենն առաջանում է շատ ավելի բարձր կոնցենտրացիաներով, քան աֆիմոքսիֆենը և այժմ համարվում է տամոքսիֆենի հիմնական ակտիվ ձևը օրգանիզմում[19][20][22]։ Տամոքսիֆենը մրցակցում է էնդոգեն էստրոգենի հետ ուռուցքային բջիջներում և այլ թիրախ հյուսվածքներում էԸ-ին կապվելու համար՝ առաջացնելով կորիզային համալիր, որը նվազեցնում է ԴՆԹ-ի սինթեզը և արգելակում էստրոգենի ազդեցությունը։ Տամոքսիֆենը հանգեցնում է նրան, որ բջիջները մնում են բջջային ցիկլի G0 և G1 փուլերում։ Քանի որ այն կանխում է (նախա)քաղցկեղային բջիջների բաժանումը, բայց չի առաջացնում բջիջների մահ, տամոքսիֆենն ավելի հավանականորեն ցիտոստատիկ է, քան ցիտոցիդ։ Դեղամիջոցը կապվում է ԷԸ-ին, ստեղծված համալիրը հավաքագրում է այլ սպիտակուցներ, որոնք հայտնի են որպես կո-ռեպրեսորներ, և այնուհետև կոմպլեքսը միանում է ԴՆԹ-ին՝ գեների էքսպրեսիան կարգավորելու համար։ Այս սպիտակուցներից մի քանիսը ներառում են NCoR և SMRT[23]: Աճի գործոններն ազդեցություն ունեն տամոքսիֆենի ակտիվության վրա[24]։ Տամոքսիֆենը արգելափակում է աճի գործոնի սպիտակուցները՝ ErbB2/HER2-ը, քանի որ ապացուցվել է, որ ErbB2-ի բարձր մակարդակները բնորոշ են տամոքսիֆեն-կայուն քաղցկեղին[25][26]։ Դրան իր լիարժեք հակաքաղցկեղային ազդեցության համար, ենթադրաբար, անհրաժեշտ է PAX2 սպիտակուց[25][27]։ PAX2 բարձր էքսպրեսիայի դեպքում տամոքսիֆեն/ԷԸ համալիրն ի վիճակի է ճնշել պրոլիֆերատիվ ERBB2 սպիտակուցի էքսպրեսիան։ Ի հակադրություն, երբ AIB-1 էքսպրեսիան ավելի բարձր է, քան PAX2-ը, նշված համալիրը մեծացնում է ERBB2-ի էքսպրեսիան, ինչը հանգեցնում է կրծքագեղձի քաղցկեղի աճի խթանմանը[25][28]:Տամոքսիֆենը հակագոնադոտրոպային ազդեցություն ունի հետդաշտանադադարային շրջանի կանանց մոտ և մասամբ ճնշում է գոնադոտրոպինների, լյուտեինացնող հորմոնի (LH) և ֆոլիկուլ խթանող հորմոնի (FSH) մակարդակը նրանց մոտ[29]։ Այն ունի գոնադոտրոպային ազդեցություն նախադաշտանադադարային շրջանի կանանց մոտ և նրանց մոտ 6 անգամ ավելացնում է էստրոգենի մակարդակը[29]։ Էստրոգենի մակարդակի այս աճը կարող է խանգարել տամոքսիֆենի հակաէստրոգենային արդյունավետությանը[29]։ Կրծքագեղձի քաղցկեղի Ki-67 սպիտակուցի էքսպրեսիայի, սեռական հորմոն կապող գլոբուլինի (SHBG) մակարդակների և ինսուլինանման աճի գործոն 1-ի (IGF-1) մակարդակների վրա տամոքսիֆենի ազդեցությունը կրծքագեղձի քաղցկեղով տառապող կանանց մոտ 1-ից 20 մգ/օր դեղաչափի միջակայքում դեղաչափ կախյալ են[30]։ Պարզվել է, որ տամոքսիֆենը կանանց և տղամարդկանց մոտ նվազեցնում է IGF-1-ի մակարդակը 17-ից 38%-ով[31]։ Լյարդում IGF-1-ի արտադրության ճնշումը էստրոգենների և SERM-ների հայտնի ազդեցություն է[31]։ Տամոքսիֆենի 10 մգ/օր դեղաչափը գրեթե նույնքան արդյունավետ է, որքան 20 մգ/օր դեղաչափը՝ IGF-1 մակարդակը ճնշելու համար[32]։
Այլ ազդեցություններ[խմբագրել | խմբագրել կոդը]
Աֆիմոքսիֆենը G սպիտակուց- զուգակցված էստրոգենային ընկալիչի (GPER) համեմատաբար ցածր աֆինությամբ ագոնիստ է[33]։ Նրա աֆինությունը ընկալիչների նկատմամբ 100-ից 1000 նՄ միջակայքում է ՝ էստրադիոլի դեպքում 3-ից 6 նՄ-ի համեմատ։ Աֆիմոքսիֆենը կապվում է և՛ էստրոգենի հետ կապված β ընկալիչի, և՛ էստրոգենի հետ կապված γ ընկալիչի հետ և հանդիսանում է էստրոգենի հետ կապված γ ընկալիչի ներհակորդը[34]։ Նորենդոքսիֆենը (4-հիդրօքսի-N, N-դիդեսմեթիլթամոքսիֆեն), տամոքսիֆենի մեկ այլ ակտիվ մետաբոլիտ, պարզվել է, որ գործում է որպես արոմատազայի ուժեղ մրցակցային արգելակիչ և կարող է նաև ներգրավված լինել տամոքսիֆենի հակաէստրոգենային ազդեցության մեխանիզմի մեջ[35]։ Տամոքսիֆենը թերապևտիկ կոնցենտրացիաներով պրոտեինկինազա C-ի ընտրողական հզոր արգելակիչ է։ Ենթադրվում է, որ այս մեխանիզմն ընկած է տամոքսիֆենի երկբևեռ խանգարման բուժման մեջ արդյունավետության հիմքում[36]։ Տամոքսիֆենը P-գլիկոպրոտեինի արգելակիչ է։
Ֆարմակոկինետիկա[խմբագրել | խմբագրել կոդը]
Ներծծում[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը ներքին ընդունման դեպքում արագորեն ներծծվում է աղիներից[32][37]։ Կենսամատչելիությունը մոտ 100% է, ինչը վկայում է աղիներում և լյարդով առաջին անցման ժամանակ նվազագույն նյութափոխանակության (մետաբոլիզմի) ենթարկվելու մասին։ Ընդունումից հետո տամոքսիֆենի առավելագույն կոնցենտրացիան դիտվում է երեքից յոթ ժամ հետո[32][38]։ Տամոքսիֆենի կայուն մակարդակ սովորաբար դիտվում է ամենօրյա ընդունման դեպքում 3-ից 4 շաբաթ, հնարավոր է մինչև 16 շաբաթ հետո[32][39]։ Աֆիմոքսիֆենի կայուն մակարդակի կարելի է հասնել տամոքսիֆենի ամենօրյա ընդունումից 8 շաբաթ հետո[39][40]։ Տամոքսիֆենին բնորոշ է հստակ դեղաչափ կախյալություն 1-ից 20 մգ/օր միջակայքում[32][41]։ Տամոքսիֆենի արյան մեջ շրջանառվող ամենամեծ կոնցենտրացիաներ ունեցող մետաբոլիտներն են՝ N-դեսմեթիլթամոքսիֆենը, N,N-դիդեսմեթիլթամոքսիֆենը, (Z)-էնդոքսիֆենը և տամոքսիֆեն N-օքսիդը[42][43]։
Բաշխում[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենի բաշխման ծավալը 50-ից 60 լ/կգ է, իսկ արտազատումը 1,2-ից 5,1 լ/ժամ արագությամբ է[32][38]։ Տամոքսիֆենի բարձր կոնցենտրացիաները հայտնաբերվել են կրծքագեղձում, արգանդում, լյարդում, երիկամում, թոքերում, ենթաստամոքսային գեղձում և ձվարաններում[32]։ Պարզվել է, որ արգանդում տամոքսիֆենի մակարդակը 2-3 անգամ ավելի բարձր է, քան շրջանառության մեջ[32], իսկ կրծքագեղձերում՝ 10 անգամ ավելի, քան շրջանառության մեջ[41]։ Տամոքսիֆենի և աֆիմոքսիֆենի կապումը պլազմային սպիտակուցների հետ 99%-ից ավելի է[40]։ Տամոքսիֆենի մեծ մասը կապվում է ալբումինի հետ[32]։
Նյութափոխանակություն[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը նախադեղ է և լյարդում մետաբոլիզմի է ենթարկվում ցիտոքրոմ P450 իզոֆորմներով՝ վերածվելով ակտիվ մետաբոլիտների, ինչպիսիք են էնդոքսիֆենը և աֆիմոքսիֆենը[20][32] : Տամոքսիֆենի փոխակերպումը N-դեմեթիլացման միջոցով N-դեսմեթիլթամոքսիֆենի, որը կատալիզվում է հիմնականում CYP3A4-ով և CYP3A5-ով, պատասխանատու է տամոքսիֆենի նյութափոխանակության մոտավորապես 92%-ի համար[19]։ Իսկ տամոքսիֆենի 4-հիդրօքսիլացումը աֆիմոքսիֆենի պատասխանատու է տամոքսիֆենի նյութափոխանակության միայն մոտ 7%-ի համար[19]։ Իր ձևավորումից հետո N-դեսմեթիլթամոքսիֆենն օքսիդացվում է մի քանի այլ մետաբոլիտների, որոնցից ամենաուշագրավը էնդոքսիֆենն է[19]։ Մեկ այլ ակտիվ մետաբոլիտ՝ նորենդոքսիֆենը (4-հիդրօքսի-N, N-դիդեսմեթիլթամոքսիֆեն), ձևավորվում է էնդոքսիֆենի N-դեմեթիլացման կամ N,N-դիդեսմեթիլթամոքսիֆենի 4-հիդրօքսիլացման միջոցով[20]։
Տամոքսիֆենը և նրա մետաբոլիտները ենթարկվում են կոնյուգացիայի, ներառյալ գլյուկուրոնիդացումը և սուլֆացումը[39]։ Տամոքսիֆենը կարող է արգելակել սեփական նյութափոխանակությունը[32]։
Արտազատում[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենն ունի երկարատև կիսակյանք՝ սովորաբար 5-7 օր (4-11օր)[20][32][38]։ Աֆիմոքսիֆենի կիսակյանքի տևողությունը 14 օր է[40], էնդոքսիֆենինը՝ 50-ից 70 ժամ(2-3 օր)[20]։ Սա պայմանավորված է պլազմայի սպիտակուցների հետ կապմամբ, ինչպես նաև աղելյարդային (էնտերոհեպատիկ) վերաշրջանառությամբ[40]։ Բուժման դադարեցումից հետո տամոքսիֆենի և նրա մետաբոլիտների մակարդակները պահպանվում են արյան շրջանառության մեջ առնվազն 6 շաբաթ[40]։ Տամոքսիֆենն արտազատվում է լեղիով, կղանքով, փոքր քանակությամբ՝ մեզով[32]։
Դեղորայքային փոխազդեցություններ[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը կարող է լիարժեք արդյունավետ չլինել CYP2D6 գենի տարբեր ֆենոտիպեր ունեցող հիվանդների մոտ տամոքսիֆեն նախադեղի չափազանց դանդաղ նյութափոխանակության պատճառով[44][45] 2006թ. հոկտեմբերի 18-ին Կլինիկական ֆարմակոլոգիայի ենթահանձնաժողովը առաջարկեց տամոքսիֆենի փաթեթի ներդիրում այս գենի մասին տեղեկատվություն ներառել[46]։ Կրծքագեղձի քաղցկեղով հիվանդների մոտ CYP2D6 որոշակի տեսակների առկայությունը հանգեցնում է տամոքսիֆենով բուժման փոքր արդյունավետության[47]։ Հետևաբար, գենոտիպավորումը հնարավորություն ունի բացահայտելու այն կանանց, ովքեր ունեն այս CYP2D6 ֆենոտիպերը, և որոնց համար տամոքսիֆենի կիրառումը պակաս արդյունավետ է։ Սա կօգնի բժշկին ճիշտ ընտրել դեղորայքը։ Վերջին ուսումնասիրությունները ցույց են տալիս, որ սերոտոնինի հետադարձ զավթման ընտրողական պաշարիչների՝ (SSRIs) հակադեպրեսանտներ պարոքսետինի (Paxil), ֆլուոքսետինի (Prozac) և սերտրալինի (Zoloft) ընդունումը կարող է նվազեցնել տամոքսիֆենի արդյունավետությունը, քանի որ այս դեղամիջոցները մրցակցում են տամոքսիֆենի նյութափոխանակությունն ապահովող CYP2D6 ֆերմենտի համար[48]։ Հետազոտության համաձայն, երկու տարի անց միայն տամոքսիֆեն ընդունած կանանց 7,5%-ի մոտ է քաղցկեղը կրկնվել, ի համեմատ 16%-ի հետ, ովքեր զուգահեռ ընդունել են պարոքսետին, ֆլուոքսետին կամ սերտրալին։ Այդ տարբերությունը կարելի է դիտարկել որպես կրծքագեղձի քաղցկեղի կրկնության ռիսկի 120% աճ։ SSRI-ներ ցիտալոպրամ (Celexa), էսցիտալոպրամ (Lexapro) և ֆլյուվոքսամին (Luvox) ընդունող հիվանդների մոտ կրկնվելու վտանգ չկար՝ CYP2D6 ֆերմենտի համար մրցակցության բացակայության պատճառով[49]։
Տամոքսիֆենը փոխազդում է որոշ այլ հակաէստրոգենային դեղորայքների հետ[32]։ Արոմատազայի ինհիբիտոր ամինոգլուտետիմիդը խթանում է տամոքսիֆենի նյութափոխանակությունը[32]։ Ընդհակառակը, արոմատազայի ինհիբիտոր Լետրոզոլը չի ազդում տամոքսիֆենի նյութափոխանակության վրա[32]։ Այնուամենայնիվ, տամոքսիֆենը խթանում է լետրոզոլի նյութափոխանակությունը և զգալիորեն նվազեցնում դրա կոնցենտրացիաները[32]։
Բժշկական ցուցումներ[խմբագրել | խմբագրել կոդը]
Ցավոտ դաշտան (դիսմենորեա)[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը դիսմենորեայով հիվանդների մոտ արդյունավետորեն բարելավել է արյունահոսքը, փոքրացրել է արգանդի կծկողականությունը և նվազեցրել ցավը[50]։
Կրծքագեղձի քաղցկեղ[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը նախա- և հետդաշտանադադարային շրջանի կանանց մոտ օգտագործվում է էստրոգեն ընկալիչ-դրական (ԷԸ+) կրծքագեղձի քաղցկեղի ինչպես վաղ, այնպես էլ ուշ փուլերի բուժման համար[51]։ Տամոքսիֆենը մեծացնում է հետդաշտանադադարային արյունահոսության, էնդոմետրիումի պոլիպների, հիպերպլազիայի և քաղցկեղի ռիսկը։ Տամոքսիֆենի օգտագործումը լևոնորգեստրել արտազատող ներարգանդային պարույրի հետ կարող է մեծացնել հեշտոցային արյունահոսության ռիսկը 1-2 տարի հետո, բայց նաև որոշ չափով նվազեցնում է էնդոմետրիումի պոլիպները և հիպերպլազիան[52]։ Բացի այդ, այն տղամարդկանց կրծքագեղձի քաղցկեղի ամենատարածված հորմոնալ բուժումն է[53]։ Այն Սննդի և դեղերի վարչության կողմից հաստատվել է կրծքագեղձի զարգացան բարձր ռիսկ ունեցող կանանց մոտ քաղցկեղի կանխարգելման համար[54]։ Հետագայում հաստատվել է կոնտրալատերալ (հակառակ կրծքագեղձի) քաղցկեղի դեմ բուժման համար։ Տամոքսիֆենի օգտագործումը խորհուրդ է տրվում 10 տարի[55]։
Անպտղություն[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը ձվազատման խանգարումներ ունեցող կանանց մոտ օգտագործվում է ձվազատման խթանման և անպտղության բուժման համար։ Այն տրվում է կանանց ցիկլի երրորդից յոթերորդ օրերին[56]։ Տամոքսիֆենը անպտղություն ունեցող տղամարդկանց մոտ ապարգելակելում է հիպոթալամուս-հիպոֆիզ-սեռական գեղձ առանցքը ԷԸ անտագոնիզմի միջոցով՝ մեծացնելով լյուտեինացնող հորմոնի, ֆոլիկուլ խթանող հորմոնի և ամորձիներում տեստոստերոնի արտադրությունը[57]։
Գինեկոմաստիա[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենն օգտագործվում է գինեկոմաստիայի կանխարգելման և բուժման համար[58][59]։ Այն փոքր չափաբաժիններով ընդունվում է որպես կանխարգելիչ միջոց կամ կիրառվում է այնպիսի ախտանիշների առաջացման ժամանակ, ինչպիսիք են պտուկների ցավը կամ զգայունությունը։ Նմանատիպ նպատակներով ընդունվում են նաև կլոմիֆեն և հակաարոմատազային դեղամիջոցներ, հորմոնների հետ կապված անբարենպաստ ազդեցություններից խուսափելու համար[57]։
Վաղ սեռահասունացում[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենն ինչպես աղջիկների, այնպես էլ տղաների մոտ օգտակար է ծայրամասային վաղ սեռահասունացման բուժման համար, օրինակ՝ ՄակՔյուն-Օլբրայթ համախտանիշի դեպքում[60][61][62]։ Պարզվել է, որ այն նվազեցնում է աճի և ոսկրերի հասունացման արագությունը աղջիկների մոտ և, հետևաբար, նրանց մոտ ապահովում նորմալ հասակ։
Հակացուցումներ[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը հակացուցված է դեղի կամ այլ բաղադրիչների նկատմամբ գերզգայունություն ունեցող, կումարինի տիպի հակամակարդիչներով միաժամանակյա թերապիա ընդունող անձանց և երակային թրոմբոէմբոլիայի պատմություն ունեցող կանանց (խորանիստ երակային թրոմբոզ կամ թոքային էմբոլիա)։
Կողմնակի ազդեցություններ[խմբագրել | խմբագրել կոդը]
2009 թվականի սեպտեմբերի Առողջապահության և մարդկային ծառայությունների գործակալության զեկույցի համաձայն կրծքագեղձի քաղցկեղի բուժման համար օգտագործվող տամոքսիֆենը, ռալոքսիֆենը և տիբոլոնը զգալիորեն նվազեցնում են կրծքագեղձի ինվազիվ քաղցկեղը միջին տարիքի և տարեց կանանց մոտ, բայց նաև մեծացնում են կողմնակի ազդեցությունների վտանգը[63]։
Էնդոմետրիումի քաղցկեղ[խմբագրել | խմբագրել կոդը]
Չնայած տամոքսիֆենը ԷԸ անտագոնիստ է կրծքագեղձի հյուսվածքում, այն էնդոմետրիումում գործում է որպես մասնակի ագոնիստ և որոշ կանանց մոտ կապված է էնդոմետրիումի քաղցկեղի ռիսկի հետ։ Հետևաբար, էնդոմետրիումի փոփոխությունները, ներառյալ քաղցկեղը, տամոքսիֆենի կողմնակի ազդեցություններից են[64]։ Ժամանակի ընթացքում էնդոմետրիումի քաղցկեղի ռիսկը կարող է կրկնապատկվել և քառապատկվել, այդ պատճառով տամոքսիֆենը սովորաբար օգտագործվում է միայն հինգ տարի[65]։ Ամերիկյան քաղցկեղի միությունը նշում է տամոքսիֆենը որպես հայտնի քաղցկեղածին նյութ՝ նշելով, որ այն մեծացնում է արգանդի քաղցկեղի որոշ տեսակների վտանգը՝ միաժամանակ նվազեցնելով կրծքագեղձի քաղցկեղի կրկնվելու ռիսկը[66]։
Սրտանոթային և նյութափոխանակային[խմբագրել | խմբագրել կոդը]
Հետդաշտանադադարային շրջանի կանանց մոտ տամոքսիֆենով բուժումը կապված է արյան լիպիդային պրոֆիլի վրա բարենպաստ ազդեցությունների հետ։ Այնուամենայնիվ, կլինիկական փորձարկումների երկարաժամկետ տվյալները ցույց չեն տվել սրտի վրա պաշտպանիչ ազդեցություն[67]։ Որոշ կանանց մոտ տամոքսիֆենը կարող է առաջացնել արյան մեջ տրիգլիցերիդների կոնցենտրացիայի արագ աճ։ Բացի այդ, կա թրոմբոէմբոլիայի ռիսկի բարձրացում հատկապես խոշոր վիրահատութուններից կամ երկարատև անշարժությունից անմիջապես առաջ և հետո[68]։ Տամոքսիֆենի օգտագործումը փոքր-ինչ մեծացնում է խորը երակային թրոմբոզի, թոքային էմբոլիզմի և ինսուլտի ռիսկը[69]։
Լյարդ[խմբագրել | խմբագրել կոդը]
Տամոքսիֆենը կապված է լյարդի վրա թունավոր ազդեցության (հեպատոտոքսիկության) մի շարք դեպքերի հետ[70]։ Տամոքսիֆենը մեկ տարի 20 մգ/օր դեղաչափով օգտագործելուց հետո գեր և ավելորդ քաշ ունեցող կանանց մոտ ~40% հավանականությամբ կարող է առաջացնել ոչ ալկոհոլային ճարպային լյարդի հիվանդություն[71]։
Գերդոզավորում[խմբագրել | խմբագրել կոդը]
Մարդկանց մոտ տամոքսիֆենի սուր գերդոզավորում չի գրանցվել։ Դեղաչափի որոշման հետազոտություններում տամոքսիֆենը կանանց մոտ կիրառվել է շատ բարձր չափաբաժիններով (օրինակ՝ 300 մգ/մ2) և առաջացրել է սուր նեյրոտոքսիկություն՝ ներառյալ ցնցում, հիպերռեֆլեքսիա, անկայուն քայլվածք և գլխապտույտ։ Այս ախտանշանները առաջացել են թերապիայի ավարտից երեքից հինգ օրվա ընթացքում և անհետացել են թերապիայի դադարեցումից հետո երկու-հինգ օրվա ընթացքում։ Մշտական նեյրոտոքսիկության նշաններ չեն նկատվել։ Նկատվել է նաև QT երկարացում։ Տամոքսիֆենի չափից մեծ դոզայի համար հատուկ հակաթույն չկա, բուժումը պետք է հիմնված լինի ախտանիշների վրա։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 tamoxifen
- ↑ «Tamoxifen Citrate». NCI. 2015 թ․ օգոստոսի 26. Արխիվացված օրիգինալից 2016 թ․ հունվարի 4-ին. Վերցված է 2015 թ․ նոյեմբերի 28-ին.
- ↑ Cano A, Calaf i Alsina J, Duenas-Diez JL, eds. (2006). Selective Estrogen Receptor Modulators a New Brand of Multitarget Drugs. Berlin, Heidelberg: Springer-Verlag Berlin Heidelberg. էջ 52. ISBN 9783540347422.
- ↑ 4,0 4,1 «Tamoxifen Citrate». The American Society of Health-System Pharmacists. Արխիվացված օրիգինալից 2014 թ․ հունվարի 4-ին. Վերցված է 2015 թ․ նոյեմբերի 27-ին.
- ↑ 5,0 5,1 5,2 Quirke VM (2017 թ․ սեպտեմբերի 12). «Tamoxifen from Failed Contraceptive Pill to Best-Selling Breast Cancer Medicine: A Case-Study in Pharmaceutical Innovation». Frontiers in Pharmacology. 8: 620. doi:10.3389/fphar.2017.00620. PMC 5600945. PMID 28955226.
- ↑ 6,0 6,1 Jordan VC (January 2006). «Tamoxifen (ICI46,474) as a targeted therapy to treat and prevent breast cancer». British Journal of Pharmacology. 147 (Suppl 1): S269–S276. doi:10.1038/sj.bjp.0706399. PMC 1760730. PMID 16402113.
- ↑ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ «The Top 300 of 2020». ClinCalc. Վերցված է 2022 թ․ հոկտեմբերի 7-ին.
- ↑ «Tamoxifen Citrate - Drug Usage Statistics». ClinCalc. Արխիվացված է օրիգինալից 2020 թ․ սեպտեմբերի 22-ին. Վերցված է 2022 թ․ հոկտեմբերի 7-ին.
- ↑ Sneader W (2005). Drug Discovery: A History. New York: Wiley. էջ 472 pages. ISBN 978-0-471-89979-2.
- ↑ Jordan VC (March 2003). «Tamoxifen: a most unlikely pioneering medicine». Nature Reviews. Drug Discovery. 2 (3): 205–213. doi:10.1038/nrd1031. PMID 12612646. S2CID 31333174.
- ↑ Kirk E (2002 թ․ հուլիսի 24). «Dog's tale of survival opens door in cancer research». Health and Behavior. USA Today. Արխիվացված օրիգինալից 2008 թ․ հունիսի 28-ին. Վերցված է 2008 թ․ հունիսի 24-ին.
- ↑ Shiau AK, Barstad D, Loria PM, Cheng L, Kushner PJ, Agard DA, Greene GL (December 1998). «The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen». Cell. 95 (7): 927–937. doi:10.1016/S0092-8674(00)81717-1. PMID 9875847. S2CID 10265320.
- ↑ Wang DY, Fulthorpe R, Liss SN, Edwards EA (February 2004). «Identification of estrogen-responsive genes by complementary deoxyribonucleic acid microarray and characterization of a novel early estrogen-induced gene: EEIG1». Molecular Endocrinology. 18 (2): 402–411. doi:10.1210/me.2003-0202. PMID 14605097.
- ↑ Nakamura T, Imai Y, Matsumoto T, Sato S, Takeuchi K, Igarashi K, և այլք: (September 2007). «Estrogen prevents bone loss via estrogen receptor alpha and induction of Fas ligand in osteoclasts». Cell. 130 (5): 811–823. doi:10.1016/j.cell.2007.07.025. PMID 17803905. S2CID 17177462.
- ↑ Krum SA, Miranda-Carboni GA, Hauschka PV, Carroll JS, Lane TF, Freedman LP, Brown M (February 2008). «Estrogen protects bone by inducing Fas ligand in osteoblasts to regulate osteoclast survival». The EMBO Journal. 27 (3): 535–545. doi:10.1038/sj.emboj.7601984. PMC 2241656. PMID 18219273.
- ↑ Mincey BA, Moraghan TJ, Perez EA (August 2000). «Prevention and treatment of osteoporosis in women with breast cancer». Mayo Clinic Proceedings. 75 (8): 821–829. doi:10.4065/75.8.821. PMID 10943237.
- ↑ Runnebaum B, Rabe T (2013 թ․ ապրիլի 17). Gynäkologische Endokrinologie und Fortpflanzungsmedizin: Band 1: Gynäkologische Endokrinologie. Springer-Verlag. էջեր 88–. ISBN 978-3-662-07635-4.
- ↑ 19,0 19,1 19,2 19,3 19,4 19,5 Klein DJ, Thorn CF, Desta Z, Flockhart DA, Altman RB, Klein TE (November 2013). «PharmGKB summary: tamoxifen pathway, pharmacokinetics». Pharmacogenetics and Genomics. 23 (11): 643–647. doi:10.1097/FPC.0b013e3283656bc1. PMC 4084801. PMID 23962908.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 Sanchez-Spitman AB, Swen JJ, Dezentje VO, Moes DJ, Gelderblom H, Guchelaar HJ (June 2019). «Clinical pharmacokinetics and pharmacogenetics of tamoxifen and endoxifen». Expert Review of Clinical Pharmacology. 12 (6): 523–536. doi:10.1080/17512433.2019.1610390. PMID 31008668.
- ↑ Ahmad A, Shahabuddin S, Sheikh S, Kale P, Krishnappa M, Rane RC, Ahmad I (December 2010). «Endoxifen, a new cornerstone of breast cancer therapy: demonstration of safety, tolerability, and systemic bioavailability in healthy human subjects». Clinical Pharmacology and Therapeutics. 88 (6): 814–817. doi:10.1038/clpt.2010.196. PMID 20981001. S2CID 24590365.
- ↑ Binkhorst L, Mathijssen RH, Jager A, van Gelder T (March 2015). «Individualization of tamoxifen therapy: much more than just CYP2D6 genotyping». Cancer Treatment Reviews. 41 (3): 289–299. doi:10.1016/j.ctrv.2015.01.002. PMID 25618289.
- ↑ Shang Y, Hu X, DiRenzo J, Lazar MA, Brown M (December 2000). «Cofactor dynamics and sufficiency in estrogen receptor-regulated transcription». Cell. 103 (6): 843–852. doi:10.1016/S0092-8674(00)00188-4. PMID 11136970. S2CID 6659079.
- ↑ Massarweh S, Osborne CK, Creighton CJ, Qin L, Tsimelzon A, Huang S, և այլք: (February 2008). «Tamoxifen resistance in breast tumors is driven by growth factor receptor signaling with repression of classic estrogen receptor genomic function». Cancer Research. 68 (3): 826–833. doi:10.1158/0008-5472.CAN-07-2707. PMID 18245484.
- ↑ 25,0 25,1 25,2 Hurtado A, Holmes KA, Geistlinger TR, Hutcheson IR, Nicholson RI, Brown M, և այլք: (December 2008). «Regulation of ERBB2 by oestrogen receptor-PAX2 determines response to tamoxifen». Nature. 456 (7222): 663–666. Bibcode:2008Natur.456..663H. doi:10.1038/nature07483. PMC 2920208. PMID 19005469.
- ↑ Osborne CK, Bardou V, Hopp TA, Chamness GC, Hilsenbeck SG, Fuqua SA, և այլք: (March 2003). «Role of the estrogen receptor coactivator AIB1 (SRC-3) and HER-2/neu in tamoxifen resistance in breast cancer». Journal of the National Cancer Institute. 95 (5): 353–361. doi:10.1093/jnci/95.5.353. PMID 12618500.
- ↑ «New Mechanism Predicts Tamoxifen Response: PAX2 gene implicated in tamoxifen-induced inhibition of ERBB2/HER2-mediated tumor growth». www.modernmedicine.com. 2008 թ․ նոյեմբերի 13. Արխիվացված օրիգինալից 2011 թ․ հուլիսի 14-ին. Վերցված է 2008 թ․ նոյեմբերի 14-ին.
- ↑ «Study sheds new light on tamoxifen resistance». News. CORDIS News. Արխիվացված օրիգինալից 2009 թ․ փետրվարի 20-ին. Վերցված է 2008 թ․ նոյեմբերի 14-ին.
- ↑ 29,0 29,1 29,2 Li J, Ma Z, Jiang RW, Wu B (September 2013). «Hormone-related pharmacokinetic variations associated with anti-breast cancer drugs». Expert Opinion on Drug Metabolism & Toxicology. 9 (9): 1085–1095. doi:10.1517/17425255.2013.802771. PMID 23687971. S2CID 26846314.
- ↑ Fabian CJ, Kimler BF (March 2005). «Selective estrogen-receptor modulators for primary prevention of breast cancer». Journal of Clinical Oncology. 23 (8): 1644–1655. doi:10.1200/JCO.2005.11.005. PMID 15755972.
- ↑ 31,0 31,1 Duarte FH, Jallad RS, Bronstein MD (November 2016). «Estrogens and selective estrogen receptor modulators in acromegaly». Endocrine. 54 (2): 306–314. doi:10.1007/s12020-016-1118-z. PMID 27704479. S2CID 10136018.
- ↑ 32,00 32,01 32,02 32,03 32,04 32,05 32,06 32,07 32,08 32,09 32,10 32,11 32,12 32,13 32,14 32,15 32,16 Morello KC, Wurz GT, DeGregorio MW (2003). «Pharmacokinetics of selective estrogen receptor modulators». Clinical Pharmacokinetics. 42 (4): 361–372. doi:10.2165/00003088-200342040-00004. PMID 12648026. S2CID 13003168.
- ↑ Prossnitz ER, Arterburn JB (July 2015). «International Union of Basic and Clinical Pharmacology. XCVII. G Protein-Coupled Estrogen Receptor and Its Pharmacologic Modulators». Pharmacological Reviews. 67 (3): 505–540. doi:10.1124/pr.114.009712. PMC 4485017. PMID 26023144.
- ↑ Ariazi EA, Jordan VC (2006). «Estrogen-related receptors as emerging targets in cancer and metabolic disorders». Current Topics in Medicinal Chemistry. 6 (3): 203–215. doi:10.2174/1568026610606030203. PMID 16515477.
- ↑ Liu J, Flockhart PJ, Lu D, Lv W, Lu WJ, Han X, և այլք: (September 2013). «Inhibition of cytochrome p450 enzymes by the e- and z-isomers of norendoxifen». Drug Metabolism and Disposition. 41 (9): 1715–1720. doi:10.1124/dmd.113.052506. PMC 3876808. PMID 23824607.
- ↑ Zarate CA, Manji HK (2009). «Protein kinase C inhibitors: rationale for use and potential in the treatment of bipolar disorder». CNS Drugs. 23 (7): 569–582. doi:10.2165/00023210-200923070-00003. PMC 2802274. PMID 19552485.
- ↑ Brenner GM, Stevens C (2017 թ․ սեպտեմբերի 28). Brenner and Stevens' Pharmacology E-Book. Elsevier Health Sciences. էջեր 394–. ISBN 978-0-323-39172-6.
- ↑ 38,0 38,1 38,2 DeVita VT, Lawrence TS, Rosenberg SA (2016 թ․ մարտի 18). Prostate and Other Genitourinary Cancers: From Cancer: Principles & Practice of Oncology, 10th edition. Wolters Kluwer Health. էջեր 990–. ISBN 978-1-4963-5421-1.
- ↑ 39,0 39,1 39,2 Nagar S (2010). «Pharmacokinetics of anti-cancer drugs used in breast cancer chemotherapy». Advances in Experimental Medicine and Biology. 678: 124–132. doi:10.1007/978-1-4419-6306-2_16. ISBN 978-1-4419-6305-5. PMID 20738014. S2CID 12537667.
- ↑ 40,0 40,1 40,2 40,3 40,4 Chabner BA, Longo DL (2011 թ․ դեկտեմբերի 7). Cancer Chemotherapy and Biotherapy: Principles and Practice. Lippincott Williams & Wilkins. էջեր 655–. ISBN 978-1-4511-4820-6.
- ↑ 41,0 41,1 Kisanga ER, Gjerde J, Guerrieri-Gonzaga A, Pigatto F, Pesci-Feltri A, Robertson C, և այլք: (April 2004). «Tamoxifen and metabolite concentrations in serum and breast cancer tissue during three dose regimens in a randomized preoperative trial». Clinical Cancer Research. 10 (7): 2336–2343. doi:10.1158/1078-0432.ccr-03-0538. PMID 15073109.
- ↑ Mürdter TE, Schroth W, Bacchus-Gerybadze L, Winter S, Heinkele G, Simon W, և այլք: (May 2011). «Activity levels of tamoxifen metabolites at the estrogen receptor and the impact of genetic polymorphisms of phase I and II enzymes on their concentration levels in plasma». Clinical Pharmacology and Therapeutics. 89 (5): 708–717. doi:10.1038/clpt.2011.27. PMID 21451508. S2CID 20082053.
- ↑ Jordan VC (1982). «Metabolites of tamoxifen in animals and man: identification, pharmacology, and significance». Breast Cancer Research and Treatment. 2 (2): 123–138. doi:10.1007/BF01806449. PMID 6184101. S2CID 25119313.
- ↑ Goetz MP, Rae JM, Suman VJ, Safgren SL, Ames MM, Visscher DW, և այլք: (December 2005). «Pharmacogenetics of tamoxifen biotransformation is associated with clinical outcomes of efficacy and hot flashes». Journal of Clinical Oncology. 23 (36): 9312–9318. doi:10.1200/JCO.2005.03.3266. PMID 16361630.
- ↑ Beverage JN, Sissung TM, Sion AM, Danesi R, Figg WD (September 2007). «CYP2D6 polymorphisms and the impact on tamoxifen therapy». Journal of Pharmaceutical Sciences. 96 (9): 2224–2231. doi:10.1002/jps.20892. PMID 17518364.
- ↑ Information about CYP2D6 and tamoxifen from DNADirect's website Արխիվացված 11 Մարտ 2007 Wayback Machine
- ↑ Schroth W, Goetz MP, Hamann U, Fasching PA, Schmidt M, Winter S, և այլք: (October 2009). «Association between CYP2D6 polymorphisms and outcomes among women with early stage breast cancer treated with tamoxifen». JAMA. 302 (13): 1429–1436. doi:10.1001/jama.2009.1420. PMC 3909953. PMID 19809024.
- ↑ Jin Y, Desta Z, Stearns V, Ward B, Ho H, Lee KH, և այլք: (January 2005). «CYP2D6 genotype, antidepressant use, and tamoxifen metabolism during adjuvant breast cancer treatment». Journal of the National Cancer Institute. 97 (1): 30–39. doi:10.1093/jnci/dji005. PMID 15632378.
- ↑ Staff Reports (Summer 2009). «ASCO Updates: Antidepressants Reduce the Effectiveness of Tamoxifen». CURE (Cancer Updates, Research and Education). Արխիվացված օրիգինալից 2009 թ․ հունիսի 22-ին.
- ↑ Thomas B, Magos A (2009). «Modern management of dysmenorrhoea». Trends in Urology, Gynaecology & Sexual Health. 14 (5): 25–29. doi:10.1002/tre.120.
- ↑ Jordan VC (October 1993). «Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer». British Journal of Pharmacology. 110 (2): 507–517. doi:10.1111/j.1476-5381.1993.tb13840.x. PMC 2175926. PMID 8242225.
- ↑ Romero SA, Young K, Hickey M, Su HI (December 2020). «Levonorgestrel intrauterine system for endometrial protection in women with breast cancer on adjuvant tamoxifen». The Cochrane Database of Systematic Reviews. 12 (2): CD007245. doi:10.1002/14651858.CD007245.pub4. PMC 8092675. PMID 33348436.
- ↑ «Breast cancer in men». CancerHelp UK. Cancer Research UK. 2007 թ․ սեպտեմբերի 28. Արխիվացված է օրիգինալից 2008 թ․ դեկտեմբերի 1-ին. Վերցված է 2009 թ․ մարտի 22-ին.
- ↑ Center for Drug Evaluation and Research (2005 թ․ հուլիսի 7). «Tamoxifen Information: reducing the incidence of breast cancer in women at high risk». U.S. Food and Drug Administration. Արխիվացված է օրիգինալից 2007 թ․ հունիսի 19-ին. Վերցված է 2007 թ․ հուլիսի 3-ին.
- ↑ Burstein HJ, Temin S, Anderson H, Buchholz TA, Davidson NE, Gelmon KE, և այլք: (July 2014). «Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update». Journal of Clinical Oncology. 32 (21): 2255–2269. doi:10.1200/JCO.2013.54.2258. PMC 4876310. PMID 24868023.
- ↑ Steiner AZ, Terplan M, Paulson RJ (June 2005). «Comparison of tamoxifen and clomiphene citrate for ovulation induction: a meta-analysis». Human Reproduction. 20 (6): 1511–1515. doi:10.1093/humrep/deh840. PMID 15845599.
- ↑ 57,0 57,1 Chua ME, Escusa KG, Luna S, Tapia LC, Dofitas B, Morales M (September 2013). «Revisiting oestrogen antagonists (clomiphene or tamoxifen) as medical empiric therapy for idiopathic male infertility: a meta-analysis». Andrology. 1 (5): 749–757. doi:10.1111/j.2047-2927.2013.00107.x. PMID 23970453. S2CID 38345293.
- ↑ Lapid O, van Wingerden JJ, Perlemuter L (2013). «Tamoxifen therapy for the management of pubertal gynecomastia: a systematic review». Journal of Pediatric Endocrinology & Metabolism. 26 (9–10): 803–807. doi:10.1515/jpem-2013-0052. PMID 23729603. S2CID 2101602.
- ↑ Viani GA, Bernardes da Silva LG, Stefano EJ (July 2012). «Prevention of gynecomastia and breast pain caused by androgen deprivation therapy in prostate cancer: tamoxifen or radiotherapy?». International Journal of Radiation Oncology, Biology, Physics. 83 (4): e519–e524. doi:10.1016/j.ijrobp.2012.01.036. PMID 22704706.
- ↑ Neyman A, Eugster EA (December 2017). «Treatment of Girls and Boys with McCune-Albright Syndrome with Precocious Puberty - Update 2017». Pediatric Endocrinology Reviews. 15 (2): 136–141. doi:10.17458/per.vol15.2017.nau.treatmentgirlsboys. PMC 5808444. PMID 29292624.
- ↑ Haddad NG, Eugster EA (June 2019). «Peripheral precocious puberty including congenital adrenal hyperplasia: causes, consequences, management and outcomes». Best Practice & Research. Clinical Endocrinology & Metabolism. 33 (3): 101273. doi:10.1016/j.beem.2019.04.007. hdl:1805/19111. PMID 31027974. S2CID 135410503.
- ↑ Zacharin M (May 2019). «Disorders of Puberty: Pharmacotherapeutic Strategies for Management». Handbook of Experimental Pharmacology. 261: 507–538. doi:10.1007/164_2019_208. ISBN 978-3-030-50493-9. PMID 31144045. S2CID 169040406.
- ↑ OncoGenetics.Org (September 2009). «Medications Effective in Reducing Risk of Breast Cancer But Increase Risk of Adverse Effects». OncoGenetics.Org. Արխիվացված է օրիգինալից 2009 թ․ սեպտեմբերի 24-ին. Վերցված է 2009 թ․ սեպտեմբերի 14-ին.
- ↑ Grilli S (2006). «Tamoxifen (TAM): the dispute goes on» (PDF). Annali dell'Istituto Superiore di Sanità. 42 (2): 170–173. PMID 17033137. Արխիվացված է օրիգինալից (PDF) 2007 թ․ օգոստոսի 10-ին. Վերցված է 2007 թ․ հուլիսի 3-ին.
- ↑ «Tamoxifen for Breast Cancer & Side Effects». Health and Life. 2009 թ․ դեկտեմբերի 11. Արխիվացված օրիգինալից 2010 թ․ փետրվարի 16-ին.
- ↑ «Known and Probable Carcinogens». American Cancer Society. 2006 թ․ փետրվարի 3. Արխիվացված օրիգինալից 2008 թ․ մարտի 17-ին. Վերցված է 2008 թ․ մարտի 21-ին.
- ↑ Esteva FJ, Hortobagyi GN (June 2006). «Comparative assessment of lipid effects of endocrine therapy for breast cancer: implications for cardiovascular disease prevention in postmenopausal women». Breast. 15 (3): 301–312. doi:10.1016/j.breast.2005.08.033. PMID 16230014.
- ↑ Decensi A, Maisonneuve P, Rotmensz N, Bettega D, Costa A, Sacchini V, և այլք: (February 2005). «Effect of tamoxifen on venous thromboembolic events in a breast cancer prevention trial». Circulation. 111 (5): 650–656. doi:10.1161/01.CIR.0000154545.84124.AC. PMID 15699284.
- ↑ Harvey HA, Kimura M, Hajba A (April 2006). «Toremifene: an evaluation of its safety profile». Breast. 15 (2): 142–157. doi:10.1016/j.breast.2005.09.007. PMID 16289904.
- ↑ Cameron R, Feuer G, de la Iglesia F (2012 թ․ դեկտեմբերի 6). Drug-Induced Hepatotoxicity. Springer Science & Business Media. էջեր 565–. ISBN 978-3-642-61013-4.
- ↑ Osman KA, Osman MM, Ahmed MH (January 2007). «Tamoxifen-induced non-alcoholic steatohepatitis: where are we now and where are we going?». Expert Opinion on Drug Safety. 6 (1): 1–4. doi:10.1517/14740338.6.1.1. PMID 17181445. S2CID 33505288.
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Տամոքսիֆեն» հոդվածին։ |
| ||||||||||
