«Ատոմ»–ի խմբագրումների տարբերություն
չNo edit summary |
|||
| Տող 2. | Տող 2. | ||
{{Տեղեկաքարտ Տարրական մասնիկ}} |
{{Տեղեկաքարտ Տարրական մասնիկ}} |
||
'''Ատոմ''', քիմիական |
'''Ատոմ''', քիմիական տարրի հատկություններ ունեցող փոքրագույն մասնիկ։ Ցանկացած [[պինդ մարմին]], [[հեղուկ]], [[գազ]] կամ [[Պլազմա (ֆիզիկա)|պլազմա]] կազմված է չեզոք կամ [[Իոնացում|իոնացված]] ատոմներից։ Ատոմները շատ փոքր են. սովորաբար մոտ 100 [[պիկոմետր]] (մեկ մետրի տասը միլիարդերորդը)։ |
||
[[Դը Բրոյլի ալիք|Փոքր չափերի]] պատճառով ատոմների վաքագծի վերաբերյալ դասական ֆիզիկայի կանխատեսումները նկատելիորեն սխալ են, ինչը պայմանավորված է [[Քվանտային մեխանիկա|քվանտային էֆեկտներով]]։ Ֆիզիկայի զարգմացման ընթացքում ատոմային մոդելները հիմնվել են քվանտային սկզբունքների վրա՝ |
[[Դը Բրոյլի ալիք|Փոքր չափերի]] պատճառով ատոմների վաքագծի վերաբերյալ [[Դասական ֆիզիկա|դասական ֆիզիկայի]] կանխատեսումները նկատելիորեն սխալ են, ինչը պայմանավորված է [[Քվանտային մեխանիկա|քվանտային էֆեկտներով]]։ Ֆիզիկայի զարգմացման ընթացքում ատոմային մոդելները հիմնվել են քվանտային սկզբունքների վրա՝ ատոմի վարքագիծն ավելի լավ կանխատեսելու և բացատրելու համար։ |
||
Ցանկացած ատոմ կազմված է մեկ [[Միջուկ (ատոմ)|միջուկից]] և մեկ կամ ավելի [[էլեկտրոն]]ներից։ Միջուկը կառուցված է մեկ կավ ավել պրոտոններից և սովորաբար գրեթե նույն քանակությամբ [[նեյտրոն]]ներից։ Պրոտոններն ու նեյտրոնները կոչվում են [[նուկլոն]]ները։ Ատոմի զանգվածի ավելի քան 99.94%-ը միջուկն է։ Պրոտոններն ունեն դրական, էլեկտրոնները՝ բացասական, իսկ նեյտրոնները՝ չեզոք [[էլեկտրական լիցք]]։ Եթե ատոմում էլեկտրոնների և պրոտոնների թիվը հավասար է, ուրեմն այն էլեկտրականապես չեզոք է։ Եթե ատոմում պրոտոնների համեմատ կան ավել կամ պակաս էլեկտրոններ, ուրեմն այն համապատասխանաբար բացասական կամ դրական լիցք ունի և կոչվում է [[իոն]]։ |
Ցանկացած ատոմ կազմված է մեկ [[Միջուկ (ատոմ)|միջուկից]] և մեկ կամ ավելի [[էլեկտրոն]]ներից։ Միջուկը կառուցված է մեկ կավ ավել պրոտոններից և սովորաբար գրեթե նույն քանակությամբ [[նեյտրոն]]ներից։ Պրոտոններն ու նեյտրոնները կոչվում են [[նուկլոն]]ները։ Ատոմի զանգվածի ավելի քան 99.94%-ը միջուկն է։ Պրոտոններն ունեն դրական, էլեկտրոնները՝ բացասական, իսկ նեյտրոնները՝ չեզոք [[էլեկտրական լիցք]]։ Եթե ատոմում էլեկտրոնների և պրոտոնների թիվը հավասար է, ուրեմն այն էլեկտրականապես չեզոք է։ Եթե ատոմում պրոտոնների համեմատ կան ավել կամ պակաս էլեկտրոններ, ուրեմն այն համապատասխանաբար բացասական կամ դրական լիցք ունի և կոչվում է [[իոն]]։ |
||
| Տող 10. | Տող 10. | ||
Ատոմում էլեկտրոնները միջուկի հետ կապված են [[էլեկտրամագնիսականություն|էլեկտրամագնիսական]] ուժի միջոցով։ Պրոտոնները և նեյտրոնները միջուկում կապված են [[միջուկային ուժեր]]ով, որոնք սովորաբար ավելի ուժեղ են էլեկտրամագնիսական ուժերից և չեզոքացնում են դրական լիցք ունեցող պրոտոնների միջև եղած վանող ուժերին։ Որոշակի պայմաններում վանող էլեկտրամագնիսական ուժը կարող է միջուկային ուժերից ուժեղ դառնալ, ինչի հետևանքով միջուկից կարող են նուկլոններ հեռանալ (այս [[Ռադիոակտիվություն|միջուկային տրոհման]] արդյունքում առաջանում է այլ քիմիական տարր)։ |
Ատոմում էլեկտրոնները միջուկի հետ կապված են [[էլեկտրամագնիսականություն|էլեկտրամագնիսական]] ուժի միջոցով։ Պրոտոնները և նեյտրոնները միջուկում կապված են [[միջուկային ուժեր]]ով, որոնք սովորաբար ավելի ուժեղ են էլեկտրամագնիսական ուժերից և չեզոքացնում են դրական լիցք ունեցող պրոտոնների միջև եղած վանող ուժերին։ Որոշակի պայմաններում վանող էլեկտրամագնիսական ուժը կարող է միջուկային ուժերից ուժեղ դառնալ, ինչի հետևանքով միջուկից կարող են նուկլոններ հեռանալ (այս [[Ռադիոակտիվություն|միջուկային տրոհման]] արդյունքում առաջանում է այլ քիմիական տարր)։ |
||
Ատոմում պրոտոնների քանակով է պայմանավորված թե ինչ քիմիական տարրի ատոմ է այն. օրինակ՝ [[պղինձ|պղնձի]] բոլոր ատոմները ունեն 29 պրոտոն, իսկ նեյտրոնների թվով պայմանավորված թե քիմիական տարիի որ իզոտոպից է ատոմը։ Էլեկտրոնների քանակը ազդեցություն ունի ատոմի էլեկտրամագնիսական հատկությունների վրա։ [[Քիմիական կապ]]երի միջոցով ատոմները կարող են [[քիմիական միացություններ]] կազմել, ինչպես օրինակ [[մոլեկուլ]]ները։ |
Ատոմում պրոտոնների քանակով է պայմանավորված թե ինչ քիմիական տարրի ատոմ է այն. օրինակ՝ [[պղինձ|պղնձի]] բոլոր ատոմները ունեն 29 պրոտոն, իսկ նեյտրոնների թվով պայմանավորված է թե քիմիական տարիի որ իզոտոպից է ատոմը։ Էլեկտրոնների քանակը ազդեցություն ունի ատոմի էլեկտրամագնիսական հատկությունների վրա։ [[Քիմիական կապ]]երի միջոցով ատոմները կարող են [[քիմիական միացություններ]] կազմել, ինչպես օրինակ [[մոլեկուլ]]ները։ |
||
== Ատոմային տեսության պատմություն == |
== Ատոմային տեսության պատմություն == |
||
=== Ատոմները փիլիսոփայությունում === |
=== Ատոմները փիլիսոփայությունում === |
||
{{հիմնական|ատոմիզմ}} |
{{հիմնական|ատոմիզմ}} |
||
Այն միտքը, որ նյութը կազմած է դիսկրետ միավորներից հանդիպում է բազմաթիվ անտիկ մշակույթներում, ինչպես օրինակ՝ Հնդկաստանում և |
Այն միտքը, որ նյութը կազմած է դիսկրետ միավորներից հանդիպում է բազմաթիվ անտիկ մշակույթներում, ինչպես օրինակ՝ [[Հնդկաստան|Հնդկաստանում]] և [[Հունաստան|Հունաստանում]]։ «Ատոմ» անվանումը տրվել է հին հույն փիլիսոփաների կողմից։ Սակայն, այս գաղափաները հիմնված էին փիլիսոփայական և աստվածաբանական հիմնավորումների վրա, ոչ թե ապացույցների և փորձերի։ Այդ պատճառով ատոմի կառուցվածքի և վարքագծի մասին նրանց պատկերացումները սխալ էին։ Նրանք նաև չէին կարող ապացուցել իրենց վարկածը, այսպիսով ատոմիզմը նյութի բնույթի վերաբերյալ բազմաթիվ տեսություններից մեկն էր։ Միայն 19-րդ դարում ատոմի գաղափարը ընդունվեց գիտնականների կողմից, երբ քիմիայում արվեցին այնպիսի հայտնագորցություններ, որոնք միայն կարող էին բացատրվել ատոմի գոյությամբ։ |
||
===Ապացույցի վրա հիմնված առաջին տեսություն=== |
===Ապացույցի վրա հիմնված առաջին տեսություն=== |
||
[[File:Daltons symbols.gif |
[[File:Daltons symbols.gif|thumb| |
||
Բազմաթիվ ատոմների և մոլեկուլների պատկերներ [[Ջոն Դալթոն|Ջոն Դալթոնի]] «Քիմիական փիլիսոփայության նոր համակարգ» (''A New System of Chemical Philosophy,'' 1808) աշխատությունում։]] |
|||
1800-ական թվականների սկզբին [[Ջոն Դալթոն]]ը ատոմի գաղափարի միջոցով է բացատրել այն, որ [[Քիմիական տարրեր|տարրերը]] միշտ փոխազդում են փոքր ամբողջ թվերի հարաբերությամբ։՚ Օրինակ՝ գոյություն ունի երկու անագի օքսիդ. մեկը՝ 88.1% անագ, 11.9% թթվածին, երկրորդը՝ 78.7% անագ, 21.3% թթվածին (համապատասխանաբար [[անագի օքսիդ(II)]] և [[անագի օքսիդ(IV)]])։ Սա նշանակում է, որ 100 գրամ միայն կարող է միանալ 13.5 կամ 27 գրամ թթվածնի հետ։ 13.5-ը և 27-ը կազմում եմ 1:2 հարաբերություն։ Այս փաստից ելնելով Դալթոնը եզրակացրեց, որ տարրերը փոխազդում են դիսկրետ միավորների (այլ կերպ ասած՝ ատոմների) ամբողջ թվի բազմապատիկներով։ Անագի օքսիդի պարագայում մեկ անագի ատոմը կարող է միանալ կամ մեկ, կամ երկու թթվածնի ատոմի հետ։<ref name="From AtomosToAtom">{{cite book|author=Andrew G. van Melsen |year=1952 |title=From Atomos to Atom |isbn= 0-486-49584-1 |publisher=Dover Publications |location=Mineola, N.Y.}}</ref> |
1800-ական թվականների սկզբին [[Ջոն Դալթոն]]ը ատոմի գաղափարի միջոցով է բացատրել այն, որ [[Քիմիական տարրեր|տարրերը]] միշտ փոխազդում են փոքր ամբողջ թվերի հարաբերությամբ։՚ Օրինակ՝ գոյություն ունի երկու անագի օքսիդ. մեկը՝ 88.1% անագ, 11.9% թթվածին, երկրորդը՝ 78.7% անագ, 21.3% թթվածին (համապատասխանաբար [[անագի օքսիդ(II)]] և [[անագի օքսիդ(IV)]])։ Սա նշանակում է, որ 100 գրամ անագը միայն կարող է միանալ 13.5 կամ 27 գրամ թթվածնի հետ։ 13.5-ը և 27-ը կազմում եմ 1:2 հարաբերություն։ Այս փաստից ելնելով Դալթոնը եզրակացրեց, որ տարրերը փոխազդում են դիսկրետ միավորների (այլ կերպ ասած՝ ատոմների) ամբողջ թվի բազմապատիկներով։ Անագի օքսիդի պարագայում մեկ անագի ատոմը կարող է միանալ կամ մեկ, կամ երկու թթվածնի ատոմի հետ։<ref name="From AtomosToAtom">{{cite book|author=Andrew G. van Melsen |year=1952 |title=From Atomos to Atom |isbn= 0-486-49584-1 |publisher=Dover Publications |location=Mineola, N.Y.}}</ref> |
||
Դալթոնը նաև հավատում էր, որ ատոմի տեսությունը կարող է բացատրել, թե ինչու է ջուրը տարբեր գազեր տարբեր հարաբերությամբ կլանում։ Օրինակ՝ նա գտավ, որ ջուրը [[ածխաթթու գազ]] շատ ավելի լավ է կլանում, քան [[ազոտ]]։<ref name = "Dalton_1803_paper">Dalton, John. "[http://web.lemoyne.edu/~GIUNTA/dalton52.html On the Absorption of Gases by Water and Other Liquids]", in ''Memoirs of the Literary and Philosophical Society of Manchester''. 1803. Retrieved on August 29, 2007.</ref> Դալթոնը կարծում էր, որ սա կապված է գազերի համապատասխան մասնիկների զանգվածների և դասավորության տարբերությունների հետ (ածխաթթու գազի մոլեկուլը (CO<sub>2</sub>) շատ ավելի մեծ և ծանր է ազոտի մոլեկուլից (N<sub>2</sub>))։ |
Դալթոնը նաև հավատում էր, որ ատոմի տեսությունը կարող է բացատրել, թե ինչու է ջուրը տարբեր գազեր տարբեր հարաբերությամբ կլանում։ Օրինակ՝ նա գտավ, որ ջուրը [[ածխաթթու գազ]] շատ ավելի լավ է կլանում, քան [[ազոտ]]։<ref name = "Dalton_1803_paper">Dalton, John. "[http://web.lemoyne.edu/~GIUNTA/dalton52.html On the Absorption of Gases by Water and Other Liquids]", in ''Memoirs of the Literary and Philosophical Society of Manchester''. 1803. Retrieved on August 29, 2007.</ref> Դալթոնը կարծում էր, որ սա կապված է գազերի համապատասխան մասնիկների զանգվածների և դասավորության տարբերությունների հետ (ածխաթթու գազի մոլեկուլը (CO<sub>2</sub>) շատ ավելի մեծ և ծանր է ազոտի մոլեկուլից (N<sub>2</sub>))։ |
||
=== Բրոունյան շարժում === |
=== Բրոունյան շարժում === |
||
1827 թվականին [[Բուսաբանություն|բուսաբան]] [[Ռոբերտ Բրոուն]]ը ջրի մեջ ծաղկափոշու շարժը մանրադիտոկով ուսումնասիրելիս հայտնաբերեց, որ նրանք շարժվում են անկոնոն, |
1827 թվականին [[Բուսաբանություն|բուսաբան]] [[Ռոբերտ Բրոուն]]ը ջրի մեջ ծաղկափոշու շարժը մանրադիտոկով ուսումնասիրելիս հայտնաբերեց, որ նրանք շարժվում են անկոնոն և անդադար, այս երևույթը այժմ կոչվում է «[[Բրոունյան շարժում]]»։ Ենթադրվում էր, որ սրա պատճառը ջրի մոլեկուլների շարժն է։ 1905 թվականին [[Ալբերտ Այնշտայն]]ը ապացուցեց այս մոլեկուլների և նրանց շարժման գոյությունը՝ բրոունյան շարժման առաջին վիճակագրական վերլուծությամբ։<ref name=adp322_8_549/><ref>{{cite book |
||
|last=Mazo|first=Robert M.|year=2002 |
|last=Mazo|first=Robert M.|year=2002 |
||
|title=Brownian Motion: Fluctuations, Dynamics, and Applications |
|title=Brownian Motion: Fluctuations, Dynamics, and Applications |
||
| Տող 35. | Տող 35. | ||
=== Էլեկտրոնի հայտնաբերում === |
=== Էլեկտրոնի հայտնաբերում === |
||
[[File:Gold foil experiment conclusions.svg|thumb|right|'''Գեյգեր-Մարսդենի փորձ'''<br /> ''Վերևում։'' Ակնկալվող արդյունք: Ալֆա մասնիկները անցնում են ատոմի պուդինգային մոդելի միջով աննշան շեղմամբ։<br /> ''Ներքևում:'' Դիտարկված արդյունք: Մասնիկների փոքր մասը շեղվել է դրական լիցքավորված միջուկի պատճառով։]] |
[[File:Gold foil experiment conclusions.svg|thumb|right|'''Գեյգեր-Մարսդենի փորձ'''<br /> ''Վերևում։'' Ակնկալվող արդյունք: Ալֆա մասնիկները անցնում են ատոմի պուդինգային մոդելի միջով աննշան շեղմամբ։<br /> ''Ներքևում:'' Դիտարկված արդյունք: Մասնիկների փոքր մասը շեղվել է դրական լիցքավորված միջուկի պատճառով։]] |
||
Ֆիզիկոս [[Ջոզեֆ Ջոն Թոմսոն]] հաշվել է կաթոդային ճառագայթների զանգվածը՝ ցույց տալով, որ դրանք կազմված են մասնիկներից, բայց որոնք մոտ 1800 անգամ ավելի թեթև են, քան ամենաթեթև ատոմը՝ [[ջրածին]]ը։ Հետևաբար՝, դրանք ատոմները չեն, բայց մասնիկ են։ Սա առաջին հայտնաբերված ''[[ներատոմային մասնիկ]]''ն էր, որը սկզբում Թոմսոնը անվանեց «կորպուսկուլ», սակայն հետագայում անվանվել է «էլեկտրոն»։ [[Ջորջ Սթոնի]]ն ցույց է տվել, որ |
Ֆիզիկոս [[Ջոզեֆ Ջոն Թոմսոն|Ջոզեֆ Ջոն Թոմսոնը]] հաշվել է կաթոդային ճառագայթների զանգվածը՝ ցույց տալով, որ դրանք կազմված են մասնիկներից, բայց որոնք մոտ 1800 անգամ ավելի թեթև են, քան ամենաթեթև ատոմը՝ [[ջրածին]]ը։ Հետևաբար՝, դրանք ատոմները չեն, բայց մասնիկ են։ Սա առաջին հայտնաբերված ''[[ներատոմային մասնիկ]]''ն էր, որը սկզբում Թոմսոնը անվանեց «կորպուսկուլ», սակայն հետագայում անվանվել է «էլեկտրոն»։ [[Ջորջ Սթոնի]]ն ցույց է տվել, որ սրանք նույն այն մասնիկներն են, որոնք անջատվում են ֆոտոէլեկտրական և ռադիոակտիվ նյութերից։<ref name="Thomson">{{cite journal|last=Thomson|first=J. J.|title=On bodies smaller than atoms|journal=The Popular Science Monthly|volume=|issue= |pages=323–335|publisher=Bonnier Corp.|location= |date=August 1901|url=https://books.google.com/?id=3CMDAAAAMBAJ&pg=PA323|doi= |id= |accessdate=2009-06-21}}</ref> Արագորեն հայտնաբերվեց, որ դրանք մետաղական լարերում [[էլեկտրական հոսանք]] կրող մասնիկներն են, որոնք նաև կրում են ատոմում բացասական էլեկտրական լիցքը։ Այս աշխատանքի համար 1906 թվականին Թոմսոնը ստացավ [[Ֆիզիկայի Նոբելյան մրցանակ]]։ Այսպիսով, նա վերացրեց այն տեսակետը թե ատոմները նույթի անբաժանելի, վերջնական մասնիկներն են։<ref name=nobel1096/> Թոմսոնը սխալմամբ կարծում էր, որ տարրերի ատոմները կազմված են մի քանի բացասականապես լիցքավորված էլեկտրոններից, որոնք մտնում են համասեռ բաշխված դրական էլեկտրական լիցք ունեցող ոլորտի մեջ (սա հայտնի է [[Թոմսոնի ատոմի մոդել]] անվամբ)։ |
||
=== Միջուկի հայտնաբերում === |
=== Միջուկի հայտնաբերում === |
||
Պարզվեց, որ [[ատոմի թոմսոնյան մոդել]]ը անբավարար է բազմաթիվ երևույթներ բացատրելու համար։ Դրանով չհաջողվեց բացատրել ատոմների կողմից [[ալֆա մասնիկներ|ալֆա–մասնիկների]] ցրման երևույթը հաստատող անգլիացի ֆիզիկոս [[Էռնեստ Ռեզերֆորդ]]ի և նրա |
Պարզվեց, որ [[ատոմի թոմսոնյան մոդել]]ը անբավարար է բազմաթիվ երևույթներ բացատրելու համար։ Դրանով չհաջողվեց բացատրել ատոմների կողմից [[ալֆա մասնիկներ|ալֆա–մասնիկների]] ցրման երևույթը հաստատող անգլիացի ֆիզիկոս [[Էռնեստ Ռեզերֆորդ]]ի և նրա աշխատակիցների՝ Հանս Գեյգերի և Էրնեստ Մարսդեի, 1909 թվականին կատարած փորձերի արդյունքները։ Անցնելով նյութի միջով, ալֆա–մասնիկներն ընդհարվում են ատոմների հետ։ Յուրաքանչյուր ընդհարման ժամանակ ալֆա–մասնիկը, անցնելով ատոմի էլեկտրական դաշտով, փոխում է շարժման ուղղությունը՝ ցրվում է։ Այդ շեղումները հիմնականում շատ փոքր են։ Ուստի և նյութի բարակ շերտով ալֆա–մասնիկների փունջը անցնելիս տեղի էր ունենում փնջի շատ փոքր ցրում։ Սակայն մասնիկներից մի քանիսը շեղվում էին 90°–ից ավելի անկյունով։ Այս երևույթը չէր բացատրվում Թոմսոնի մոդելով, որովհետև «հոծ» ատոմի էլեկտրական դաշտը չէր կարող մեծ անկյունով շեղել զանգվածեղ և արագաշարժ ալֆա–մասնիկը։ Ռեզերֆորդը առաջարկեց ատոմի սկզբունքորեն նոր մոդել, որն իր կառուցվածքով հիշեցնում է [[արեգակնային համակարգ]]ը և ստացավ մոլորակային մոդել անունը։ Ըստ այդ մոդելի՝ ատոմի կենտրոնում գտնվում է դրական լիցք ունեցող միջուկը, որի չափերը (~10<sup>−14</sup> ''մ'') շատ փոքր են ատոմի չափերից (~10<sup>−10</sup> ''մ''), իսկ զանգվածը գրեթե հավասար է ատոմի զանգվածին։ Միջուկի շուրջը պտտվում են [[էլեկտրոններ]]ը (ինչպես մոլորակները Արեգակի շուրջը)։ Չլիցքավորված (չեզոք) ատոմում էլեկտրոնների թիվը այնպիսին է, որ նրանց գումարային բացասական լիցքը չեզոքացնում է միջուկի դրական լիցքը։ Ի տարբերություն մոլորակային համակարգում գործող [[Գրավիտացիոն դաշտ|ձգողականության ուժի]], ատոմում գործում են [[Էլեկտրական դաշտ|էլեկտրական (կուլոնյան) ուժեր]]։<ref>{{Գիրք:ՀՍՀ}}</ref><ref name=pm21_669/><ref>{{cite web|title=The Gold Foil Experiment|url=http://myweb.usf.edu/~mhight/goldfoil.html|website=myweb.usf.edu}}</ref> |
||
=== Իզոտոպների հայտնաբերում === |
=== Իզոտոպների հայտնաբերում === |
||
1913 թվականին ռադիոակտիվ նյութերի հետ փորձարկումներ անելիս [[Ռադիոքիմիա|ռադիոքիմիկոս]] [[Ֆրեդերիկ Սոդդի]]ը հայտնաբերեց, որ պարբերական համակարգի յուրաքանչյուր դիրքի համար կան ավելի քան մեկ տեսակի ատոմներ։<ref name=npc1921/> |
1913 թվականին ռադիոակտիվ նյութերի հետ փորձարկումներ անելիս [[Ռադիոքիմիա|ռադիոքիմիկոս]] [[Ֆրեդերիկ Սոդդի]]ը հայտնաբերեց, որ պարբերական համակարգի յուրաքանչյուր դիրքի համար կան ավելի քան մեկ տեսակի ատոմներ։<ref name=npc1921/> [[Իզոտոպ]] անվանումը տվել է Մարգարետ Թոդ։ Ջ. Ջ. Թոմսոնը իոնացված գազերի վերաբերյալ իր աշխատանքի ընթացքում ատոմների տեսակները առանձնացնելու եղանակ է ստեղծել, ինչը հետագայում հանգեցրեց կայուն իզոտոպների հայտնաբերմանը։<ref name=prsA_89_1_1913/> |
||
=== Բորի մոդել === |
=== Բորի մոդել === |
||
[[File:Bohr atom animation 2.gif|right|thumb|Ատոմի Բորի մոդել։ Էլեկտրոնը ակնթարթային «քվանտային թռիչքով» փոխում է ուղեծիրը։ Այս մոդելը հնացած է։]] |
[[File:Bohr atom animation 2.gif|right|thumb|Ատոմի Բորի մոդել։ Էլեկտրոնը ակնթարթային «քվանտային թռիչքով» փոխում է ուղեծիրը։ Այս մոդելը հնացած է։]] |
||
{{հիմնական|Բորի մոդել}} |
{{հիմնական|Բորի մոդել}} |
||
1913 թվականին ֆիզիկոս [[Նիլս Բոր]]ը առաջ քաշեց մոդել, ըստ որի՝ էլեկտրոնները ատոմում կարող են շարժվել միայն որոշակի ուղեծրերով և չճկառագայթել, սակայն մի ուղեծրից մյուսին անցնել կարող են միայն դիսկրետ քանակությամբ էներգիա կլանելով կամ ճառագայթելով։<ref name=stern20050516/> Այս մոդելը բացատրեց էլեկտրոնների ուղեծրերի կայությունը (դասական էլեկտրադինամիկայի տեսանկյունից Ռեզերֆորդի մոդելում էլեկտրոնը, որը պտտվում էր միջուկի շուրջը պետք է անընդհատ ճառագայթեր և շատ արագ կորցնելով էներգիան՝ ընկներ միջուկի վրա) և այն, որ էլեկտրոնները |
1913 թվականին ֆիզիկոս [[Նիլս Բոր]]ը առաջ քաշեց մոդել, ըստ որի՝ էլեկտրոնները ատոմում կարող են շարժվել միայն որոշակի ուղեծրերով և չճկառագայթել, սակայն մի ուղեծրից մյուսին անցնել կարող են միայն դիսկրետ քանակությամբ էներգիա կլանելով կամ ճառագայթելով։<ref name=stern20050516/> Այս մոդելը բացատրեց էլեկտրոնների ուղեծրերի կայությունը (դասական էլեկտրադինամիկայի տեսանկյունից Ռեզերֆորդի մոդելում էլեկտրոնը, որը պտտվում էր միջուկի շուրջը պետք է անընդհատ ճառագայթեր և շատ արագ կորցնելով էներգիան՝ ընկներ միջուկի վրա) և այն, որ էլեկտրոնները էլեկտրամագնիսական ճառագայթումը կլանում կամ արձագում են դիսկրետ սպեկտրային չափով։<ref name=bohr19221211/> |
||
Նույն թվականին արված Հենրի Մոսելեիի փորձերով նույնպես ապացուցվում էր [[Բորի մոդել|Նիլս Բորի տեսությունը]]։ Այս արդյունքները կատարելագործեցին [[Էռնեստ Ռեզերֆորդ]]ի և [[Անտոնիո Վան դե Դոր Բրոք]]ի մոդելը, ըստ որի՝ ատոմի միջուկի լիցքը հավասար է պարբերական համակարգում իր համարին։ Մինչև այս փորձերը [[ատոմական համար]]ը ֆիզիկական կամ փորձարարական մեծություն չէր։ Այն, որ ատոմային համարը համապատասխանում է ատոմի միջուկի լիցքին, ընդունվում է նաև ատոմի ժամանակակից մոդելի կողմից։<ref>{{Cite book |
Նույն թվականին արված Հենրի Մոսելեիի փորձերով նույնպես ապացուցվում էր [[Բորի մոդել|Նիլս Բորի տեսությունը]]։ Այս արդյունքները կատարելագործեցին [[Էռնեստ Ռեզերֆորդ]]ի և [[Անտոնիո Վան դե Դոր Բրոք]]ի մոդելը, ըստ որի՝ ատոմի միջուկի լիցքը հավասար է պարբերական համակարգում իր համարին։ Մինչև այս փորձերը [[ատոմական համար]]ը ֆիզիկական կամ փորձարարական մեծություն չէր։ Այն, որ ատոմային համարը համապատասխանում է ատոմի միջուկի լիցքին, ընդունվում է նաև ատոմի ժամանակակից մոդելի կողմից։<ref>{{Cite book |
||
| Տող 54. | Տող 54. | ||
=== Քիմիական կապերի բացատրություն === |
=== Քիմիական կապերի բացատրություն === |
||
1916 թվականին Գիլբերտ Նյուտոն Լյուիսը բացատրել է ատոմների միջև [[քիմիական կապ]]երը որպես իրենց բաղադրիչ էլեկտրոնների փոխազդեցություն։<ref name=jacs38_4_762/> Քանի որ տարրերի քիմիական հատկությունները [[պարբերական օրենք]] |
1916 թվականին Գիլբերտ Նյուտոն Լյուիսը բացատրել է ատոմների միջև [[քիմիական կապ]]երը որպես իրենց բաղադրիչ էլեկտրոնների փոխազդեցություն։<ref name=jacs38_4_762/> Քանի որ տարրերի քիմիական հատկությունները [[պարբերական օրենք|պարբերական օրենքի]] համաձայն կրկնվում են,<ref>{{cite book |
||
|last=Scerri|first=Eric R. |
|last=Scerri|first=Eric R. |
||
|title=The periodic table: its story and its significance |
|title=The periodic table: its story and its significance |
||
|publisher=Oxford University Press US|year=2007 |
|publisher=Oxford University Press US|year=2007 |
||
|isbn=0-19-530573-6|pages=205–226}}</ref> 1919 թվականին ամերիկացի քիմիկոս Իրվինգ |
|isbn=0-19-530573-6|pages=205–226}}</ref> 1919 թվականին ամերիկացի քիմիկոս Իրվինգ Լենգմյուրը ենթադրեց, որ սա կարող է բացատրվել, եթե ատոմում էլեկտրոնները կապված կամ խմբավորված են ինչ-որ ձևով։ Նա կարծում էր, որ միջուկի շուրջը էլեկտրոնների խմբերը զբաղեցնում են էլեկտրոնային շերտեր։<ref name=jacs41_6_868/> |
||
=== Քվանտային ֆիզիկայի հետագա զարգացումներ === |
=== Քվանտային ֆիզիկայի հետագա զարգացումներ === |
||
1922 թվականի [[Շտեռն-Գեռլախի փորձ]]ը լրացուցիչ ապացույցներ տրամադրեց ատոմի քվանտային բնույթի համար։ Արծաթի ատոմների փունջը, անցնելով խիստ անհամասեռ մագնիսական դաշտով, ճեղքվում էր և էկրանի վրա առաջացնում շերտեր, որոնք վկայում էին մագնիսական մոմենտի պրոյեկցիայի քվանտացումը։ Դասական տեսության համաձայն, էկրանի վրա պետք է առաջանար մեկ հաստ շերտ, սակայն իրականում առաջանում էին սիմետրիկ դասավորված 2 նեղ շերտեր։<ref name=fop17_6_575/> |
1922 թվականի [[Շտեռն-Գեռլախի փորձ]]ը լրացուցիչ ապացույցներ տրամադրեց ատոմի քվանտային բնույթի համար։ Արծաթի ատոմների փունջը, անցնելով խիստ անհամասեռ մագնիսական դաշտով, ճեղքվում էր և էկրանի վրա առաջացնում շերտեր, որոնք վկայում էին մագնիսական մոմենտի պրոյեկցիայի քվանտացումը։ Դասական տեսության համաձայն, էկրանի վրա պետք է առաջանար մեկ հաստ շերտ, սակայն իրականում առաջանում էին սիմետրիկ դասավորված 2 նեղ շերտեր։<ref name=fop17_6_575/> |
||
1924 թվականին [[Լուի դը Բրոյլ]]ը առաջարկեց, որ բոլոր մասնիկները որոշ չափով վարվում են ալիքների նման։ 1926 թվականին [[Էրվին Շրյոդինգեր]] օգտագործեց այս միտքը՝ ատոմի մաթեմատիկական մոդել ստեղծելու համար, որը |
1924 թվականին [[Լուի դը Բրոյլ]]ը առաջարկեց, որ բոլոր մասնիկները որոշ չափով վարվում են ալիքների նման։ 1926 թվականին [[Էրվին Շրյոդինգեր]] օգտագործեց այս միտքը՝ ատոմի մաթեմատիկական մոդել ստեղծելու համար, որը էլեկտրոններին նկարագում էր որպես եռաչափ ալիքի ձևերի<!-- waveform wave-ալիք, form-ձև, բայց վստահ չեմ, որ այս թարգմանությունը ճիշտ է -->, ոչ թե կետային մասնիկի տեսքով։ Այս մոդելի հետևանքն այն էր, որ տրված պահին մասնիկի դիրքի և [[Իմպուլս (շարժման քանակ)|իմպուլսի]] համար մաթեմատիկորեն անհնար է ստանալ ճշգրիտ արժեքներ։ Այլ կերպ ասած, որքան ավելի մեծ ճշգրտությամբ հնարավոր է իմանալ հատկություններից որևէ մեկը, այնքան սակավ ճշգրտությամբ է հնարավոր չափել, վերահսկել կամ իմանալ մյուս հատկությունը։<ref>{{cite web|url=https://www.youtube.com/watch?v=TQKELOE9eY4|title=What is the Heisenberg Uncertainty Principle? - Chad Orzel|first=|last=TED-Ed|date=16 September 2014|publisher=|via=YouTube}}</ref> Սա հայտնի է [[անորոշությունների սկզբունք]] անվամբ, որը ձևակերպել է [[Վերներ Հայզենբերգ]]ը 1926 թվականին։ Այս մոդելի օգնությամբ բացատրվեցին դիտումների ընթացքում նկատրված ատոմի վարքագծեր, որոնք նախկին մոդելը չէր կարող բացատրել, ինչպես օրինակ՝ ջրածնից մեծ ատոմներում որոշակի կառուցվածքային և սպեկտրյալ նմանությունները։<ref name=brown2007/><ref name=harrison2000/> |
||
=== Նեյտրոնի հայտնաբերում === |
=== Նեյտրոնի հայտնաբերում === |
||
[[Մասս-սպեկտրաչափություն|Մասս-սպեկտրաչափության]] զարգացումը հնարավորություն տվեց մեծ |
[[Մասս-սպեկտրաչափություն|Մասս-սպեկտրաչափության]] զարգացումը հնարավորություն տվեց մեծ ճշտությամբ չափել ատոմի զանգվածը։ Քիմիկոս [[Ֆրենսիս Ուիլյամ Աստոն]]ը այս սարքի օգնությամբ ցույց է տվել, որ իզոտոպները տարբեր զանգված ունեն։ Իզոտոմների [[ատոմային զանգված]]ը տարբերվում է ջրածնի ատոմի ծանգվածի ամբողջ բազմապատիկների քանակով։<ref name=pm39_6_449/> 1932 թվականին ֆիզիկոս [[Ջեյմս Չադվիկ]]ը [[նեյտրոն|նեյտրոնի]] հայտնաբերմաբ բացատրեց այս երևույթը։ Նեյտրոնը չեզոք լիցք ունեցող մասնիկ է, որի զանգվածը գրեթե հավասար է պրոտոնի զանգվածին։ Իզոտոպները նույն նույն քանակությամբ պրոտոն, բայց տարբեր քանակությամբ նեյտրոն ունեցող տարրեր են։<ref name=chadwick1935/> |
||
=== Տրոհում, բարձր էներգիայի ֆիզիկա և կոնդենսացված նյութ === |
=== Տրոհում, բարձր էներգիայի ֆիզիկա և կոնդենսացված նյութ === |
||
1938 թվականին գերմանացի քիմիկոս Օտտո Հահնը՝ Ռեզերֆորդի ուսանողներից մեկը, [[տրանսուրան տարր]] ստանալու նպատակով ուրանի |
1938 թվականին գերմանացի քիմիկոս Օտտո Հահնը՝ Ռեզերֆորդի ուսանողներից մեկը, [[տրանսուրան տարր]] ստանալու նպատակով ուրանի ատոմները ռմբակոծեց նեյտրոններով։ Սակայն նա դրա փոխարեն ստացավ [[բարիում]]։<ref name=Bowden/><ref name=CHF/> Մեկ տարի անց [[Լիզա Մեյտներ]]ը և իր ազգական Օտտո Ֆրիշը հաստատեցին, որ Հահնի արդյունքները առաջին փորձարարական ''միջուկային տրոհումն'' էր։<ref name=nature143_3615_239/><ref name=schroeder/> 1944 թվականին Հահն ստացավ [[Քիմիայի Նոբելյան մրցանակ]]։ Չնայած Հահնի ջանքերին, Մեյտների և Ֆրիշի ներդրումները չեն ճանաչվել։<ref name=pt50_9_26/> |
||
1950-ական թվականներին [[արագացուցիչ]]ների և մասնիկների դետեկտորների կատարելագործումը գիտնականներին թույլ տվեց ուսումնասիրել բարձր էներգիաներում ատոմների շարժի հետևանքները։<ref name=kullander2001/> Պարզվեց, որ նեյտրոններն ու պրոտոնները [[հադրոն]]ներ են, |
1950-ական թվականներին [[արագացուցիչ]]ների և մասնիկների դետեկտորների կատարելագործումը գիտնականներին թույլ տվեց ուսումնասիրել բարձր էներգիաներում ատոմների շարժի հետևանքները։<ref name=kullander2001/> Պարզվեց, որ նեյտրոններն ու պրոտոնները [[հադրոն]]ներ են, և կազմված են ավելի փոքր մասնիկներից, որոնք կոչվում են [[քվարկ]]ներ։ Ձևավորվել է [[ստանդարտ մոդել]]ը, որը մինչև այժմ բարեհաջող բացատրել է միջուկի հատկությունները։<ref name=npp1990/> |
||
== Ատոմի միջուկի կառուցվածք == |
== Ատոմի միջուկի կառուցվածք == |
||
03:36, 25 Հուլիսի 2017-ի տարբերակ
 | |
| Ենթադաս | chemical entity?[1] և բաղադրյալ մասնիկ |
|---|---|
| Դյուի տասնորդական դասակարգում | 539.7 |
Ատոմ, քիմիական տարրի հատկություններ ունեցող փոքրագույն մասնիկ։ Ցանկացած պինդ մարմին, հեղուկ, գազ կամ պլազմա կազմված է չեզոք կամ իոնացված ատոմներից։ Ատոմները շատ փոքր են. սովորաբար մոտ 100 պիկոմետր (մեկ մետրի տասը միլիարդերորդը)։
Փոքր չափերի պատճառով ատոմների վաքագծի վերաբերյալ դասական ֆիզիկայի կանխատեսումները նկատելիորեն սխալ են, ինչը պայմանավորված է քվանտային էֆեկտներով։ Ֆիզիկայի զարգմացման ընթացքում ատոմային մոդելները հիմնվել են քվանտային սկզբունքների վրա՝ ատոմի վարքագիծն ավելի լավ կանխատեսելու և բացատրելու համար։
Ցանկացած ատոմ կազմված է մեկ միջուկից և մեկ կամ ավելի էլեկտրոններից։ Միջուկը կառուցված է մեկ կավ ավել պրոտոններից և սովորաբար գրեթե նույն քանակությամբ նեյտրոններից։ Պրոտոններն ու նեյտրոնները կոչվում են նուկլոնները։ Ատոմի զանգվածի ավելի քան 99.94%-ը միջուկն է։ Պրոտոններն ունեն դրական, էլեկտրոնները՝ բացասական, իսկ նեյտրոնները՝ չեզոք էլեկտրական լիցք։ Եթե ատոմում էլեկտրոնների և պրոտոնների թիվը հավասար է, ուրեմն այն էլեկտրականապես չեզոք է։ Եթե ատոմում պրոտոնների համեմատ կան ավել կամ պակաս էլեկտրոններ, ուրեմն այն համապատասխանաբար բացասական կամ դրական լիցք ունի և կոչվում է իոն։
Ատոմում էլեկտրոնները միջուկի հետ կապված են էլեկտրամագնիսական ուժի միջոցով։ Պրոտոնները և նեյտրոնները միջուկում կապված են միջուկային ուժերով, որոնք սովորաբար ավելի ուժեղ են էլեկտրամագնիսական ուժերից և չեզոքացնում են դրական լիցք ունեցող պրոտոնների միջև եղած վանող ուժերին։ Որոշակի պայմաններում վանող էլեկտրամագնիսական ուժը կարող է միջուկային ուժերից ուժեղ դառնալ, ինչի հետևանքով միջուկից կարող են նուկլոններ հեռանալ (այս միջուկային տրոհման արդյունքում առաջանում է այլ քիմիական տարր)։
Ատոմում պրոտոնների քանակով է պայմանավորված թե ինչ քիմիական տարրի ատոմ է այն. օրինակ՝ պղնձի բոլոր ատոմները ունեն 29 պրոտոն, իսկ նեյտրոնների թվով պայմանավորված է թե քիմիական տարիի որ իզոտոպից է ատոմը։ Էլեկտրոնների քանակը ազդեցություն ունի ատոմի էլեկտրամագնիսական հատկությունների վրա։ Քիմիական կապերի միջոցով ատոմները կարող են քիմիական միացություններ կազմել, ինչպես օրինակ մոլեկուլները։
Ատոմային տեսության պատմություն
Ատոմները փիլիսոփայությունում
Այն միտքը, որ նյութը կազմած է դիսկրետ միավորներից հանդիպում է բազմաթիվ անտիկ մշակույթներում, ինչպես օրինակ՝ Հնդկաստանում և Հունաստանում։ «Ատոմ» անվանումը տրվել է հին հույն փիլիսոփաների կողմից։ Սակայն, այս գաղափաները հիմնված էին փիլիսոփայական և աստվածաբանական հիմնավորումների վրա, ոչ թե ապացույցների և փորձերի։ Այդ պատճառով ատոմի կառուցվածքի և վարքագծի մասին նրանց պատկերացումները սխալ էին։ Նրանք նաև չէին կարող ապացուցել իրենց վարկածը, այսպիսով ատոմիզմը նյութի բնույթի վերաբերյալ բազմաթիվ տեսություններից մեկն էր։ Միայն 19-րդ դարում ատոմի գաղափարը ընդունվեց գիտնականների կողմից, երբ քիմիայում արվեցին այնպիսի հայտնագորցություններ, որոնք միայն կարող էին բացատրվել ատոմի գոյությամբ։
Ապացույցի վրա հիմնված առաջին տեսություն

1800-ական թվականների սկզբին Ջոն Դալթոնը ատոմի գաղափարի միջոցով է բացատրել այն, որ տարրերը միշտ փոխազդում են փոքր ամբողջ թվերի հարաբերությամբ։՚ Օրինակ՝ գոյություն ունի երկու անագի օքսիդ. մեկը՝ 88.1% անագ, 11.9% թթվածին, երկրորդը՝ 78.7% անագ, 21.3% թթվածին (համապատասխանաբար անագի օքսիդ(II) և անագի օքսիդ(IV))։ Սա նշանակում է, որ 100 գրամ անագը միայն կարող է միանալ 13.5 կամ 27 գրամ թթվածնի հետ։ 13.5-ը և 27-ը կազմում եմ 1:2 հարաբերություն։ Այս փաստից ելնելով Դալթոնը եզրակացրեց, որ տարրերը փոխազդում են դիսկրետ միավորների (այլ կերպ ասած՝ ատոմների) ամբողջ թվի բազմապատիկներով։ Անագի օքսիդի պարագայում մեկ անագի ատոմը կարող է միանալ կամ մեկ, կամ երկու թթվածնի ատոմի հետ։[2]
Դալթոնը նաև հավատում էր, որ ատոմի տեսությունը կարող է բացատրել, թե ինչու է ջուրը տարբեր գազեր տարբեր հարաբերությամբ կլանում։ Օրինակ՝ նա գտավ, որ ջուրը ածխաթթու գազ շատ ավելի լավ է կլանում, քան ազոտ։[3] Դալթոնը կարծում էր, որ սա կապված է գազերի համապատասխան մասնիկների զանգվածների և դասավորության տարբերությունների հետ (ածխաթթու գազի մոլեկուլը (CO2) շատ ավելի մեծ և ծանր է ազոտի մոլեկուլից (N2))։
Բրոունյան շարժում
1827 թվականին բուսաբան Ռոբերտ Բրոունը ջրի մեջ ծաղկափոշու շարժը մանրադիտոկով ուսումնասիրելիս հայտնաբերեց, որ նրանք շարժվում են անկոնոն և անդադար, այս երևույթը այժմ կոչվում է «Բրոունյան շարժում»։ Ենթադրվում էր, որ սրա պատճառը ջրի մոլեկուլների շարժն է։ 1905 թվականին Ալբերտ Այնշտայնը ապացուցեց այս մոլեկուլների և նրանց շարժման գոյությունը՝ բրոունյան շարժման առաջին վիճակագրական վերլուծությամբ։[4][5][6] Ֆրանսիացի ֆիզիկոս Ժան Բատիստ Պերրենը օգտագործել է Այնշտայնի աշխատանքները՝ ատոմների զանգվածն ու չափերը փորձնականորեն որոշելու համար։[7]
Էլեկտրոնի հայտնաբերում
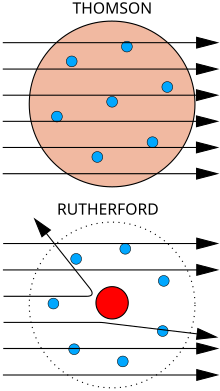
Վերևում։ Ակնկալվող արդյունք: Ալֆա մասնիկները անցնում են ատոմի պուդինգային մոդելի միջով աննշան շեղմամբ։
Ներքևում: Դիտարկված արդյունք: Մասնիկների փոքր մասը շեղվել է դրական լիցքավորված միջուկի պատճառով։
Ֆիզիկոս Ջոզեֆ Ջոն Թոմսոնը հաշվել է կաթոդային ճառագայթների զանգվածը՝ ցույց տալով, որ դրանք կազմված են մասնիկներից, բայց որոնք մոտ 1800 անգամ ավելի թեթև են, քան ամենաթեթև ատոմը՝ ջրածինը։ Հետևաբար՝, դրանք ատոմները չեն, բայց մասնիկ են։ Սա առաջին հայտնաբերված ներատոմային մասնիկն էր, որը սկզբում Թոմսոնը անվանեց «կորպուսկուլ», սակայն հետագայում անվանվել է «էլեկտրոն»։ Ջորջ Սթոնին ցույց է տվել, որ սրանք նույն այն մասնիկներն են, որոնք անջատվում են ֆոտոէլեկտրական և ռադիոակտիվ նյութերից։[8] Արագորեն հայտնաբերվեց, որ դրանք մետաղական լարերում էլեկտրական հոսանք կրող մասնիկներն են, որոնք նաև կրում են ատոմում բացասական էլեկտրական լիցքը։ Այս աշխատանքի համար 1906 թվականին Թոմսոնը ստացավ Ֆիզիկայի Նոբելյան մրցանակ։ Այսպիսով, նա վերացրեց այն տեսակետը թե ատոմները նույթի անբաժանելի, վերջնական մասնիկներն են։[9] Թոմսոնը սխալմամբ կարծում էր, որ տարրերի ատոմները կազմված են մի քանի բացասականապես լիցքավորված էլեկտրոններից, որոնք մտնում են համասեռ բաշխված դրական էլեկտրական լիցք ունեցող ոլորտի մեջ (սա հայտնի է Թոմսոնի ատոմի մոդել անվամբ)։
Միջուկի հայտնաբերում
Պարզվեց, որ ատոմի թոմսոնյան մոդելը անբավարար է բազմաթիվ երևույթներ բացատրելու համար։ Դրանով չհաջողվեց բացատրել ատոմների կողմից ալֆա–մասնիկների ցրման երևույթը հաստատող անգլիացի ֆիզիկոս Էռնեստ Ռեզերֆորդի և նրա աշխատակիցների՝ Հանս Գեյգերի և Էրնեստ Մարսդեի, 1909 թվականին կատարած փորձերի արդյունքները։ Անցնելով նյութի միջով, ալֆա–մասնիկներն ընդհարվում են ատոմների հետ։ Յուրաքանչյուր ընդհարման ժամանակ ալֆա–մասնիկը, անցնելով ատոմի էլեկտրական դաշտով, փոխում է շարժման ուղղությունը՝ ցրվում է։ Այդ շեղումները հիմնականում շատ փոքր են։ Ուստի և նյութի բարակ շերտով ալֆա–մասնիկների փունջը անցնելիս տեղի էր ունենում փնջի շատ փոքր ցրում։ Սակայն մասնիկներից մի քանիսը շեղվում էին 90°–ից ավելի անկյունով։ Այս երևույթը չէր բացատրվում Թոմսոնի մոդելով, որովհետև «հոծ» ատոմի էլեկտրական դաշտը չէր կարող մեծ անկյունով շեղել զանգվածեղ և արագաշարժ ալֆա–մասնիկը։ Ռեզերֆորդը առաջարկեց ատոմի սկզբունքորեն նոր մոդել, որն իր կառուցվածքով հիշեցնում է արեգակնային համակարգը և ստացավ մոլորակային մոդել անունը։ Ըստ այդ մոդելի՝ ատոմի կենտրոնում գտնվում է դրական լիցք ունեցող միջուկը, որի չափերը (~10−14 մ) շատ փոքր են ատոմի չափերից (~10−10 մ), իսկ զանգվածը գրեթե հավասար է ատոմի զանգվածին։ Միջուկի շուրջը պտտվում են էլեկտրոնները (ինչպես մոլորակները Արեգակի շուրջը)։ Չլիցքավորված (չեզոք) ատոմում էլեկտրոնների թիվը այնպիսին է, որ նրանց գումարային բացասական լիցքը չեզոքացնում է միջուկի դրական լիցքը։ Ի տարբերություն մոլորակային համակարգում գործող ձգողականության ուժի, ատոմում գործում են էլեկտրական (կուլոնյան) ուժեր։[10][11][12]
Իզոտոպների հայտնաբերում
1913 թվականին ռադիոակտիվ նյութերի հետ փորձարկումներ անելիս ռադիոքիմիկոս Ֆրեդերիկ Սոդդիը հայտնաբերեց, որ պարբերական համակարգի յուրաքանչյուր դիրքի համար կան ավելի քան մեկ տեսակի ատոմներ։[13] Իզոտոպ անվանումը տվել է Մարգարետ Թոդ։ Ջ. Ջ. Թոմսոնը իոնացված գազերի վերաբերյալ իր աշխատանքի ընթացքում ատոմների տեսակները առանձնացնելու եղանակ է ստեղծել, ինչը հետագայում հանգեցրեց կայուն իզոտոպների հայտնաբերմանը։[14]
Բորի մոդել

1913 թվականին ֆիզիկոս Նիլս Բորը առաջ քաշեց մոդել, ըստ որի՝ էլեկտրոնները ատոմում կարող են շարժվել միայն որոշակի ուղեծրերով և չճկառագայթել, սակայն մի ուղեծրից մյուսին անցնել կարող են միայն դիսկրետ քանակությամբ էներգիա կլանելով կամ ճառագայթելով։[15] Այս մոդելը բացատրեց էլեկտրոնների ուղեծրերի կայությունը (դասական էլեկտրադինամիկայի տեսանկյունից Ռեզերֆորդի մոդելում էլեկտրոնը, որը պտտվում էր միջուկի շուրջը պետք է անընդհատ ճառագայթեր և շատ արագ կորցնելով էներգիան՝ ընկներ միջուկի վրա) և այն, որ էլեկտրոնները էլեկտրամագնիսական ճառագայթումը կլանում կամ արձագում են դիսկրետ սպեկտրային չափով։[16]
Նույն թվականին արված Հենրի Մոսելեիի փորձերով նույնպես ապացուցվում էր Նիլս Բորի տեսությունը։ Այս արդյունքները կատարելագործեցին Էռնեստ Ռեզերֆորդի և Անտոնիո Վան դե Դոր Բրոքի մոդելը, ըստ որի՝ ատոմի միջուկի լիցքը հավասար է պարբերական համակարգում իր համարին։ Մինչև այս փորձերը ատոմական համարը ֆիզիկական կամ փորձարարական մեծություն չէր։ Այն, որ ատոմային համարը համապատասխանում է ատոմի միջուկի լիցքին, ընդունվում է նաև ատոմի ժամանակակից մոդելի կողմից։[17]
Քիմիական կապերի բացատրություն
1916 թվականին Գիլբերտ Նյուտոն Լյուիսը բացատրել է ատոմների միջև քիմիական կապերը որպես իրենց բաղադրիչ էլեկտրոնների փոխազդեցություն։[18] Քանի որ տարրերի քիմիական հատկությունները պարբերական օրենքի համաձայն կրկնվում են,[19] 1919 թվականին ամերիկացի քիմիկոս Իրվինգ Լենգմյուրը ենթադրեց, որ սա կարող է բացատրվել, եթե ատոմում էլեկտրոնները կապված կամ խմբավորված են ինչ-որ ձևով։ Նա կարծում էր, որ միջուկի շուրջը էլեկտրոնների խմբերը զբաղեցնում են էլեկտրոնային շերտեր։[20]
Քվանտային ֆիզիկայի հետագա զարգացումներ
1922 թվականի Շտեռն-Գեռլախի փորձը լրացուցիչ ապացույցներ տրամադրեց ատոմի քվանտային բնույթի համար։ Արծաթի ատոմների փունջը, անցնելով խիստ անհամասեռ մագնիսական դաշտով, ճեղքվում էր և էկրանի վրա առաջացնում շերտեր, որոնք վկայում էին մագնիսական մոմենտի պրոյեկցիայի քվանտացումը։ Դասական տեսության համաձայն, էկրանի վրա պետք է առաջանար մեկ հաստ շերտ, սակայն իրականում առաջանում էին սիմետրիկ դասավորված 2 նեղ շերտեր։[21]
1924 թվականին Լուի դը Բրոյլը առաջարկեց, որ բոլոր մասնիկները որոշ չափով վարվում են ալիքների նման։ 1926 թվականին Էրվին Շրյոդինգեր օգտագործեց այս միտքը՝ ատոմի մաթեմատիկական մոդել ստեղծելու համար, որը էլեկտրոններին նկարագում էր որպես եռաչափ ալիքի ձևերի, ոչ թե կետային մասնիկի տեսքով։ Այս մոդելի հետևանքն այն էր, որ տրված պահին մասնիկի դիրքի և իմպուլսի համար մաթեմատիկորեն անհնար է ստանալ ճշգրիտ արժեքներ։ Այլ կերպ ասած, որքան ավելի մեծ ճշգրտությամբ հնարավոր է իմանալ հատկություններից որևէ մեկը, այնքան սակավ ճշգրտությամբ է հնարավոր չափել, վերահսկել կամ իմանալ մյուս հատկությունը։[22] Սա հայտնի է անորոշությունների սկզբունք անվամբ, որը ձևակերպել է Վերներ Հայզենբերգը 1926 թվականին։ Այս մոդելի օգնությամբ բացատրվեցին դիտումների ընթացքում նկատրված ատոմի վարքագծեր, որոնք նախկին մոդելը չէր կարող բացատրել, ինչպես օրինակ՝ ջրածնից մեծ ատոմներում որոշակի կառուցվածքային և սպեկտրյալ նմանությունները։[23][24]
Նեյտրոնի հայտնաբերում
Մասս-սպեկտրաչափության զարգացումը հնարավորություն տվեց մեծ ճշտությամբ չափել ատոմի զանգվածը։ Քիմիկոս Ֆրենսիս Ուիլյամ Աստոնը այս սարքի օգնությամբ ցույց է տվել, որ իզոտոպները տարբեր զանգված ունեն։ Իզոտոմների ատոմային զանգվածը տարբերվում է ջրածնի ատոմի ծանգվածի ամբողջ բազմապատիկների քանակով։[25] 1932 թվականին ֆիզիկոս Ջեյմս Չադվիկը նեյտրոնի հայտնաբերմաբ բացատրեց այս երևույթը։ Նեյտրոնը չեզոք լիցք ունեցող մասնիկ է, որի զանգվածը գրեթե հավասար է պրոտոնի զանգվածին։ Իզոտոպները նույն նույն քանակությամբ պրոտոն, բայց տարբեր քանակությամբ նեյտրոն ունեցող տարրեր են։[26]
Տրոհում, բարձր էներգիայի ֆիզիկա և կոնդենսացված նյութ
1938 թվականին գերմանացի քիմիկոս Օտտո Հահնը՝ Ռեզերֆորդի ուսանողներից մեկը, տրանսուրան տարր ստանալու նպատակով ուրանի ատոմները ռմբակոծեց նեյտրոններով։ Սակայն նա դրա փոխարեն ստացավ բարիում։[27][28] Մեկ տարի անց Լիզա Մեյտները և իր ազգական Օտտո Ֆրիշը հաստատեցին, որ Հահնի արդյունքները առաջին փորձարարական միջուկային տրոհումն էր։[29][30] 1944 թվականին Հահն ստացավ Քիմիայի Նոբելյան մրցանակ։ Չնայած Հահնի ջանքերին, Մեյտների և Ֆրիշի ներդրումները չեն ճանաչվել։[31]
1950-ական թվականներին արագացուցիչների և մասնիկների դետեկտորների կատարելագործումը գիտնականներին թույլ տվեց ուսումնասիրել բարձր էներգիաներում ատոմների շարժի հետևանքները։[32] Պարզվեց, որ նեյտրոններն ու պրոտոնները հադրոններ են, և կազմված են ավելի փոքր մասնիկներից, որոնք կոչվում են քվարկներ։ Ձևավորվել է ստանդարտ մոդելը, որը մինչև այժմ բարեհաջող բացատրել է միջուկի հատկությունները։[33]
Ատոմի միջուկի կառուցվածք
Ատոմի միջուկի շառավիղը մոտ 100,000 անգամ փոքր է ատոմի շառավղից։ Չնայած միջուկի այդքան փոքր չափերին՝ դա էական դեր է կատարում։
Միջուկը բաղկացած է առանձին մասնիկներից, որոնք կոչվում են նուկլոններ։ Նուկլոնները երկու տեսակ են՝ պրոտոններ և նեյտրոններ։ Պրոտոնը դրական լիքավորված մասնիկ է, որի զանգվածը 1836 անգամ մեծ է էլեկտրոնի զանգվածից։ Պրոտոնի լիցքը հավասար էլեկտրոնի լիցքի մոդուլին՝
Տարբեր ատոմների միջուկները պարունակում են տարբեր թվով պրոտոններ։ Օրինակ՝ ջրածնի ատոմի միջուկն ունի միայն մեկ պրոտոն, թթվածնի ատոմի միջուկում դրանց թիվը 8 է, իսկ ուրանի միջուկում՝ 92։
Պրոտոնների թիվը միջուկում համընկնում է Մենդելեևի քիմիական տարրերի աղյուսակում տվյալ էլեմենտի կարգաթվի հետ։ Կարգաթվի հետ է համընկնում նաև ատոմում էլեկտրոնների թիվը։ Այսպիսով, միջուկում պրոտոնների թիվը համընկնում է նրա շուրջը շարժվող էլեկտրոնների թվի հետ, այդ պատճառով էլ ընդունված է ատոմում պրոտոնների և էլեկտրոնների թիվը նշանակել նույն տառով․ - պրոտոնների թիվը միջուկում։
Հասկացության ձևավորում
Ատոմի մասին հասկացությունները՝ որպես մատերիայի անբաժանելի և ամենափոքր մասնիկ, առաջին անգամ սահմանվել է հին հնդիկ և հույն փիլիսոփաների կողմից (ատոմիզմ)։ 17-րդ և 18-րդ դարերում քիմիկոսներին հաջողվեց փորձով ապացուցել այդ վարկածը՝ ցույց տալով, որ որոշ նյութեր չեն կարող ենթարկվել հետագա քայքայումների ավելի փոքր բաղկացուցիչ տարրերի քիմիական մեթոդների միջոցով։ Սակայն 19-րդ դարի վերջին և 20-րդ դարի սկզբին ֆիզիկոսները հայտնաբերեցին սուբատոմական մասնիկներ և առաջարկեցին ատոմի կառուցվածքը։ Դրանից հետո պարզ դարձավ, որ ատոմն ինքնին անբաժանելի չէ։
1860 թվականին Գերմանիայի Կարլսրուե քաղաքում ըեղի ունեցած Քիմիկոսների միջազգային կոնֆերանսում ընդունվեցին մոլեկուլի և ատոմի կառուցվածքի մասին հասկացությունների սահմանումներ։ Ատոմը քիմիական տարրի այն փոքրագույն մասնիկն է, որը մտնում է պարզ և բարդ նյութերի բաղադրության մեջ։
Ծանոթագրություններ
- ↑ ChEBI — EBI.
- ↑ Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, N.Y.: Dover Publications. ISBN 0-486-49584-1.
- ↑ Dalton, John. "On the Absorption of Gases by Water and Other Liquids", in Memoirs of the Literary and Philosophical Society of Manchester. 1803. Retrieved on August 29, 2007.
- ↑ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (German). 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. Վերցված է 4 February 2007-ին.
{{cite journal}}: CS1 սպաս․ չճանաչված լեզու (link) - ↑ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. էջեր 1–7. ISBN 0-19-851567-7. OCLC 48753074.
- ↑ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Արխիվացված է օրիգինալից 18 December 2007-ին. Վերցված է 18 December 2007-ին.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - ↑ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ↑ Thomson, J. J. (August 1901). «On bodies smaller than atoms». The Popular Science Monthly. Bonnier Corp.: 323–335. Վերցված է 2009-06-21-ին.
- ↑ «J.J. Thomson». Nobel Foundation. 1906. Վերցված է 20 December 2007-ին.
- ↑ Խմբագրական կոլեգիա, Հայկական Սովետական Հանրագիտարան, հ. {{{1}}} (խմբ. Վիկտոր Համբարձումյան), Ե., «Հայկական ՍՍՀ Գիտությունների Ակադեմիա Հայկական Սովետական Հանրագիտարանի գլխավոր խմբագրություն», էջ {{{2}}}։
- ↑ Rutherford, E. (1911). «The Scattering of α and β Particles by Matter and the Structure of the Atom» (PDF). Philosophical Magazine. 21 (125): 669–88. doi:10.1080/14786440508637080.
- ↑ «The Gold Foil Experiment». myweb.usf.edu.
- ↑ «Frederick Soddy, The Nobel Prize in Chemistry 1921». Nobel Foundation. Վերցված է 18 January 2008-ին.
- ↑ Thomson, Joseph John (1913). «Rays of positive electricity». Proceedings of the Royal Society. A. 89 (607): 1–20. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057.
- ↑ Stern, David P. (16 May 2005). «The Atomic Nucleus and Bohr's Early Model of the Atom». NASA/Goddard Space Flight Center. Վերցված է 20 December 2007-ին.
- ↑ Bohr, Niels (11 December 1922). «Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture». Nobel Foundation. Վերցված է 16 February 2008-ին.
- ↑ Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. էջեր 228–230. ISBN 0-19-851971-0.
- ↑ Lewis, Gilbert N. (1916). «The Atom and the Molecule». Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002.
- ↑ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. էջեր 205–226. ISBN 0-19-530573-6.
- ↑ Langmuir, Irving (1919). «The Arrangement of Electrons in Atoms and Molecules». Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.
- ↑ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). «On the theory of the Stern-Gerlach apparatus». Foundations of Physics. 17 (6): 575–583. Bibcode:1987FoPh...17..575S. doi:10.1007/BF01882788.
- ↑ TED-Ed (16 September 2014). «What is the Heisenberg Uncertainty Principle? - Chad Orzel» – via YouTube.
- ↑ Brown, Kevin (2007). «The Hydrogen Atom». MathPages. Վերցված է 21 December 2007-ին.
- ↑ Harrison, David M. (2000). «The Development of Quantum Mechanics». University of Toronto. Արխիվացված է օրիգինալից 25 December 2007-ին. Վերցված է 21 December 2007-ին.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - ↑ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–55. doi:10.1080/14786440408636058.
- ↑ Chadwick, James (12 December 1935). «Nobel Lecture: The Neutron and Its Properties». Nobel Foundation. Վերցված է 21 December 2007-ին.
- ↑ Bowden, Mary Ellen (1997). «Otto Hahn, Lise Meitner, and Fritz Strassmann». Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. էջեր 76–80, 125. ISBN 9780941901123.
- ↑ «Otto Hahn, Lise Meitner, and Fritz Strassmann». Chemical Heritage Foundation. Վերցված է 27 October 2016-ին.
- ↑ Meitner, Lise; Frisch, Otto Robert (1939). «Disintegration of uranium by neutrons: a new type of nuclear reaction». Nature. 143 (3615): 239–240. Bibcode:1939Natur.143..239M. doi:10.1038/143239a0.
- ↑ Schroeder, M. «Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages» (German). Վերցված է 4 June 2009-ին.
{{cite web}}: CS1 սպաս․ չճանաչված լեզու (link) - ↑ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). «A Nobel tale of postwar injustice». Physics Today. 50 (9): 26–32. Bibcode:1997PhT....50i..26C. doi:10.1063/1.881933.
- ↑ Kullander, Sven (28 August 2001). «Accelerators and Nobel Laureates». Nobel Foundation. Վերցված է 31 January 2008-ին.
- ↑ «The Nobel Prize in Physics 1990». Nobel Foundation. 17 October 1990. Վերցված է 31 January 2008-ին.
<references>-ում սահմանված <ref> թեգը սկզբնական տեքստում չի օգտագործվել:Աղբյուրներ
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0-306-46562-0. OCLC 228374906.
{{cite book}}: Invalid|ref=harv(օգնություն)
Գրականություն
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
{{cite book}}: Invalid|ref=harv(օգնություն) - Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 0-521-77351-2. OCLC 50441595.
{{cite book}}: Invalid|ref=harv(օգնություն) - Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 0-415-17995-5. OCLC 44541769.
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 0-7486-0954-7.
{{cite book}}: Invalid|ref=harv(օգնություն) - Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
{{cite book}}: Invalid|ref=harv(օգնություն)CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - Liddell, Henry George; Scott, Robert. «A Greek-English Lexicon». Perseus Digital Library.
- Liddell, Henry George; Scott, Robert. «ἄτομος». A Greek-English Lexicon. Perseus Digital Library. Վերցված է 21 June 2010-ին.
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 1-58115-203-5.
{{cite book}}: Invalid|ref=harv(օգնություն) - Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0-674-01495-2.
{{cite book}}: Invalid|ref=harv(օգնություն) - Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0-7503-0251-8. OCLC 26853108.
{{cite book}}: Invalid|ref=harv(օգնություն) - Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry. Century science series. New York: Macmillan. Վերցված է 3 April 2011-ին.
{{cite book}}: Invalid|ref=harv(օգնություն) - Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0-87169-924-9. OCLC 186607849.
{{cite book}}: Invalid|ref=harv(օգնություն) - Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. էջեր 213–214. ISBN 0-7432-4379-X.
- Various (2002). Lide, David R. (ed.). Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 0-8493-0486-5. OCLC 179976746. Արխիվացված է օրիգինալից 23 May 2008-ին. Վերցված է 23 May 2008-ին.
{{cite book}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X.
{{cite book}}: Invalid|ref=harv(օգնություն)
Արտաքին հղումներ
- "Quantum Mechanics and the Structure of Atoms" ՅուԹյուբում The actual physics lesson begins 2:20 into the video.
- Freudenrich, Craig C. «How Atoms Work». How Stuff Works. Արխիվացված է օրիգինալից 8 January 2007-ին. Վերցված է 9 January 2007-ին.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - «The Atom». Free High School Science Texts: Physics. Wikibooks. Վերցված է 10 July 2010-ին.
- Anonymous (2007). «The atom». Science aid+. Վերցված է 10 July 2010-ին.—a guide to the atom for teens.
- Anonymous (3 January 2006). «Atoms and Atomic Structure». BBC. Արխիվացված է օրիգինալից 2 January 2007-ին. Վերցված է 11 January 2007-ին.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - Various (3 January 2006). «Physics 2000, Table of Contents». University of Colorado. Արխիվացված է օրիգինալից 14 January 2008-ին. Վերցված է 11 January 2008-ին.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - Various (3 February 2006). «What does an atom look like?». University of Karlsruhe. Վերցված է 12 May 2008-ին.


