«Ատոմ»–ի խմբագրումների տարբերություն
| Տող 80. | Տող 80. | ||
<ref name=e31_2_50>{{cite journal|last=Patterson|first=G.|year=2007 |title=Jean Perrin and the triumph of the atomic doctrine|journal=[[Endeavour (journal)|Endeavour]]|volume=31|issue=2|pages=50–53|doi=10.1016/j.endeavour.2007.05.003|pmid=17602746}}</ref> |
<ref name=e31_2_50>{{cite journal|last=Patterson|first=G.|year=2007 |title=Jean Perrin and the triumph of the atomic doctrine|journal=[[Endeavour (journal)|Endeavour]]|volume=31|issue=2|pages=50–53|doi=10.1016/j.endeavour.2007.05.003|pmid=17602746}}</ref> |
||
<ref name=nobel1096>{{cite web|year=1906|title=J.J. Thomson|url=http://nobelprize.org/nobel_prizes/physics/laureates/1906/thomson-bio.html|publisher=[[Nobel Foundation]]|accessdate=20 December 2007}}</ref> |
|||
<ref name=pm21_669>{{cite journal|last=Rutherford|first=E.|title=The Scattering of α and β Particles by Matter and the Structure of the Atom|url=http://users.uoa.gr/~pjioannou/mech1/READING/structureatom.pdf|journal=[[Philosophical Magazine]]|year=1911|volume=21|pages=669–88|doi=10.1080/14786440508637080|issue=125}}</ref> |
|||
<ref name=npc1921>{{cite web|url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1921/soddy-bio.html|title=Frederick Soddy, The Nobel Prize in Chemistry 1921 |publisher=[[Nobel Foundation]]|accessdate=18 January 2008}}</ref> |
|||
<ref name=prsA_89_1_1913>{{cite journal|doi=10.1098/rspa.1913.0057|last=Thomson|first=Joseph John|title=Rays of positive electricity|url=http://web.lemoyne.edu/~giunta/canal.html|series=A|journal=[[Proceedings of the Royal Society]]|year=1913|volume=89|issue=607|pages=1–20|bibcode = 1913RSPSA..89....1T |doi-access=free}}</ref> |
|||
<ref name=stern20050516>{{cite web|last=Stern|first=David P.|date=16 May 2005|title=The Atomic Nucleus and Bohr's Early Model of the Atom|url=http://www-spof.gsfc.nasa.gov/stargaze/Q5.htm|publisher=[[NASA]]/[[Goddard Space Flight Center]]|accessdate=20 December 2007}}</ref> |
|||
<ref name=bohr19221211>{{cite web|last=Bohr|first=Niels|date=11 December 1922|title=Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture|url=http://nobelprize.org/nobel_prizes/physics/laureates/1922/bohr-lecture.html|publisher=[[Nobel Foundation]]|accessdate=16 February 2008}}</ref> |
|||
}} |
}} |
||
00:39, 25 Հուլիսի 2017-ի տարբերակ
 | |
| Ենթադաս | chemical entity?[1] և բաղադրյալ մասնիկ |
|---|---|
| Դյուի տասնորդական դասակարգում | 539.7 |
Ատոմ, քիմիական տարրերի հատկություններ ունեցող սովորական նյութի ամենափոքր բաղադրիչ մասը։ Ցանկացած պինդ մարմին, հեղուկ, գազ կամ պլազմա կազմված է չեզոք կամ իոնացված ատոմներից։ Ատոմները շատ փոքր են. սովորաբար մոտ 100 պիկոմետր (մեկ մետրի տասը միլիարդերորդը)։
Փոքր չափերի պատճառով ատոմների վաքագծի վերաբերյալ դասական ֆիզիկայի կանխատեսումները նկատելիորեն սխալ են, ինչը պայմանավորված է քվանտային էֆեկտներով։ Ֆիզիկայի զարգմացման ընթացքում ատոմային մոդելները հիմնվել են քվանտային սկզբունքների վրա՝ ատոմը վարքագիծն ավելի լավ կանխատեսելու և բացատրելու համար։
Ցանկացած ատոմ կազմված է մեկ միջուկից և մեկ կամ ավելի էլեկտրոններից։ Միջուկը կառուցված է մեկ կավ ավել պրոտոններից և սովորաբար գրեթե նույն քանակությամբ նեյտրոններից։ Պրոտոններն ու նեյտրոնները կոչվում են նուկլոնները։ Ատոմի զանգվածի ավելի քան 99.94%-ը միջուկն է։ Պրոտոններն ունեն դրական, էլեկտրոնները՝ բացասական, իսկ նեյտրոնները՝ չեզոք էլեկտրական լիցք։ Եթե ատոմում էլեկտրոնների և պրոտոնների թիվը հավասար է, ուրեմն այն էլեկտրականապես չեզոք է։ Եթե ատոմում պրոտոնների համեմատ կան ավել կամ պակաս էլեկտրոններ, ուրեմն այն համապատասխանաբար բացասական կամ դրական լիցք ունի և կոչվում է իոն։
Ատոմում էլեկտրոնները միջուկի հետ կապված են էլեկտրամագնիսական ուժի միջոցով։ Պրոտոնները և նեյտրոնները միջուկում կապված են միջուկային ուժերով, որոնք սովորաբար ավելի ուժեղ են էլեկտրամագնիսական ուժերից և չեզոքացնում են դրական լիցք ունեցող պրոտոնների միջև եղած վանող ուժերին։ Որոշակի պայմաններում վանող էլեկտրամագնիսական ուժը կարող է միջուկային ուժերից ուժեղ դառնալ, ինչի հետևանքով միջուկից կարող են նուկլոններ հեռանալ (այս միջուկային տրոհման արդյունքում առաջանում է այլ քիմիական տարր)։
Ատոմում պրոտոնների քանակով է պայմանավորված թե ինչ քիմիական տարրի ատոմ է այն. օրինակ՝ պղնձի բոլոր ատոմները ունեն 29 պրոտոն, իսկ նեյտրոնների թվով պայմանավորված թե քիմիական տարիի որ իզոտոպից է ատոմը։ Էլեկտրոնների քանակը ազդեցություն ունի ատոմի էլեկտրամագնիսական հատկությունների վրա։ Քիմիական կապերի միջոցով ատոմները կարող են քիմիական միացություններ կազմել, ինչպես օրինակ մոլեկուլները։
Ատոմային տեսության պատմություն
Ատոմները փիլիսոփայությունում
Այն միտքը, որ նյութը կազմած է դիսկրետ միավորներից հանդիպում է բազմաթիվ անտիկ մշակույթներում, ինչպես օրինակ՝ Հնդկաստանում և Հունաստանում։ «Ատոմ» անվանումը տրվել է հին հույն փիլիսոփաների կողմից։ Սակայն, այս գաղափաները հիմնված էին փիլիսոփայական և աստվածաբանական հիմնավորումների վրա, ոչ թե ապացույցների և փորձերի։ Այդ պատճառով ատոմի կառուցվածքի և վարքագծի մասին նրանց պատկերացումները սխալ էին։ Նրանք նաև չէին կարող համոզել, այսպիսով ատոմիզմը նյութի բնույթի վերաբերյալ բազմաթիվ տեսություններից մեկն էր։ Միայն 19-րդ դարում ատոմի գաղափարը ընդունվեց գիտնականների կողմից, երբ քիմիայում արվեցին այնպիսի հայտնագորցություններ, որոնք միայն կարող էին բացատրվել ատոմի գոյությամբ։
Ապացույցի վրա հիմնված առաջին տեսություն

1800-ական թվականների սկզբին Ջոն Դալթոնը ատոմի գաղափարի միջոցով է բացատրել այն, որ տարրերը միշտ փոխազդում են փոքր ամբողջ թվերի հարաբերությամբ։՚ Օրինակ՝ գոյություն ունի երկու անագի օքսիդ. մեկը՝ 88.1% անագ, 11.9% թթվածին, երկրորդը՝ 78.7% անագ, 21.3% թթվածին (համապատասխանաբար անագի օքսիդ(II) և անագի օքսիդ(IV))։ Սա նշանակում է, որ 100 գրամ միայն կարող է միանալ 13.5 կամ 27 գրամ թթվածնի հետ։ 13.5-ը և 27-ը կազմում եմ 1:2 հարաբերություն։ Այս փաստից ելնելով Դալթոնը եզրակացրեց, որ տարրերը փոխազդում են դիսկրետ միավորների (այլ կերպ ասած՝ ատոմների) ամբողջ թվի բազմապատիկներով։ Անագի օքսիդի պարագայում մեկ անագի ատոմը կարող է միանալ կամ մեկ, կամ երկու թթվածնի ատոմի հետ։[2]
Դալթոնը նաև հավատում էր, որ ատոմի տեսությունը կարող է բացատրել, թե ինչու է ջուրը տարբեր գազեր տարբեր հարաբերությամբ կլանում։ Օրինակ՝ նա գտավ, որ ջուրը ածխաթթու գազ շատ ավելի լավ է կլանում, քան ազոտ։[3] Դալթոնը կարծում էր, որ սա կապված է գազերի համապատասխան մասնիկների զանգվածների և դասավորության տարբերությունների հետ (ածխաթթու գազի մոլեկուլը (CO2) շատ ավելի մեծ և ծանր է ազոտի մոլեկուլից (N2))։
Բրոունյան շարժում
1827 թվականին բուսաբան Ռոբերտ Բրոունը ջրի մեջ ծաղկափոշու շարժը մանրադիտոկով ուսումնասիրելիս հայտնաբերեց, որ նրանք շարժվում են անկոնոն, այ երևույթը այժմ կոչվում է «Բրոունյան շարժում»։ Ենթադրվում էր, որ սրա պատճառը ջրի մոլեկուլների շարժն է։ 1905 թվականին Ալբերտ Այնշտայնը ապացուցեց այս մոլեկուլների և նրանց շարժման գոյությունը՝ բրոունյան շարժման առաջին վիճակագրական վերլուծությամբ։[4][5][6] Ֆրանսիացի ֆիզիկոս Ժան Բատիստ Պերրենը օգտագործել է Այնշտայնի աշխատանքները՝ ատոմների զանգվածն ու չափերը փորձնականորեն որոշելու համար։[7]
Էլեկտրոնի հայտնաբերում
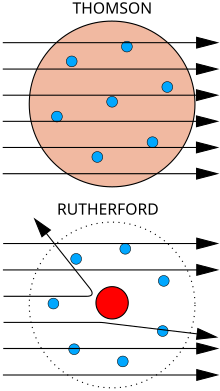
Վերևում։ Ակնկալվող արդյունք: Ալֆա մասնիկները անցնում են ատոմի պուդինգային մոդելի միջով աննշան շեղմամբ։
Ներքևում: Դիտարկված արդյունք: Մասնիկների փոքր մասը շեղվել է դրական լիցքավորված միջուկի պատճառով։
Ֆիզիկոս Ջոզեֆ Ջոն Թոմսոն հաշվել է կաթոդային ճառագայթների զանգվածը՝ ցույց տալով, որ դրանք կազմված են մասնիկներից, բայց որոնք մոտ 1800 անգամ ավելի թեթև են, քան ամենաթեթև ատոմը՝ ջրածինը։ Հետևաբար՝, դրանք ատոմները չեն, բայց մասնիկ են։ Սա առաջին հայտնաբերված ներատոմային մասնիկն էր, որը սկզբում Թոմսոնը անվանեց «կորպուսկուլ», սակայն հետագայում անվանվել է «էլեկտրոն»։ Ջորջ Սթոնին ցույց է տվել, որ այս սրանք նույն այն մասնիկներն են, որոնք անջատվում են ֆոտոէլեկտրական և ռադիոակտիվ նյութերից։[8] Արագորեն հայտնաբերվեց, որ դրանք մետաղական լարերում էլեկտրական հոսանք կրող մասնիկներն են, որոնք նաև կրում են ատոմում բացասական էլեկտրական լիցքը։ Այս աշխատանքի համար 1906 թվականին Թոմսոնը ստացավ Ֆիզիկայի Նոբելյան մրցանակ։ Այսպիսով, նա վերացրեց այն տեսակետը թե ատոմները նույթի անբաժանելի, վերջնական մասնիկներն են։[9] Թոմսոնը սխալմամբ կարծում էր, որ տարրերի ատոմները կազմված են մի քանի բացասականապես լիցքավորված էլեկտրոններից, որոնք մտնում են համասեռ բաշխված դրական էլեկտրական լիցք ունեցող ոլորտի մեջ (սա հայտնի է Թոմսոնի ատոմի մոդել անվամբ)։
Միջուկի հայտնաբերում
Պարզվեց, որ ատոմի թոմսոնյան մոդելը անբավարար է բազմաթիվ երևույթներ բացատրելու համար։ Դրանով չհաջողվեց բացատրել ատոմների կողմից ալֆա–մասնիկների ցրման երևույթը հաստատող անգլիացի ֆիզիկոս Էռնեստ Ռեզերֆորդի և նրա աշխատակիցների՝Հանս Գեյգերի և Էրնեստ Մարսդեի, 1909 թվականին կատարած փորձերի արդյունքները։ Անցնելով նյութի միջով, ալֆա–մասնիկներն ընդհարվում են ատոմների հետ։ Յուրաքանչյուր ընդհարման ժամանակ ալֆա–մասնիկը, անցնելով ատոմի էլեկտրական դաշտով, փոխում է շարժման ուղղությունը՝ ցրվում է։ Այդ շեղումները հիմնականում շատ փոքր են։ Ուստի և նյութի բարակ շերտով ալֆա–մասնիկների փունջը անցնելիս տեղի էր ունենում փնջի շատ փոքր ցրում։ Սակայն մասնիկներից մի քանիսը շեղվում էին 90°–ից ավելի անկյունով։ Այս երևույթը չէր բացատրվում Թոմսոնի մոդելով, որովհետև «հոծ» ատոմի էլեկտրական դաշտը չէր կարող մեծ անկյունով շեղել զանգվածեղ և արագաշարժ ալֆա–մասնիկը։ Ռեզերֆորդը առաջարկեց ատոմի սկզբունքորեն նոր մոդել, որն իր կառուցվածքով հիշեցնում է Արեգակնային համակարգը և ստացավ մոլորակային մոդել անունը։ Ըստ այդ մոդելի ատոմի կենտրոնում գտնվում է դրական լիցք ունեցող միջուկը, որի չափերը (~10−14 մ) շատ փոքր են ատոմի չափերից (~10−10 մ), իսկ զանգվածը գրեթե հավասար է ատոմի զանգվածին։ Միջուկի շուրջը պտտվում են էլեկտրոնները (ինչպես մոլորակները Արեգակի շուրջը)։ Չլիցքավորված (չեզոք) ատոմում էլեկտրոնների թիվը այնպիսին է, որ նրանց գումարային բացասական լիցքը չեզոքացնում է միջուկի դրական լիցքը։ Ի տարբերություն մոլորակային համակարգում գործող ձգողականության ուժի, ատոմում գործում են էլեկտրական (կուլոնյան) ուժեր։[10][11][12]
Իզոտոպների հայտնաբերում
1913 թվականին ռադիոակտիվ նյութերի հետ փորձարկումներ անելիս ռադիոքիմիկոս Ֆրեդերիկ Սոդդիը հայտնաբերեց, որ պարբերական համակարգի յուրաքանչյուր դիրքի համար կան ավելի քան մեկ տեսակի ատոմներ։[13] Իզոտոպ անվանումը տվել է Մարգարետ Թոդ։ Ջ. Ջ. Թոմսոնը իոնացված գազերի վերաբերյալ իր աշխատանքի ընթացքում ատոմների տեսակները առանձնացնելու եղանակ է ստեղծել, ինչը հետագայում հանգեցրեց կայուն իզոտոպների հայտնաբերմանը։[14]
Բորի մոդել

1913 թվականին ֆիզիկոս Նիլս Բորը առաջ քաշեց մոդել, ըստ որի՝ էլեկտրոնները ատոմում կարող են շարժվել միայն որոշակի ուղեծրերով և չճկառագայթել, սակայն մի ուղեծրից մյուսին անցնել կարող են միայն դիսկրետ քանակությամբ էներգիա կլանելով կամ ճառագայթելով։[15] Այս մոդելը բացատրեց էլեկտրոնների ուղեծրերի կայությունը (դասական էլեկտրադինամիկայի տեսանկյունից Ռեզերֆորդի մոդելում էլեկտրոնը, որը պտտվում էր միջուկի շուրջը պետք է անընդհատ ճառագայթեր և շատ արագ կորցնելով էներգիան՝ ընկներ միջուկի վրա) և այն, որ էլեկտրոնները էլեկտրամագնիսկան ճառագայթումը կլանում կամ արձագում են դիսկրետ սպեկտրային չափով։[16]
Նույն թվականին արված Հենրի Մոսելեիի փորձերով նույնպես ապացուցվում էր Նիլս Բորի տեսությունը։ Այս արդյունքները կատարելագործեցին Էռնեստ Ռեզերֆորդի և Անտոնիո Վան դե Դոր Բրոքի մոդելը, ըստ որի՝ ատոմի միջուկի լիցքը հավասար է պարբերական համակարգում իր համարին։ Մինչև այս փորձերը ատոմական համարը ֆիզիկական կամ փորձարարական մեծություն չէր։ Այն, որ ատոմային համարը համապատասխանում է ատոմի միջուկի լիցքին, ընդունվում է նաև ատոմի ժամանակակից մոդելի կողմից։[17]
Ատոմի միջուկի կառուցվածք
Ատոմի միջուկի շառավիղը մոտ 100,000 անգամ փոքր է ատոմի շառավղից։ Չնայած միջուկի այդքան փոքր չափերին՝ դա էական դեր է կատարում։
Միջուկը բաղկացած է առանձին մասնիկներից, որոնք կոչվում են նուկլոններ։ Նուկլոնները երկու տեսակ են՝ պրոտոններ և նեյտրոններ։ Պրոտոնը դրական լիքավորված մասնիկ է, որի զանգվածը 1836 անգամ մեծ է էլեկտրոնի զանգվածից։ Պրոտոնի լիցքը հավասար էլեկտրոնի լիցքի մոդուլին՝
Տարբեր ատոմների միջուկները պարունակում են տարբեր թվով պրոտոններ։ Օրինակ՝ ջրածնի ատոմի միջուկն ունի միայն մեկ պրոտոն, թթվածնի ատոմի միջուկում դրանց թիվը 8 է, իսկ ուրանի միջուկում՝ 92։
Պրոտոնների թիվը միջուկում համընկնում է Մենդելեևի քիմիական տարրերի աղյուսակում տվյալ էլեմենտի կարգաթվի հետ։ Կարգաթվի հետ է համընկնում նաև ատոմում էլեկտրոնների թիվը։ Այսպիսով, միջուկում պրոտոնների թիվը համընկնում է նրա շուրջը շարժվող էլեկտրոնների թվի հետ, այդ պատճառով էլ ընդունված է ատոմում պրոտոնների և էլեկտրոնների թիվը նշանակել նույն տառով․ - պրոտոնների թիվը միջուկում։
Հասկացության ձևավորում
Ատոմի մասին հասկացությունները՝ որպես մատերիայի անբաժանելի և ամենափոքր մասնիկ, առաջին անգամ սահմանվել է հին հնդիկ և հույն փիլիսոփաների կողմից (ատոմիզմ)։ 17-րդ և 18-րդ դարերում քիմիկոսներին հաջողվեց փորձով ապացուցել այդ վարկածը՝ ցույց տալով, որ որոշ նյութեր չեն կարող ենթարկվել հետագա քայքայումների ավելի փոքր բաղկացուցիչ տարրերի քիմիական մեթոդների միջոցով։ Սակայն 19-րդ դարի վերջին և 20-րդ դարի սկզբին ֆիզիկոսները հայտնաբերեցին սուբատոմական մասնիկներ և առաջարկեցին ատոմի կառուցվածքը։ Դրանից հետո պարզ դարձավ, որ ատոմն ինքնին անբաժանելի չէ։
1860 թվականին Գերմանիայի Կարլսրուե քաղաքում ըեղի ունեցած Քիմիկոսների միջազգային կոնֆերանսում ընդունվեցին մոլեկուլի և ատոմի կառուցվածքի մասին հասկացությունների սահմանումներ։ Ատոմը քիմիական տարրի այն փոքրագույն մասնիկն է, որը մտնում է պարզ և բարդ նյութերի բաղադրության մեջ։
Տես նաև
Ծանոթագրություններ
- ↑ ChEBI — EBI.
- ↑ Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, N.Y.: Dover Publications. ISBN 0-486-49584-1.
- ↑ Dalton, John. "On the Absorption of Gases by Water and Other Liquids", in Memoirs of the Literary and Philosophical Society of Manchester. 1803. Retrieved on August 29, 2007.
- ↑ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (German). 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. Վերցված է 4 February 2007-ին.
{{cite journal}}: CS1 սպաս․ չճանաչված լեզու (link) - ↑ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. էջեր 1–7. ISBN 0-19-851567-7. OCLC 48753074.
- ↑ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Արխիվացված է օրիգինալից 18 December 2007-ին. Վերցված է 18 December 2007-ին.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (օգնություն) - ↑ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ↑ Thomson, J. J. (August 1901). «On bodies smaller than atoms». The Popular Science Monthly. Bonnier Corp.: 323–335. Վերցված է 2009-06-21-ին.
- ↑ «J.J. Thomson». Nobel Foundation. 1906. Վերցված է 20 December 2007-ին.
- ↑ Խմբագրական կոլեգիա, Հայկական Սովետական Հանրագիտարան, հ. {{{1}}} (խմբ. Վիկտոր Համբարձումյան), Ե., «Հայկական ՍՍՀ Գիտությունների Ակադեմիա Հայկական Սովետական Հանրագիտարանի գլխավոր խմբագրություն», էջ {{{2}}}։
- ↑ Rutherford, E. (1911). «The Scattering of α and β Particles by Matter and the Structure of the Atom» (PDF). Philosophical Magazine. 21 (125): 669–88. doi:10.1080/14786440508637080.
- ↑ «The Gold Foil Experiment». myweb.usf.edu.
- ↑ «Frederick Soddy, The Nobel Prize in Chemistry 1921». Nobel Foundation. Վերցված է 18 January 2008-ին.
- ↑ Thomson, Joseph John (1913). «Rays of positive electricity». Proceedings of the Royal Society. A. 89 (607): 1–20. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057.
- ↑ Stern, David P. (16 May 2005). «The Atomic Nucleus and Bohr's Early Model of the Atom». NASA/Goddard Space Flight Center. Վերցված է 20 December 2007-ին.
- ↑ Bohr, Niels (11 December 1922). «Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture». Nobel Foundation. Վերցված է 16 February 2008-ին.
- ↑ Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. էջեր 228–230. ISBN 0-19-851971-0.


