«Պոլոնիում»–ի խմբագրումների տարբերություն
չ վերջակետների ուղղում, փոխարինվեց: ց: → ց։ (28) oգտվելով ԱՎԲ |
ոճակական ուղղումներ |
||
| Տող 1. | Տող 1. | ||
{{Քիմիական տարր |
|||
[[Պատկեր:alpha po lattice.jpg|մինի|Պոլոնիում]] |
|||
| անվանում =Պոլոնիում / Polonium (Po) |
|||
{{Նշան|Po}} |
|||
| համար = 84 |
|||
| սիմվոլ = Po |
|||
| վերևից =[[Տելուր|Te]] |
|||
| ներքևից = [[Լիվերմորիում |Lv]] |
|||
| խումբ = |
|||
| պարբերություն = |
|||
| բլոկ = |
|||
| արտաքին տեսք =[[Պատկեր:Polonium.jpg|200px|Մետաղական պոլոնիումը չժանգոտվող պողպատից բարակ թաղանե սկավառակի վրա]] Սպիտակ-արծաթափայլ փափուկ մետաղ |
|||
| պատկեր = |
|||
| ատոմային զանգված =208,9824<ref name="iupac atomic weights">{{статья|автор=Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu.|заглавие=Atomic weights of the elements 2011 (IUPAC Technical Report)|ссылка=http://iupac.org/publications/pac/85/5/1047/|язык=en|издание=[[Pure and Applied Chemistry]]|год=2013|том=85|номер=5|страницы=1047-1078|doi=10.1351/PAC-REP-13-03-02}}</ref> |
|||
| կոնֆիգուրացիա =[Xe] 4f<sup>14</sup> 5d<sup>10</sup> 6s<sup>2</sup> 6p<sup>4</sup> |
|||
| էլեկտրոնային թաղանթ = |
|||
| ատոմի շառավիղ = 176 |
|||
| կովալենտային շառավիղ =146 |
|||
| Վան-դեր-Վալսի շառավիղ = |
|||
| իոնի շառավիղ = (+6e) 67 |
|||
| էլեկտրաբացասականություն = 2,3 |
|||
| էլեկտրոդային պոտենցիալ = Po ← Po<sup>3+</sup> 0,56 В<br />Po ← Po<sup>2+</sup> 0,65 В |
|||
| օքսիդացման աստիճան = –2, +2, +4, +6 |
|||
| իոնիզացման էներգիա 1 = 813,1 (8,43) |
|||
| իոնիզացման էներգիա 2 = |
|||
| իոնիզացման էներգիա 3 = |
|||
| ֆազ = |
|||
| խտություն = 9,196 գ/սմ<sup>3</sup><ref name=WebElements>{{cite web|url=http://www.webelements.com/polonium/|title=Polonium: physical properties|publisher=WebElements|lang=en|accessdate=2013-08-28}}</ref> |
|||
| խտություն2 = |
|||
| խտություն3 = |
|||
| խտություն հջ = |
|||
| հալման ջերմաստիճան = 527 K (254 °C, 489 °F) |
|||
| եռման ջերմաստիճան = 1235 K (962 °C, 1764 °F) |
|||
| կրիտիկական կետ Կ = |
|||
| հալման ջերմունակություն = |
|||
| հալման ջերմունակություն2 = |
|||
| գոլորշիացման ջերմունակություն = |
|||
| ջերմունակություն = 26,4<ref name="ХЭ">{{ռուսերեն գիրք |
|||
|автор = Редкол.:Зефиров Н. с. (гл. ред.) |
|||
|ժаվրկть = |
|||
|заглавие = Химическая энциклопедия: в 5 т |
|||
|оригинал = |
|||
|վրկվրկылка = |
|||
|ответվրկтвенный = |
|||
|издание = |
|||
|меվրկто = Москва |
|||
|издательվրկтво = Большая Российская энциклопедия |
|||
|год = 1999 |
|||
|том = 5 |
|||
|վրկтраницы = 487 |
|||
|վրկтраниц = |
|||
|վրկерия = |
|||
|isbn = |
|||
|тираж = |
|||
}} |
|||
</ref> |
|||
| ջերմունակություն2 = |
|||
| մոլային ծավալ = 22,7 |
|||
| հագեցած գոլորշի = |
|||
| ճնշում հգ 1 = |
|||
| ճնշում հգ 10 = |
|||
| ճնշում հգ 100 = |
|||
| ճնշում հգ 1 k = |
|||
| ճնշում հգ 10 k = |
|||
| ճնշում հգ 100 k = |
|||
| բյուրեղացանցի կառուցվածք = խորանարդ |
|||
| բյուրեղացանցի տվյալներ = 3,350 |
|||
| C/a հարաբերություն = |
|||
| Դեբայի ջերմաստիճան = |
|||
| մագնիսական կառուցվածք = |
|||
| տեսակարար դիմադրություն = |
|||
| ջերմահաղորդականություն = |
|||
| ջերմաստիճանահաղորդականություն = |
|||
| ջերմային ընդարձակում = |
|||
| ձայնի արագություն = |
|||
| Յունգի մոդուլ = |
|||
| CAS համար = |
|||
| արգելվող գոտի = |
|||
| իզոտոպներ = |
|||
| իզոտոպներ լրացումներ = |
|||
}} |
|||
{{Պարբերական համակարգի տարր|align=center|fontsize=100%|number=84}} |
|||
'''Պոլոնիում''', քիմիական տարր է, որի նշանն է ''Po'' և ատոմային թիվը՝ 84։ |
|||
'''Պոլոնիում''' ({{lang-la|Polonium}}), քիմիական տարր է, որի նշանն է ''Po'' և ատոմային թիվը՝ 84: Տարրերի [[պարբերական համակարգ]]ի 6-րդ պարբերության 6-րդ խմբի քիմիական տարր, p տարր է, ատոմի էլեկտրոնային թաղանթների կառուցվածքն է 5s<sup>2</sup>5p<sup>6</sup>5d<sup>10</sup>6s<sup>2</sup>6p<sup>4</sup>: К, L, M և N թաղանթները լրացված են: Պատկանում է [[հալոգեններ]]ի խմբին: Պոլոնիումը սպիտակ-արծաթափայլ մետաղ է<ref>Полоний - статья из Большой советской энциклопедии</ref>: |
|||
Պոլոնիումը քիմիական տարր է, որի քիմիական նշանն է Po, իսկ [[կարգատիվը]]՝84: Տարրը հայտնաբերվել է [[1898 թվականին]] [[Մարի Կուրիի]] և [[Պիեր Կուրիի]] կողմից։ Այն հազվադեպ հանդիպվող և շատ [[ռադիոակտիվ տարր]] է, որը չունի լրացված շերտերով [[իզոտոպներ]]: Պոլոնիումը քիմիապես նման է [[բիզմիթին]] և [[Թելուրին]] ու հանդիպվում է [[ուրանի]] հանքաքարերում։ |
|||
Տարրը հայտնաբերվել է [[1898]] թվականին [[Մարի Կյուրի]]ի և [[Պիեռ Կյուրի]]ի կողմից: Այն հազվադեպ հանդիպվող և շատ [[ռադիոակտիվ տարր]] է, որը չունի լրացված շերտերով [[իզոտոպներ]]: Պոլոնիումը քիմիապես նման է [[բիսմութ]]ին և [[տելուր]]ին ու հանդիպվում է [[ուրան]]ի հանքաքարերում<ref>{{книга|автор=E. Rutherford.|заглавие=Radioactive Substances and Their Radiations|ссылка=http://books.google.de/books?id=GMqoKqLsrsgC|место=Лондон|издательство=Forgotten Books|страницы=20|страниц=699|isbn=1451001983, 9781451001983}}</ref>: |
|||
Պոլոնիումի կիրառությունները քիչ են։ Այն օգտագործվում է տիեզերագնաց և հակաստատիկ սարքերի պատրաստման մեջ։ Նաև հանդիսանում է [[նեյրոնների]] և [[ալֆա մասնիկների]] աղբյուր։ |
|||
[[Պարբերական |
[[Պարբերական աղյուսակ]]ում իր դիրքի պատճառով Պոլոնիումը երբեմն դասվում է որպես մետաղանման, բայց նրա հատկությունները և պահվացքը փաստում են, որ այն միանշանակ [[մետաղ]] է: |
||
== Պատմություն և անվան ծագում == |
|||
== Հատկություններ == |
|||
Պոլոնիումը ռադիոակտիվ հատկությունների շնորհիվ հայտնաբերված աոաջին տարրն է: Պոլոնիումը հայտնաբերել են Պ․ Կյուրի և Մ․ Սկլադովսկայա-Կյուրի ամուսինները ([[1898]])<ref name=c1>{{cite journal | author1=Curie, P. | author2=Curie, M. | title = Sur une substance nouvelle radio-active, contenue dans la pechblende | trans_title = On a new radioactive substance contained in pitchblende | language = fr | journal = Comptes rendus | volume = 127 | pages = 175–178 | date = 1898 | url = http://www.academie-sciences.fr/activite/archive/dossiers/Curie/Curie_pdf/CR1898_p175_178.pdf}} [http://web.lemoyne.edu/~giunta/curiespo.html English translation.]</ref>, ուրանի խեժահանքում<ref>{{книга|автор=E. Rutherford.|заглавие=Radioactive Substances and Their Radiations|ссылка=http://books.google.de/books?id=GMqoKqLsrsgC|место=Лондон|издательство=Forgotten Books|страницы=20|страниц=699|isbn=1451001983, 9781451001983}}</ref> և անվանել Մ․ Սկլադովսկայա-Կյուրիի հայրենիքի՝ [[Լեհաստան]]ի ({{lang-lat|Polonia}})<ref>{{cite journal |
|||
=== Իզոտոպներ === |
|||
| title = Borders of the Nuclear World – 100 Years After Discovery of Polonium |
|||
| last = Pfützner | first =M. |
|||
| journal = Acta Physica Polonica B |
|||
| volume = 30 |
|||
| date = 1999 |
|||
| page= 1197 |
|||
| bibcode =1999AcPPB..30.1197P}}</ref><ref>{{cite journal |
|||
| title = The centennial of the 1903 Nobel Prize for physics |
|||
| last = Adloff | first =J. P. |
|||
| journal = Radichimica Acta |
|||
| volume = 91 |
|||
| issue = 12–2003 |
|||
| pages=681–688 |
|||
| date=2003 |
|||
| doi = 10.1524/ract.91.12.681.23428}}</ref> պատվին: Բնական ոլոնիումի՝ <sup>2l0</sup>Po կշռելի քանակներն (0,15 գ) առաջին անգամ անջատվել են <sup>212</sup>PO-ի քայքայման արդյունքներից: |
|||
Փորձնականորեն ռադիում Էֆ անվանված պոլոնիումը հայտնաբերել է Մարի Կյուրին [[1898]] թվականին և այն անվանվել է իր հայրենիքի` [[Հոլանդիա]]յի անունով (''Poland''): |
|||
Պոլոնիումը ունի 33 հայտնի [[իզոտոպներ]], որոնք բոլորը ռադիոակտիվ են։ Նրանց [[հարաբերական ատոմային զանգվածները]] տատանվում են 188-ից 220: <sup>210</sup>Po-ը (կես կիանք-138.376 օր) և բոլոր իզոտոպներից ամենատարածվածն է։ Իսկ ամենաերկարակյաց իզոտոպը <sup>209</sup>Po-ը (կես կյանք125.2 ± 3.3 տարի) և <sup>208</sup>Po-ը (կես կյանք 2.9 տարի): |
|||
Այդ ժամանակ Հոլանդիան ռուսական, գերմանական և [[Ավստրո-Հունգարիա|Ավստրո-Հունգարական]] տիրապետության տակ էին և գոյություն չունեին որպես անկախ երկրներ: |
|||
<sup>208</sup>Po-ը կարող է ստացվել հատուկ անօդի մեջ կապարի կամ բիզմիթի [[ալֆա]],[[պրոտոն]] կամ [[դուտրոն]] ռմբակոծումից։ |
|||
<sup>Պինդ վիճակ</sup> |
|||
Կյուրին հույս ուներ, որ տարրը իր հայրենիքի անունով անվանելով՝ հայտնի կդառնար իրենց երկրում անկախության պակասը: Այն առաջին տարրն էր, որի անվանումը օգնեց կարևորել քաղաքական հակասություններ: |
|||
Պոլոնիումը ռադիոակտիվ տարր է, որը գոյություն ունի երկու մետաղական ալոտրոպներում։ |
|||
[[Ալֆա]] վիճակը պարզ խորանարդային կառուցվացքի միակ հայտնի օրինակն է մեկ ատոմի դեպքում, որի գագաթնային չափսերն են 335.2 [[պիկոմետր]] է, իսկ [[բետա]] վիճակը ռոմբոջրային։ |
|||
Պոլոնիումի կառուցվացքը բնութագրվել է [[ռենտգենյան ճառադայթների]] և [[էլեկտրոնների]] օգնությամբ։ |
|||
== Միացություններ == |
|||
Այս տարրը Կյուրիների կողմից հայտնաբերված առաջին տարրն էր: Այն հայտնաբերվեց, երբ նրանք ուսումնասիրում էին Փիչբլենդ ռադիոակտիվության պատճառը: Փիչբլենդի միջից ռադիոակտիվ տարրերը՝ [[ուրան]]ը ու [[թորիում]]ը հանելուց հետո, ավելի ռադիոակտիվ է քան ուրանը ու թորիումը միասին: Այս գաղափարը ստիպեց Կյուրիներին հայթհայթել նոր ռադիոակտիվ տարրեր: [[1898]] թվականի հուլիսին նրանք փիչբլենդը առանձնացրեցին պոլոնիումից, և հինգ ամիս հետո նաև մեկուսացրեցին ռադիումը: |
|||
Պոլոնիումը չունի հասարակ միացություններ և իր գրեթե բոլոր միացությունները արհեստականորեն են պատրաստվում։ Այդ միացություններիցավելի քան 50-ը ճանաչված են։ Պոլոնիումի ամենակայուն միացությունները [[պոլոնիդներն]] են, որոնք պատրաստվում են երկու տարրերի անմիջական փոխազդեցությունից։ |
|||
Na2Po-ը ունի անտիֆլոռիտ կառուցվացքը, Ca, Ba, Hg, Pb տարրերի պոլոնիդների և լանթինադների փոխազդեցությունից առաջանում է NaCl-ի ցանցեր, իսկ BePo-ը և CdPo-ը ունեն ուըրտզիտ և MgPo-ը նիկել արսենիդ կառուցվացքը։ |
|||
== Պատմություն == |
|||
== Բնության մեջ == |
|||
Փորձնականորեն Ռադիում Էֆ անվանված պոլոնիումը հայտնաբերել է Մարի Կուրին [[1898 թվականին]] և այն անվանվել է իր հայրենիքի` [[Հոլանդիայի]] անունով([[Poland]]): |
|||
[[Պատկեր:Electron shell 084 Polonium - no label.svg|մինի]] |
|||
Այդ ժամանակ Հոլանդիան ռուսասական, գերմանական և Ավստրո-Հունգարական բաժանմունքի տակ էինև գոյություն չունեին րպես անկախ երկիր։ |
|||
Պոլոնիումը շատ հազվադեպ է հանդիպվում բնության մեջ, քանի որ իր բոլոր [[իզոտոպներ]]ը ունեն շատ կարճ կես-կյանք: <sup>210</sup>Po, <sup>214</sup>Po, և <sup>218</sup>Po գոյություն ունեն փտած <sup>238</sup>U-ի մեջ: Պոլոնուոմի ռադիոնուկլիդները մտնում են հազվագյուտ ռադիոակտիվ շարքեր կազմի մեջ: |
|||
Կուրին հույս ուներ, որ տարրը իր հայրենիքի անունով անվանելով՝ հայտնի կդառնար իրենց երկրում անկախության պակասը։ Այն առաջին տարրն էր, որիանվանումը օգնեց կարևորել քաղաքական հակասություններ։ |
|||
*<sup>210</sup>Po ({{math|''Т''}}<sub>1/2</sub> = 138,376 суток), <sup>218</sup>Po ({{math|''Т''}}<sub>1/2</sub> = 3,10 мин) и <sup>214</sup>Po ({{math|''Т''}}<sub>1/2</sub> = 1,643{{e|−4}} с) - в ряд <sup>238</sup>U; |
|||
Այս տարրը Կուրիների կողմից հայնաբերված առաջին տարրն էր։Այն հայտնաբերվեց երբ նրանք ուսումնասիրում էին Փիչբլենդ ռադիոակտիվության պատճառը։ Փիչբլենդի միջից ռադիոակտիվ տարրերը՝ ուրանը ու թորիումը հանելուց հետո, ավելի ռադիոակտիվ է քան ուրանը ու թորիումը միասին։ Այս գաղափարը ստիպեց Կուրիներին հայթհայթել նոր ռադիոակտիվ տարրեր։ 1898 թվականի հուլիսին նրանք փիչբլենդը առանձնացրեցին պոլոնիումից, և հինգ ամիս հետո նաև մեկուսացրեցին ռադիումը։ |
|||
== Տարածվածությունը և Արտադրությունը == |
|||
*<sup>216</sup>Po ({{math|''Т''}}<sub>1/2</sub> = 0,145 с) и <sup>212</sup>Po ({{math|''Т''}}<sub>1/2</sub> = 2,99{{e|−7}} с) - в ряд Th; |
|||
Պոլոնիումը շատ հազվադեպ է հանդիպվում բնության մեջ, քանի որ իր բոլոր իզոտոպները ունեն շատ կարճ կես-կյանք։ <sup>210</sup>Po, <sup>214</sup>Po, և <sup>218</sup>Po գոյություն ունեն փտած <sup>238</sup>U-ի մեջ։ |
|||
== Կիրառությունը == |
|||
*<sup>215</sup>Po ({{math|''Т''}}<sub>1/2</sub> = 1,781{{e|−3}} с) и <sup>211</sup>Po({{math|''Т''}}<sub>1/2</sub> = 0,516 с) - в ряд <sup>235</sup>U: |
|||
Պոլոնիումային հիմքով ալֆա մասնիկների աղբյուրները առաջացել էին [[ԽՍՀՄ]]-ում։ Այսպիսի աղբյուրներ օգտագործվում էին արդյունաբերական ծածկույթների հաստությունը որոշելու համար։ |
|||
Պոլոնիումը հազվագյուտ տարր է, պարունակությունը [[երկրակեղև]]ում 2·10<sup>−14</sup> զանգված % է, ուրանի խեժահանքում մինչև 5,8 •10<sup>-5</sup> %, [[հրաբխային ապարներ]]ում՝ մինչև 3•10<sup>-6</sup> %: |
|||
Պոլոնիում-2 փոքր քանակությամբ գտնվում է բնության մեջ և կուտակվում է [[Ծխախոտ (բույս)|ծխախոտ]]ում<ref name=polonium-epa>[http://www.epa.gov/radiation/sources/tobacco.html Tobacco Smoke] / EPA Radiation Protection {{ref-en}}: "tobacco leaves used in making cigarettes contain radioactive material, particularly lead-210 and polonium-210."</ref><ref>[http://www.sciencemag.org/content/153/3738/880.abstract Source of Lead-210 and Polonium-210 in Tobacco] / Science 19 August 1966: Vol. 153 no. 3738 pp. 880-882 [[DOI: 10.1126/science.153.3738.880]]</ref><ref>[http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2509609/ Waking a Sleeping Giant: The Tobacco Industry’s Response to the Polonium-210 Issue] / Am J Public Health. 2008 September; 98(9): 1643–1650. [[doi:10.2105/AJPH.2007.130963]]</ref>: |
|||
Պլոնիումի հայտնաբերվել է նաև [[սննդային շղթա]]ներում, հատկապես ծովամթերքում<ref>{{cite journal|display-authors = 4|author = Ota, Tomoko|author2 = Sanada, Tetsuya|author3 = Kashiwara, Yoko|author4 = Morimoto, Takao|author5 = Sato, Kaneaki|last-author-amp = yes|journal = Japanese Journal of Health Physics|date = 2009|volume = 44|title = Evaluation for Committed Effective Dose Due to Dietary Foods by the Intake for Japanese Adults|url = http://ci.nii.ac.jp/naid/110007226760|doi = 10.5453/jhps.44.80|pages = 80–88}}</ref><ref>{{cite journal|author = Smith-Briggs, JL|author2 = Bradley, EJ|journal =Science of the Total Environment |date=1984 |volume=35 |title=Measurement of natural radionuclides in U.K. diet |pmid=6729447 |issue=3 |pages=431–40|doi = 10.1016/0048-9697(84)90015-9}}</ref>: |
|||
== Տե՛ս նաև == |
|||
== Ֆիզիկական հատկություններ == |
|||
[[File:alpha po lattice.jpg|thumb|left|Պոլոիումի բյուրեղացանցի ալֆա ձևը]] |
|||
Պոլոնիումը փափուկ, սպիտակ արծաթափայլ ռադիոակտիվ մետաղ է, հալման ջերմաստիճանը՝ 254 °C, եռմանը՝ 1162 °C<ref>{{cite journal| first1 = Bogdan |last1=Wąs| first2 = Ryszard |last2=Misiak| first3 = Mirosław |last3=Bartyzel| first4 = Barbara |last4=Petelenz | title = Thermochromatographic Separation of <sup>206,208</sup>Po from a Bismuth Target Bombardet with Protons | journal =Nukleonica | date =2006| volume =51 | issue = Suppl. 2 | pages = s3–s5 | url =http://www.ichtj.waw.pl/ichtj/nukleon/back/full/vol51_2006/v51s2p03f.pdf}}</ref>, [[խտություն]]ը՝ 9300 կգ/մ<sup>3</sup>, 366°-ից բարձր առաջանում է պոլոնիումի β-ձևափոխությունը (9398 կգ/մ<sup>3</sup>): |
|||
Պոլոնիումը և նրա միացությունները չափազանց թունավոր են, միացություններից շատերը նաև ցնդող, որի հետևաքով քիմիական հատկություններն անբավարար են ուսումնասիրված: |
|||
== Քիմիական հատկություններ == |
|||
Քիմիական հատկություններով պոլոնիումը մոտ է [[տելուր]]ին, մասամբ նաև բիսմութին: Միացություններում ունի 4-4, ավելի հազվադեպ -2, +3 և +6 [[օքսիդացման աստիճան]]ներ: Լուծվում է [[թթուներ]]ում՝ անջատելով [[ջրածին]]: |
|||
Օդում տաքացնելիս (250°C) առաջացնում է PoO<sub>2</sub>: Ինդիկատորային (չկշռվող) քանակներով ստացվել են РоО<sub>3</sub> և պոլոնիումական թթվի [[աղեր]]ը՝ պոլոնատները (օրինակ, K<sub>2</sub>PoO<sub>4</sub>): Հայտնի են նաև PoO օքսիդը, լուծույթում՝ Po<sup>2+</sup>, Po<sup>+4</sup>, PoO<sub>3</sub><sup>-2</sup>, PoO<sub>4</sub><sup>-2</sup> իոնները, հիդրօքսիդը՝ Ро(ОН)<sub>2</sub>, հալոզենիդները՝ РоС1<sub>2</sub>, РоВr<sub>2</sub> և այլն, սուլֆիդը՝ PoS<ref name=figgins>Figgins, P. E. (1961) [http://www.osti.gov/bridge/purl.cover.jsp?purl=/4034029-SolPsF/ The Radiochemistry of Polonium], National Academy of Sciences, US Atomic Energy Commission, pp. 13–14 [http://books.google.com/books?id=N0MrAAAAYAAJ&printsec=frontcover Google Books]</ref><ref>[[#Bagnall|Bagnall]], pp. 212–226</ref>: |
|||
{|class="wikitable" style="text-align:center" |
|||
|+Պոլոնիումի միացություններ<ref>Wiberg, Egon; Holleman, A. F. and Wiberg, Nils [http://books.google.com/books?id=Mtth5g59dEIC&pg=PA594 Inorganic Chemistry], Academic Press, 2001, p. 594, ISBN 0-12-352651-5.</ref> |
|||
|- |
|||
!Բանաձև!!Գույն!! [[Հալման ջերմաստիճան]] (°C)|| [[Սուբլիմացիա (ֆիզիկա)|Սուբլիմացիան]] <br>ջերմ. (°C) ||Սիմետրիա||Փիրսոն սիմվոլ ||Բյուրեղագրաֆիկ խումբ ||Ոչ||a (pm) || b(pm) || c(pm) || Z || [[Խտություն|ρ]] (գ/սմ<sup>3</sup>) ||ref |
|||
|- |
|||
|[[պոլոնիումի (IV) օքսիդ|PoO<sub>2</sub>]]|| բաց դեղին|| 500 ||885 ||[[Խորանարդային համակարգ|խորանարդ]] ||cF12||Fm{{overline|3}}m ||225 ||563.7||563.7||563.7||4|| 8.94 || <ref name=Bagnall>{{cite journal |last1=Bagnall |first1=K. W. |last2=d'Eye |first2=R. W. M. |date=1954 |title=The Preparation of Polonium Metal and Polonium Dioxide |journal=[[Journal of the Chemical Society|J. Chem. Soc]] |pages=4295–4299|doi=10.1039/JR9540004295 }}</ref> |
|||
|- |
|||
|[[պոլոնիումի քլորիդ|PoCl<sub>2</sub>]]|| մուգ կարմիր|| 355 ||130 ||[[շեղանկյուն]] ||oP3||Pmmm||47 ||367||435||450||1|| 6.47 || <ref name=PoCl>{{cite journal|doi=10.1039/JR9550002320|title=The polonium halides. Part I. Polonium chlorides|date=1955|last1=Bagnall|first1=K. W.|last2=d'Eye|first2=R. W. M.|last3=Freeman|first3=J. H.|journal=Journal of the Chemical Society (Resumed)|page=2320}}</ref> |
|||
|- |
|||
|[[պոլոնիումի բրոմիդ|PoBr<sub>2</sub>]]||մանուշակագույն-շագանակագույն|| 270 || || || || || || || || || || ||<ref name=PoBr>{{cite journal|doi=10.1039/JR9550003959|title=The polonium halides. Part II. Bromides|date=1955|last1=Bagnall|first1=K. W.|last2=d'Eye|first2=R. W. M.|last3=Freeman|first3=J. H.|journal=Journal of the Chemical Society (Resumed)|page=3959}}</ref> |
|||
|- |
|||
|[[պոլոնիումի տետրաքլորիդ|PoCl<sub>4</sub>]]|| դեղին||300 || 200 ||[[մոնոցիկլիկ]] || || || || || || || || ||<ref name=PoCl/> |
|||
|- |
|||
|[[պոլոնիումի տետրաբրոմիդ|PoBr<sub>4</sub>]]|| կարմիր||330 || ||[[Խորանարդային համակարգ|Խորանարդ]] || cF100 || Fm{{overline|3}}m ||225||560||560||560||4|| || <ref name=PoBr/> |
|||
|- |
|||
|[[պոլոնիումի տետրայոդիդ|PoI<sub>4</sub>]]||սև || || || || || || || || || || || || <ref>{{cite journal|doi=10.1039/JR9560003385|title=657. The polonium halides. Part III. Polonium tetraiodide|date=1956|last1=Bagnall|first1=K. W.|last2=d'Eye|first2=R. W. M.|last3=Freeman|first3=J. H.|journal=Journal of the Chemical Society (Resumed)|page=3385}}</ref> |
|||
|} |
|||
{{col-begin}} |
|||
{{col-break}} |
|||
'''Օքսիդներ''' |
|||
* [[Պոլոնիումի օքսիդ|PoO]] |
|||
* [[Պոլոնիումի (IV) օքսիդ|PoO<sub>2</sub>]] |
|||
* [[Պոլոնիումի (III) օքսիդ|PoO<sub>3</sub>]] |
|||
{{col-break}} |
|||
'''Հիդրիդներ''' |
|||
* [[Պոլոնիումի հիդրիդ|PoH<sub>2</sub>]] |
|||
{{col-break}} |
|||
'''Հալոիդներ''' |
|||
* PoX<sub>2</sub>, օրինակ պլոնիումի քլորիդ, PoCl<sub>2</sub> |
|||
* PoX<sub>4</sub>, օրինակ [պոլոնիումի տետրաքլորիդ, PoCl<sub>4</sub> |
|||
* [[Պոլոնիումի հեքսաֆտորիդ|PoF<sub>6</sub>]] (փորձնական) |
|||
{{col-end}} |
|||
Կշռելի քանակներով ստացվել են քառահալոգենիդները և [[սուլֆատներ]]ը, որոնք ջրում [[հիդրոլիզ]]վում են: [[Հալոգեններ]]ի հետ առաջացնում է տետրահալոգենիդներ: [[Թթուներ]]ի ազդեցությամբ լուծվում է [[լուծույթներ]]ում, առաջացնելով Ро<sup>2+</sup>-ի վարդագույն գույին իոնը: |
|||
:: <math>\mathsf{Po + 2HCl \rightarrow PoCl_2 + H_2\uparrow}</math> |
|||
Սինթեզվել են պոլոնիում-օրգանական միացությունները՝ (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>Po, (С<sup>б</sup>Н<sub>5</sub>)<sub>2</sub>РоС1<sub>2</sub> և այլն: |
|||
Մետաղական պոլոնիումը օդում արագ օքսիդանում է: Հայտնի են պոլոնիումի երկօքսիդը (РоО<sub>2</sub>)<sub>x</sub> և պոլոնիումի մոնօքսիդը РоО: |
|||
Պոլոնիումը [[մագնեզիում]]ի առկայությամբ փոխազդում է [[Աղաթթու|աղաթթվ]]ի հետ առաջացնելով պոլոնոջրածին. |
|||
:: <math>\mathsf{Po + Mg + 2HCl \rightarrow MgCl_2 + H_2Po}</math>, |
|||
որոնք սենյակային ջերմաստիճանում գտնվում են հեղուկ վիճակում (−36,1 մինչև 35,3 °C) |
|||
Պոլոնիում ը հանդիսանում է միակ քիմիական տարրը, որը ցածր ջերմաստիճանում ձևավորում է միատոմանի, պարզ խորանարդ բյուրեղացանց<ref>{{cite web|url=http://elementy.ru/news/430560|title=Разгадана загадка полония|author=Игорь Иванов.|quote=Вычисления, проведенные чешскими исследователями, дали ответ на вопрос, давно мучивший физиков: почему полоний предпочитает кубическую кристаллическую решетку?|date=12.07.07|pages=1|lang=ru|accessdate=2010-05-04|archiveurl=http://www.webcitation.org/618RuMN6a|archivedate=2011-08-22}}</ref>: |
|||
[[Ալֆա]] վիճակը պարզ խորանարդային կառուցվացքի միակ հայտնի օրինակն է մեկ ատոմի դեպքում, որի գագաթնային չափսերն են 335.2 [[պիկոմետր]] է, իսկ [[բետա]] վիճակը ռոմբոբջջրային<ref>[[#Greenwood|Greenwood]], p. 753</ref><ref>{{cite book |first1=Gary L. |last1=Miessler|first2= Donald A. |last2=Tarr |title=Inorganic Chemistry |edition=3rd |page=285 |isbn=0-13-120198-0 |date=2004 |publisher=Pearson Prentice Hall |location=Upper Saddle River, N.J.}}</ref><ref>{{cite web| url = http://cst-www.nrl.navy.mil/lattice/struk/a_i.html| archiveurl = https://web.archive.org/web/20010204004200/http://cst-www.nrl.navy.mil/lattice/struk/a_i.html| archivedate = 2001-02-04|date= 2000-11-20|work=Naval Research Laboratory |title = The beta Po (A_i) Structure| accessdate = 2009-05-05}}</ref>: Պոլոնիումի կառուցվացքը բնութագրվել է [[ռենտգենյան ճառագայթներ]]ի և [[էլեկտրոններ]]ի օգնությամբ: |
|||
== Իզոտոպներ == |
|||
Պոլոնիումը ունի 33 հայտնի [[իզոտոպներ]], որոնք բոլորը ռադիոակտիվ են: Հայտնի են 193-218 զանգվածի թվերով [[ռադիոակտիվ իզոտոպներ]]ը, որոնցից ամենակայունը <sup>209</sup>Po(T<sub>1/2</sub> = 103 տարի) արհեստական իզոտոպն է: Բնության մեջ հանդիպում են 210-212, 214-216 և 218 զանգվածի թվերով իզոտոպները, առաջանում են որպես բնական ռադիոակտիվ շարքերի անդամներ: Նրանց հարաբերական ատոմային զանգվածները տատանվում են 188-ից 220: <sup>210</sup>Po-ը (կես կիանք-138.376 օր) և բոլոր իզոտոպներից ամենատարածվածն է: Իսկ ամենաերկարակյաց իզոտոպը <sup>209</sup>Po-ը (կես կյանք125.2 ± 3.3 տարի) և <sup>208</sup>Po-ը (կես կյանք 2.9 տարի): Պոլոնիումի կայուն իզոտոպներ հայտնի չեն:<ref name="ХЭ">{{книга |
|||
|автор = Глав. ред.: Н.С. Зефиров. |
|||
|часть = |
|||
|заглавие = Химическая энциклопедия |
|||
|оригинал = |
|||
|ссылка = http://www.xumuk.ru/encyklopedia/2/3623.html |
|||
|ответственный = Н.С. Зефиров |
|||
|издание = |
|||
|место = Москва |
|||
|издательство = Большая Российская Энциклопедия |
|||
|год = 1995 |
|||
|том = 4 |
|||
|страницы = 53 |
|||
|страниц = 639 |
|||
|серия = 5 томов |
|||
|isbn = 5852700924 |
|||
|тираж = 20 000 |
|||
}}</ref>: |
|||
Ամենակայունը բնական իզոտոպն է՝ <sup>210</sup>Po(T<sub>1/2</sub>= 138 օր, α-ճառագայթիչ, փոխարկվում է <sup>206</sup>Рb-ի) որն աննշան քանակներով կուտակվում է [[ուրան]]ի հանքերում, մշտապես ուղեկցում [[ռադիում]]ին և նրա միացություններին: |
|||
<sup>208</sup>Po-ը կարող է ստացվել հատուկ անօդի մեջ [[կապար]]ի կամ [[բիսմութ]]ի [[ալֆա]], [[պրոտոն]] կամ [[դեյտրոն]] ռմբակոծումից:<sup>Պինդ վիճակ</sup> |
|||
Պոլոնիումը ռադիոակտիվ տարր է, որը գոյություն ունի երկու մետաղական ալոտրոպներում: |
|||
<center> |
|||
{| class="wikitable" |
|||
!Իզոտոպ||Անվանում||Նշան||Ռադիոակտիվ շարք |
|||
|- |
|||
|<sup>210</sup>Po||Ռադիում F||RaF ||<sup>238</sup>U |
|||
|- |
|||
|<sup>211</sup>Po||Ակտինիում C'||AcC' ||<sup>235</sup>U |
|||
|- |
|||
|<sup>212</sup>Po||Թորյում C'||ThC' ||<sup>232</sup>Th |
|||
|- |
|||
|<sup>214</sup>Po||Ռադիում C'||RaC' ||<sup>238</sup>U |
|||
|- |
|||
|<sup>215</sup>Po||Ակտինիում A||AcA ||<sup>235</sup>U |
|||
|- |
|||
|<sup>216</sup>Po||Թորիում A||ThA ||<sup>232</sup>Th |
|||
|- |
|||
|<sup>218</sup>Po||Ռադիում A||RaA ||<sup>238</sup>U |
|||
|} |
|||
</center> |
|||
== Ստացում == |
|||
Պոլոնիումը (<sup>210</sup>Ро) միլիգրամային քանակներով ստանում են միջուկային ռեակտորներում՝ բիսմութը նեյտրոններով ճառագայթելով: |
|||
::<math>{ Bi^{209} + p \rightarrow {Po}^{209} + n}</math> |
|||
[[2006]] թվականին բրիտանացի գիտնական և գրող Ջոն Էմսլի հաստատմամբ, այդ տարվա ընթացքում արտադրվել է մոտ 100 գրամ <sup>210</sup>Ро-ում.<ref>[http://www.rsc.org/chemistryworld/News/2006/November/27110601.asp Q&A: Polonium-210], Royal Society of Chemistry, 27 November 2006</ref>: |
|||
== Արժեք == |
|||
Ըստ բրիտանացի փորձագետների, պոլոնիումի-210 մանրադիտակային դոզան արժի միլիոնավոր ԱՄՆ դոլլարներ<ref>[http://www.bbc.com/russian/uk/2015/07/150730_litvinenko_met_police_satement «Дело Литвиненко: Россия причастна "так или иначе"»], Би-Би-Си, 31 июля 2015</ref>: Մյուս կողմից, ռադիոքիմիկոսների հաստատմամբ բիսմութից ստացված պոլոնիումի-210 շատ էժան է<ref name="trv-science">[http://trv-science.ru/2015/02/10/zachem-byl-nuzhen-polonium/ Зачем был нужен полоний?], «Троицкий вариант», 10 февраля 2015 года.</ref>: Համաձայն 2006 թվականի տվյալների արտադրված պոլոնիումի-210-ի 9,6 գրամի համար վճարվում էր շուրջ 10 մլն ռուբլի<ref>[http://www.rg.ru/2006/12/06/ilkaev.html Когда полоний призвали на службу], Российская газета, 31 июля 2015 года</ref>, որը համընկնում է տրիտիումի գնի հետ<ref>[http://news.bbc.co.uk/2/hi/science/nature/8547273.stm Is fusion power really viable?], Би-Би-Си, 5 марта 2010</ref>: |
|||
Սակայն ամերիկյան ''United Nuclear'' ընկերություն, ստանալով իզոտոպը [[Ռուսաստան]]ում, [[2006]] թվականին պոլոնիումի նմուշները վաճառեց $69 գնով, պնդելով որ մահացու դոզայի համար կպահանջվի ավեի քան $1 միլիոն դոլլար<ref>[http://ria.ru/society/20061211/56733537.html Человек, пораженный полонием-210, не может оставлять после себя следы], РИАНОВОСТИ, 11 декабря 2006 г.</ref>: |
|||
== Միացություններ == |
|||
Պոլոնիումը չունի հասարակ միացություններ և իր գրեթե բոլոր միացությունները արհեստականորեն են պատրաստվում: Այդ միացություններիցավելի քան 50-ը ճանաչված են: Պոլոնիումի ամենակայուն միացությունները [[պոլոնիդներն]] են, որոնք պատրաստվում են երկու տարրերի անմիջական փոխազդեցությունից: |
|||
Na2Po-ը ունի անտիֆլոռիտ կառուցվացքը, Ca, Ba, Hg, Pb տարրերի պոլոնիդների և լանթինադների փոխազդեցությունից առաջանում է NaCl-ի ցանցեր, իսկ BePo-ը և CdPo-ը ունեն ուըրտզիտ և MgPo-ը նիկել արսենիդ կառուցվացքը: |
|||
== Կիրառություն == |
|||
Պոլոնիումային հիմքով ալֆա մասնիկների աղբյուրները առաջացել էին [[ԽՍՀՄ]]-ում: Այսպիսի աղբյուրներ օգտագործվում էին արդյունաբերական ծածկույթների հաստությունը որոշելու համար: |
|||
Պոլոնիումի կիրառությունները քիչ են: Այն օգտագործվում է տիեզերագնաց և հակաստատիկ սարքերի պատրաստման մեջ: Նաև հանդիսանում է [[նեյրոններ]]ի և [[ալֆա մասնիկներ]]ի աղբյուր: |
|||
== Թունավորություն == |
|||
<sup>210</sup>Po բնական ռադիոակտիվ նստվածքի սովորական բաղադրիչն է, որը [[արմատ]]ների և վերգետնյա օրգանների միջոցով անցնում է բույսին: Մարդու և [[կենդանիներ]]ի օրգանիզմ է ներմուծվում սննդի հետ․ թեյը պարունակում է 500-600․ ծովային ձուկը՝ 20-100, միսը՝ 2-3, ձավարեղենը՝ 2, հացը՝ 1 պԿյուրի/կգ: |
|||
Մարդու և կենդանիների [[հյուսվածքներ]]ում պոլոնիումի պարունակությունը մոտ 4•10<sup>-2</sup> պԿյուրի/կգ է: Նրա այդպիսի փոքր քանակների կենսաբանական ներգործությունը վատ է ուսումնասիրված, մեծ քանակները α-ճառագայթման պատճառով ազդում են բազմաթիվ օրգանների վրա: |
|||
== Պոլոնիում-210-ից թունավորման դեպքեր == |
|||
*[[Ալեքսանդր Լիտվինենկո|Ալեքսանդր Վալտերովիչ Լիտվինենկո]]ն [[2006]] թվականին մահացել է պոլոնիում-210-ի թունավորումից: |
|||
Պոլոնիումը հայտնաբերվել է [[Յասեր Արաֆաթ]]ի անձնական իրերում, ով մահացել է [[2004]] թվականին: Որոշվել է անցկացենել արտաշիրիմում<ref>{{cite web|url=http://lenta.ru/news/2012/11/27/arafat/|title=Останки Ясира Арафата извлекли из мавзолея|date=2012-11-27|publisher=Лента.Ру|accessdate=2013-08-09|archiveurl=http://www.webcitation.org/6IqSPUwc1|archivedate=2013-08-13}}</ref>: Սկզբում շվեյցարական միջազգային հանձնաժողովը հաստատեց, այն փաստը, որ թունավորվել է պոլոնիումով<ref>{{cite web|url=http://ria.ru/world/20131106/975128407.html#13839289686343&message=resize&relto=register&action=addClass&value=registration|title=Экспертиза подтвердила, что Арафата отравили полонием|date=6.11.2013|publisher=РИА Новости|accessdate=2013-11-08}}</ref>: Ավելի ուշ ռուսական և ֆրանսիական կողմերի արդյունքների եզրակացության համաձայն թունավորման ոչ մի ապացույց չկար<ref>{{cite web|url=http://ria.ru/world/20131226/986591916.html|title=Российские медики: Арафат умер свой смертью|date=2013-12-26}}</ref>: |
|||
== Տես նաև == |
|||
* [[Պարբերական աղյուսակ]] |
* [[Պարբերական աղյուսակ]] |
||
*[[Ռադիոակտիվ շարքեր]] |
|||
== Ծանոթագրություններ == |
|||
{{Փոքր պարբերական աղյուսակ}} |
|||
{{ծանցանկ|2}} |
|||
== Գրականություն == |
|||
{{Chem-stub}} |
|||
* {{cite book |title=Advances in Inorganic Chemistry and Radiochemistry |chapter=The Chemistry of Polonium |ref=Bagnall|last1=Bagnall |first1=K. W. |date=1962 |publisher=[[Academic Press]] |location=New York |isbn=0-12-023604-4|doi=10.1016/S0065-2792(08)60268-X|pages=197–226 |accessdate=June 14, 2012 |url=http://books.google.com/books?id=8qePsa3V8GQC&pg=PA212|volume=4}} |
|||
* {{cite book|ref=Greenwood|author=Greenwood, Norman N.|author2=Earnshaw, Alan |date=1997|title= Chemistry of the Elements|edition= 2nd|publisher= Butterworth–Heinemann|isbn=0080379419}} |
|||
== Արտաքին հղումներ == |
|||
* [http://www.rsc.org/chemistryworld/podcast/element.asp Chemistry in its element podcast] (MP3) from the Royal Society of Chemistry's Chemistry World: [http://www.rsc.org/images/CIIE_polonium_48kbps_tcm18-120639.mp3 Polonium] |
|||
* [http://www.periodicvideos.com/videos/084.htm Polonium] at ''The Periodic Table of Videos'' (University of Nottingham) |
|||
* [http://www.lenntech.com/deutsch/Data-PSE/Po.htm Gesundheits- und Umweltaspekte] von Polonium |
|||
* [http://www.chemie-im-alltag.de/articles/0089/index.html Polonium-210 – In tödlicher Mission] |
|||
* [http://www.fz-juelich.de/gs/DE/UeberUns/Organisation/S-B/S-BA/_node.html Verfahren zur Bestimmung von Polonium-210 in Urin] in einem radiochemischen Labor des Forschungszentrums Jülich |
|||
{{Փոքր պարբերական աղյուսակ}} |
|||
{{ՀՍՀ}} |
|||
[[Կատեգորիա:Կիսամետաղներ]] |
[[Կատեգորիա:Կիսամետաղներ]] |
||
[[Կատեգորիա:Խալկոգեններ]] |
[[Կատեգորիա:Խալկոգեններ]] |
||
19:42, 28 Սեպտեմբերի 2015-ի տարբերակ
| |||||
|---|---|---|---|---|---|
Մետաղական պոլոնիումը չժանգոտվող պողպատից բարակ թաղանե սկավառակի վրա Սպիտակ-արծաթափայլ փափուկ մետաղ | |||||
| Ատոմի հատկություններ | |||||
| Անվանում, սիմվոլ, կարգաթիվ | Պոլոնիում / Polonium (Po), Po, 84 | ||||
| Ատոմային զանգված (մոլային զանգված) | 208,9824[1] զ. ա. մ. (գ/մոլ) | ||||
| Էլեկտրոնային կոնֆիգուրացիա | [Xe] 4f14 5d10 6s2 6p4 | ||||
| Ատոմի շառավիղ | 176 պմ | ||||
| Քիմիական հատկություններ | |||||
| Կովալենտ շառավիղ | 146 պմ | ||||
| Իոնի շառավիղ | (+6e) 67 պմ | ||||
| Էլեկտրաբացասականություն | 2,3 (Պոլինգի սանդղակ) | ||||
| Էլեկտրոդային պոտենցիալ | Po ← Po3+ 0,56 В Po ← Po2+ 0,65 В | ||||
| Օքսիդացման աստիճաններ | –2, +2, +4, +6 | ||||
| Իոնացման էներգիա (առաջին էլեկտրոն) | 813,1 (8,43) կՋ/մոլ (էՎ) | ||||
| Պարզ նյութի թերմոդինամիկական հատկություններ | |||||
| Հալման ջերմաստիճան | 527 K (254 °C, 489 °F) | ||||
| Եռման ջերմաստիճան | 1235 K (962 °C, 1764 °F) | ||||
| Մոլյար ջերմունակություն | 26,4[3] Ջ/(Կ·մոլ) | ||||
| Մոլային ծավալ | 22,7 սմ³/մոլ | ||||
| Պարզ նյութի բյուրեղային ցանց | |||||
| Բյուրեղացանցի կառուցվածք | խորանարդ | ||||
| Բյուրեղացանցի տվյալներ | 3,350 | ||||
| CAS համար | CAS գրանցման համար? | ||||
| 84 | Պոլոնիում
|
(209) | |
| 4f145d106s26p4 | |
Պոլոնիում (լատին․՝ Polonium), քիմիական տարր է, որի նշանն է Po և ատոմային թիվը՝ 84: Տարրերի պարբերական համակարգի 6-րդ պարբերության 6-րդ խմբի քիմիական տարր, p տարր է, ատոմի էլեկտրոնային թաղանթների կառուցվածքն է 5s25p65d106s26p4: К, L, M և N թաղանթները լրացված են: Պատկանում է հալոգենների խմբին: Պոլոնիումը սպիտակ-արծաթափայլ մետաղ է[4]:
Տարրը հայտնաբերվել է 1898 թվականին Մարի Կյուրիի և Պիեռ Կյուրիի կողմից: Այն հազվադեպ հանդիպվող և շատ ռադիոակտիվ տարր է, որը չունի լրացված շերտերով իզոտոպներ: Պոլոնիումը քիմիապես նման է բիսմութին և տելուրին ու հանդիպվում է ուրանի հանքաքարերում[5]:
Պարբերական աղյուսակում իր դիրքի պատճառով Պոլոնիումը երբեմն դասվում է որպես մետաղանման, բայց նրա հատկությունները և պահվացքը փաստում են, որ այն միանշանակ մետաղ է:
Պատմություն և անվան ծագում
Պոլոնիումը ռադիոակտիվ հատկությունների շնորհիվ հայտնաբերված աոաջին տարրն է: Պոլոնիումը հայտնաբերել են Պ․ Կյուրի և Մ․ Սկլադովսկայա-Կյուրի ամուսինները (1898)[6], ուրանի խեժահանքում[7] և անվանել Մ․ Սկլադովսկայա-Կյուրիի հայրենիքի՝ Լեհաստանի (լատին․՝ Polonia)[8][9] պատվին: Բնական ոլոնիումի՝ 2l0Po կշռելի քանակներն (0,15 գ) առաջին անգամ անջատվել են 212PO-ի քայքայման արդյունքներից:
Փորձնականորեն ռադիում Էֆ անվանված պոլոնիումը հայտնաբերել է Մարի Կյուրին 1898 թվականին և այն անվանվել է իր հայրենիքի` Հոլանդիայի անունով (Poland):
Այդ ժամանակ Հոլանդիան ռուսական, գերմանական և Ավստրո-Հունգարական տիրապետության տակ էին և գոյություն չունեին որպես անկախ երկրներ:
Կյուրին հույս ուներ, որ տարրը իր հայրենիքի անունով անվանելով՝ հայտնի կդառնար իրենց երկրում անկախության պակասը: Այն առաջին տարրն էր, որի անվանումը օգնեց կարևորել քաղաքական հակասություններ:
Այս տարրը Կյուրիների կողմից հայտնաբերված առաջին տարրն էր: Այն հայտնաբերվեց, երբ նրանք ուսումնասիրում էին Փիչբլենդ ռադիոակտիվության պատճառը: Փիչբլենդի միջից ռադիոակտիվ տարրերը՝ ուրանը ու թորիումը հանելուց հետո, ավելի ռադիոակտիվ է քան ուրանը ու թորիումը միասին: Այս գաղափարը ստիպեց Կյուրիներին հայթհայթել նոր ռադիոակտիվ տարրեր: 1898 թվականի հուլիսին նրանք փիչբլենդը առանձնացրեցին պոլոնիումից, և հինգ ամիս հետո նաև մեկուսացրեցին ռադիումը:
Բնության մեջ

Պոլոնիումը շատ հազվադեպ է հանդիպվում բնության մեջ, քանի որ իր բոլոր իզոտոպները ունեն շատ կարճ կես-կյանք: 210Po, 214Po, և 218Po գոյություն ունեն փտած 238U-ի մեջ: Պոլոնուոմի ռադիոնուկլիդները մտնում են հազվագյուտ ռադիոակտիվ շարքեր կազմի մեջ:
- 210Po (Т1/2 = 138,376 суток), 218Po (Т1/2 = 3,10 мин) и 214Po (Т1/2 = 1,643×10−4 с) - в ряд 238U;
- 216Po (Т1/2 = 0,145 с) и 212Po (Т1/2 = 2,99×10−7 с) - в ряд Th;
- 215Po (Т1/2 = 1,781×10−3 с) и 211Po(Т1/2 = 0,516 с) - в ряд 235U:
Պոլոնիումը հազվագյուտ տարր է, պարունակությունը երկրակեղևում 2·10−14 զանգված % է, ուրանի խեժահանքում մինչև 5,8 •10-5 %, հրաբխային ապարներում՝ մինչև 3•10-6 %:
Պոլոնիում-2 փոքր քանակությամբ գտնվում է բնության մեջ և կուտակվում է ծխախոտում[10][11][12]:
Պլոնիումի հայտնաբերվել է նաև սննդային շղթաներում, հատկապես ծովամթերքում[13][14]:
Ֆիզիկական հատկություններ
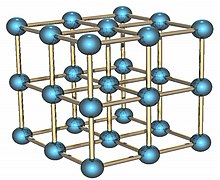
Պոլոնիումը փափուկ, սպիտակ արծաթափայլ ռադիոակտիվ մետաղ է, հալման ջերմաստիճանը՝ 254 °C, եռմանը՝ 1162 °C[15], խտությունը՝ 9300 կգ/մ3, 366°-ից բարձր առաջանում է պոլոնիումի β-ձևափոխությունը (9398 կգ/մ3):
Պոլոնիումը և նրա միացությունները չափազանց թունավոր են, միացություններից շատերը նաև ցնդող, որի հետևաքով քիմիական հատկություններն անբավարար են ուսումնասիրված:
Քիմիական հատկություններ
Քիմիական հատկություններով պոլոնիումը մոտ է տելուրին, մասամբ նաև բիսմութին: Միացություններում ունի 4-4, ավելի հազվադեպ -2, +3 և +6 օքսիդացման աստիճաններ: Լուծվում է թթուներում՝ անջատելով ջրածին:
Օդում տաքացնելիս (250°C) առաջացնում է PoO2: Ինդիկատորային (չկշռվող) քանակներով ստացվել են РоО3 և պոլոնիումական թթվի աղերը՝ պոլոնատները (օրինակ, K2PoO4): Հայտնի են նաև PoO օքսիդը, լուծույթում՝ Po2+, Po+4, PoO3-2, PoO4-2 իոնները, հիդրօքսիդը՝ Ро(ОН)2, հալոզենիդները՝ РоС12, РоВr2 և այլն, սուլֆիդը՝ PoS[16][17]:
| Բանաձև | Գույն | Հալման ջերմաստիճան (°C) | Սուբլիմացիան ջերմ. (°C) |
Սիմետրիա | Փիրսոն սիմվոլ | Բյուրեղագրաֆիկ խումբ | Ոչ | a (pm) | b(pm) | c(pm) | Z | ρ (գ/սմ3) | ref |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PoO2 | բաց դեղին | 500 | 885 | խորանարդ | cF12 | Fm3m | 225 | 563.7 | 563.7 | 563.7 | 4 | 8.94 | [19] |
| PoCl2 | մուգ կարմիր | 355 | 130 | շեղանկյուն | oP3 | Pmmm | 47 | 367 | 435 | 450 | 1 | 6.47 | [20] |
| PoBr2 | մանուշակագույն-շագանակագույն | 270 | [21] | ||||||||||
| PoCl4 | դեղին | 300 | 200 | մոնոցիկլիկ | [20] | ||||||||
| PoBr4 | կարմիր | 330 | Խորանարդ | cF100 | Fm3m | 225 | 560 | 560 | 560 | 4 | [21] | ||
| PoI4 | սև | [22] |
|
Օքսիդներ |
Հիդրիդներ |
Հալոիդներ
|
Կշռելի քանակներով ստացվել են քառահալոգենիդները և սուլֆատները, որոնք ջրում հիդրոլիզվում են: Հալոգենների հետ առաջացնում է տետրահալոգենիդներ: Թթուների ազդեցությամբ լուծվում է լուծույթներում, առաջացնելով Ро2+-ի վարդագույն գույին իոնը:
Սինթեզվել են պոլոնիում-օրգանական միացությունները՝ (C6H5)2Po, (СбН5)2РоС12 և այլն:
Մետաղական պոլոնիումը օդում արագ օքսիդանում է: Հայտնի են պոլոնիումի երկօքսիդը (РоО2)x և պոլոնիումի մոնօքսիդը РоО:
Պոլոնիումը մագնեզիումի առկայությամբ փոխազդում է աղաթթվի հետ առաջացնելով պոլոնոջրածին.
- ,
որոնք սենյակային ջերմաստիճանում գտնվում են հեղուկ վիճակում (−36,1 մինչև 35,3 °C)
Պոլոնիում ը հանդիսանում է միակ քիմիական տարրը, որը ցածր ջերմաստիճանում ձևավորում է միատոմանի, պարզ խորանարդ բյուրեղացանց[23]:
Ալֆա վիճակը պարզ խորանարդային կառուցվացքի միակ հայտնի օրինակն է մեկ ատոմի դեպքում, որի գագաթնային չափսերն են 335.2 պիկոմետր է, իսկ բետա վիճակը ռոմբոբջջրային[24][25][26]: Պոլոնիումի կառուցվացքը բնութագրվել է ռենտգենյան ճառագայթների և էլեկտրոնների օգնությամբ:
Իզոտոպներ
Պոլոնիումը ունի 33 հայտնի իզոտոպներ, որոնք բոլորը ռադիոակտիվ են: Հայտնի են 193-218 զանգվածի թվերով ռադիոակտիվ իզոտոպները, որոնցից ամենակայունը 209Po(T1/2 = 103 տարի) արհեստական իզոտոպն է: Բնության մեջ հանդիպում են 210-212, 214-216 և 218 զանգվածի թվերով իզոտոպները, առաջանում են որպես բնական ռադիոակտիվ շարքերի անդամներ: Նրանց հարաբերական ատոմային զանգվածները տատանվում են 188-ից 220: 210Po-ը (կես կիանք-138.376 օր) և բոլոր իզոտոպներից ամենատարածվածն է: Իսկ ամենաերկարակյաց իզոտոպը 209Po-ը (կես կյանք125.2 ± 3.3 տարի) և 208Po-ը (կես կյանք 2.9 տարի): Պոլոնիումի կայուն իզոտոպներ հայտնի չեն:[3]: Ամենակայունը բնական իզոտոպն է՝ 210Po(T1/2= 138 օր, α-ճառագայթիչ, փոխարկվում է 206Рb-ի) որն աննշան քանակներով կուտակվում է ուրանի հանքերում, մշտապես ուղեկցում ռադիումին և նրա միացություններին:
208Po-ը կարող է ստացվել հատուկ անօդի մեջ կապարի կամ բիսմութի ալֆա, պրոտոն կամ դեյտրոն ռմբակոծումից:Պինդ վիճակ
Պոլոնիումը ռադիոակտիվ տարր է, որը գոյություն ունի երկու մետաղական ալոտրոպներում:
| Իզոտոպ | Անվանում | Նշան | Ռադիոակտիվ շարք |
|---|---|---|---|
| 210Po | Ռադիում F | RaF | 238U |
| 211Po | Ակտինիում C' | AcC' | 235U |
| 212Po | Թորյում C' | ThC' | 232Th |
| 214Po | Ռադիում C' | RaC' | 238U |
| 215Po | Ակտինիում A | AcA | 235U |
| 216Po | Թորիում A | ThA | 232Th |
| 218Po | Ռադիում A | RaA | 238U |
Ստացում
Պոլոնիումը (210Ро) միլիգրամային քանակներով ստանում են միջուկային ռեակտորներում՝ բիսմութը նեյտրոններով ճառագայթելով:
2006 թվականին բրիտանացի գիտնական և գրող Ջոն Էմսլի հաստատմամբ, այդ տարվա ընթացքում արտադրվել է մոտ 100 գրամ 210Ро-ում.[27]:
Արժեք
Ըստ բրիտանացի փորձագետների, պոլոնիումի-210 մանրադիտակային դոզան արժի միլիոնավոր ԱՄՆ դոլլարներ[28]: Մյուս կողմից, ռադիոքիմիկոսների հաստատմամբ բիսմութից ստացված պոլոնիումի-210 շատ էժան է[29]: Համաձայն 2006 թվականի տվյալների արտադրված պոլոնիումի-210-ի 9,6 գրամի համար վճարվում էր շուրջ 10 մլն ռուբլի[30], որը համընկնում է տրիտիումի գնի հետ[31]:
Սակայն ամերիկյան United Nuclear ընկերություն, ստանալով իզոտոպը Ռուսաստանում, 2006 թվականին պոլոնիումի նմուշները վաճառեց $69 գնով, պնդելով որ մահացու դոզայի համար կպահանջվի ավեի քան $1 միլիոն դոլլար[32]:
Միացություններ
Պոլոնիումը չունի հասարակ միացություններ և իր գրեթե բոլոր միացությունները արհեստականորեն են պատրաստվում: Այդ միացություններիցավելի քան 50-ը ճանաչված են: Պոլոնիումի ամենակայուն միացությունները պոլոնիդներն են, որոնք պատրաստվում են երկու տարրերի անմիջական փոխազդեցությունից: Na2Po-ը ունի անտիֆլոռիտ կառուցվացքը, Ca, Ba, Hg, Pb տարրերի պոլոնիդների և լանթինադների փոխազդեցությունից առաջանում է NaCl-ի ցանցեր, իսկ BePo-ը և CdPo-ը ունեն ուըրտզիտ և MgPo-ը նիկել արսենիդ կառուցվացքը:
Կիրառություն
Պոլոնիումային հիմքով ալֆա մասնիկների աղբյուրները առաջացել էին ԽՍՀՄ-ում: Այսպիսի աղբյուրներ օգտագործվում էին արդյունաբերական ծածկույթների հաստությունը որոշելու համար:
Պոլոնիումի կիրառությունները քիչ են: Այն օգտագործվում է տիեզերագնաց և հակաստատիկ սարքերի պատրաստման մեջ: Նաև հանդիսանում է նեյրոնների և ալֆա մասնիկների աղբյուր:
Թունավորություն
210Po բնական ռադիոակտիվ նստվածքի սովորական բաղադրիչն է, որը արմատների և վերգետնյա օրգանների միջոցով անցնում է բույսին: Մարդու և կենդանիների օրգանիզմ է ներմուծվում սննդի հետ․ թեյը պարունակում է 500-600․ ծովային ձուկը՝ 20-100, միսը՝ 2-3, ձավարեղենը՝ 2, հացը՝ 1 պԿյուրի/կգ:
Մարդու և կենդանիների հյուսվածքներում պոլոնիումի պարունակությունը մոտ 4•10-2 պԿյուրի/կգ է: Նրա այդպիսի փոքր քանակների կենսաբանական ներգործությունը վատ է ուսումնասիրված, մեծ քանակները α-ճառագայթման պատճառով ազդում են բազմաթիվ օրգանների վրա:
Պոլոնիում-210-ից թունավորման դեպքեր
- Ալեքսանդր Վալտերովիչ Լիտվինենկոն 2006 թվականին մահացել է պոլոնիում-210-ի թունավորումից:
Պոլոնիումը հայտնաբերվել է Յասեր Արաֆաթի անձնական իրերում, ով մահացել է 2004 թվականին: Որոշվել է անցկացենել արտաշիրիմում[33]: Սկզբում շվեյցարական միջազգային հանձնաժողովը հաստատեց, այն փաստը, որ թունավորվել է պոլոնիումով[34]: Ավելի ուշ ռուսական և ֆրանսիական կողմերի արդյունքների եզրակացության համաձայն թունավորման ոչ մի ապացույց չկար[35]:
Տես նաև
Ծանոթագրություններ
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report)(անգլ.) // Pure and Applied Chemistry. — 2013. — Т. 85. — № 5. — С. 1047-1078. —
- ↑ «Polonium: physical properties» (անգլերեն). WebElements. Վերցված է 2013-08-28-ին.
- ↑ 3,0 3,1 Редкол.:Зефиров Н. с. (гл. ред.) Химическая энциклопедия: в 5 т. — 1999. — Т. 5.
Քաղվածելու սխալ՝ Սխալ
<ref>թեգ. «ХЭ» անվանումը սահմանվել է մի քանի անգամ, սակայն տարբեր բովանդակությամբ: - ↑ Полоний - статья из Большой советской энциклопедии
- ↑ E. Rutherford. Radioactive Substances and Their Radiations. — Лондон: Forgotten Books. — С. 20. — 699 с. — ISBN 1451001983, 9781451001983
- ↑ Curie, P.; Curie, M. (1898). «Sur une substance nouvelle radio-active, contenue dans la pechblende» (PDF). Comptes rendus (ֆրանսերեն). 127: 175–178.
{{cite journal}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (օգնություն) English translation. - ↑ E. Rutherford. Radioactive Substances and Their Radiations. — Лондон: Forgotten Books. — С. 20. — 699 с. — ISBN 1451001983, 9781451001983
- ↑ Pfützner, M. (1999). «Borders of the Nuclear World – 100 Years After Discovery of Polonium». Acta Physica Polonica B. 30: 1197. Bibcode:1999AcPPB..30.1197P.
- ↑ Adloff, J. P. (2003). «The centennial of the 1903 Nobel Prize for physics». Radichimica Acta. 91 (12–2003): 681–688. doi:10.1524/ract.91.12.681.23428.
- ↑ Tobacco Smoke / EPA Radiation Protection (անգլ.): "tobacco leaves used in making cigarettes contain radioactive material, particularly lead-210 and polonium-210."
- ↑ Source of Lead-210 and Polonium-210 in Tobacco / Science 19 August 1966: Vol. 153 no. 3738 pp. 880-882 DOI: 10.1126/science.153.3738.880
- ↑ Waking a Sleeping Giant: The Tobacco Industry’s Response to the Polonium-210 Issue / Am J Public Health. 2008 September; 98(9): 1643–1650. doi:10.2105/AJPH.2007.130963
- ↑ Ota, Tomoko; Sanada, Tetsuya; Kashiwara, Yoko; Morimoto, Takao; և այլք: (2009). «Evaluation for Committed Effective Dose Due to Dietary Foods by the Intake for Japanese Adults». Japanese Journal of Health Physics. 44: 80–88. doi:10.5453/jhps.44.80.
{{cite journal}}: Unknown parameter|last-author-amp=ignored (|name-list-style=suggested) (օգնություն) - ↑ Smith-Briggs, JL; Bradley, EJ (1984). «Measurement of natural radionuclides in U.K. diet». Science of the Total Environment. 35 (3): 431–40. doi:10.1016/0048-9697(84)90015-9. PMID 6729447.
- ↑ Wąs, Bogdan; Misiak, Ryszard; Bartyzel, Mirosław; Petelenz, Barbara (2006). «Thermochromatographic Separation of 206,208Po from a Bismuth Target Bombardet with Protons» (PDF). Nukleonica. 51 (Suppl. 2): s3–s5.
- ↑ Figgins, P. E. (1961) The Radiochemistry of Polonium, National Academy of Sciences, US Atomic Energy Commission, pp. 13–14 Google Books
- ↑ Bagnall, pp. 212–226
- ↑ Wiberg, Egon; Holleman, A. F. and Wiberg, Nils Inorganic Chemistry, Academic Press, 2001, p. 594, ISBN 0-12-352651-5.
- ↑ Bagnall, K. W.; d'Eye, R. W. M. (1954). «The Preparation of Polonium Metal and Polonium Dioxide». J. Chem. Soc: 4295–4299. doi:10.1039/JR9540004295.
- ↑ 20,0 20,1 Bagnall, K. W.; d'Eye, R. W. M.; Freeman, J. H. (1955). «The polonium halides. Part I. Polonium chlorides». Journal of the Chemical Society (Resumed): 2320. doi:10.1039/JR9550002320.
- ↑ 21,0 21,1 Bagnall, K. W.; d'Eye, R. W. M.; Freeman, J. H. (1955). «The polonium halides. Part II. Bromides». Journal of the Chemical Society (Resumed): 3959. doi:10.1039/JR9550003959.
- ↑ Bagnall, K. W.; d'Eye, R. W. M.; Freeman, J. H. (1956). «657. The polonium halides. Part III. Polonium tetraiodide». Journal of the Chemical Society (Resumed): 3385. doi:10.1039/JR9560003385.
- ↑ Игорь Иванов. (12.07.07). «Разгадана загадка полония» (ռուսերեն). էջ 1. Արխիվացված է օրիգինալից 2011-08-22-ին. Վերցված է 2010-05-04-ին. «Вычисления, проведенные чешскими исследователями, дали ответ на вопрос, давно мучивший физиков: почему полоний предпочитает кубическую кристаллическую решетку?»
- ↑ Greenwood, p. 753
- ↑ Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry (3rd ed.). Upper Saddle River, N.J.: Pearson Prentice Hall. էջ 285. ISBN 0-13-120198-0.
- ↑ «The beta Po (A_i) Structure». Naval Research Laboratory. 2000-11-20. Արխիվացված է օրիգինալից 2001-02-04-ին. Վերցված է 2009-05-05-ին.
- ↑ Q&A: Polonium-210, Royal Society of Chemistry, 27 November 2006
- ↑ «Дело Литвиненко: Россия причастна "так или иначе"», Би-Би-Си, 31 июля 2015
- ↑ Зачем был нужен полоний?, «Троицкий вариант», 10 февраля 2015 года.
- ↑ Когда полоний призвали на службу, Российская газета, 31 июля 2015 года
- ↑ Is fusion power really viable?, Би-Би-Си, 5 марта 2010
- ↑ Человек, пораженный полонием-210, не может оставлять после себя следы, РИАНОВОСТИ, 11 декабря 2006 г.
- ↑ «Останки Ясира Арафата извлекли из мавзолея». Лента.Ру. 2012-11-27. Արխիվացված է օրիգինալից 2013-08-13-ին. Վերցված է 2013-08-09-ին.
- ↑ «Экспертиза подтвердила, что Арафата отравили полонием». РИА Новости. 6.11.2013. Վերցված է 2013-11-08-ին.
- ↑ «Российские медики: Арафат умер свой смертью». 2013-12-26.
Գրականություն
- Bagnall, K. W. (1962). «The Chemistry of Polonium». Advances in Inorganic Chemistry and Radiochemistry. Vol. 4. New York: Academic Press. էջեր 197–226. doi:10.1016/S0065-2792(08)60268-X. ISBN 0-12-023604-4. Վերցված է June 14, 2012-ին.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 0080379419.
Արտաքին հղումներ
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Polonium
- Polonium at The Periodic Table of Videos (University of Nottingham)
- Gesundheits- und Umweltaspekte von Polonium
- Polonium-210 – In tödlicher Mission
- Verfahren zur Bestimmung von Polonium-210 in Urin in einem radiochemischen Labor des Forschungszentrums Jülich
| Պարբերական աղյուսակ | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից։ |




