Մասնակից:Narine Man/Ավազարկղ
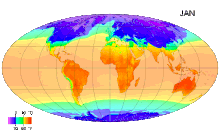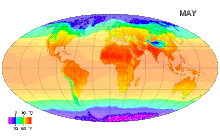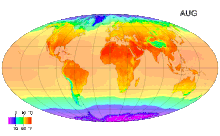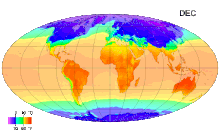
Ջերմաստիճան (լատ. temperatura - պատշաճ խառնուրդ, նորմալ վիճակ,) ֆիզիկական մեծություն, որը բնութագրում է թերմոդինամիկական համակարգը և աստիճանաբար արտահայտում է մարմնի տարբեր աստիճանի ջերմության ներըմբռնումհասկացությունը:
Կենդանի օրգանիզմները կարող են ուղակիորեն ջերմության և սառնության զգացողությունները զգալ զգայարանների միջոցով: Այնուամենայնիվ, ջերմաստիճանի ճշգրիտ որոշումը պահանջում է, որ ջերմաստիճանը չափվի օբյեկտիվորեն օգտագործելով որոշակի գործիքներ: Նման սարքերը կոչվում են ջերմաչափեր և չափում են այսպես կոչված էմպիրիկ ջերմաստիճանը: Էմպիրիկ սանդղակով ջերմաստիճանը որոշվում է 2 հիմնարար կետերի միջև եղած ստորաբաժանումների քանակով, այդպես են ստեղծված կիրառվող Ցելսյուսի սանդղակը, ֆարենհայտի և ուրիշների սանդղակները: Կելվինի սանդղակով ջերմաստիճանը որոշվում է մեկ հիմակետի միջոցով[1] հաշվի առնելով այն հանգամանքը,որ բնության մեջ կա մի նվազագույն սահմանաչափ՝ բացարձակ զրո: Վերին ջերմաստիճանը սահմանափակում է Պլանկի ջերմաստիճանը:
Եթե համակարգը գտնվում է ջերմային հավասարակշռության մեջ, ապա նրա բոլոր մասերի ջերմությունը նույնն է: Հակառակ դեպքում համակարում էներգիան փոխանցվում է ավելի ջեռուցված մասերից դեպի ավելի քիչ ջերմացնող մասերը, ինչը հանգեցնում է ջերմաստիճանի հավասարեցմանը համակարգում և նրանք համապատասխանում են ջերմաստիճանի բաշխման համակարգում կամ ջերմաստիճանի սկալյար դաշտում: Ջերմադինամիկայում ջերմաստիճանը ինտենսիվ թերմոդինամիկ մեծություն է:
Թերմոդինամիկայի հետ մեկտեղ, ֆիզիկայի այլ բաժիններում կարող են ներկայացվել ջերմաստիճանի որոշման այլ եղանակներ: Մոլեկուլային-կինետիկ տեսությունում ցույց է տրված, որ ջերմաստիճանը համամասնական է համակարգի մասնիկների միջին քանակային էներգիային: Ջերմաստիճանը որոշում է մասնիկների բաշխումը էներգետիկ համակարգի մակարդակներում (տե՛ս Մաքսվել- Բոլցմանի վիճակագրություն), մասնիկների բաշխման արագությունները (Տես, Մաքսվելի բաշխումը), իոնացման աստիճանը (տես, Սախայի հավասարում), արտանետումների սպեկտրային խտությունը (տես Պլանկի ճառագայթման օրենք), ամբողջական ճառագայթման խտությունը (տես, Ստեֆան-Բոլցմանի օրենք) և այլն: Բոլցմանի բաշխման պարամետրերի մեջ մտնող ջերմաստիճանները հաճախ կոչվում են շարժման ջերմաստիճան, Սահայի բանաձևը՝ իոնացման ջերմաստիճան և Ստեֆանի- Բոլցմանի օրենքը՝ ճառագայթային ջերմաստիճան: Թերմոդինամիկ հավասարակշռության համակարգում այս բոլոր պարամետրերը հավասար են միմյանց և կոչվում են պարզապես ջերմաստիճանային համակարգ[2]:
Միջազգային միավորների համակարգում (անգլ. International System of Quantities, ISQ) ջերմաստիճանը ընտովեւմ է, որպես համակարգի յոթ հիմնական ֆիզիկական մեծություններից մեկը: Միավորների միջազգային համակարգում (SI) Կելվինի ջերմաստիճանը համարվում է յոթ հիմանական սորաբաժանումներից մեկը SI [3]: SI համակարգում եւ գործնականում կիրառվում ևնաեւ Ցելսիուսի ջերմաստիճանը, որի միավորը Ցելսիուսի սանդղակում (° C) աստիճանն է, հավասար է Կել ինին[4]: Սա հարմար է, քանի որ Երկրի կլիմայական առավելագույն գործընթացները ընթանում են բնական պայմաններում, -50-ից +50 °C-ի պայմաններում:

Ջերմաստիճանը որպես տեղական պարամետր: Ջերմաստիճանային դաշտ:[խմբագրել | խմբագրել կոդը]
Խտացված նյութի ֆիզիկական ջերմաստիճանը դիտարկում են, որպես տեղային մակրոսկոպիկ փոփոխական, այսինքն, շրջակա միջավայրի մոտավոր հատկացված տարածքի տարրական ծավալը բնութագրող արժեքը,որի չափերը անսահման փոքր է քան միջավայրի անհամապատասխանությունները և անսահմանորեն մեծ են միջավայրի մասնիկների (ատոմներ, իոնների, մոլեկուլներ և այլն) չափերից[5]: Ջերմաստիճանը կարող է փոփոխվել մի կետից մյուսը (մեկ տարրական ծավալից մյուսը ), տիեզերքում ջերմաստիճանի որոշումը տվյալ ժամանակում կատարվում է սկալյարային դաշտով (ջերմաստիճանի դաշտ )[6]:
Ջերմաստիճանային դաշտը կարող է լինել անկայուն (ժամանակի ընթացքում փոփոխվող), և կախված չէ ժամանակի կայունությունից: Միևնույն ջերմաստիճանի արժեքն ունեցող միջավայրը բոլոր կետերում համարվում է ջերմայինորեն համասեռ: Մաթեմատիկական առումով, ջերմաստիճանը բնութագրվում է ջերմաստիճանի կախվածության հավասարման միջոցով T՝ տարածական կոորդինատներով (Երբեմն դիտարկում են մեկ կամ երկու կոորդինատներ) և ժամանակով: Ջերմային համասեռ համակարգերի համար, T=0:
Թերմոդինամիկ սահմանումը[խմբագրել | խմբագրել կոդը]
Թերմոդինամիկ մոտեցման պատմություն[խմբագրել | խմբագրել կոդը]
«Ջերմաստիճան» բառը ծագեց այն օրերին, երբ մարդիկ հավատում էին, որ ավելի շատ ջերմային մարմիններում կա ավելի շատ հատուկ նյութ`ջերմություն, քան ավելի քիչ ջերմացվում է: Հետեւաբար, ջերմաստիճանը ընկալվեց որպես մարմնի և ջերմության խառնուրդի ուժ: Այդ պատճառով ալկոհոլի և ջերմաստիճանի ուժեղ միավորները կոչվում են նույն աստիճաններ:
Ջերմադինամիկական հավասարակշռության պայմաններում ջերմաստիճանը նույն արժեքն ունի համակարգի բոլոր մակրոսկոպիկ մասերի համար: Եթե երկու մարմիններն ունեն նույն ջերմաստիճանը համակարգում, ապա մասնիկների կինետիկ էներգիան (ջերմաքանակ)նրանց մևեւ չի փոխանցվում: Եթե կա ջերմաստիճանի տարբերություն, ապա ջերմության փոխանցումը տեղի է ունենում ավելի բարձր ջերմաստիճանի մարմնից դեպի ավելի ցածր ջերմաստիճանի մարմնը:
Ջերմությունը նույնպես կապված է ջերմության և ցրտի զգացողության հետ, այսինքն կապված կենդանի հյուսվածքից ստանում է ջերմություն կամ տալիս է այն:
Որոշ քվանտային մեխանիկական համակարգեր (օրինակ, լազերային աշխատանքային մարմինը, որտեղ առկա են ներկառուցված մակարդակները) կարող է լինել այնպիսի պետությունում, որտեղ էնտրոպիան չի աճում, բայց նվազում է էներգիայի ավելացման հետ, որը պաշտոնապես համապատասխանում է բացասական բացարձակ ջերմաստիճանի: Այնուամենայնիվ այսպիսի վիճակը գտնվում է «բացարձակ զրոյից ցածր», բայև«վերեւում անսահմանություն», քանի որ այս համակարգի շփումը մաշկի հետ է ջերմային էներգիան փոխանցբում է համակարգից մարմնին, բայց հակառակը տեղի չի ունենում (տես, բացարձակ ջերմաստիճանը):
Ջերմաստիճանի հատկությունները ուսումնասիրվում են ֆիզիկայի բաժնում`թերմոդինամիկայում: Ջերմաստիճանը նույնպես կարևոր դեր է խաղում գիտության բազմաթիվ ոլորտներում, այդ թվում` ֆիզիկայի այլ ճյուղերում, ինչպես նաև քիմիայում և կենսաբանությունում:
Հավասարակշռված և անհավասարակշռված ջերմաստիճան[խմբագրել | խմբագրել կոդը]
Թերմոդինամիկական համակարգը, որը գտնվում է թերմոդինամիկական համակարգի հավասարակշռության վիճակում, ունի կայուն ջերմաստիճանի դաշտ: Եթե նման համակարգում գոյություն չունեն ադիաբատիկ (էներգակիրային) բաժանմունքներ, ապա համակարգի բոլոր մասերը նույն ջերմաստիճանը ունեն: Այլ կերպ ասած, ջերմային համասեռ համակարգի հավասարակշռման ջերմաստիճանն անմիջապես կախված չէ կախվածությունից (բայց կարող է տարբեր լինել քվազի-ստատիկ գործընթացներում): Ընդհանուր գործողության մեջ անհավատարմային համակարգ ունի ոչ կայուն ջերմաստիճանի դաշտ, որի միջավայրի յուրաքանչյուր տարրական ծավալը ունի իր անհավասարակշռող ջերմաստիճանը, որը կախված է իր ժամանակից:
Ֆենոմենոլոգիական թերմոդինամիկայի ջերմաստիճան[խմբագրել | խմբագրել կոդը]
Ֆենոմենոլոգիական ջերմոդինամիկայում ջերմաստիճանի որոշումը կախված է տվյալ կարգի մաթեմատիկական ապարատի կառուցվածքի մեթոդից (տես,Թերմոդինամիկայի ակսիոմատիկա):
Ֆենոմենոլոգիական թերմոդինամիկայում ջերմաստիճանը կախված է մաթեմատիկական ապարատի կառուցումով (տես Թերմոդինամիկայի ակսիոմատիկա):Թերմոդինամիկական ջերմաստիճանի սահմանումների տարբերությունները տարբեր համակարգերում թերմոդինամիկայի կառուցումը չի ենթադրում ավելի մեծ տեսանելիություն որոշ նման համակարգերի համեմատ,բոլոր այդ համակարգերում առաջին հերթին ջերմաստիճանը նկարագրելու համար դիտարկվում է տաքացվածության աստիճանը/մարմնի սառեցմանը, և երկրորդ իմաստալից սահմանումը, որը ստեղծում է կապ թերմոդինամիկական ջերմաստիճանի և նրա չափման համար կիրառվող ջերմաստիճանները համնկնում են:
Ռացիոնալ թերմոդինամիկայում առաջին հերթին հրաժարվելով այդ կարգու կանոնից բաժանվում են թերմոդինամիկական հավասարակշռության և թերմոդինամիկական անհավասարակշռության մեջ (այսինքն, չկատարելու հավասարակշռությաևեւ հավասարակշռության ջերմաստիճանների մևեւ տարբերություն), ջերմաստիճանը նախնական չճանաչելի փոփոխական է, նկարագրվում են միայն այն հատկություններով, որոնք կարող են արտահայտվել մաթեմատիկայի լեովվ: [7]ով Էներգիայի, ջերմության, էնտրոպիական և քիմիական պոտենցիալ հասկացությունները ռացիոնալ թերմոդինամիկայում ներկայացվում են միաժամանակ. սկզբունքորեն նրանք անհատապես չեն կարող որոշվել: Այս հասկացությունների ներդրման մեթոդը ցույց է տալիս, որ հաշվի են առնվում տարբեր էներգետիկ հոսքերին համապատասխանող տարբեր ջերմաստիճանները: Օրինակ, մենք կարող ենք ներկայացնել տրանսֆորմացիոն և սպինորային ջերմաստիճաններով, ճառագաայիլ|ջերմաստիճանին և այլն[8]։
Զրոյական սկիզբը (օրենքը) ներկայացնում է թերմոդինամիկական հավասարակշռման էմպիրիկական ջերմաստիճանի հասկացթյոււ նը[9][10][11][12] , որպես պետությունների պարամետր, որի բոլոր կետերում հավասարությունը ջերմային հավասարակշռության պայման է առանց համակարգային բաժանման առանցքային համակարգում:
Ռ.Կ Կլաուզիուսի հևեւորդների կողմից օգտագործվող տերմոդինամիկայի կառուցման մոտեցման մեջ հավասարակշռության պարամետրերը`տերմոդինամիկային ջերմաստիճանը T- ն եւ էնտրոպիան S- ը որոշում են թերմոդինամիկային պարամետրը:
| (Թերմոդինամիկական ջերմաստիճանը և էնտրոպիան, ըստ Կլաուզիուսի) |
որտեղ - ն տարրական (անսահմանափակ) հավասարակշռման գործընթացում ստացված կամ տրամադրված ջերմության քանակն է փակ համակարգում: Ավելին, ըստ Կլաուզիուսի[13] համաձայն ջերմոդինամիկ ջերմաստիճանի հասկացությունը տարածվում է բաց համակարգերի և օրենքների շարքում լրացուցիչ ակիոմներ ներառելու հարցը:
Կարատեոդիալ ակսիոմատիկայում - ն [14][15] համարվում է, որպես դիֆերենցիալ Պֆաֆֆյան ձև, իսկ հավասարակշռության թերմոդինամիկ ջերմաստիճանը, որպես այս դիֆերենցիալ ձևի ինտեգրող բաժանարար[16] :
Ա.Ա. Գուխմանի ակսիոմաների համակարգում[17][18] համակարգի ներքին էներգիայի փոփոխությունը տարրական հավասարակշռության գործընթացում արտահայտվում է փոխգործակցության ներուժով՝ , և պետական կոորդինատներով՝ :
| (Գուխմանի հավասարում) |
Ջերմային ներուժը հանդիսանում է թերմոդինամիկական ջերմաստիճանը , իսկ ջերմային կոորդինատը՝ էնտրոպիան՝ . ճնշումը (հակառակ նշանով) դեր է խաղում մեխանիկական դեֆորմացիայի փոխազդեցության ներդաշնակության, հեղուկների և գազերի ներգործության համար, և ճնշման ծավալը համադրում է որպես ծավալ: քիմիական և փուլային անցումների համար պետական կոորդինատներն ու պոտենցիալները, և դրանց հետ կապված քիմիական ներուժը բաղադրիչների զանգվածներն են: Այլ կերպ ասած, Գուխմանի ակսիոմատիկայում, ըստ Գիբբսի հավասարման թերմոդինամիկայում ջերմաստիճանը և քիմիական պոտենցիալները հավասարապես հավասարակշռում են: Օգտագործվում է Գուխմանի և նրա հետեւորդների կողմից առաջարկված պետական համակարգը, որը երկրաչափական, մեխանիկակաևեւ էլեկտրամագնիսական փոփոխականներից բացի իր մեջ ներառում է տարրերի էնտրոպիան և զանգվածը, և բացառում է ընդհանրացված թերմոդինամիկական կոորդինատների հետ կապված երկիմաստությունը. Որոշ հեղինակներ առնչվում են ընդհանրացված համակարգերի փոփոխականներին՝ Էնտրոպիաին և զանգվածին[19], իսկ մյուսները սահմանափակվում են երկրաչափական, մեխանիկական և էլեկտրամագնիսական փոփոխականներով[20]:
Գիբբսի թերմոդինամիկայում հավասարակշռության ջերմաստիճանը արտահայտվում է ներքին էներգիայով և էնտրոպիայով[21][22][23]:
| (Թերմոդինամիկական ջերմաստիճանը, ըստ Գիբսի) |
որտեղ -ն ներքին էներգիայի բնական փոփոխականների (առանց էնտրոպիա) սահմանումն է, որպես բնորոշ գործընթաց: Համակարգի բոլոր կետերում ջերմաստիճանի հավասարությունը, առանց ադրբիատիկ ճնշման, որպես Գիբսսի թերմոդինամիկային ջերմային հավասարակշռության պայման, բխում է ներքին էներգիայի հատկություններից և թերմոդինամիկ հավասարակշռության վիճակում գտնվող էնթրոպիայից:
Ֆալկի եւ Յունգի ակսիոմատիկան, էնտրոպիայի որոշման ժամանակ, չի զիջում հավասարակշռության և հավասարակշռված պետությունների միջև, և, հետեւաբար, այս համակարգում տեղադրված ջերմաստիճանի և ներքին էներգիայի սահմանման համար ջերմաստիճանի սահմանումը հավասարապես կիրառելի է ցանկացած ջերմային համասեռ համակարգերի համար.
| (Թերմոդինամիկական ջերմաստիճանը, ըստ Ֆալկի և Յունգի) |
որտեղ -ն անկախ էնտրոպիայի փոփոխականների սահմանն է (որը չի պարունակում ներքին էներգիա):
Լոկալ հավասարակշռության սկզբունքը թույլ է տալիս ոչ հավասարակշռված համակարգերին փոխարինել ջերմաստիճանի սահմանումը հավասարակշռության տերմոդինամիկայից եւ օգտագործել այս փոփոխականը, որպես միջավայրի տարրական ծավալի անխափան ջերմաստիճան[24].:
Լոկալ անհավասարակշռության սկզբունքի մերժման հիման վրա ընդլայնված տատանումային տերմոդինամիկայի (RNT) պայմաններում անհավասարակշռող ջերմաստիճանը տրվում է Ֆալկի և Յունգի ակսիոմատկայի (տես Ֆալկի և Յունգի Թերմոդինամիկ ջերմաստիճան[25]) օգտագործման հետ կապված հարաբերության հետ, այլ ընդարձակ մուտանտի տարբեր փոփոխականների հետ: Գիբսի տեղական հավասարակշռված ջերմաստիճանի պայմաններում տարբերում են նաև RNT- ի անհավասարակշռված ջերմաստիճանի ընտրությամբ կախված էնտրոպիայի փոփոխությունից [25]:
Ն. Ի. Բելոկոնի [26] ակսիոմատիկայում ջերմաստիճանի նախնական որոշումը հետևում է Բելոկոնի պոստուլից, որը կրում է հետևյալ անվանումը՝ ջերմաքանակի երկրորդ սկզբունքի պոստուլիտը: Ջերմաստիճանը մարմինների վիճակի միակ գործառույթն է, որը որոշում է այդ մարմինների միջև ինքնաբուխ ջերմության փոխանակման ուղղությունը, այսինքն` ջերմային հավասարակշռության մարմինները նույն ջերմաստիճանը ունեն ցանկացած ջերմաստիճանի մասշտաբով: Հևեւաբար, երկու մարմինները, որոնք չունեն ջերմային կոնտակտներ միմյանց հետ, սակայն նրանցից յուրաքանչյուրը ջերմային հավասարման մեջ երրորդի (չափիչ սարքի) հետ, ապա ունեն նույն ջերմաստիճանը:
Էմպիրիկական, բացարձակ և թերմոդինամիկ ջերմաստիճան[խմբագրել | խմբագրել կոդը]
Ջերմաստիճանը չի կարող ուղղակիորեն չափվել: Ջերմաստիճանի փոփոխությունները գնահատվում են մարմնի այլ ֆիզիկական հատկությունների փոփոխություններով (ծավալ, ճնշում, էլեկտրական դիմադրություն, ճառագայթման ինտենսիվություևեւ այլն), որը միանգամայն կապված է դրա հետ (այսպես կոչված, ջերմաչափական հատկություններ): Քանակականորեն, ջերմաստիճանը որոշվում է`ցույց տալով, թե ինչպես է այն չափվում ջերմաչափով: Նման որոշումը չի ամրագրում կամ հաշվետվության սկիզբը կամ ջերմաստիճանի միավորի չափումը, այնպես որ ջերմաստիճանի չափման ցանկացած մեթոդ կապված է ջերմաստիճանային ցուցիչի ընտրության հետ: Էմպիրիկական ջերմաստիճանը չափվում է ընտրված ջերմաստիճանում:
Թերմոդինամիկ ջերմաստիճանի որոշման ֆենոմենոլոգիական թերմոդինամիկան կախված չի չափման համար օգտագործվող ջերմաչափային գույքի ընտրությունից: Ջերմաստիճանի փոփոխությունը սահմանվում է թերմոդինամիկական ջերմաստիճանային սանդղակի օգնությամբ:
Թերմոդինամիկայում, որպես ակսիոմ, ենթադրությունը հիմնված է այն փորձի վրա, որ հավասարակշռության թերմոդինամիկ ջերմաստիճանը քանակական էբոլոր միակողմանի համակարգերի համար, ինչպես նաև ջերմաստիճանը համապատասխան այս ինտերֆեյսի նույնն է բոլոր թերմոդինամիկական համակարգերի համար, հետեւաբար, կարող է օգտագործվել որպես բնական ստուգիչ տվյալկետում ջերմաստիճանի ստուգման համար:Եթե տվյալ կետում ջերմաստիճանը զրոյական արժեք ունի է ջերմաստիճանի, ապա ջերմաստիճանային սանդղակի հիման վրա նույն տեղեկանքում միշտ կունենա նույն նշանը[27]: Երկրորդ կետին դրական ջերմաստիճանի արժեքը սահմանելով` դրական ջերմաստիճանի բացարձակ ջերմաստիճան է տրվում, բացարձակ զրոյից չափվող ջերմաստիճանը կոչվում է բացարձակ ջերմաստիճան: Հետեւաբար, բացարձակ զրոյից չափվող թերմոդինամիկ ջերմաստիճանը կոչվում է բացարձակ թերմոդինամիկական ջերմաստիճան (տես, Կելվինի ջերմաստիճանը)[28]: Բացարձակ զրոյից ջերմաստիճանի ընթերցմամբ էմպիրիկ ջերմաստիճանի օրինակ է միջազգային գործնական ջերմաստիճանի մասշտաբը:
Ցելսիուսի ջերմաստիճանի մասշտաբը բացարձակ չէ:
Բացարձակ ջերմաստիճանի որոշումը որոշ հեղինակների կարծիքով կախված չէ բացարձակ զրոյից, այլ կախված է ջերմաստիճանային ցուցնակներից և չափման համար օգտագործվող ջերմաչափային գույքի ընտրությունից[29][30]:
Բացասական բացարձակ ջերմաստիճանները[խմբագրել | խմբագրել կոդը]
Հավասարակշռված թերմոդինամիկ բացարձակ ջերմաստիճանը միշտ դրական է (տես էմպիրիկ, բացարձակ և թերմոդինամիկական ջերմաստիճանները): Բացասական ( Կելվինի մասշտաբով) ջերմաստիճանի օգտագործումը հարմար մաթեմատիկական մեթոդ է, որը հատուկ է առանձնահատկություններ ունեցող անհավասարակշիռ համակարգերը նկարագրելու համար [31]: Այս մեթոդը բաղկացած է մտավոր բաժանման մեջ ֆիզիկական համակարգի մի մասնիկ ունեցող առանձնահատկություններ ունեցող օբյեկտների անկախ ենթահամակարգերից և ձեռք բերված մասնակի ենթահամակարգի առանձին հետազոտություններից: Այլ կերպ ասած, տիեզերքի նույն ծավալը համարվում է միաժամանակ զբաղված երկու կամ ավելի մասնակի ենթահամակարգերի կողմից, որոնք միմյանց հետ խոցելի են: Այս մոտեցման օրինակ է մագնիսական դաշտում բյուրեղի միջուկային պտույտների դիտարկումը, որը կախված է թույլ բյուրեղյա վանդակի ջերմային թրթռումներից: Եթե մագնիսական դաշտի ուղղությունը արագ փոխվում է, երբ սպիններըիեն կարողանում փոփոխել դաշտը, միջուկային պտույտների համակարգը միաժամանակ կունենա բացասական անհավասարակշռության ջերմաստիճան [32], այսինքն, այս տեսանկյունից ներկայիս նույն տարածական տարածաշրջանում կլինեն երկու զուգահեռ փոխազդող համակարգեր տարբեր ջերմաստիճաններով [33]: Շնորհիվ փոխազդեցության, երկու համակարգերի ջերմաստիճանը որոշ ժամանակ անց հավասարվում է:
Դասական ֆենոմենոլոգիական տերմոդինամիկայի ֆորմալիզմը կարելի է համալրել բացասական բացարձակ ջերմաստիճանների ներկայացմամբ [34] [33]:
Տեսիի պոստուլին համապատասխան, ցանկացած համակարգի ներքին էներգիան սահմանափակվում է նվազագույնից, և այս սահմանը համապատասխանում է բացարձակ զրոյական ջերմաստիճանին [35]: Համակարգերում, որոնք ունեն ոչ միայն ստորին, այլև ներքին էներգիայի վերին սահման, ջերմաստիճանը մեծանալով ներքին էներգիան ավելանում է և հասնում է իր սահմանային արժեքին. ջերմաստիճանի հետագա աճը չի հանգեցնում ներքին էներգիայի ավելացմանը, այլեւ համակարգի իջեցմանը -ից [33]: Թերմոդինամիկական բանաձևերի համաձայն, դա համապատասխանում է դրական ջերմաստիճանի շրջանից անցում դեպի բացասական ջերմաստիճան ( և ջերմաստիճանները ֆիզիկապես նույնական են) հավասարաչափ ջերմաստիճանի սահմանով կետի ուղղությունը [36] [33]:
Մոլեկուլային-կինետիկ հասկացությունը[խմբագրել | խմբագրել կոդը]
Մոլեկուլային-կինետիկ տեսության մեջ ջերմաստիճանը սահմանվում է որպես մակրոսկոպիկական համակարգի մասնիկների միջին քննակականն էներգիայի բնութագիր, որը գտնվում է թերմոդինամիկ հավասարակշռության վիճակում մի աստիճանի ազատության վրա:
«... ջերմաստիճանի չափը շարժումը չէ, այլ շարժման պատահականությունը: Մարմնի քաոսային վիճակը սահմանում է իր ջերմաստիճանը և այդ գաղափարը (որն առաջին անգամ մշակել է Բոլցմանը), որ մարմնի որոշակի ջերմաստիճանի վիճակն ամենևին էլ չի որոշվում շարժման էներգիայով, այլ այս շարժման քաոսային բնույթով և այն նոր հայեցակարգ է, որը նկարագրում է ջերմային երեւույթները, որոնք մենք պետք է օգտագործենք ...
Վիճակագրական ֆիզիկայի ջերմաստիճանի որոշում[խմբագրել | խմբագրել կոդը]
Վիճակագրական ֆիզիկայի մեջ ջերմաստիճանը որոշվում է որպես համակարգային էներգիայի ածանցյալ իր էնտրոպիայից
որտեղ -ը էնտրոպիան է, -ն ջերմատունկի էներգիան է: Աև ձեւով ներկայացված քանակությունը նույնն է տարբեր մարմինների համար`թերմոդինամիկ հավասարակշռության ներքո: Երբ երկու մեծ արժեքով մարմինները շփվում են մեկը մյուսին էներգիա է տալիս:
Ջերմաստիճանի չափում[խմբագրել | խմբագրել կոդը]
Թերմոդինամիկ ջերմաստիճանը չափելու համար ընտրվում է ջերմաչափային նյութի որոշակի թերմոդինամիկ պարամետր: Այս պարամետրի փոփոխությունը բացառապես կապված է ջերմաստիճանի փոփոխության հետ: Թերմոդինամիկ ջերմաչափի դասական օրինակ կարող է հանդիսանալ գազայինի ջերմաչափը, որի ջերմաստիճանը որոշվում է մշտական գոլորշիով գազի ճնշումը չափելու մեթոդով: Հայտնենե ւ բացարձակ ճառագայթման ջերմաչափեր, աղմուկևեւ ակուստիկ ջերմաչափեր:
Թերմոդինամիկ ջերմաչափերը շատ բարդ կառուցվածքներ են, որոնք չեն կարող օգտագործվել գործնական նպատակների համար: Հետևաբար, չափումների մեծ մասը կատարվում է պրակտիկ ջերմաչափերով, որոնք երկրորդական են, քանի որ դրանք չեն կարող ուղղակիորեն չափել որոշակի նյութերի ջերմաստիճանը: Ինտերպոլիֆիկացման գործառույթը ձեռք բերելու համար դրանք պետք է ստուգեն միջազգային ջերմաստիճանը հիմնական կետերում:
Մարմնի ջերմաստիճանը չափելու համար սովորաբար չափվում է ցանկացած ֆիզիկական պարամետր, որը կապված է ջերմաստիճանի հետ, օրինակ, գազերի համար երկրաչափական չափերը (տես, դիլատոմետր) ծավալը կամ ճնշումը, ձայնի արագությունը, էլեկտրական հաղորդունակությունը, էլեկտրամագնիսական կլանումը կամ ճառագայթման սպեկտրը (օրինակ, պիրոմետրերը, ֆոտոսֆերայի ջերմաստիճանի չափումը և մթնոլորտում աստղերի ճնշումը, վերջին դեպքում դոպլեր ընդլայնումը սպեկտրալ գծերի կլանումը կամ ճառագայթումը):
Ամենօրյա պրակտիկայում ջերմաստիճանը սովորաբար չափվում է հատուկ գործիքներով՝ կոնտակտային ջերմաչափերո վ:Այս դեպքում ջերմաչափը հաստատում է ջերմային կապ ուսումնասիրվող մարմնի հետ և ջերմաչափը մարմնի թերմոդինամիկ հավասարակշռությունը հաստատելուց հետո, հավասարեցնում է ջերմաստիճանը, կախված ջերմաչափի ֆիզիկական հատկություններից: Թերմոմետրի և մարմնի մևեւ ջերմային կոնտակտը պետք է լինի բավարար, որպեսզի ջերմաստիճանի հավասարությունը տեղի ունենա ավելի արագ, ինչպես նաև ջերմաստիճանի հավասարեցման արագությունը տեղի է ունենում ջերմաչափի ջերմային հզորությունը իջեցնելու հետ մեկտեղ, համեմատած մարմնի ուսումնասիրության հետ, սովորաբար նվազեցնելով ջերմաչափի չափերը: Ջերմաչափի ջերմային հզորության նվազումը նույնպես նվազեցնում է չափման արդյունքները, քանի որ ուսումնասիրվող մարմնի ջերմության փոքր մասը տեղափոխվում է կամ փոխանցվում է ջերմաչափին: Իդեալական ջերմաչափը զրոյական ջերմային հզորություն ունի[38] :
Ջերմաստիճանի չափման միջոցներ՝ Ցելսիուսի կամ Ֆարենհայտի սանդղակներ:
Գործնականում ջերմաստիճանի չափուման համար կիրառվում է նաև
Առավել ճշգրիտ գործնական ջերմաչափը պլատինային դիմադրության ջերմաչափն է [39] : Լազերային ճառագայթման չափման հիման վրա մշակվում են ջերմաստիճանի չափման նորագույն մեթոդներ [40] ։
Ջերմաստիճանի չափման սանդղակը և միավորները[խմբագրել | խմբագրել կոդը]
Այն փաստը, որ ջերմաստիճանը մոլեկուլների կինետիկ էներգիան է, պարզ է, որ դա բնական է չափել էներգետիկ միավորներում (այսինքն, SI համակարգում, տես նաեւ eV): Այնուամենայնիվ, ջերմաստիճանի չափումը սկսվել է դեռևս մոլեկուլային-կինետիկ տեսության ստեղծումից առաջ, այնպես որ գործնական սանդղակներով ջերմաստիճանը չափում են պայմանական միավորների համակարգում՝ աստիճաններով:
Բացարձակ ջերմաստիճան: Կելվինի ջերմաստիճանը[խմբագրել | խմբագրել կոդը]
Բացարձակ ջերմաստիճանի հասկացությունը ներկայացրեց ՈՒ. Թոմսոնը (Կելվին), ըստ որի բացարձակ ջերմաստիճանի սանդղակը կոչվում է Կելվինի սանդղակ կամ մթնոլորտային ջերմաստիճան: Բացարձակ ջերմաստիճանի միավորը Կելվինն (K) է:
Բացարձակ ջերմաստիճանը է կոչվում, քանի որ ջերմաստիճանի ցածր սահմանային հորիզոնականը՝ բացարձակ զրոն է, այսինքն, ամենացածր հնարավոր ջերմաստիճանը, ըստ որի սկզբունքորեն հնարավոր չէ ջերմային էներգիա հանել նյութից:
Բացարձակ զրոն ներկայացված է այսպես՝ 0 K, որը հավասար է -273.15 °C և -459.67 °F:
Կալվինի ջերմաստիճանը սանդղակ է, որը սկսվում է բացարձակ զրոյից:
Կելվինի սանդղակը կարևոր նշանակություն ունի գործնականում կիրառվող միջազգային սանդղակներում, ելակետային կետերի հիման վրա մաքուր նյութերի փուլային անցումը առաջնային որոշվում է ջերմաչափերի միջոցով: Առաջին միջազգային ջերմաստիճանային սանդղակը ընդունվել է 1927 թ.՝ ՄՏՍ-27: 1927 թ.-ից սկսած սանդղալը մի քանի անգամ վերանայվել է (ՄՏՍ-48, ՄՊՏՍ-68, ՄՏՍ-90). հիմնական ջերմաստիճանն ու ինտերպոլյացիոն մեթոդները փոխվել են, սակայն սկզբունքը մնաց նույնը: Ներկայումս գործում է ՄՏՍ-90 սանդղակը: Հիմնական փաստաթուղթը (սանդղակների մասին կանոնակարգ) սահմանում է Կելվինի սահմանումը, ֆազային անցումների ջերմաստիճանի արժեքները (ուղիները)[41] և ինտերպոլացիայի մեթոդները:
Ամենօրյա կյանքում օգտագործվող ջերմաստիճանի սանդղակները Ցելսիուսը և Ֆարենհայտ (օգտագործում են հիմնականում ԱՄՆ-ում), բացարձակ են և անհարմար են փորձերի անցկացման համար, երբ ջերմաստիճանը ջրի սառեցման աստիճանից ցածր է, ապա ջերմաստիճանը արտահայտվում է բացասական թիվով: Նման դեպքերում, ներկայացվել են բացարձակ ջերմաստիճանի սանդղակներ:
Նրանցից մեկը կոչվում է Ռանկինի սանդղակ, իսկ մյուսը կոչվում է բացարձակ թերմոդինամիկ սանդղակ (Կելվինի սանդղակ), այս սանդղակներով ջերմաստիճանները համապատասխանաբար չափվում են Ռանկինի (° Ra) և Կելվինի (K) աստիճաններով: Երկու սանդղակները սկսվում են բացարձակ զրոյից:
Նրանք տարբերվում են, նրանով որ Կելվինի սանդղակով մեկ բաժնի գինը հավասար է Ցելսիուսի սանդղակի բաժանման գնին, իսկ Ռանկինի սանդղակի բաժանման գինը համարժեք է Ֆարենհայտի սանդղակով ջերմաչափերի բաժանման գնին: Ստանդարտ մթնոլորտային ճնշման տակ ջրի սառեցման ջերմաստիճանը համապատասխանում է 273.15 K, 0 ° C, 32 ° F:
Կելվինի սանդղակի մասշտաբըը կապված է ջրի եռակի մակարդակի հետ (273.16 К), իսկ Բոլցմանի մշտական կախվածությունը դրա վրա է: Դա առաջացնում է խնդիրներ բարձր ջերմաստիճանի չափման ճշգրտությունը ապահովելու համա ր:Այժմ Միջազգային բյուրոյի կշիռներով եւ միջոցառումներից հաշվի ենք առնում անցումը դեպի կելվինի նոր սահմանմանին, որը թվային արժեք է՝ Բոլցմանի հաստատունը,որի չափման համար պարտադիր չէ եռակի մակարդակի ջերմաստիճանի որոշումը[42]:
ՑԵլսիուսի սանդղակ[խմբագրել | խմբագրել կոդը]
Ճարտարագիտության, բժշկության, օդերեւութաբանության մեջ և տանը Ցելսիուսի սանդղակը օգտագործվում է, որպես ջերմաստիճանի չափման միավոր: Ներկայումս SI համակարգում Ցելսիուսի թերմոդինամիկ սանդղակը որոշվում է Կելվինի սանդղակով `t (° C) = T (K) - 273.15 (ճշգրտորեն), այսինքն, Ցելսիուսի սանդղակով մեկ բաժանման գինը հավասար է Կելվինի բաժանման սանդղակին: Ցելսիուսի սանդղակով ջրի եռակի ջերմաստիճանը կազմում է մոտավորապես 0.008 ° C, [43], ուստի ջրի սառեցման աստիճանը 1 ատմ. ճնշման տակ շատ մոտ է 0 ° C- ին: Ջրի եռման աստիճանը սկզբնապես ընտրվել է Ցելսիուսի կողմից, որպես 100°С: Ըստ ժամանակակից գնահատականների, ջերմաստիճանի նորմալ մթնոլորտային ճնշման տակ ջրի եռման կետը Ցելսիուսի թերմոդինամիկական սանդղակում կազմում է մոտ 99.975 ° C: Ցելսիուսի սանդղակը շատ հարմար է գործնական տեսանկյունից, քանի որ մեր մոլորակում շատ տարածված է ջուրը, և մեր կյանքը հիմնված է դրա վրա: Ցելսիուսի զրոյականը օդերևութաբանական հատուկ կետ է, քանի որ այն կապված է մթնոլորտային ջրի սառեցման հետ: Սանդղակը 1742-ին առաջարկել է Անդերս Ցելսիուսը:
Ֆարենհայտի սանդղակ[խմբագրել | խմբագրել կոդը]
Անգլիայում և, մասնավորապես, ԱՄՆ-ում, օգտագործվում է Ֆարենհեյթի սանդղակը: Զրոյական աստիճան ցելսիուսը համապատասղանում է 32 աստիճան Ֆարենհեյթի, իսկ 100 աստիճանի ցելյոսը `212 աստիճան Ֆարենհայտի:
Ներկայումս Ֆարենհեյթի սանդղակի սահմանումն ընդունվում է այսպես. Այն ջերմաստիճանի մասշտաբ է, որի 1 աստիճանը (1 ° F) հավասար է 1/180 ջերմաստիճանի միջև եղած տարբերության և մթնոլորտի միջև ջերմաստիճանի մթնոլորտային ճնշման , և սառույցի հալման կետն ունի +32 ° F ջերմաստիճան: Ֆարենհայտիի սանդղակի վրա ջերմաստիճանը պայմանավորված է Ցելսիուսի ջերմաստիճանային սանդղակով (t ° C) t ° C = 5/9 (t ° F-32), t ° F = 9/5 t ° C + 32. Սանդղակը առաջարկավել է 1724 թ. Գ. Ֆարենհայտի կողմից:
Ռեոմյուրի սանդղակ[խմբագրել | խմբագրել կոդը]
Այն առաջարկվել է 1730 թ. Ռ. Ա. Ռեոմյուրի կողմից, որը նկարագրել է իր հորինած ալկոհոլային ջերմաչափը:
Ռեոմյուրի միավորը (° Ré) աստիճանն է, 1 ° Ré հավասար է 1/80 ջերմաստիճանի, սառույցի հալման ջերմաստիճանը (0 °Ré), իսկ ջրի եռման ջերմաստիճանը (80 °Ré) է:
1 °Ré = 1,25 °C:
Ներկայումս սանդղակը չի օգտագործվում, այն երկար կիրառվել է Ֆրանսիայում` հեղինակի հայրենիքում:
Ջերմային շարժման էներգիան բացարձակ զրոյի պայմաններում[խմբագրել | խմբագրել կոդը]
Երբ մատերիան սառչում է, ջերմային էներգիայի և դրանց հետ կապված ազդեցությունների բազմաթիվ ձևերը միաժամանակ նվազում են:Նյութը անցնում է ավելի քիչ կարգավորված վիճակից դեպի ավելի կարգավորվածը:
«... բացարձակ զրոյի ժամանակակից հայեցակարգը բացարձակ հանգստության գաղափար չէ, ընդհակառակը, բացարձակ զրոյի դեպքում կարող է շարժում լինել, և դա ամբողջական կարգավիճակ է ...
Գազը վերածվում է հեղուկի և այնուհետեւ բյուրեղացվում է ամուր մարմնի ( բացարձակ զրո մթնոլորտային ճնշման դեպքում հելիումը մնում է հեղուկ վիճակում ): Ատոմների և մոլեկուլների շարժումը դանդաղում է, դրանց կինետիկ էներգիան նվազում է: Մետաղների մեծամասնության դիմադրությունը ընկնում է էլեկտրոնների ցրման նվազման շնորհիվ, բյուրեղյա ցանցի ատոմների ավելի փոքր ամպլիտուդի թրթռանքով: Այսպիսով, նույնիսկ բացարձակ զրոյի դեպքում, էլեկտրոնները շարժվում են ատոմների որոշակի արագությամբ, որն ըստ Ֆերմի հավասար է 106 մ / վ:
Ջերմաստիճանը, որում նյութի մասնիկները ունեն նվազագույն քանակի արագություն, որը պահպանվում է միայն քվանտային մեխանիկական շարժման միջոցով անվանում են բացարձակ զրոյական ջերմաստիճանը (T = 0K):
Ջերմաստիճանները բացարձակ զրոյականի հասնել չեն կարող: 2003 թ-ին ՄՏԻ- ի հետազոտողները ստացել են ամենացարծր ջերմաստիճանը (450 ± 80) ·10−12 К, որն ստացել Բոզե-Այնշտայնը նատրիումի ատոմների կոնդենսատորից[44]: Այս դեպքում ջերմային ճառագայթման ալիքի երկարությոոնը կազմում է 6400 կիլոմետր, որմ մոտավորապես հավասար է Երկրի շառավղին:
Ջերմաստիճանը եւ ճառագայթումը[խմբագրել | խմբագրել կոդը]
Մարմնի կողմից արտանետվող էներգիան համաչափ է իր ջերմաստիճանի չորրորդ փուլին: Այսպիսով, 300 կիլոմետր քառակուսի մակերեսի դեպքում հասնում է մինչև 450 վտ: Այսպես բացատրվում է, օրինակ, ձմռանը երկրի մակերևույթի օդի ջերմաստիճանից ցածր լինելը: Բացարձակապես սև մարմնի ճառագայթային էներգիան նկարագրվում է Ստեֆան-Բոլցման օրենքով:
Անցումներ տարբեր սանդղակներից[խմբագրել | խմբագրել կոդը]
| Սանդղակ | Նշան | Ցելսիուսից (°C) | Ցելսիուս |
|---|---|---|---|
| Ֆարենհայտ | (°F) | [°F] = [°C] × 9⁄5 + 32 | [°C] = ([°F] − 32) × 5⁄9 |
| Կելվին | (K) | [K] = [°C] + 273,15 | [°C] = [K] − 273,15 |
| Ռանկին (Rankin) | (°R) | [°R] = ([°C] + 273,15) × 9⁄5 | [°C] = ([°R] − 491,67) × 5⁄9 |
| Դելիսլե (Delisle) | (°Д или °De) | [°De] = (100 − [°C]) × 3⁄2 | [°C] = 100 − [°De] × 2⁄3 |
| Նյուտոն (Newton) | (°N) | [°N] = [°C] × 33⁄100 | [°C] = [°N] × 100⁄33 |
| Ռեոմոյուր (Réaumur) | (°Re, °Ré, °R) | [°Ré] = [°C] × 4⁄5 | [°C] = [°Ré] × 5⁄4 |
| Ռյոմեր (Rømer) | (°Rø) | [°Rø] = [°C] × 21⁄40 + 7,5 | [°C] = ([°Rø] − 7,5) × 40⁄21 |
Ջերմաստիճանի կշիռների համեմատություն[խմբագրել | խմբագրել կոդը]
| Նկարագրություն | Կելվին | Ցելսիում | Ֆարենհայտ | Ռանկին | Դելիսլե | Նյուտոն | Ռեոմյուր | Ռյոմեր |
|---|---|---|---|---|---|---|---|---|
| Բացարձակ զրո | 0 | −273,15 | −459,67 | 0 | 559,725 | −90,14 | −218,52 | −135,90 |
| Ֆարենհայտի խառնուրդի հալվածքի ջերմաստիճանը (հավասար քանակությամբ աղ և սառույց) | 255,37 | −17,78 | 0 | 459,67 | 176,67 | −5,87 | −14,22 | −1,83 |
| Ջրի սառեցման ջերմաստիճան (նորմալ պայմաններ) | 273,15 | 0 | 32 | 491,67 | 150 | 0 | 0 | 7,5 |
| Մարդու մարմնի միջին ջերմաստիճան¹ | 309,75 | 36,6 | 98,2 | 557,9 | 94,5 | 12,21 | 29,6 | 26,925 |
| Ջրի եռման ջերմաստիճան (նորմալ պայմաններ) | 373,15 | 100 | 212 | 671,67 | 0 | 33 | 80 | 60 |
| Տիտանի հալեցում | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Արև² | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹ Մարդու մարմնի բնականոն միջին ջերմաստիճանը +36.6 ° C ± 0.7 ° C է կամ +98.2 ° F ± 1.3 ° F. +98.6 ° F- ի սովորական արժեքը ճշգրիտ փոխակերպումն է 19-րդ դարում Գերմանիայում +37 ° C արժեքով Ֆարենհեյթի սանդղակին: Այնուամենայնիվ, այդ արժեքը չի ընկնում մարդու բնականոն միջին ջերմաստիճանի սահմաններում, քանի որ մարմնի տարբեր մասերի ջերմաստիճանը տարբեր է[45]:
² Այս աղյուսակում որոշ արժեքներ կլորացվում են: Օրինակ, արեւի մակերեւութային ջերմաստիճանը հավասար է 5800 աստիճանով Կելվիին: Այնուամենայնիվ, մնացած ջերմաստիճանների համար, արդեն իսկ տրվել է 5800 աստիճանով Կելվինի ճշգրիտ արդյունքը:
Ֆազային անցումների բնութագիրը[խմբագրել | խմբագրել կոդը]
Նկարագրելու համար տարբեր նյութերի փուլային անցումների բնութագիրը, օգտագործվում են հետևյալ ջերմաստիճանի արժեքները.
- Հալման ջերմաստիճան
- Եռման ջերմաստիճան
- Այրման ջերմաստիճան
- Խտացման ջերմաստիճան
- Սինթեզի ջերմաստջիճան
- Հողի ջերմաստիճան
- Հոմոլոգիական ջերմաստիճան
- Եռակի կետ
- Դեբայի ջերմաստիճան (բնութագրական ջերմաստիճան)
- Կյուրիի ջերմաստիճան
- Նելի ջերմաստիճան
Ընկալման հոգեբանություն[խմբագրել | խմբագրել կոդը]
Քանի որ բազմաթիվ փորձերի արդյունքները ցույց են տալիս, որ ցրտի կամ ջերմության զգացումը կախված է ոչ միայն շրջակա միջավայրի ջերմաստիճանից, այլև տրամադրությունից:
Այսպիսով, եթե ուսումնասիրվողը զգում է իրեն միայնակ, օրինակ, գտնվում է մարդկանց հետ մի սենյակում, որը չի կիսում իր տեսակետները կամ արժեքները, կամ պարզապես հեռու է այլ մարդկանցից, ապա սենյակը դառնում է ավելի սառը, և հակառակը[46]:
Հետաքրքիր փաստեր[խմբագրել | խմբագրել կոդը]
- Ամենաբարձր ջերմաստիչանը ստեղծվել է մարդու կողմից 2010 թ.-ին՝ մոտավորապես 10 տրլն К, (որը համապատասխանում է իր կյանքի առաջին վարկյանների տիեզերական ջերմաստիճանին) կապարի իոնների բախման ժամանակ, արագացված մոտ լույսի արագությամբ: Փորձը կատարվել է Մեծ Ադրոն Կոլլերի կողմից [47]:
- Տեսականորեն հնարավոր ամենաբարձր ջերմաստիճանը դա Պլանկի ջերմաստիճանն է: Ավելի բարձր ջերմաստիճան չի կարող գոյություն ունենալ ժամանակակից ֆիզիկական հասկացությունների համաձայն, քանի որ լրացուցիչ էներգիա ավելացնելու համար նման ջերմաստիճանը չի բարձրացնում մասնիկների արագությունը, այլ միայն բախումներ է առաջացնում նոր մասնիկների հետ, իսկ համակարգում մասնիկների թիվը և զանգվածը աճում է: Դա մոտավորապես հավասար է 1,41679(11)·1032 K (մոտ 142 նոնիլիոն K):
- Արևի մակերևույթը մոտավորապես 6000 K ջերմաստիճան ունի, իսկ արևի միջուկը, մոտ 15.000.000 K.:
- Մարդու կողմից ամենացածր ջերմաստիճանը ստացվել է 1995 թվականին, ԱՄՆ-ում Էրիկ Կոռնելի և Կարլ Վիմանի կողմից, ռուբիդիումի ատոմների սառեցմամբ [48][49] : Այն բացարձակ զրոյից բարձր էր, քան կալվինի 1/170 միլիարդերորդը (5,9·10−12 K):
- Երկրի մակերևույթում գրանցված ցածր ջերմաստիճանը` -89.2 ° C, 1983 թ. Հուլիսի 21-ին գրանցվել է Խորհրդային Ներքին գիտական « Վոստոկ » կայանում (Անտարկտիդա) (ծովի մակերեւույթից 3488 մ բարձրության վրա)[50][51]:
- 9 դեկտեմբերի, 2013 թ. Ամերիկյան երկրաֆիզիկական միության կոնֆերանսում մի խումբ ամերիկացի հետազոտողների հաղորդմամբ, 2010 թ. Օգոստոսի 10-ին, Անտարկտիդայի կետերից մեկում օդի ջերմաստիճանը իջավ մինչեւ -135.8 ° F (-93.2 ° C): Այս տեղեկատվությունը հայտնաբերվել է ՆԱՍԱ-ի արբանյակային տվյալների վերլուծության արդյունքում [52]: Ըստ բանախոսի, Տ. Սկամբոսի (անգլերեն Ted Scambos) զեկույցի ձեռք բերված արժեքը չի գրանցվի որպես ռեկորդ, որը որոշվում է արբանյակային չափումներով, այլ ոչ թե ջերմաչափի օգտագործմամբ [53]:
- Երկրի մակերեւույթի +56.7 ˚C ռեկորդային բարձր օդի ջերմաստիճանը գրանցվել է 1913 թ. հուլիսի 10-ին, Կանադայի Death Valley- ում (Կալիֆորնիա, ԱՄՆ) Գրենլանդի ռանչոում[54][55]:
- Բարձրագույն բույսերի սերմերը պահպանվում են մինչեւ -269 ° C ցրտից հետո:
Տես նաև[խմբագրել | խմբագրել կոդը]
- Բացասական բացարձակ ջերմաստիճան
- Գույնի ջերմաստիճան
- Պայծառության ջերմաստիճան
- Անտենային ջերմաստիճան
- Ջերմային պոմպ
Գրականության ցանկ[խմբագրել | խմբագրել կոդը]
- ↑ В качестве реперной точки 10-я Генеральная конференция по мерам и весам в 1954 году приняла тройную точку воды, приписав ей точное значение температуры 273,16 К по определению.
- ↑ Физика. Большой энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — С. 741. — 944 с.
- ↑ The SI brochure Описание СИ на сайте Международного бюро мер и весов
- ↑ ГОСТ 8.417-2002. Государственная система обеспечения единства измерений. Единицы величин.
- ↑ Жилин П. А., Рациональная механика сплошных сред, 2012, էջ 84
- ↑ «Температурное поле». БСЭ, 3-е изд., 1976, т. 25 (ռուսերեն).
{{cite web}}: no-break space character in|work=at position 24 (օգնություն) - ↑ Трусделл К., Термодинамика для начинающих, 1970, էջ 117
- ↑ Жилин П. А., Рациональная механика сплошных сред, 2012, էջ 48
- ↑ Физика. Большой энциклопедический словарь, 1998, էջ 751
- ↑ Залевски К., Феноменологическая и статистическая термодинамика, 1973, էջ 11–12
- ↑ Вукалович М. П., Новиков И. И., Термодинамика, 1972, էջ 11
- ↑ Зоммерфельд А., Термодинамика и статистическая физика, 1955, էջ 11
- ↑ Клаузиус Р., Механическая теория тепла, 1934
- ↑ Каратеодори К., Об основах термодинамики, 1964
- ↑ Борн М., Критические замечания по поводу традиционного изложения термодинамики, 1964
- ↑ Базаров И. П., Термодинамика, 2010, էջ 57
- ↑ Гухман А. А., Об основаниях термодинамики, 1986
- ↑ Леонова В. Ф., Термодинамика, 1968
- ↑ Базаров И. П., Термодинамика, 2010, էջ 29, 58, 127, 171
- ↑ Кубо Р., Термодинамика, 1970, էջ 20–21
- ↑ Гиббс Дж. В., Термодинамика. Статистическая механика, 1982, էջ 93
- ↑ Guggenheim E. A., Thermodynamics, 1986, էջ 15
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1986, էջ 35
- ↑ Дьярмати И., Неравновесная термодинамика, 1974, էջ 26
- ↑ 25,0 25,1 Falk G., Jung H., Axiomatik der Thermodynamik, 1959, էջ 156
- ↑ Белоконь Н. И., Основные принципы термодинамики, 1968, էջ 10
- ↑ Базаров И. П., Термодинамика, 2010, էջ 62
- ↑ «Абсолютная температура». БСЭ, 3-е изд., 1969, т. 1 (ռուսերեն).
{{cite web}}: no-break space character in|work=at position 24 (օգնություն) - ↑ Пригожин И., Кондепуди Д., Современная термодинамика, 2002, էջ 23, 83, 86
- ↑ Сорокин В. С., Макроскопическая необратимость и энтропия. Введение в термодинамику, 2004, էջ 60
- ↑ «Отрицательная температура». БСЭ, 3-е изд., 1975, т. 19 (ռուսերեն).
{{cite web}}: no-break space character in|work=at position 24 (օգնություն) - ↑ Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1, 2002, էջ 262
- ↑ 33,0 33,1 33,2 33,3 Поулз Д., Отрицательные абсолютные температуры, 1964
- ↑ Базаров И. П., Термодинамика, 2010, էջ 136–148
- ↑ Tisza L., Generalized Thermodynamics, 1966, էջ 125
- ↑ Базаров И. П., Термодинамика, 2010, էջ 137–138
- ↑ Капица П. Л. Свойства жидкого гелия // Природа. — 1997. — № 12.
- ↑ Шахмаев Н. М. и др. Физика: Учебник для 10 класса общеобразовательных учреждений. — М.: Просвещение, 1996. — С. 21. — 240 с. — ISBN 5090067937
- ↑ Платиновый термометр сопротивления — основной прибор МТШ-90.
- ↑ Лазерная термометрия
- ↑ Реперные точки МТШ-90
- ↑ Разработка нового определения кельвина
- ↑
Д. А. Паршин, Г. Г. Зегря. «Критическая точка. Свойства вещества в критическом состоянии. Тройная точка. Фазовые переходы II рода. Методы получения низких температур» (PDF). Статистическая термодинамика. Лекция 11 (ռուսերեն). Санкт-Петербургский академический университет. Արխիվացված է օրիգինալից (PDF) 2012-12-03-ին. Վերցված է 2011-06-02-ին.
{{cite web}}: Unknown parameter|deadlink=ignored (|url-status=suggested) (օգնություն) - ↑ Belle Dumé (2003-09-12). «Bose-Einstein condensates break temperature record» (անգլերեն). Արխիվացված է օրիգինալից 2013-07-25-ին.
{{cite web}}: Unknown parameter|publisger=ignored (օգնություն) - ↑ О различных измерениях температуры тела(անգլ.)
- ↑ Тальма Лобель, 2014, էջ 24
- ↑ BBC News — Large Hadron Collider (LHC) generates a 'mini-Big Bang'
- ↑ Всё про всё. Рекорды температуры
- ↑ Чудеса науки
- ↑ «Самая низкая температура на поверхности Земли». National Geographic Россия. Վերցված է 2013-12-09-ին.
- ↑ «World: Lowest Temperature» (անգլերեն). Arizona State University. Վերցված է 2013-12-09-ին.
- ↑ «NASA-USGS Landsat 8 Satellite Pinpoints Coldest Spots on Earth» (անգլերեն). NASA.
- ↑ «Antarctica sets low temperature record of -135.8 degrees» (անգլերեն). FoxNews.
- ↑ «Старый температурный рекорд оспорен». Компьюлента. Վերցված է 2013-11-30-ին.
- ↑ «Press Release No. 956» (անգլերեն). World Meteorological Organizayion. Վերցված է 2013-11-30-ին.











![{\displaystyle T\equiv \left[\left({\frac {\partial S}{\partial U}}\right)_{\{x_{i}\}}\right]^{-1},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3199aedd04aecf0811bc8ef796f064be37d4cbac)







