Գլյուկոզ-6-ֆոսֆատ դեհիդրոգենազայի պակասուրդ
| Գլյուկոզ-6-ֆոսֆատ դեհիդրոգենազայի պակասուրդ | |
|---|---|
 Գլյուկոզ 6-ֆոսֆատ դեհիդրոգենազ | |
| Տեսակ | հիվանդության կարգ |
| Պատճառ | Գենետիկ (X-շղթայակված ռեցեսիվ)[1] |
| Հիվանդության ախտանշաններ | Դեղնուկ, մեզի գույնի մգացում, հևոց[1] |
| Բժշկական մասնագիտություն | Բժշկական գենետիկա |
| Հոմանիշներ | Ֆավիզմ[1] |
| Ռիսկի գործոններ | Հրահրիչ գործոնի դերում կարող են լինել՝ ինֆեկցիաները, որոշ դեղերը, սթրեսը, ֆավա լոբին[1][2] |
| Ախտորոշում | Հիմնված է ախտանիշների, գենետիկ և արյան հետազոտությունների վրա[3] |
| Տարբերակիչ ախտորոշում | Պիրուվատ կինազի անբավարարություն, ժառանգական սֆերոցիտոզ, մանգաղաբջջային անեմիա[3] |
| Բուժում | Խուսափում հրահրող գործոններից, վնասող դեղորայքից, արյան փոխներարկում[2] |
| Բարդություններ | Անեմիա, նորածինների դեղնուկ[1][3] |
| Մահացություն | 33,000 (2015 թվ.)[4] |
| Սկիզբը | Հրահրիչ գործոնի (տրիգեր) ազդեցությունից մի քանի օր անց[3] |
| Հանդիպման հաճախականություն | 400 մլն[1] |
Գլյուկոզ-6-ֆոսֆատ դեհիդրոգենազայի պակասուրդ (Գ6ՖԴՊ), մետաբոլիզմի բնածին խանգարում, որը բերում է արյան կարմիր բջիջների (էրիթրոցիտներ) քայքայմանը[1]։ Հաճախ ախտահարվածները չեն ունենում ախտանիշներ[2]։ Որոշակի տրիգերների ազդեցությանը հետևում է այնպիսի ախտանիշների դրսևորումն, ինչպիսիք են՝ դեղնուկը, մեզի գույնի մգացումը, հևոցը, հոգնածության զգացում[1][3]։ Բարդությունները կարող են ներառել սակավարյունությունն և նորածինների դեղնուկը[3] Որոշներն երբեք ախտանիշներ չեն ունենում[2]։
Այն X-շղթայակցված ռեցեսիվ խանգարում է, որը հանգեցնում է գլյուկոզ-6-ֆոսֆատ դեհիդրոգենազա ֆերմենտի պակասուրդին[1]։ Էրիթրոցիտների քայքայումը կարող է հարուցվել ինֆեկցիայով, որոշակի դեղամիջոցներով, սթրեսով կամ սննդամթերքով՝ ինչպիսին է ֆավա լոբին[1][2]։ Կախված մուտացիայի տեսակից ծանրության աստիճանը կարող է տարբեր լինել[3]։ Ախտորոշումը հաստատվում է ախտանիշների հիման վրա, ինչպես նաև արյան քննությամբ և գենետիկական թեստավորմամբ[3]։
Կարևորվում է հրահրող գործոններից խուսափումը[2]։ Սուր էպիզոդների բուժումը կատարվում է ինֆեկցիայի դեմ դեղամիջոցների կիրառմամբ, վնասող դեղերի դադարեցմամբ և արյան փոխներարկմամբ[2]։ Նորածնային դեղնուկը հնարավոր է բուժել ֆոտոթերապիայով։ Մինչ այնպիսի դեղորայքի կիրառումն ինչպիսին է Պրիմաքվինը, խորհուրդ է տրվում անցնել Գ6ՖԴՊ թեստ[3]։
Ողջ աշխարհում շուրջ 400 միլիոն մարդ տառապում է Գ6ՖԴՊ-ով[1]։ Այն մասնավորապես տարածված է Աֆրիկայի որոշ հատվածներում, Ասիայում, Միջերկրական ծովում և Մերձավոր Արևելքում[1]։ Տղամարդիկ ավելի հաճախ են հիվանդանում, քան կանայք[1]։ Ըստ ենթադրություններիրի՝ 2015 թվականին մահացել է 33.000 մարդ[4]։ Գ6ՖԴՊ ալելը կրողները մասամբ պաշտպանված են մալարիայից[1]։
Նշաններ և ախտանիշներ[խմբագրել | խմբագրել կոդը]
Գ6ՖԴ պակասուրդ ունեցող անհատների մեծամասնությունը ասիմպտոմ են։
Սիմպտոմատիկ հիվանդները բացառապես տղամարդիկ են պայմանավորված ժառանգման X-շղթայակցված ձևով, սակայն կին կրողները կարող են կլինիկական դրսևորումներ ունենալ քրոմոսոմի անբարենպաստ ինակտիվացիայի հետևանքով, երբ X-քրոմոսոմի պատահական ինակտիվացիան որոշակի բջիջներում բերում է Գ6ՖԴՊ ունեցող էրիթրոցիտար խմբի ձևավորևման։
G6PD- ի պակասուրդի դեպքում արյան կարմիր բջիջների քայքայումը ( հայտնի որպես հեմոլիզ) կարող է դրսևորվել մի շարք ձևերով․
- նորածինների երկարատև դեղնուկը, որը կարող է բերել կորիզային դեղնուկի ( Գ6ՖԴ պակասուրդի ամենալուրջ բարդություններից մեկը)
- Հեմոլիտիկ կրիզ, ի պատասխան
- Հիվանդությունների (հատկապես վարակային)
- Որոշ դեղերի (տես ստորև)
- Որոշ սննդամթերքների, հատկապես բակլաի, որից էլ բխում է ֆավիզմ բառը
- Որոշակի քիմիական նյութերի
- Դիաբետիկ կետոացիդոզ
- Ծանր ճգնաժամերը կարող են առաջացնել սուր երիկամային անբավարարություն
Ֆավիզմը հեմոլիտիկ պատասխանն է ֆավա լոբու սպառմանը։ Թեև բոլոր ֆավիզ ունեցողների մոտ կա Գ6ՖԴ պակասուրդ, սակայն ոչ բոլոր Գ6ՖԴ պակասուրդով անձինք ունեն ֆավիզմ։ Այս վիճակը առավել տարածված է նորածինների և երեխաների մոտ, Գ6ՖԴ գենետիկ տարբերակը կարող է ազդել քիմիական զգայունության վրա[5]։ Բացի դրանից Գ6ՖԴ և ֆավիզմի միջև քիմիական կապի յուրահատկությունները լավ հասկանալի չեն։
Պատճառներ[խմբագրել | խմբագրել կոդը]
Ազդակներ[խմբագրել | խմբագրել կոդը]
Հիվանդության հիմքում ընկած մուտացիան կրողները չունեն որև ախտանիշներ մինչ նրանց էրիթոցիտները կենթարկվեն որոշակի ազդակների, որոնք լինում են երեք հիմնական տեսակի։
- Սնունդ (ֆավա լոբին Գ6ՖԴ մուտացիան կրողների մոտ տարբերակիչ ազդակն է)
- Որոշակի դեղորայք (Ասպիրին, Քինին և նրանից ստացված այլ հակամալարիային միջոցներ)
- Նավթալին[6]
- Սթրես բակտերիալ կամ վիրուսային վարակի պատճառով[7]
Հեմոլիտիկ սակավարյունությունից խուսափելու համար Գ6ՖԴ մուտացիա կրողները պետք է խուսափեն որոշակի դեղամիջոցներից և սննդից[7]։
Դեղամիջոցներ[խմբագրել | խմբագրել կոդը]
Գ6ՖԴ պակասուրդ ունեցող մարդկանց համար շատ նյութեր պոտենցիալ վտանգ են ներկայացնում։ Այս նյութերի հանդեպ ռեակցիայի տարբերությունը դժվարեցնում է անհատական կանխատեսումները։ Հակամալարիային սուր հեմոլիզ առաջացնող դեղերի շարքին են պատկանում պրիմաքվին, պարմաքվին և քլորոքվին։ Կան ապացույցներ, որ այլ հակամալարիային դեղամիջոցները նույնպես վատթարացնում են Գ6ՖԴ պակասուրդը, բայց ավելի բարձր դեզաչափերի դեպքում։ Հարկավոր է նաև խուսափել Սուլֆանիլամիդնեերից (Սուլֆանիդամին, Սուլֆամետօքսազոլ, Մաֆենիդ), Թիազոլսուլֆոնից, Մեթիլեն կապույտից, նավթալինից, որոնք հակազդում են Ֆոլաթթվի սինթեզին։ Նաև որոշակի անալգետիկներից (Ացետամին, Ֆենազոպիրիդին) և մի քանի ոչ սուլֆատային հակաբիոտիկներից (Նալդիքսաթթո, Նիտրոֆուրանտոին, Իզոնիազիդ, Ֆուրազոլիդոն, Դապսոն)[8][9][10]։ Հայտնի է, որ Հինան առաջացնում է հեմոլիտիկ կրիզ Գ6ՖԴՊ նորածինների մոտ[11]։ Վիտամին C- ի ներերակային բարձր դեղաչաձերը հեմոլիտիկ կրիզի զարգացման պատճառ կարող են հանդիսանալ[12][13]։
Գենետիկա[խմբագրել | խմբագրել կոդը]
Երկու տարբերակները (Գ6ՖԴ A- և Գ6ՖԴ Միջերկրածովյան) մարդկային պոպուլյացիայում առավել տարածված են։ Գ6ՖԴ A- ը տարածված է աֆրիկացիների և աֆրո-ամերիկացիների 10% -ի մոտ, իսկ Միջին Արևելքում տարածված է Գ6ՖԴ Միջերկրածովյան տեսակը։ Հայտնի մուտացված ալելի տարածումը հիմնականում սահմանափակված է Միջերկրական ծագում ունեցող ժողովոիրդներում (իսպանացիներ, իտալացիներ, հույներ, հայեր, սեֆարդի հրեաներ և այլ սեմական ժողովուրդներ)[14]։ Ըստ ենթադրության՝ երկու տարբերակն էլ առաջացնում են ուժեղ պաշտպանություն Plasmodium falciparum և Plasmodium vivax մալարիայի դեմ[15]։ Դա հատկապես հաճախակի է հանդիպում քրդական, հրեական պոպուլացիայում, որտեղ, մոտավորապես, երկու տղամարդկանցից մեկը հիվանդ է, իսկ կանանց նույն չափը՝ կրող[7]։ Այն նաև տարածված է աֆրո-ամերիկացիների, Սաուդյան Արաբիայի, սարդինյան տղամարդկանց մոտ, որոշ աֆրիկական պոպուլացիաներում և ասիական խմբերում[7]։
Գ6ՖԴ պակասուրդ առաջացնող բոլոր մուտացիաները գտնվում են X քրոմոսոմի երկար թևի վրա, Xq28 խմբում։ G6PD գենը կազմում է մոտ 18.5 կիլոբազ[9]։ Հետևյալ մուտացիաներն ու տարբերակներն առավել հայտնի են և նկարագրված։
| Նկարագրված մուտացիաները | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Մուտացիա | Գեն | Սպիտակուց | |||||||
| Անվանումը | Կարճ անվանումը | Իզոֆորմ Գ6ՖԴ սպիտակուց | OMIM կոդ | Տիպ | Ենթատիպ | Դիրք | Դիրք | Կառուցվածքի փոփոխություն | Ֆունկցիայի փոփոխություն |
| Գ6ՖԴ-Ա(+) | Գդ-A(+) | Գ6ՖԴ Ա | +305900.0001 | Նուկլեոտիդի պոլիմորֆիզմ | A→G | 376 (Էկզոն 5) |
126 | Ասպարագին→Ասպարագինաթթու(ASN126ASP) | Չկա ֆերմենտի դեֆեկտ |
| Գ6ՖԴ-Ա(-) | Gd-A(-) | Գ6ՖԴ Ա | +305900.0002 | Նուլեոտիդի փոխարինում | G→A | 376 (Էկզոն 5) և 202 |
68 և 126 |
Վալին→Մեթիոնին (VAL68MET)Ասպարագին→Ասպարագինաթթո (ASN126ASP) |
|
| Գ6ՖԴ-Միջերկրածովյան | Գդ-Մկջ | Գ6ՖԴ Բ | +305900.0006 | Նուլեոտիդի փոխարինում | C→T | 563 (Էկզոն 6) |
188 | Սերին→Ֆենիլալանին (SER188PHE) | Դաս II |
| Գ6ՖԴ-Կանտոն | Gd-Canton | Գ6ՖԴ Բ | +305900.0021 | Նուլեոտիդի փոխարինում | G→T | 1376 | 459 | Արգինին→Լեյցին (ARG459LEU) | Դաս II |
| Գ6ՖԴ-Չատամ | Գդ-Չատամ | Գ6ՖԴ | +305900.0003 | Նուլեոտիդի փոխարինում | G→A | 1003 | 335 | Ալանին→Թրեոնին (ALA335THR) | Դաս II |
| Գ6ՖԴ-Կոսենզա | Գդ-Կոսենզա | Գ6ՖԴ Բ | +305900.0059 | Նուլեոտիդի փոխարինում | G→C | 1376 | 459 | Արգինին→Պրոլին (ARG459PRO) | Գ6ՖԴ-ակտիվությունը<10%, պացիենտների մեծամասնության մոտ |
| Գ6ՖԴ-Մահիդոլ | Գդ-Մահիդոլ | Գ6ՖԴ | +305900.0005 | Նուլեոտիդի փոխարինում | G→A | 487 (Էկզոն 6) |
163 | Գլիցին→Սերին (GLY163SER) | Դաս III |
| Գ6ՖԴ-Օրիսա | Գդ-Օրիսա | Գ6ՖԴ | +305900.0047 | Նուլեոտիդի փոխարինում | C→G | 131 | 44 | Ալանին→Գլիցին (ALA44GLY) | NADP կապող հատվածը վնասված է։ առավել կայուն է մյուս տարբերակնիերից |
| Գ6ՖԴ-Ասահի | Գդ-Ասահի | G6PD Ա- | +305900.0054 | Նուլեոտիդի փոխարինում
(Մի քանի) |
A→G ± G→A |
376 (Էկզոն 5) 202 |
126 68 |
Ասպարագին→Ասպարագինաթթու (ASN126ASP) Վալին→Մեթիոնին(VAL68MET) |
|
Ախտաֆիզիոլոգիա[խմբագրել | խմբագրել կոդը]
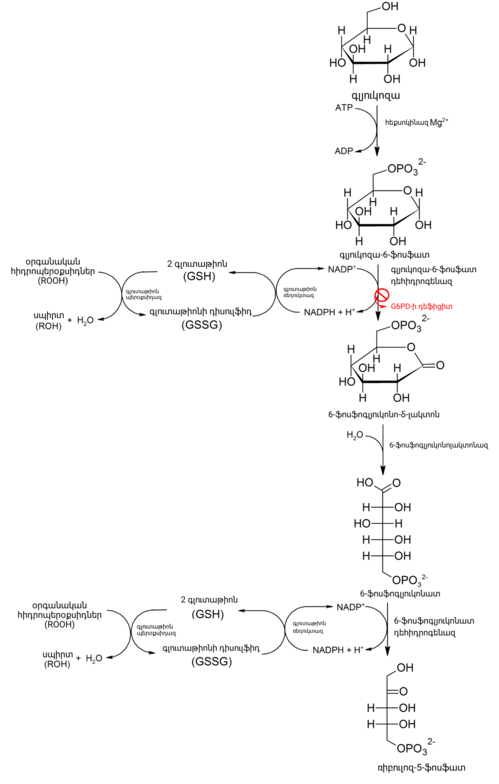
Գլյուկոզ-6-ֆոսֆատ դեհիդրոգենազան (Գ6ՖԴ) հանդիսանում է պենտոզ ֆոսֆատային ուղու ֆերմենտ (տես պատկերը, որը նաև հայտնի է որպես HMP շունտային ուղի)։ Գ6ՖԴ փոխակերպում է գլյուկոզ-6-ֆոսֆատը 6-ֆոսֆոգլյուկոնոլակտոնի և հանդիսանում է այս մետաբոլիկ ուղու արագությունը լիմիտավորող ֆերմենտ։ Ուղին ապահովում է կոֆերմենտ նիկոտինամիդ ադենին դինուկլեոտիդ ֆոսֆատի (NADPH) վերականգնված ձևի մակարդակը։ NADPH իր հերթին պահպանում է վերականգնված գլյուտաթիոնի մակարդակը բջիջներում, որն էլ օգտագործվում է օքսիդատիվ վնասում առաջացնող ազատ ռադիկալներին չեզոքացնելու համար։
Գ6ՖԴ/ՆԱԴՖ ուղին արյան կարմիր բջիջներում (էրիթրոցիտ) վերականգնված գլյուտաթիոնի միակ աղբյուրն է։ Չնայած Գ6ՖԴ/ՆԱԴՖ/գյլուտաթիոն պրոտեկտիվ ազդեցությանը, էրիթրոցիտներում բարձր է օսիդատիվ վնասման ռիսկը, քանի որ դրանք թթվածնի փոխադրիչներ են։ Հետևաբար Գ6ՖԴ պակասուրդ ունեցող անհատները օքսիդատիվ սթրեսի պայմաններում ունենում են հեմոլիտիլ անեմիայի ռիսկ։ Օքսիդատիվ սթրեսը կարող է հարուցվել ինֆեկցիայով, դեղորայքների քիմիական ազդեցության հետևանքով և որոշակի սննդից[16]։
Երբ ողջ վերականգնված գլյուտաթիոնը սպառվում է, ֆերմենտներն ու սպիտակուցները (ներառյալ հեմոգլոբինը) վնասվում են օքսիդանտներով։ Առաջ է գալիս էրիթրոցիտների թաղանթների վնասում, վնասված էրիթրոցիտնրը ենթարկվում են ֆագոցիտոզի և սեկվեստրացիայի (դուրս են մղվում շրջանառությունից) փայծաղով։ Հեմոգլոբինը փոխակերպվում է բիլիռուբինի (բարձր կոնցենտրացիայով առաջացնում է դեղնուկ)։ Էրիթրոցիտնրը հազվադեպ քայքայվում են արյան շրջանառությունում, և հեմոգլոբինը անուղղակիորեն էքսկրեցիայի է ենթարկվում երիկամներով, սակայն ծանր դեպքերում կարող է առաջանալ սուր երիկամային անբավարարության։ Գ6ՖԴ պակասուրդն այլընտրանքային ուղում բերում է գլյուկոզի կուտակմանը, գլիկացման վերջնական պրոդուկտների շատացմանը։ Պակասուրդը նաև նվազեցնում է NADPH- ի մակարդակը, որը պահանջվում է ազոտի օքսիդի (NO) առաջացման համար։ Արևմուտքում տիպ 2 շաքարային դիաբետի և հիպերտոնիայի բարձր տարածվածությունը աֆրո-կարիբիանների մոտ հնարավոր է, որ այդ պոպուլյացիայում անուղղակի կապված է Գ6ՖԴՊ հաճախականության հետ[17]։
Չնայած որ կին կրողները կարող են ունենալ Գ6ՖԴՊ մեղմ ձևը (կախված չախտահարված X-քրոմոսոմի ինակտիվացիայի աստիճանից) հոմոզիգոտ կանայք ունենում են կինիկա։ Այս կանաց մոտ հանդիպում է հազվադեպ հանդիպող, քրոնիկ գրանուլեմատոզ հիվանդություն կոչվող իմուն խանգարում։
Ախտորոշում[խմբագրել | խմբագրել կոդը]
Ախտորոշումը սովորաբար հաստատվում է, երբ որոշակի էթնիկ խմբերի հիվանդների (տես՝ էպիդեմիոլոգիան) մոտ վերը նշված պատճառներից որևէ մեկին բախվելուց հետո (հատկապես, երբ դրական ընտանեկան պատմություն կա) զարգացնում են սակավարյունություն, դեղնախտ և հեմոլիզի ախտանիշներ։
Հիմնական ախտորոշիչ մեթոդներն են
- Արյան ընդհանուր և ռետիկուլոցիտների անալիզ։ Ակտիվ Գ6ՖԴՊ դեպքում էրիթրոցիտներում կարող են նկատվել Հեյնցի մարմնիկներ։
- Լյարդի ֆերմենտներ (ժխտելու համար այլ ծագման դեղնախտը)
- Լակտատ դեհիդրոգենազա ( բարձրանում է հեմոլիզի դեպքում և հանդիսանում է հեմոլզի ծանրության մարկեր)
- Հապտոգլոբին (նվազում է հեմոլիզի ժամանակ)
- «Ուղղակի անտիգլոբուլինային թոստ» (Կումբսի թեստ)։ Այն պետք է լինի բացասական, քանի որ հեմոլիզը իմուն միջնորդավորված չէ։
Երբ կան բավարար հիմքեր Գ6ՖԴՊ կասկածելու համար «Բեյտլերի ֆլյուրեսցենտային հետքի թեստը» հանդիսանում է ուղղակի թեստ։ Այն մեծապես փոխարինեց հին թեստը (Մոտուլսկու ներկի անգունացման թեստ)։ Այլ միջոցներ են ԴՆԹ-ի ուղղակի թեստավորումը և/կամ Գ6ՖԴ գենի սեկվենացիան
Բեյտլերի ֆլյուրեսցենտային հետքի թեստն արագ և ոչ թանկարժեք միջոց է, որը ուլտրամանուշակագույն լույսի տակ վիզուալիզացնում է Գ6ՖԴ-ի կողմից արտադրված ՆԱԴՖ-ն։ Երբ արյան հետքը ֆլյուրեսցենցիայի չի ենթարկվում, թեստը համարվում է դրակաՆ։ Այն կարող է կեղծ բացասական լինել ակտիվ հեմոլիզ ունեցող հիվանդների մոտ։ Այդ պատճառով էլ այն կատարվում է հեմոլիտիկ կրիզից 2-3 շաբաթ անց։
Երբ փայծաղում մակրոֆագը իդենտիֆիկացնում է Հեյնցի մարմնիկով էրիթրոցիտ, վերացնում է պրեցիպիտատն և թաղանթի մի փոքր հատված։ Առաջանում է բնութագրական «կծած բջիջներ»։ Երբ Հեյնցի մարմնիկներն արտադրվում են մեծ քանակությամբ, (ինչպես Գ6ՖԴՊ-ի դեպքում) դրանցից որոշները տեսանելի են դառնում էրիթրոցիտներում՝ բյուրեղային մանուշակագույնով ներկելիս։ Այս հեշտ և ոչ թանկարժեք թեստի միջոցով կարելի է նախնական ենթադրել Գ6ՖԴՊ մասին, որը հետագայում կարելի է հաստատել այլ թեստերով։
Դասակարգում[խմբագրել | խմբագրել կոդը]
Առողջապահություն համաշխարհային կազմակերպությունը (ԱՀԿ) Գ6ՖԴ գենետիկ տարբերակները դասակարգում է 5 դասերի, որոնցից առաջին երեքը վիճակներ են[18].
- Դաս I: Սուր պակասուրդ (<10% ակտիվություն) քրոնիկ (ոչ սֆերոցիտեմիկ) հեմոլիտիկ անեմիայով
- Դաս II: Սուր պակասուրդ (<10% ակտիվություն), ինտերմիտվող հեմոլիզով
- Դաս III: Միջին աստիճանի պակասուրդ (10-60% ակտիվություն) հեմոլիզ միայն սթրեսսորների ազդեցությամբ
- Դաս IV: Ոչ պակասուրդային տարբերակ (չկա կլինական հետևանքներ)
- Դաս V: Ֆերմենտի աճող ակտիվությամբ (չկա կլինական հետևանքներ)
Տարբերակիչ ախտորոշում[խմբագրել | խմբագրել կոդը]
6-ֆոսֆոգլուկոնատ դեհիդրոգենազային (6ՖԳԴ) անբավարարությունը ունի նույնատիպ ախտանիշներ և հաճախ շփոթվում է Գ6ՖԴՊ-ի հետ։ Երկուսն էլ նույն ուղու ֆերմենտներ են, սակայն այս հիվանդությունները կապված չեն և կարող են միաժամանկ հայտնաբերվել նույն անհատի մոտ։
Բուժում[խմբագրել | խմբագրել կոդը]
Առավել կարևոր է կանխարգելումը։ Պետք է խուսափել հեմոլիզ առաջացնող դեղամիջոցներից և պրոդուկտներից։ Որոշ պաթոգենների դեմ (հեպատիտ A և հեմպատիտ B) վակցինացիան կարող է կանխել ինֆեկցիա ինդուկցված գրոհը[19]։
Հեմոլիզի սուր փուլում կարող է անհրաժեշտ լինել արյան փոխներարկում կամ նույնիսկ դիալիզ սուր երիկամային անբավարարության ժամանակ։ Արյան փոխներարկումը համարվում է կարևոր սիմպտոմատիկ միջոց, քանի որ փոխներարկված էրիթրոցիտները չունեն Գ6ՖԴՊ և կունենան կյանքի նորմալ տևողություն ռեցիպիենտի արյան շրջանառությունում։ Հիվանդները պետք է խուսափեն այնպիսի դեղորայքից ինչպիսին է ասպիրինը։
Որոշ հիվանդներ կարող են շահել փայծաղի հեռացումի (սպլենէկտոմիա)[20], քանի որ այն համարվում է էրիթրոցիտների ոչնչացման կարևոր վայր։ Ֆոլաթթուն նշանակվում է ցանկացած դեպքում, երբ շրջանառվող էրիթրոցիտների քանակը բարձր է։ Թեպետ վիտամին E և սելենն ունեն հակաօքսիդանտային հատկություն, սակայն դրանց կիրառումը չի թեթևացնում Գ6ՖԴՊ-ի ծանրությունը։
Կանխատեսում[խմբագրել | խմբագրել կոդը]
Գ6ՖԴՊ ունեցող անհատները համեմատած առողջների ունեն սրտի իշեմիկ հիվանդության և ցերեբրովասկուլյար հիվանդություններով հիվանդանալու ավելի ցածր ռիսկ[21]։
Համաճարակաբանություն[խմբագրել | խմբագրել կոդը]
Գ6ՖԴ պակասուրդը երկրորդ ամենատարածված ֆերմենտային ախտահարումն է ALDH2-ից հետո։ Այն ամբողջ աշխարհում հանդիպում է առավել քան 400 միլիոն մարդկանց մոտ[22]։ Գ6ՖԴՊ-ից 2013 թվականին մահացել է 4.100 մարդ և 3400 մարդ 1990 թվականին[23]։ Աֆրիկյան, Մերձավոր Արևելքի և Հարավային Ասիայի բնակչությանը ամենից հաճախն են ախտահարվում[24][25]։ Գ6ՖԴՊ կոմնակի ազդեցությունն է մալարիայից պաշտպանությունը[26], մասնավորապես, Plasmodium falciparum-ով հարուցված (համարվում է առավել մահացու ձևը)։ Կա նմանատիպ կապ մալարիայի և մանգաղաձև բջջային անեմիայի միջև։ Մի տեսության համաձայն Plasmodium պարազիտով ախտահարված բջիջները արագ են հեռանում փայծաղով։ Այս երևույթը Գ6ՖԴՊ կրողներին տալիս է էվոլուցիոն առավելություն էնդեմիկ միջավայրում։ In vitro փորձարկումները պարզել են, որ Plasmodium falciparum -ը շատ զգայուն է օքսիդատիվ վնասմանը։ Սա հիմք է հանդիսանում մյուս տեսության համար։ Գենետիկական դեֆեկտը հաղորդում է կայունության այն պատճառով, որ Գ6ՖԴՊ-ով տերը ունի օքսիդանտների բարձր մակարդակ, որոնք տանելի են տիրոջ կողմից, սակայն մահացու են պարազիտի համար[27]։
Պատմություն[խմբագրել | խմբագրել կոդը]
Վիճակի ժամանակակից հասկացությունը սկսվել է Պրիմաքվինի նկատմամբ զգայուն անհատների հետազոտությամբ[28]։ Գ6ՖԴ պակասուրդի հայտանբերումը մեծապես իրականացվել է Իլլինոիսի պետական բանտի բանտարկյալ-կամավորների վրա թեստավորման արդյունքում։ Այս հետազոտման մեթոն այսօր չի կատարվում և համարվում է ոչ էթիկական։ Երբ որոշ բանտարկյալներին տալիս էին Պրիմաքվին դեղորայքը, մի մասի մոտ ի հայտ էր գալիս հեմոլիզ, մնուսների մոտ` ոչ։ Չնայած այս արդյունքներին, ԱՄՆ զինված ուժերը լայնորեն կիրառեցին դեղամիջոցը Կորեական պատերազմի ժամանակ, որպեսզի կանխեն վարակի տարածումը, որը հարուցվել էր Plasmodium vivax -ով։ Հյուսիս-աֆրիկյան և միջերկրածովյան ծագում ունեցող ամերիկյան զինվորների մոտ նկատվեցին բազմաթիվ հեմոլիտիկ անեմիայի դեպքեր[29]։
Cr51 թեստի միջոցով մեխանիզմը ուսումնասիրելուց հետո պարզ դարձավ, որ Պրիմաքվինի հեմոլիտիկ ազդեցությունը պայմանավորված է էրիթրոցիտների ներքին դեֆեկտի հետ[30]։
Հասարակություն և մշակույթ[խմբագրել | խմբագրել կոդը]
Թե՛ դիցաբանությունում, թե՛ լեգենդներում ֆավիզմը հայտնի է հնագույն ժամանակներից։ Հունա-հռոմեկան դարաշրջանի քրմերին արգելված էր ուտել կամ նույնիսկ հիշատակել բակլայի մասին։ Պիֆագորասը ուներ խիստ կանոն, ըստ որի պիֆագորյան հասարակությանը միանալու համար պետք էր հրաժարվել բակլայից[31]։ Ենթադրաբար այս արգելքն այն պատճառով էր, որ բակլան նման էր տղամարդու սեռական օրգաններին։ Կար նաև համոզմունք, թե բակլան և մարդիկ ստեղծված են միևնույն նյութից[32]։
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 «Glucose-6-phosphate dehydrogenase deficiency». Genetics Home Reference (անգլերեն). 2017 թ․ դեկտեմբերի 6. Վերցված է 2017 թ․ դեկտեմբերի 10-ին.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 «Glucose-6-phosphate dehydrogenase deficiency». Genetic and Rare Diseases Information Center (GARD) (անգլերեն). 2017. Արխիվացված է օրիգինալից 2021 թ․ ապրիլի 27-ին. Վերցված է 2017 թ․ դեկտեմբերի 10-ին.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 «Glucose-6-Phosphate Dehydrogenase Deficiency». NORD (National Organization for Rare Disorders). 2017. Արխիվացված է օրիգինալից 2021 թ․ ապրիլի 3-ին. Վերցված է 2017 թ․ դեկտեմբերի 11-ին.
- ↑ 4,0 4,1 GBD 2015 Mortality and Causes of Death, Collaborators. (2016 թ․ հոկտեմբերի 8). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
{{cite journal}}:|first1=has generic name (օգնություն)CS1 սպաս․ թվային անուններ: authors list (link) - ↑ Luzzatto, L. "GLUCOSE-6-PHOSPHATE DEHYDROGENASE DEFICIENCY." Advanced Medicine-Twelve: Proceedings of a Conference Held at the Royal College of Physicians of London, 11–14 February 1985. Vol. 21. Churchill Livingstone, 1986.
- ↑ «Triggers of G6PD crisis» (PDF). Sydney Local Health District. Արխիվացված է օրիգինալից (PDF) 2020 թ․ հուլիսի 31-ին.
- ↑ 7,0 7,1 7,2 7,3 Glucose-6-Phosphate Dehydogenase Deficiency (G6PD) on The Jewish Genetic Disease Consortium (JGDC) website [1].Արխիվացված 1 Հուլիս 2017 Wayback Machine
- ↑ Frank JE (2005 թ․ հոկտեմբեր). «Diagnosis and management of G6PD deficiency». Am Fam Physician. 72 (7): 1277–82. PMID 16225031. Արխիվացված է օրիգինալից 2021 թ․ օգոստոսի 28-ին. Վերցված է 2019 թ․ հունիսի 8-ին.
- ↑ 9,0 9,1 Warrell, David A.; Timothy M. Cox; John D. Firth; Edward J. Benz (2005). Oxford Textbook of Medicine, Volume Three. Oxford University Press. էջեր 720–725. ISBN 978-0-19-857013-4.
- ↑ A comprehensive list of drugs and chemicals that are potentially harmful in G6PD deficiency can be found in Beutler E (1994 թ․ դեկտեմբեր). «G6PD deficiency». Blood. 84 (11): 3613–36. PMID 7949118.(չաշխատող հղում).
- ↑ Raupp P, Hassan JA, Varughese M, Kristiansson B (2001). «Henna causes life threatening haemolysis in glucose-6-phosphate dehydrogenase deficiency». Arch. Dis. Child. 85 (5): 411–2. doi:10.1136/adc.85.5.411. PMC 1718961. PMID 11668106.
- ↑ Rees, DC; Kelsey, H; Richards, JD (1993 թ․ մարտի 27). «Acute haemolysis induced by high dose ascorbic acid in glucose-6-phosphate dehydrogenase deficiency». BMJ (Clinical Research Ed.). 306 (6881): 841–2. doi:10.1136/bmj.306.6881.841. PMC 1677333. PMID 8490379.
- ↑ Mehta, JB; Singhal, SB; Mehta, BC (1990 թ․ հոկտեմբերի 13). «Ascorbic-acid-induced haemolysis in G-6-PD deficiency». Lancet. 336 (8720): 944. doi:10.1016/0140-6736(90)92317-b. PMID 1976956.
- ↑ «Favism | genetic disorder».
- ↑ Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; Aster, Jon (2009-05-28). Robbins and Cotran Pathologic Basis of Disease, Professional Edition: Expert Consult - Online (Robbins Pathology) (Kindle Locations 33351-33354). Elsevier Health. Kindle Edition.
- ↑ Chevion, Mordechai; Navok, Tikva; Glaser, Gad; Mager, Jacob (1982 թ․ հոկտեմբերի 1). «The Chemistry of Favism-Inducing Compounds». European Journal of Biochemistry (անգլերեն). 127 (2): 405–409. doi:10.1111/j.1432-1033.1982.tb06886.x. ISSN 1432-1033.
- ↑ Gaskin RS, Estwick D, Peddi R (2001). «G6PD deficiency: its role in the high prevalence of hypertension and diabetes mellitus». Ethnicity & Disease. 11 (4): 749–54. PMID 11763298.
- ↑ WHO Working Group (1989). «Glucose-6-phosphate dehydrogenase deficiency». Bulletin of the World Health Organization. 67 (6): 601–11. PMC 2491315. PMID 2633878.
- ↑ Monga A, Makkar RP, Arora A, Mukhopadhyay S, Gupta AK (2003 թ․ հուլիս). «Case report: Acute hepatitis E infection with coexistent glucose-6-phosphate dehydrogenase deficiency». Can J Infect Dis. 14 (4): 230–1. doi:10.1155/2003/913679. PMC 2094938. PMID 18159462.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Hamilton JW, Jones FG, McMullin MF (2004 թ․ օգոստոս). «Glucose-6-phosphate dehydrogenase Guadalajara – a case of chronic non-spherocytic haemolytic anaemia responding to splenectomy and the role of splenectomy in this disorder». Hematology. 9 (4): 307–9. doi:10.1080/10245330410001714211. PMID 15621740.
- ↑ thefreedictionary.com > glucose-6-phosphate dehydrogenase deficiency citing: Gale Encyclopedia of Medicine. Copyright 2008
- ↑ Cappellini MD, Fiorelli G (2008 թ․ հունվար). «Glucose-6-phosphate dehydrogenase deficiency». Lancet. 371 (9606): 64–74. doi:10.1016/S0140-6736(08)60073-2. PMID 18177777.
- ↑ GBD 2013 Mortality and Causes of Death, Collaborators (2014 թ․ դեկտեմբերի 17). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
{{cite journal}}:|first1=has generic name (օգնություն)CS1 սպաս․ թվային անուններ: authors list (link) - ↑ Gelabert, Pere; Olalde, Iñigo; de-Dios, Toni; Civit, Sergi; Lalueza-Fox, Carles (2017). «Malaria was a weak selective force in ancient Europeans». Scientific Reports. 7 (1): 1377. Bibcode:2017NatSR...7.1377G. doi:10.1038/s41598-017-01534-5. ISSN 2045-2322. PMC 5431260. PMID 28469196.
- ↑ G-6-PD FAQ section
- ↑ Mehta A, Mason PJ, Vulliamy TJ (2000). «Glucose-6-phosphate dehydrogenase deficiency». Best Practice & Research Clinical Haematology. 13 (1): 21–38. doi:10.1053/beha.1999.0055. PMC 2398001. PMID 10916676.
- ↑ Nelson, David L.; Cox, Michael M. (2013 թ․ փետրվարի 13). Lehninger Principles of Biochemistry (6th ed.). Basingstoke, England: Macmillan Higher Education. էջ 576. ISBN 978-1-4641-0962-1.
- ↑ Alving AS, Carson PE, Flanagan CL, Ickes CE (1956 թ․ սեպտեմբեր). «Enzymatic deficiency in primaquine-sensitive erythrocytes». Science. 124 (3220): 484–5. Bibcode:1956Sci...124..484C. doi:10.1126/science.124.3220.484-a. PMID 13360274.
- ↑ Baird K (2015). «Origins and implications of neglect of G6PD deficiency and primaquine toxicity in Plasmodium vivax malaria». Pathog Glob Health. 109 (3): 93–106. doi:10.1179/2047773215Y.0000000016. PMC 4455359. PMID 25943156.
- ↑ Beutler E (2008 թ․ հունվար). «Glucose-6-phosphate dehydrogenase deficiency: a historical perspective». Blood. 111 (1): 16–24. doi:10.1182/blood-2007-04-077412. PMID 18156501.
- ↑ Simoons, F.J. (1996 թ․ օգոստոսի 30). «8». Plants of Life, Plants of Death. University of Wisconsin Press. էջ 216. ISBN 978-0299159047.
- ↑ Rendall, Steven; Riedweg, Christoph (2005). Pythagoras: his life, teaching, and influence. Ithaca, N.Y: Cornell University Press. ISBN 978-0-8014-4240-7.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Գլյուկոզ-6-ֆոսֆատ դեհիդրոգենազայի պակասուրդ» հոդվածին։ |
| ||||||||||
