Նատրիումի հիպոքլորիտ
| Նատրիումի հիպոքլորիտ | |
|---|---|
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | նատրիումի հիպոքլորիտ |
| Ավանդական անվանում | նատրիումի հիպոքլորիտ, լաբարակյան ջուր, ժավելաջուր[К 1] |
| Քիմիական բանաձև | NaClO |
| Ռացիոնալ բանաձև | NaOCl |
| Ֆիզիկական հատկություններ | |
| Մոլային զանգված | 1,2E−25 կիլոգրամ[3] գ/մոլ |
| Խտություն | պենտահիդրատ․ 1,574[1] գ/սմ3; 1,1[2] գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | NaOCl · 5H2O[К 2]․ 24,4 °C; NaOCl · 2,5H2O: 57,5 °C[4] °C |
| Եռման ջերմաստիճան | 5%-անոց լուծույթ[2]․ 40 °C °C |
| Գոյացան էնթալպիա | պենտահիդրատ[К 3]։ − 350,4 կՋ/մոլ[4] կՋ/մոլ |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | NaOCl · 5H2O (20 °C): 53,4[5] գ/100 մլ |
| Լուծելիությունը ջր-ում | NaOCl · 2,5H2O (50 °C): 129,9[5] գ/100 մլ |
| Դասակարգում | |
| CAS համար | 7681-52-9 |
| PubChem | 23665760 |
| EINECS համար | 231-668-3 |
| SMILES | [O-]Cl.[Na+] |
| ЕС | 231-668-3 |
| RTECS | NH3486300 |
| ChEBI | 22756 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Նատրիումի հիպոքլորիդ, NaOCl[К 4], անօրգանական միացություն, հիպոքլորաթթվի նատրիումական աղը։ Ջրային լուծույթի առօրյա անվանումը՝ «լաբարակյան ջուր» կամ «ժավելաջուր»[К 1]։
Միացությունը սովորական բաղադրությամբ շատ անկայուն է, հեշտությամբ օգտագործվում է պենտահիդրատի՝ NaOCl · 5H2O կամ ջրային լուծույթի տեսքով, որը ունի քլորին բնորոշ սուր հոտ և բավականին բարձր կոռոզման հատկություն։
Միացություն՝ ուժեղ օքսիդիչ է, պարունակում է 95,2 % ակտիվ քլոր[К 5]։ Այն ունի հականեխիչ և վարակազերծիչ հատկություն։ Օգտագործվում է վիրակապերի բաղադրության, սպիտակեղենի սպիտակեցման, վարակների, մաքրման միջոցների, ջրի ախտահանման մեջ և մի շարք քիմիական երևույթների մեջ ունի օքսիդիչ հատկություն։ Նրա բակտերիասպան և ստերիլիզացնող հատկությունը կիրառվում է բժշկության, սննդի արդյունաբերության և գյուղատնտեսության մեջ։
Ըստ The 100 Most Important Chemical Compounds (Greenwood Press, 2007) թերթի[2], նատրիումի հիպոքլորիտը մտնում է հարյուր ամենակարևոր քիմիական միացությունների մեջ։
Բացահայտման պատմություն[խմբագրել | խմբագրել կոդը]
1774 թվականին շվեդ քիմիկոս Կարլ Վիլհելմ Շեելեն բացահայտում է քլորը[6]։ 11 տարի անց՝ 1785 թվականին (մեկ այլ տվյալով 1787 թվականին[2]), մեկ այլ քիմիկոս՝ Կլոդ Լուի Բերթոլեն, բացահայտում է, որ այդ գազի ջրային լուծույթը ունի սպիտակեցնող հատկություն[7][К 6] (տես (1) հավասարումը)։
Փարիզյան ոչ մեծ Societé Javel ընկերությունը 1778 թվականին Սեն գետի ափերին և Լեոնարդ Ալբանի գլխավորությամբ (անգլ.՝ Leonard Alban) հաստատում է Բերթոլեի բացահայտումը, և այդ օրվանից սկսվում է գազային քլորը ջրի մեջ լուծելու արդյունաբերական գործընթացը։ Մեկ այլ ստացված նյութ շատ անկայուն էր և այդ պատճառով 1787 թվականին երևույթը ձևափոխվում է։ Քլորը ստանում էին պոտաշի (կալիումի կարբոնատ) ջրային լուծույթի միջոցով (տես (2) հավասարումը), որի արդյունքում առաջանում է բավականին կայուն քիմիական միացություն, որը ուներ սպտակեցնող հատկություն։ Ալաբանը դրան անվանեց «Eau de Javel» («ժավելաջուր»)։ Նոր նյութը միանգամից հայտնի դարձավ Անգլիայում և Ֆրանսիայում՝ շնորհիվ իր հեշտ փոխադրման և պահպանման[8]։
1820 թվականին ֆրզնսիացի դեղագործ Անտուան Լաբարակը (ֆր.՝ Antoine Germain Labarraque) պոտաշը փոխարինում է էժանագին կաուստիկ սոդայով (նատրիումի հիդրօքսիդ) (տես (3) հավասարումը)։ Նատրիումի հիպոքլորիտի ստացված լուծույթը անվանեցին «Eau de Labarraque» («լաբարակյան ջուր»)։ Այն դարձավ սպիտակեցման և վարակազերծման երկար կիրառման միջոցը[8]։
Չնայած նրան, որ հիպոքլորիտի վարակազերծման հատկությունը հայտնաբերվել է 19-րդ դարի առաջին կեսին, խմելու ջրի ախտահանման և ջրի թափոնների մաքրման աշխատանքները սկսվեցին միայն դարի վերջին։ Ջրի մաքրման առաջին մեխանիզմը բացահայտվեց Համբուրգում՝ 1893 թվականին[2]․ ԱՄՆ-ում թորած ջուր պատրաստելու համար առաջին գործարանը բացվեց 1908 թվականին՝ Ջերսի Սիթիում[9]։
Ֆիզիկական հատկություններ[խմբագրել | խմբագրել կոդը]
Անջուր նատրումի հիպոքլորիտը հանդես է գալիս անկայուն բյուրեղային նյութերի ձևով։ Քիմիական կազմը․ Na (30,9 %), Cl (47,6 %), O (21,5 %)։
Լավ է լուծվում ջրում․ 100 գրամ ջրում 53,4 գ (50 °C-ում՝ 100 գրամում 130 գրամ))[10]։
Միացությունից հայտնի է երեք բյուրեղահիդրատ․
- մոնոհիդրատ՝ NaOCl · H2O - չափազանց անկայուն է, քայքայվում է 60 °C-ից բարձր ջերմաստիճաններում, որը ուղեկցվում է պայթյունով[4]։
- NaOCl · 2,5H2O - բավականին կայուն է, լուծվում է 57,5 °C ջերմաստիճանային պայմաններում[4]։
- պենտահիդրատ NaOCl · 5H2O - համեմատաբար կայուն է, իրենից ներկայացնում է սպիտակ (մեկ այլ տվյալներով թույլ կանաչ[11]) շեղանկյունաձև բյուրեղ (a = 0,808 նմ, b = 1,606 նմ, c = 0,533 նմ, Z = 4)։ Հիդրոսկոպիկ չէ, լավ է լուծվում ջրում(100 գրամ ջրի հաշվարկով)․ 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C)։ Օդում տարածվում է՝ անցնում է հեղուկ վիճակի, արագ ընդլայնվում է[4]։ Հալման ջերմաստիճանը․ 24,4 °C (մեկ այլ տվյալով․ 18 °C[11]), տաքացման պայմաններում (30-50 °C) քայքայվում է[1]։
Նատրիումի հիպոքլորիտի ջրային լուծույթի խտությունը 18 °C-ում[12]։
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Խտություն, գ/լ | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Նատրիումի հիպոքլորիտի ջրային լուծույթի կոնցենտրացիան սառեցման դեպքում[13]․[էջ 458]․
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Սառեցման ջերմաստիճան, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Նատրիումի հիպոքլորիտի ջրային լուծույթի թերմոդինամիկական հատկությունները լուծույթը նոսրեցնելու դեպքում[14]․
- ձևավորման ստանդարտ էնթալպիա, ΔHo298․ −350,4 կՋ/մոլ,
- Գիբսի ստնդարտ էներգիա, ΔGo298․ −298,7 կՋ/մոլ։
Քիմիական հատկություններ[խմբագրել | խմբագրել կոդը]
Քայքայում և օքսիդավերականգնում[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորիտը անկայուն միացություն է, հեշտությամբ քայքայվում է՝ ազատ թթվածին անջատելով․
Այն կարող է հետզհետև քայքայվել նաև սենյակային ջերմաստիճաններում․ 40 օրվա ընթացքում պենտահիդրատը (NaOCl · 5H2O) անջատում է մոտ 30 % ակտիվ քլոր[К 5][14]։ 70 °C չոր հիպոքլորիտի տաքացումը հանգեցնում է պայթյունի[15]։
Տաքացմանը զուգահեռ, տեղի է ունենում օքսիդավերականգնման ռեակցիա[14]․
Հիդրոլիզ և քայքայում ջրային լուծույթում[խմբագրել | խմբագրել կոդը]
Ջրում լուծվելով նատրիումի հիպոքլորիտը դիսոցվում է իոնների․
Ինչպես և հիպոքլորաթթուն (HOCl) այն շատ աղքատ է (pKa = 7,537[14]), հիպոքլորիտ իոնը ջրային միջավայրում հիդրոլիզվում է․
Հիպոքլորաթթվի առկայությունը նատրիումի հիպոքլորիտի ջրային լուծույթում բացատրվում է նրա ուժեղ վարակազերծիչ և սպիտակեցնող հատկությամբ[14]։
Նատրիումի հիպոքլորիտի ջրային լուծույթը անկայուն է և ժամանակի ընթացքում նույնիսկ սովորական ջերմաստիճաններում քայքայվում է (օրում 0,085 %)։ Քայքայումը արագանում է լույսի ազդեցությամբ, ծանր մետաղների իոններով և ալկալիական մետաղների քլորիդներով․ հակառակը՝ մագնեզիումի սուլֆատը, սիլիկատները, նատրիումի հիդրօքսիդը և բորաթթուն դանդաղեցնում են երևույթը․ առավել կայուն են թույլ ալկալիական մետաղների նկատմամբ (pH > 11)[4]։
Ուժեղ հիմնային միջավայրում (pH > 10), որտեղ հիպոքլորիտ իոնի դիսոցումը ճնշվում է, տեղի է ունենում իոնի քայքայում[16]․
35 °C-ից բարձր ջերմաստիճաններում տեղի է ունենում օքսիդավերականգնման ռեակցիա[16]․
pH-ը 5-ից 10 միջակայքու, որտեղ հիպոքլորաթթվի կոնցենտրացիան դառնում է նկատելի, քայքայումը գնում է հաջորդ եղանակով[16]․
Թթվային միջավայրում HOCl-ի քայքայուման արագությունը մեծանում է, իսկ շատ ուժեղ թթվային միջավայրում (pH < 3) քայքայումը գնում է մեկ այլ մեխանիզմով[14]․
Եթե օքսիդացման համար օգտագործվում է աղաթթու, արդյունքում քլոր է անջատվում․
Նատրիումի հիպոքլորիտի ջրային լուծույթի վրայով ածխաթթու գազ անցկացնելով, կարող ենք ստանալ հիպոքլորաթթվի լուծույթ․
Օքսիդացնող հատկություն[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորիդի ջրային լուծույթը ջրային լուծույթը ուժեղ օքսիդիչ է, մասնակցում է մի շարք հիմիական ռեակցիաների և ցուցաբերում է վերականգնիչ հատկություն՝ անկախ թթու-հիմնային հատկությունից[17]։
Դիտարկենք օքսիդացման-վերականգնման և ստանդարտ էլեկտրոդային պոտենցիալներ զարգացման հիմնական եղանակները՝ ջրային լուծույթում[18][К 7]։
- թթվային միջավայրում․
- չեզոք և հիմնային միջավայրում․
Մի քանի օքսիդացման-վերականգնման ռեակցիաներ նատրիումի հիպոքլորիտի մասնակցությամբ․
- Սուլֆիտները օքսիդացնում է մինչև սուլֆատներ, նիտրիտները՝ նիտրատներ, օքսալատները և ֆորմիատները՝ կարբոնատներ, և այդպես շարունակ[14]․
- Ամոնիակը նատրիումի հիպոքլորիդով ազդելիս առաջացնում է միաքլորամին, իսկ հետո՝ հիդրազին (նման ձևով ստացվում է նաև միզանյութ)[19]․[էջ 181]․
-
- Մետաղների միացությունները օքսիդացման ցածր աստիճանից բարձրացմում է ավելի բարձր օքսիդացման աստիճան[19]․[էջ 138, 308][20]․[էջ 200]․
- Ըստ նմանության կարելի է իրականացնել հետրևյալ փոխակերպումը․ Fe(II) → Fe(III) → Fe(VI), Co(II) → Co(III) → Co(IV), Ni(II) → Ni(III), Ru(IV) → Ru(VIII), Ce(III) → Ce(IV) և այլն[21]։
Նույնականացում[խմբագրել | խմբագրել կոդը]
Որակական վերլուծության մեջ հիպոքլորիդ իոնը կարող է առաջացնել շագանակագույն նստվածք, որը առաջանում է երբ փորձնական լուծույթին ալկալի և թալիումի աղ ենք ավելացնում (հայտնաբերման սահմանը՝ 0,5 մկգ հիպոլքորիտ)․
Մեկ այլ տարբերակ՝ յոդ-օսլայային ռեակցիան աղաթթվային միջավայրում և 4,4’-տետրամեթիլդիամինոդիֆենիլմեթանի գունավոր ռեակցիան կամ n, n’-դիօքսիտրիֆենիլմեթան՝ կալիումի բրոմատի բերկայությամբ[22]։
Նատրիումի հիպոքլորիդի որակական վերլուծության հասարակ ձևերից է պոտենցիալաչափության եղանակը[К 8] կամ վերլուծվող լուծույթի կոնցենտրացիայի կրճատումը[К 9]՝ իոնային ընտրողական էլեկտրոդների օգնությամբ[23]։
Մեկ այլ տարբերակ է տիտրման մեթոդը՝ կալիումի յոդիդի կիրառմամաբ (յոդաչափության եղանակ)[24]
Քայքայիչ ազդեցություն[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորտիտը ունի բավականին ուժեղ քայքայիչ ազդեցություն, ինչը վկայում է ներքևում նշված տվյալները[25]․
| Նյութ | Կոնցենտրացիա NaOCl, % | Ազդեցության ձև | Ջերմաստիճան, °C | Քայքայման արագություն և բնույթ |
|---|---|---|---|---|
| Ալյումին | — | կոշտ, թաց | 25 | > 10 մմ/տարի |
| 10; pH>7 | ջրային լուծույթ | 25 | > 10 մմ/տարի | |
| պղինձ | 2 | ջրային լուծույթ | 20 | < 0,08 մմ/տարի |
| 20 | ջրային լուծույթ | 20 | > 10 մմ/տարի | |
| Պղնձե համաձուլվածք․ |
10 | ջրային լուծույթ | 20 | > 10 մմ/տարի |
| Նիկել | < 34 | ջրային լուծույթ | 20 | 0,1—3,0 մմ/տարի |
| Նիկելային համաձուլվածք | < 34; ակտիվ քլոր․ 3 | ջրային լուծույթ | 20 | 0,007 մմ/տարի |
| Նիկելային համաձուլվածք | < 34 | ջրային լուծույթ | 35—100 | < 0,004 մմ/տարի |
| Պլատին | < 34 | ջրային լուծույթ | < 100 | < 0,1 մմ/տարի |
| Կապար | < 34; ակտիվ քլոր․ 1 | ջրային լուծույթ | 20 | 0,54 մմ/տարի |
| 40 | 1,4 մմ/տարի | |||
| Արծաթ | < 34 | ջրային լուծույթ | 20 | < 0,1 մմ/տարի |
| Պողպատ | — | կոշտ, անջուր | 25—30 | < 0,05 մմ/տարի |
| 0,1; pH > 10 | ջրային լուծույթ | 20 | < 0,1 մմ/տարի | |
| > 0,1 | ջրային լուծույթ | 25 | > 10,0 մմ/տարի | |
| Պողպատ | 5 | ջրային լուծույթ | 20 | > 10,0 մմ/տարի |
| Պողպատ | < 34; ակտիվ քլոր․ 2 | ջրային լուծույթ | 40 | < 0,001 մմ/տարի |
| 1,0—3,0 մմ/տարի | ||||
| Պողպատ | < 34 | ջրային լուծույթ | 20 | < 0,1 մմ/տարի |
| Տանտալ | < 34 | ջրային լուծույթ | 20 | < 0,05 մմ/տարի |
| Տիտան | 10—20 | ջրային լուծույթ | 25—105 | < 0,05 մմ/տարի |
| 40 | ջրային լուծույթ | 25 | < 0,05 մմ/տարի | |
| Ցիրկոնիում | 10 | ջրային լուծույթ | 30—110 | < 0,05 մմ/տարի |
| 20 | ջրային լուծույթ | 30 | < 0,05 մմ/տարի | |
| Մոխրագույն թուջ | < 0,1; pH > 7 | ջրային լուծույթ | 25 | < 0,05 մմ/տարի |
| > 0,1 | ջրային լուծույթ | 25 | > 10,0 մմ/տարի | |
| Թուջ | < 34 | ջրային լուծույթ | 25—105 | < 1,3 մմ/տարի |
| Ասբեստ | 14 | ջրային լուծույթ | 20—100 | կայուն |
| Գրաֆիտ | 25 | ջրային լուծույթ | կայուն | |
| Պոլիամիդներ | < 34 | ջրային լուծույթ | 20—60 | կայուն |
| Պոլիվինիլքլորիդ | < 34 | ջրային լուծույթ | 20 | կայուն |
| 65 | համեմատաբար կայուն | |||
| Պոլիզոբութիլեն | < 34 | ջրային լուծույթ | 20 | կայուն |
| 60 | համեմատաբար կայուն | |||
| 100 | անկայուն | |||
| Պոլիմեթիլմետակրիլատ | < 34 | ջրային լուծույթ | 20 | կայուն |
| Պոլիէթիլեն | < 34 | ջրային լուծույթ | 20—60 | կայուն |
| Պոլիպրոպիլեն | < 34 | ջրային լուծույթ | 20—60 | կայուն |
| Ռետին | 10 | ջրային լուծույթ | 20—65 | կայուն |
| հագեցած | ջրային լուծույթ | 65 | կայուն | |
| Ռետին | 10—30 | ջրային լուծույթ | 65 | կայուն |
| Ռետին | ցանկացած | ջրային լուծույթ | 20—100 | կայուն |
| Ռետին | < 34 | ջրային լուծույթ | 20—93 | կայուն |
| Ռետին | 20 | ջրային լուծույթ | 24 | համեմատաբար կայուն |
| հագեցած | ջրային լուծույթ | 65 | կայուն | |
| Ռետին | < 34 | ջրային լուծույթ | 20—60 | կայուն |
| Ապակի | < 34 | ջրային լուծույթ | 20—60 | կայուն |
| Ֆոտոպլաստ | ցանկացած | ջրային լուծույթ | 20—100 | կայուն |
| էմալ | ցանկացած | ջրային լուծույթ | < 100 | կայուն |
| համեմատաբար դիմացկուն |
Ֆիզիոլոգիական հատկություններ և ազդեցությունը շրջակա միջավայրի վրա[խմբագրել | խմբագրել կոդը]
NaOCl-ը այն հայտնի նյութերից է, որի հիպոքլորիդ իոնը ունի հակաբակտերիալ ակտիվություն։ Այն նույնիսկ շատ փոքր կոնցենտրացիայով շատ արագ սպանում է միկրոօրգանիզմներին։
Ամենաբարձր բակտերիասպան հատկությունը այն ցուցաբերում է չեզոք միջավայրում, երբ HClO-ի կենցենտրացիան և ClO− հիպոքլորիտ անիոնի կոնցենտրացիան մոտավորապես հավասարվում են։ Հիպոքլորիդ անիոնի քայքայումը ուղեկցվում է մի շարք ակտիվ մասնիկների առաջացմամբ, մասնավորապես, մոլեկուլային թթվածին, որն ունի վարակազերծիչ հատկություն[26]։ Առաջացած ակտիվ մասնիկները մասնակցում են միկրոօրգանիզմների ոչնչացմանը, իրենց կառուցվածքով փոխազդում են պոլիմերների հետ, ընդունակ են օքսիդացման։ Հետազոտություններ ցույց են տվել, որ այդ գործընթացները նման են բոլոր բարձրագույն օրգանիզմներում տեղի ունեցող գործընթացներին։ Մարդու մի քանի բջիջներ (Նեյտրոֆիլային գրանուլոցիտները, հեպատոցիտները և այլն) սինթեզում են հիպոքլորային թթու, կապված են միկրոօրգանիզմների և օտարածին նյութերի պայքարի հետ[27]։
Խմորասնկերը առաջացնում են կանդիդոզ՝ Candida albicans, NaOCl-ի 5,0-0,5%-անոց 30 վայրկյանի ընթացքում կարող է սպանել բակտերիաներին և միկրոօրգանիզմներին․ եթե կոնցենտրացիան փոքր է 0,05 %-ից նյութը իր ազդեցությունը թողնում է 24 ժամվա ընթացքում։ Նատրիումի հիպոքլորիտը ավելի շատ ազդում է էնթերոկոկերի դիմադրողականության վրա։ Այպես օրինակ, պաթոգեն Enterococcus faecalis-ը[К 10] մահանում է 30 վայրկյանի ընթացքում՝ 5,25%-անոց լուծույթով և 30 րոպեի ընթացքում՝ 0,5%-անոց լուծույթով։ Գրամբացասական անաէրոբ բակտերիաները, ինչպիսիք են՝ Porphyromonas gingivalis, Porphyromonas endodontalis և Prevotella intermedia-ը[К 11] NaOCl-ի 5,0-0,5%-անոց լուծույթով սատկում են 15 վայրկյանի ընթացքում[28]։
Չնայած նատրիումի հիպոքլորիտի կենսածին հատկությանը պետք է հասկանալ, որ մի քանի պոտենցիալ վտանգավոր նախակենդանիներ, օրինակ, վտանգավոր պաթոգեններ են լամբլիոզը կամ կրիստոսպորոգինազը[29], որոնք կայուն են այդ գործողությունների նկատմամբ։
Ստացման լաբորատոր եղանակներ[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորիդի լաբորատոր ստացման հիմնական եղանակը համարվում է գազային քլորի՝ նատրիումի հիդրօքսիդի սառը լուծույթի վրայով անց կացնելը[30]․
Նատրիումի քլորիդը (NaCl) լուծույթից առանձնացնելու համար այն սառեցնում են մոտավորապես մինչև 0 °C՝ աղը նստում է նստվածքի տեսքով։ Հետո մնացած լուծույթը սառեցնում են (−40 °C) և −5 °C պայմաններում ստանում են նատրիումի հիպոքլորիդի պենտահիդրատը՝ NaOCl · 5H2O։ Անջուր աղը ստանում են վաակումային պայմաններում՝ ծծմբական թթվի առկայությամբ[30]։
Հիդրօքսիդի փոխարեն կարող ենք կիրառել նատրիումի կարբոնատ[31]․
Նատրիումի հիպոքլորիդի ջրային լուծույթ կարելի է ստանալ նատրիումի կարբոնատի և կալիցիումի հիպոքլորիդի փոխանակային ռեակցիայից[32]․
Արդյունաբերական արտադրություն[խմբագրել | խմբագրել կոդը]
Համաշխարհային արտադրություն[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորիտի արտադրության համաշխարհային ծավալների որոշ դժվարությունները կապված են նրա հետ, որ շատ բան է արտադրվում «in situ» սկզբունքով, այսինքն դա վկայում է նրա անմիջական սպառման մասին։ 2005 թվականի տվյալներով NaOCl-ի համաշխարհային արտադրությունը կազմում է 1 մլն տոննա, որի մի մասը օգտագործվում է վիրակապերի, իսկ մյուս մասը՝ արդյունաբերական ծրագրերի համար[2]։
Արդյունաբերական մեթոդով ստացման եղանակներ[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորիտի սպիտակեցնող և վարակազերծող հատկությունները հանգեցնում են դրա ինտենսիվ սպառմանը, որն իր հերթին թափ է հաղորդում արդյունաբերական արտադրությանը։
Ներկայումս գոյություն ունի նատրիումի հիպոքլորիտի ստացման երկու հիմնական եղանակ․
- քիմիական մեթոդ - նատրիումի հիդրօքսիդի լուծույթի քլորացում,
- էլեկտրաքիմիական մեթոդ - նատրիումի քլորիդի ջրային լուծույթի էլեկտրոլիզ[33]։
Իր հերթին քիմիական քլորացումը բաժանվում է երկու ճյուղի․
- հիմնական գործընթաց, որտեղ վերջնական նյութի որակը (մոտավորապես 16 % NaOCl) ստեղծվում է քլորիտի և հիպոքլորիդի խառնուրդով և նատրիումի հիդրօքսիդով․
- թույլ աղային կամ կոնցենտրիկ գործընթաց - սա թույլ է տալիս ստանալ կոնցենտրիկ լուծույթ (25-40 % NaOCl)՝ պակաս աղտոտման հետ[34]․[էջ 447-449]։
Քիմիական եղանակ[խմբագրել | խմբագրել կոդը]
NaOCl-ի քիմիական եղանակի էությունը չի փոփոխվել Լաբարկի բացահայտումիվ հետո․
Ժամանակակից քիմիական հսկան՝ Dow Chemical Company, առաջին ընկերություններից մեկն էր, որը լայնամասշտաբ հիմքերով սկսեց նատրիումի հիպոքլորիդի արտադրությունը։ 1898 թվականին բացահայտվեց NaOCl-ի արդյունաբերական ստացման եղանակը։ Ուրիշ ընկերություններից, որոնց շնորհիվ այս նյութը ձեռք բերեց իր ճանաչումը՝ Clorox-ն էր, ԱՄՆ-ում վիրակապերի արտադրությամբ զբաղվող մեծագույն ընկերությունը։ 1913 թվականին ստեղծման ժամանակ՝ մինչև 1957 թվականը, ընկերությունը գնում է Procter & Gamble կոնցեռնը, իսկ նատրիումի հիպոքլորիդի սպիտակեցման հիման վրա Clorox Bleach-ը այդ տեսականիում դարձավ միակ ընկերությունը[2]։
Նատրիումի հիպոքլորիդի արդյունաբերական ստացման հիմնական եղանակները պատկերված են նկարում[34]․[էջ 442]․
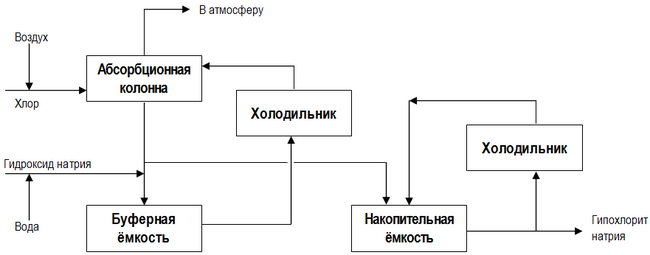
Թույլ աղային գործընթացը ի տարբերություն տեխնոլոգիական գծապատկերի, այն ներառում է երկու քլորացման փուլ (տես նկարը), որտեղ տեղի է ունենում վերջնական նյութի կոնցենտրացումը և NaOCl-ի լուծույթի ջրիկացումը՝ առաջին ռեակտորում[34]․[էջ 450]․

Ռուսաստանում նատրիումի հիպոքլորիդի արտադրանքը և վաճառքը կատարում են հետևյալ ընկերությունները․
- «Կաուստիկ» (Ստեռլիտամակ)[35],
- «Կաուստիկ» (Վոլգոգրադ)[36],
- «Նորմոսկովյան քլոր» (Նորմոսկվա)[37],
- «Սոդա-քլորատ» (Բերեզնիկի)[38]։
Էլեկտրաքիմիական եղանակ[խմբագրել | խմբագրել կոդը]
Նատրիումի հիպոքլորիդի էլեկտրաքիմիական եղանակը ստացվում է նատրիումի քլորիդի ջրային լուծույթի էլեկտրոլիզի պահին կամ ծովի ջրի մեջ էլեկտրոլիզատրի էլեկտրոդներ մտցնելով (ոչ մեմբրանային եղանակ), այսինքն էլեկրոլիզի հետևանքով առաջանում է նյութերի խառնուրդ[39]․
Գործընթաց անոդի վրա․
Գործընթաց կաթոդի վրա․
Գործընթացի հետևանքով էլեկտրոլիզային գուռում առաջանում են նոր նյութեր․
Գործընթացի ընդհանուր ռեակցիան․
Էլեկտրաքիմիական մեթոդը հիմնականում օգտագործում են վարակազերծող լուծույթներ պատրաստելու համար՝ ջրի աղտահանման համար։ Այս մեթոդի հեշտությունը կայանում է նրանում, որ հիպոքլորիդի արտադրությունը չի պահանջում քլորի մատակարարում, արտադրվում է տեղում՝ ջրով, խուսափելու համար նավերի ծախսերից․ բացի դրանից, այս եղանակը թույլ է տալիս արտադրել նատրիումի հիպոքլորիդ՝ ծավալի զարգացման բավականին լայն շրջանականերում[39]։
Աշխարհում նատրիումի հիպոքլորիդ ստանալու համար կիրառվում է մի շարք եղանակներ, որոնցից հատկանշական է Severn Trent De Nora: Seaclor և Sanilec ընկերության կազմած համակարգը[40]։
Seaclor®-ի համակարգը աշխարհում համարվում է ամենատարածված եղանակը՝ ծովի ջրից էլեկտրոլիզով նատրիումի հիպոքլորիդ ստանալու համար․ ծովային ջրի ավելի քան 70 %-ը։ Seaclor®-ի ավելի քան 400 կայան աշխատում է աշխարհի շուրջ 60 երկրներում․ տարեկան արտադրվում է ավելի քան 450 հազար տոննա NaOCl, միավոր հզորությունը տատանվում է 227-22 680 կգ/օր սահմաններում[41]։ Կայանները թույլ են տալիս լուծույթում ստանալ 0,1-0,25 % ակտիվ քլոր[42]։
Sanilec® կայանները արտադրում են 1,2-ից (շարժական գեներատորներ) 21 600 կգ/օր[43], իսկ ակտիվ քլորի կոնցենտրացիան կազմում է 0,05-0,25 %[44]։
Մեկնաբանություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 Խստորեն ասված է, որ և՛ «լաբարակյան ջուրև», և՛ «ժավելաջուրը» ստացվում են այդ աղերի խառնուրդի ջրային լուծույթից (քլորիդ և հիպոքլորիտ), համապատասխանաբար նատրիումի ու կալիումի, որը բավատրվում տեխնոլոգիական արտադրության մեջ (քլորիդ և հիպոքլորիտ)․ դրանք ստացվում են, երբ գազային քլորը անց ենք կացնում հիդրօքսիդի ջրային լուծույթով կամ ալկալիական մետաղի կարբոնատի վրայով։ Սկզբնաղբյուրենրում հիմնականում «ժավելաջուր» անվանումը վեևրաբերվում է կալիումի հիպոքլորիտին, իսկ գործնականում (այդ թվում գրականության մեջ) այս անվանումով հանդիպում է հիմնականում նատրիումի հիպոքլորիտը։
- ↑ Անջուր նատրիումի հիպոքլորիտի ֆազային անցման համար չի հայտնաբերվել միացության քայքայում։
- ↑ Ջրային լուծույթի անսահման նոսրացումը։
- ↑ Չնայած նրան, որ ներկայիս հոդվածում նատրիումի հիպոքլորիտի համար օգտագործվում է NaOCl (նատրիումը քլորի հետ կապված է ոչ անմիջապես), գիտական գրականության մեջ ցուցադրվում է ինչպես NaOCl այնպես էլ, NaClO,սակայն հաջորդ տարբերակը հանդիպում է ավելի հաճախ։ Ներկայիս հոդվածում օգտագործվում է NaOCl տարբերակը, որը կապված է վերջին տարիների գրականության մեջ հենց այդպես նշելու հետ։
- White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 454. — ISBN 978-0-470-18098-3
- Housecroft C. E., Sharpe A. G. Inorganic Chemistry. — Third edition. — Edinburgh: Pearson Education Limited, 2007. — P. 553. — ISBN 978-0-13-175553-6
- Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 2: Химия непереходных элементов. — С. 307—308. — ISBN 5-7695-1436-1
- ↑ 5,0 5,1 Под «активным хлором» понимается количество хлора, выделяющегося при взаимодействии с HCl. В чистом хлоре содержится 100 % «активного хлора». Содержание «активного хлора» в процентах рассчитывается как отношение массы одного моля хлора (70,9 г) к массе искомого вещества, способного при реакции с HCl выделить один моль хлора (74,5 г для NaOCl).
- ↑ До открытия отбеливающих свойств хлора и его производных отбелка ткани представляла собой весьма трудоёмкий и длительный процесс, часто длившийся до восьми недель. Полотно вымачивали в кислом молоке или пахте, а также долго выдерживали под солнцем. Только в 1756 году была совершена первая попытка применить химическое отбеливание для отбеливания ткани: шведский химик Френсис Хоум предложил использовать слабый раствор серной кислоты, сократив время процедуры до 12 часов.
- ↑ Приведены значения стандартных электродных потенциалов в водных растворах при температуре 25 °C и давлении 1 атм. Величины потенциалов выражены в вольтах по отношению к стандартному потенциалу водородного электрода, принятому при всех температурах за нуль.
- ↑ МДА — метод основан на прибавлении точно измеренного объёма пробы к стандартному раствору определяемого иона, специфически определяемого ионоселективным электродом.
- ↑ МУА — метод основан на прибавлении точно измеренной пробы к раствору, содержащему ион, который стехиометрически взаимодействует с определяемым ионом и специфически определяется ионоселективным электродом.
- ↑ Կաղապար:Bt-latrus — патогенная флора мочевых и половых путей.
- ↑ Все перечисленные виды — патогенная флора околозубной ткани.
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ 1,0 1,1 Лидин Р. А., Андреева Л. Л., Молочко В. А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 137. — ISBN 5-7107-8085-5
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Myers R. L. The 100 Most Important Chemical Compounds: A Reference Guide. — Westport: Greenwood Press, 2007. — P. 260. — ISBN 978-0-313-33758-1 Քաղվածելու սխալ՝ Սխալ
<ref>թեգ. «micc» անվանումը սահմանվել է մի քանի անգամ, սակայն տարբեր բովանդակությամբ: - ↑ 3,0 3,1 SODIUM HYPOCHLORITE
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Натрия гипохлорит // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 355. — ISBN 5-85270-039-8
- ↑ 5,0 5,1 Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 618. — ISBN 5-7107-8085-5
- ↑ «Хлор, Chlorum, Cl (17)». Открытие элементов и происхождение их названий. Химическая информационная сеть ChemNet. Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ հունվարի 27-ին.
- ↑ Baldwin R. T. Uses of chlorine(անգլ.) // Journal of Chemical Education. — 1927. — Т. 4. — № 4. — С. 454.
- ↑ 8,0 8,1 Ronco C., Mishkin G. J. The Hystory of Hypochlorite // Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — P. 7—8. — ISBN 978-3-8055-8193-6
- ↑ Drinking Water and Health / Assembly of Life Sciences, Safe Drinking Water Committee. — Washington: National Press Academy, 1980. — Т. 2. — P. 18. — ISBN 978-030902931-5
- ↑ «Таблица неорганических и координационных соединений». Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.com. Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ հունվարի 25-ին.
- ↑ 11,0 11,1 Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 870—871. — ISBN 0-07-049439-8
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 657. — ISBN 5-7107-8085-5
- ↑ White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 452—571. — ISBN 978-0-470-18098-3
- ↑ 14,0 14,1 14,2 14,3 14,4 14,5 14,6 14,7 Гипохлориты // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 1121—1122.
- ↑ Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 6.
- ↑ 16,0 16,1 16,2 «Химизм разложения активного хлора в растворах» (PDF). ООО ФСП «Кравт». Արխիվացված է օրիգինալից (PDF) 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ հունվարի 29-ին.
- ↑
- ↑ «Электродные процессы в растворах». Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия. ChemAnalytica.com. Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ հունվարի 25-ին.
- ↑ 19,0 19,1 19,2 Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 2: Химия непереходных элементов. — 368 с. — ISBN 5-7695-1436-1
- ↑ Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3, Книга 1: Химия переходных элементов. — 352 с. — ISBN 5-7695-2532-0
- ↑ Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3, Книга 2: Химия переходных элементов. — 400 с. — ISBN 5-7695-2533-9
- ↑ Фрумина Н. С., Лисенко Н. Ф., Чернова М. А. Хлор. — Серия: Аналитическая химия элементов. — М.: Наука, 1983. — С. 25.
- ↑ «Прямая потенциометрия». Новый справочник химика и технолога. Аналитическая химия (часть I). ChemAnalytica.com. Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ հունվարի 25-ին.
- ↑ Иодометрия // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 496—497. — ISBN 5-85270-035-5
- ↑ «Коррозионная стойкость материалов». Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия. ChemAnalytica.com. Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ հունվարի 25-ին.
- ↑ Швецов А. Б., Козырева А. В., Седунов С. Г., Тараскин К. А. Хлорные дезинфектанты и их применение в современной водоподготовке // Молекулярные технологии. — 2009. — № 3. — С. 98—121.
- ↑ Бахир В. М. Оптимальный путь повышения промышленной и экологической безопасности объектов водоподготовки и водоотведения ЖКХ // Питьевая вода. — 2007. — № 6. — С. 4—15.
- ↑ Ingle J. I., Bakland L. K., Baumgartner J. C. Ingle’s Endodontics 6. — 6. — BC Deker, 2008. — P. 998—999. — ISBN 978-1-55099-333-9
- ↑ Water Treatment and Pathogen Control: Process Efficiency in Achieving Safe Drinking Water / World Health Organization. — London: IWA Publishing, 2004. — P. 45. — ISBN 1-84339-069-8
- ↑ 30,0 30,1 Губер Ф., Шмайсер М., Шенк П. В., Фехер Ф., Штойдель Р., Клемент Р. Руководство по неорганическому синтезу: в 6 томах / Пер. с немецкого / Под редакцией Г. Брауэра. — М.: Мир, 1985. — Т. 2. — С. 355—356.
- ↑ Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под ред. проф. Н. В. Лазарева и проф. И. Д. Гадаскиной. — Издание 7-е, пер. и доп. — Л.: Химия, 1977. — Т. 3. — С. 44.
- ↑ Крамаренко В. Ф. Токсикологическая химия. — Киев: Выща школа, 1989. — С. 426. — ISBN 5-11-000148-0
- ↑ Ronco C., Mishkin G. J. Production of Sodium Hypochlorite // Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — P. 9. — ISBN 978-3-8055-8193-6
- ↑ 34,0 34,1 34,2 Handbook of Detergents, Part F: Production / Edited by Uri Zoller, co-editor Paul Sosis. — Surfactant Science Series. — CRC Press, 2009. — Т. 142. — 593 p. — ISBN 978-0-8247-0349-3
- ↑ «Натрия гипохлорит». Chemindustry.ru. Վերցված է 2010 թ․ փետրվարի 12-ին.(չաշխատող հղում)
- ↑ «Гипохлорит натрия». ОАО «Каустик». Արխիվացված օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 12-ին.
- ↑ «Гипохлорит натрия». ЗАО «НПО Реагенты». Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 12-ին.
- ↑ «Гипохлорит натрия». ООО «Сода-хлорат». Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 12-ին.
- ↑ 39,0 39,1 Ratnayaka D. D., Brandt M. J., Johnson M. Twort’s Water Supply. — 6-th edition. — Oxford: Butterworth-Heinemann, 2009. — P. 439—441. — ISBN 978-0-7506-6843-9
- ↑ Bommaraju T. V., Orosz P. J., Sokol E. A. «Electrochemistry Encyclopedia» (անգլերեն). YCES — Case Western Reserve University. Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 11-ին.
{{cite web}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ «SEACLOR® Systems» (անգլերեն). Severn Trent De Nora. Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 11-ին.
- ↑ «SEACLOR® System Technology Overview» (անգլերեն). Severn Trent De Nora. Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 11-ին.
- ↑ «SANILEC® Offshore and Marine Biofouling Control» (անգլերեն). Severn Trent De Nora. Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 11-ին.
- ↑ «SANILEC® Technology Overview — Electrochlorination» (անգլերեն). Severn Trent De Nora. Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 11-ին.
Գրականություն[խմբագրել | խմբագրել կոդը]
- Бахир В. М., Леонов Б. И., Паничева С. А., Прилуцкий В. И., Шомовская Н. Ю. Химический состав и функциональные свойства хлорсодержащих дезинфицирующих растворов // Вестник новых медицинских технологий. — 2003. — № 4.
- Беляк А. А., Касаткина А. Н., Гонтовой А. В., Смирнов А. Д., Привен Е. М., Благова О. Е. К вопросу об использовании растворов гипохлорита натрия в водоподготовке // Питьевая вода. — 2007. — № 2. — С. 25—34.
- Моргуль Т. Г., Гальченко Л. И., Бублик Ю. Н., Колесник А. Р. Перспективы использования хлора и гипохлорита натрия в качестве обеззараживающих реагентов для обеззараживания питьевых и сточных вод // Чистота воды и здоровье. — 2003.
- Перова М. Д., Петросян Э. А., Банченко Г. В. Гипохлорит натрия и его использование в стоматологии // Стоматология. — 1989. — № 2. — С. 84—87.
- Фурман Л. А. Глава 3. Гипохлорит натрия // Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. — М.: Химия, 1976. — С. 48—57.
- Эвентов В. Л., Андрианова М. Ю., Кукаева Е. А. Детоксикация и дезинфекция гипохлоритом натрия // Медицинская техника. — 1998. — № 6. — С. 36—39.
- Casson L., Bess J. Conversion to On-Site Sodium Hypochlorite Generation: Water and Wastewater Applications. — CRC Press, 2002. — 224 p. — ISBN 978-158716094-3.
- Chartier R. A. Bleaching Agents. Sodium Hypochlorite // Encyclopedia of Chemical Processing and Design: Volume 4 — Asphalt Emulsion to Blending / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1977. — Т. 4. — P. 434—437. — ISBN 0-824-72454-2.
- Ronco C., Mishkin G. J. Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — 157 p. — ISBN 978-3-8055-8193-6.
- Rutala W. A., Weber D. J. Uses of Inorganic Hypochlorite (Bleach) in Health-Care Facilities (англ.) // Clinical Microbiology Reviews. — 1997. — Vol. 10, no. 4. — P. 597—610.
- Weisblatt J. Sodium Hypochlorite // Chemical Compounds / Project editor Charles B. Montney. — Thomson Gale, 2006. — P. 759—763. — ISBN 1-4144-0150-7.
- White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 452—571. — ISBN 978-0-470-18098-3.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
- «Гипохлорит натрия и его применение». ООО «Макропул Кемиклс». Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 16-ին.
- «Sodium Hypochlorite» (PDF) (անգլերեն). The Soap and Detergent Association. 1997. Արխիվացված է օրիգինալից (PDF) 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 3-ին.
{{cite web}}: External link in|publisher= - «Sodium Hypochlorite REACH consortium» (անգլերեն). ReachCentrum. Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 12-ին.
{{cite web}}: External link in|publisher= - «HPA Compendium of Chemical Hazards Sodium hypochlorite» (անգլերեն). Health Protection Agency. 2008. Արխիվացված է օրիգինալից (PDF) 2011 թ․ օգոստոսի 20-ին. Վերցված է 2010 թ․ փետրվարի 3-ին.
{{cite web}}: External link in|publisher=












































