Մասնակից:Makruhi/Ավազարկղ
 |
Սա Makruhi մասնակցի սևագրության էջն է՝ «ավազարկղը», և մասնակցի էջի ենթաէջերից մեկն է։ Այն ծառայում է որպես սևագիր և փորձարկումների վայր։ Սա հանրագիտարանային հոդված չէ։ Ձեր անձնական ավազարկղը ստեղծելու համար սեղմեք այստեղ։ Այլ ավազարկղեր՝ Ընդհանուր ավազարկղ |

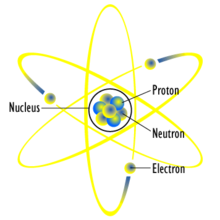
Ատոմը հանդիսանում է մատերիայի հիմնական մասնիկ,որը բաղկացած է խիտ կենտրոնական միջուկից` շրջապատված բացասական լիցքավորված էլեկտրոնային ամպից:Ատոմի միջուկը բաղկացած է դրական պրոտոններից և էլեկտրական չեզոք նեյտրոններց, բացառությամբ ջրածնի,որը միակ կայուն նուկլիդն է առանց նեյտրոնների:Ատոմի էլեկտրոնները միջուկի հետ կապված են էլեկտրոմագնիսական ուժով: Բացի այդ ատոմների խումբը կարող են միմյանց կապված մնալ քիմիական կապերի օգնությամբ, որի հիմքը կարող է հանդիսանալ դարձյալ նույնը ուժը կազմող մոլեկուլը:Ատոմը պրոտոնների և էլեկտրոնների հավասար քանակով էլեկտրականապես չեզոք է, այլապես բացասական կամ դրական լիցքավորված վիճակում հայտնի է որպես իոն:Ատոմը դասակարգվում է միջուկում գոյություն ունեցող պրոտոնների և նեյտրոնների քանակի համաձայն:Պրոտոնների քանակը որոշում է քիմիական տարրը ,իսկ նեյտրոններինը՝ իզոտոպն է:[1] Քիմիական ատոմները, որոնք ներկայումս պարզապես կոչվում են ատոմ, աննշմարելի մասնիկներ են, տասնյակերրորդ նանոմետրի տրամագիծով և շատ աննշան ծավալով:Ատոմը կարող է միայն հետազոտվել հատուկ սարքերի օգնությամբ, այնպիսին ինչպիսին է սկան անող խողովակաձև մանրադիտակը:Ատոմի ծավալի 99.94%-ը կենտրոնացված է միջուկի մեջ պրոտոնների և նեյտրոնների հավասարաչափ քանակով: Յուրաքանչյուր էլեմենտ ամենաքիչը ունի մեկ իզոտոպ մեկ ոչ կայուն միջուկով,որը կարող է ենթարկվել քայքայման:Արդյունքում այն ենթարկվում է փոփոխության,որը փոփոխում է պրոտոնների և նեյտրոնների քանակը միջուկում:[2]Էլեկտրոնները,որոնք կապված են ատոմի հետ, տիրապետում են այնպիսի կայուն էներգետիկ մակարդակների կամ օրբիտալների,որ կարող են ենթարկվել փոփոխությունների. ֆոտոններ կլանող կամ արտադրող, որոնք էլ համապատասխանում են մակարդակների միջև տեղի ունեցող տարբեր էլեկտրական մակարդակներին:Էլեկտրոնները բնորոշում են տարրի քիմիական բաղադրամասերը և մեծ ազդեցություն են ունենում ատոմի մագնիսական հատկությունների վրա:Քվանտային մեխանիկայի սկզբունքները ծառայել են որպես նմուշ մոդել ատոմի հատկությունները հետազոտելու ժամանակ:
Ծագում[խմբագրել | խմբագրել կոդը]

Ատոմ բառը ծագել է հունարեն (atomos, "անբաժանելի") բառից, որտեղ ἀ- (a-, "չ") և τέμνω (temnō, "ես կտրում եմ" , որը նշանակում է չկտրվող այսինք անբաժանանելի , այսինք մի բան, որը երբեք չի կարող մասերի բաժանվել:[3]Այն փաստը, որ ատոմն անբաժանելի է, առաջին անգամ հաստատել են հնդիկ և հույն փիլիսոփաները:18-րդ դարում և 19-րդ դարում քիմիկոսները ապացուցում են այն միտքը, որ գոյություն ունեն այնպիսի մասնիկներ , որոնք քիմիական մեթոդներով չեն ենթարկվում տրոհման և նրանց կոչում են "ատոմ" ընդունելով հնում փիլիսոփանների անբաժանելի տարրի իմաստը: 19-րդ դարի ընթացքում և 20-րդ դարի սկզբին ֆիզիկոսները հայտնաբերեցին, որ կան ատոմի մեջ ավելի փոքր մասնիկներ և որ այն բոլորովին էլ անբաժանելի չէ և նրա անունը չի համապատասխանում իր հատկությանը:[4] [5]Այնուամենայնիվ այդ անվանումը պահպանվեց: Այն դարձավ քննարկումների առարկա և հարց ծագեց արդյոք հնագույն ժամանակների փիլիսոփաները անբաժանելի մասնիկ ասելով նկատի ունենին այս մասնիկին թե լեպտոններին կամ քվարկին,որոնք նույնպես համարվում էին անբաժանելի կամ էլ մի այնպիսի տարրերի, որոնք դեռ հայտնաբերված չէին:[6]
Ատոմային տեսության պատմություն[խմբագրել | խմբագրել կոդը]
Ատոմիզմ[խմբագրել | խմբագրել կոդը]
Հազարամյակների ընթացքում ընդունված է այն սկզբունքը, թե նյութը բաղկացած է անբաժանելի փոքրիկ մասնիկներից, որոնք կամայականորեն չեն բաժանվում:Սակայն այս մտքերը հիմնված էին ավելի շուտ փիլիսոփայական վերացական դատողությունների,քան փորձնական հետազոտություների վրա:Փիլիսոփայության մեջ ատոմի բնույթը ժամանակի ընթացքում մշակույթից, դպրոցից տարբեր էր և հաճախ պարունակում էր հոգևոր տարրեր:Այնուամենայնիվ ատոմի հիմնական իմաստը գիտնականների կողմից ընդունվեց հազարամյակներ անց, որովհետև հետագայում այն թույլ տվեց նոր հայտնագործություններ անել քիմիայի բնագավառում:[7]Ատոմային տեսության «ատոմ» -ի հին անվանումը պահպանվում է որպես համընդհանուր տերմին քիմիայի բնագավառում, չնայած այն բանի ,որ կան նրանից ավելի փոքր բաժանելի մասնիկներ,իսկ հետագայում դրանցից էլ փոքր` իրականում անբաժանելի:Ատոմի սկզբունքի ծանոթագրությունը մեզ տանում են հետ դեպի հին Հունաստան և Հնդկաստան:Հնդկաստանում ատոմային տեսությամբ զբաղվող Ājīvika,Jain, Cārvāka դպրոցները գոյություն ունենին դեռևս մ.թ.ա. 6-րդ դարում:Իսկ հետագայում Nyaya և Vaisheshika դպրոցները զարգացրեցին ատոմի բաղադրության տեսություները. այն, որ ատոմը պարունակում է այլ տարրեր: Արևմուտքում ատոմի մասին ծանոթագրությունները կապված են մ.թ.ա. 5-րդ դարում Լեուսիպպուսի անվան հետ,որի աշակերտ` Դեմոկրիտուսը համակարգել է իր տեսակետները:Մոտավորապես մ.թ.ա. 450 թվին Դեմոկրիտուսը հնարել է átomos (հունարեն: ἄτομος) տերմինը,որը նշանակում էր անբաժանելի ,այսինքն նյութի ամենափոքր անբաժանելի մասնիկ: Այնուամենայնիվ հնդկական և հունական ատոմի մասին տեսությունները պարզապես հիմնված էին փիլիսոփայության վրա, իսկ ժամանակակից գիտությունը պահպանել է Դեմոկրիտուսի կողմից հորինված բառը: Կորպուսկուլարիանիզմը պնդում է, որն առաջացել է 13-րդ դարում ալքիմիկ Պսեուդու-Գեբերի [8]կողմից, երբեմն նույնացնելով Պաուլո Տառանտոյիհետ,այն, որ բոլոր ֆիզիկական մարմինները կազմված են ներքին արտաքին փոքր մասնիկներից բաղկացած շերտերից:[9]Կորպուսկուլարիանիզմը նույն ատոմային տեսությունն է, բացառությամբ այն բանի,որ եթե ատոմները համարվում են անբաժանելի, ապա այս մասնիկները զատելի էին:Այս ճանապարհով,օրինակի համար ապացուցվել է ,որ մերկուրին կարող էր թափանցել մետաղների մեջ և ձափոխել նրանց ներքին կառուցվածքը:[10]Կորպուսկուլարիանիզմի ուսմունքը մնաց տիրապետող ուսմունք հարյուրավոր տարիներ շարունակ: 1661 թվականին,բնագետ-փիլիսոփա Ռոբերտ Բոյլը հրատարակեց իր «Սնահավատ քիմիկոս» աշխատությունը, որտեղ նա քննարկում էր ավելի շուտ այն,որ նյութը բաղկացած էր տարբեր մասնիկների համադրումներից`ատոմներից,քան այն, որ դրանք օդի, հողի, կրակի և ջրի դասական տարրեր են:[11]1670 թվականներին Կորպուսկուլարիանիզմի ուսմունքն օգտագործվեց Իսահակ Նյուտոնի կողմից,որի հիման վրա նա զարգացրեց լույսի ատոմային տեսությունը:[12]
Գիտական տեսության ծագում[խմբագրել | խմբագրել կոդը]
Տարբեր ատոմներ և մոլեկուլներ ինչպես պատկերված են Ջոն Դալթոնի «Քիմիական փիլիսոփայության նոր համակարգը» աշխատության մեջ(1808),այս ուսմունքին վերաբերվող ամենավաղ գիտական աշխատություններից է: Ատոմ հասկացությունը առաջընթաց չի ունենում այնքան ժամանակ,մինչև չի սկսում զարգանալ քիմիա գիտությունը:[13] 1789 թվականին, ֆրանսիացի Նոբելյան մրցանակակիր և գիտահետազոտող Անտուան Լավուազիեն հայտնաբերեց զանգվածի պահպանման օրենքը,որի համաձայն տարրը,որով կազմվում էր հիմնական նյութը,չեր կարող քիմիական մեթոդների միջոցով հետագայում տրոհվել այլ մասնիկների:1805 թվականին,անգլիացի գիտնական և փիլիսոփա Ջոն Դալթոնը օգտագործելով ատոմների մասին սկզբունքը,բացատրելով,թե ինչու են տարրերը միշտ ռեակցիա տալիս ոչ մեծ ամբողջական թվով հարաբերականությամբ համամամասնությունների մասին օրենքը և թե ինչու որոշ գազեր ավելի լավ են լուծվում ջրում, քան մյուսները, նա առաջ քաշեց այն գաղափարը, որ յուրաքանչյուր տարր բաղկացած է միատիպ ատոմից և որ այդ ատոմները կարող են միանալ` կազմելով քիմիական միասնություններ:[14] [15] Դալթոնը համարվում է ժամանակակից ատոմային տեսության հեղինակը:[16]Դալթոնի ատոմի մասին վարկածը չմատնանշեց ատոմների չափսերը:Ընդհանուրի կարծիքով դրանք պետք է շատ փոքր լինեին,սակայն ոչ ոք չգիտեր որքան փոքր:Դրա համար էլ կարևոր նշաձող հանդիսացավ այն,որ 1865 թվականին Յոհանն Ջոզեֆը Լոսշմիդտը չափեց օդի բաղադրության մեջ եղող մոլեկուլների չափը:Մեկ այլ լրացուցիչ փաստ մասնիկների ուսմունքի վերաբերյալ`ատոմային ուսմունքի զարգացմանը նպաստող, սկսեց 1827 թվականին,երբ բուսաբան Ռոբերտ Բրաունը օգտագործեց մանրադիտակը ջրի մեջ լողացող փոշու հատիկները նայելու համար և հայտնաբերեց,որ դրանք կայուն չեն և երևույթը ճանաչվեց որպես «բրաունյան շարժում»:1877 թվականին Ջ.Դեսոլկսը առաջ քաշեց այն փաստը, որ այդ շարժումը հետևանք էր ջրի մոլեկուլների ջերմային շարժման և 1905 թվականին Ալբերտ Էյնշտեյնը կատարեց շարժման մասին առաջին մաթեմատիկական վերլուծությունը:[17] [18] [19]Ֆրանսիացի ֆիզիկոս Ժան Պերին օգտվելով Էյնշտեյնի աշխատությունից` փորձնականորեն որոշեց ատոմի զանգվածն ու չափերը, վերջնականապես հաստատելով Դալտոնի միջուկային տեսությունը:[20] Մենդելեևի առաջին պարբերականության աղյուսակը 1869-ին թվականին, հիմնվելով Լավուազիեյի ավելի վաղ արած հայտնագործությունների վրա` Դմիտրի Մենդելեևը հրատարակեց առաջին գործող պարբերականության աղյուսակը:Աղյուսակն ինքնին պարբերականության օրենքի տեսողական ներկայացումն էր,որը հաստատում էր այն փաստը,որ մասնիկների որոշ քիմիական հատկությունները պարբերաբար կրկնվում էին ատոմների որոշակի քանակի դասավորվածության դեպքում;
Ենթաբաղադրիչներ և քվանտային տեսություն[խմբագրել | խմբագրել կոդը]

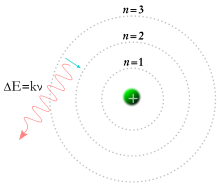
Ընդհանուր ատոմային մոլորակային մոդել կամ Ռութերֆորդի մոդել Ֆիզիկոս Թոմսոնը 1897 թվականին իր կաթոդ ճառագայթների մասին աշխատության միջոցով հայտնագործեց էլեկտրոնը և եկավ այն եզրակացության,որ նրանք յուրաքանչյուր ատոմի բաղկացուցիչ մասն էին կազմում:[21]Այսպիսով նա հերքեց այն համոզմունքը,որ ատոմները անբաժանելի են և, որ նրանք նյութի եզակի մասնիկներն են:Նա ենթադրում էր, որ փոքր զագվածը, բացասական լիցքավորված Էլեկտրոնները տարածվում են ատոմի միջոցով, հնարավորինս օղակաձև պտտվելով իրենց լիցքավորումից հավասարակշռվում է դրական լիցքերի ներկայության կողմից: Այն ավելի ուշ հայտնի դարձավ որպես սալորի շիլայի մոդել(plum pudding model): 1909 թվականին Հանս Գեյգերը և Էրնեստ Մարսդենը,Էրնեստ Ռութերֆորդի գլխավորությամբ ոսկյա թիթեղը պայթեցրեցին ալֆա ճառագայթների օգնությամբ հետագայում հայտնի որպես դրական լիցքավորված հելիումի ատոմներ և հայտնաբերվեց, որ այս մասնիկների փոքր տոկոսը, ավելի մեծ անկյան տակ հետո քան ենթադրվել էր Թոմսոնի առաջարկն օգտագործելիս: Ռութերֆորդը ոսկու թիթեղի փորձը մեկնաբանել է որպես դրական լիցքավորված ոսկու ծանր ատոմը և որ նրա զանգվածի մեծ մասը կենտրոնացված էր ատոմի կենտրոնում գտնվող միջուկի մեջ–Ռութերֆորդի մոդել:[22]1913 թվականին ռադիոքիմիկոս Ֆրեդերիկ Սոդդին փորձարկումներ՝ կատարելով ռադիոակտիվ քայքայման ենթարկվող նյութերի հետ, նա հայտնաբերեց առաջացած ավելի քան մեկ տեսակի ատոմ պարբերականության աղյուսակի յուրաքանչյուր դիրքում:[23]Իզոտոպ տերմինը հնարել է Մարգարետ Տոդդը որպես համապատասխան բառ տարբեր ատոմների համար,որոնք պատկանում են նույն տարրին:Ջ.Ջ Տոմսոնը իոնացված գազերի մասին իր աշխատության միջոցով ստեղծեց տեխնիկա ատոմի տեսակները առանջնացնելու համար,որն էլ հետևաբար հանգեցրեց կայուն իզոտոպների հայտնաբերմանը:[24] Ջրածնային ատոմի Բոհրի մոդելը, որը ցույց է տալիս էլեկտրոնի թրիչքը ֆիքսված արբանյակների և այն էներգիայի ֆոտոնների միջև, որոնք բաց են թողնվում որոշակի հաճախականությամբ: Մինչդեռ 1913 թվականին ֆիզիկոս Նիելս Բոհռը առաջարկեց,որ էլեկտրոնները սահմանափակված էին հստակ որոշակի, քվանտայնացված արբանյակներում և կարող էին թռչկոտել նրանց մեջ, սակայն չէին կարող ազատորեն ներս ու դուրս ոլորաձև շարժվել,միջանկյալ վիճակներում:[25]Էլեկտրոնը պետք է կլանի կամ արտադրի որոշակի քանակությամբ էներգիա ֆիքսված արբայակների միջև անցման պահին:Երբ լույսը շիկացած նյութից անցնում է պրիզմայի միջով,այն արտադրում է բազմագույն լուսապատկեր:Այս լուսապատկերում ֆիքսված գծերի հայտնվելը բացատրվում է օրբիտալ/արբանյակային /տեղափոխության հետ:[26] Նույն տարին, ավելի ուշ Հենրի Մսելեյը անցկացնում է դարձյալ մեկ փորձ ի ապացույց Նիելս Բոհռի ուսմունքի: Այս արդյունքները ճշտեցին Էռնեստ Ռութերֆորդի և Վան դեն Բռոեկսի մոդելը,ըստ որի ատոմի միջուկը պարունակում է բազմաթիվ դրական լիցքեր,որի քանակը համապատասխանում է պարբերականության աղյուսակում գտնվող համարին:Մինչ այս փորձերը ատոմի համարը չէր ընդունվում որպես նրա ֆիզիկական կամ փորձնական քանակություն:Այն, որ նա հավասար է լիցքավորված ատոմի միջուկին, ընդունված է այսօր ընդունել որպես ատոմի մոդել:[27] Ատոմների միջև եղող քիմիական կապերը բացատրվեցին Ջիլբերտ Նյուտոն Լյուիսի կողմից 1916 թվականին հիմնական էլեկտրոնների միջև եղող փոխազդեցությամբ:[28]Համաձայն պարբերականության օրենքի` մասնիկները ունեն կրկնվելու հատկություն:[29]1919 թվականին ամերիկացի քիմիկոս Իրվինգ Լանգմուրը առաջ քաշեց այն գաղափարը, որը կարողանում էր բացատրել արդյոք ատոմում եղած էլեկտրոնները կապվում կամ խմբվում են ինչ-որ ձևով թե ոչ:[30]1922 թվականին Ստեռն-Գեռտաչի փորձն ապացուցեցին ատոմի քվանտային բնույթը: Երբ արծաթյա ատոմի ճառագայթը անցավ հատուկ ձևավորված մագնիսական դաշտի միջով, ճառագայթը շեղվեց ատոմի անկյան ուղղությամբ:Քանի որ այս ուղղություն հազվադեպ է,ենթադրվում էր, որ ճառագայթը կարող էր տարածվել գծի տեսքով:Հակառակ դրան, ճառագայթը բաժանվում է երկու մասի կախված ատոմի ճառագայթի վեր կամ վար ուղղվածությունից:[31]1924 թվականին Լուի դե Բրոգիլեն առաջ քաշեց այն միտքը,որ մասնիկների վարքը նման է ալիքների: 1926 թվականին Էրվին Շրոդինգերը որոշեց զարգացնել մաթեմատիկական մի մոդել,որտեղ ատոմը ներկայացրված էր ավելի շուտ եռաչափ ալիքների ձևով,քան կետերի տեսքով: Ալիքաձև ատոմների օգտագործումը մասնիկները նկարագրելու պարագայում հանգեցնում էր այն բանի,որ մաթեմատիկորեն անհնարին էր դառնում ունենալ մասնիկի շարժման և դիրքի ճշգրիտ արժեքները միաժամանակ.որն էլ ճանաչվեց որպես անորոշության սկզբունք ձևակերպված Վերներ Հեսենբերգի կողմից 1926–ին:Այս սկզբունքի համաձայն դիրքի չափման ժամանակ տվյալ ճշգրտությունը հնարավոր էր ստանալ միայն մի շարք հնարավոր արժեքներ և հակառակը:Այս մոդելը կարող էր բացատրել ատոմի վարքագծի ուսումնասիրությունները, մի բան որ նախորդ մոդելը չէր անում, այնպիսի ատոմի որոշ կառուցվածքային և լուսապատկերային մասնիկներ ինչպիսին ջրածինն է:Այսպիսով ատոմի մոլորակային մոդելն անտեսվեց ի օգուտ նրա,որ միջուկի շուրջ եղող նկարագրված ատոմային ուղեծիրը տվյալ էլեկտրոնն էր, որն ավելի շուտ կարիք ուներ ուսումնասիրության:[32] [33] Սպեկտրոմետրի ի հայտ գալը թույլ տվեց ճշգրտորեն չափել ատոմների զանգվածը:Սարքի բաժանման մագնիսը օգտագործվում է իոնների փնջի հետագիծը թեքելու համար, իսկ թեքման մեծությունը որոշում է ատոմի զանգվածի հարաբերությունը լիցքավորվելու նկատմամբ:Ֆրանսիացի քիմիկոս Ֆրանսիս Ուիլյամ Աստոնը օգտագործեց այս սարքը ցույց տալու համար,որ իզոտոպները ունեին տարբեր զանգվածներ:Այս իզոտոպների ատոմային զանգվածը տարբերվում էր ամբողջական թվերով ,որոնք կոչվեցին ամբողջական միավորների կանոն:[34]Այս տարբեր իզոտոպները սպասում էին իրենց բացահայտմանը ֆիզիկոս Ջեյմս Չադվիգի կողմից 1932-ին,որը նեյտրոնն էր,չեզոք մասնիկ իր զանգվածով նման պրոտոնին, իզոտոպները միևնույն քանակությամբ պրոտոններով մասնիկներ են սակայն միջուկում եղող տարբեր քանակի նեյտրոններով:[35]
Տրոհում, բարձր էներգիայի ֆիզիկա և խիտ նյութ[խմբագրել | խմբագրել կոդը]

1938 թվականին գերմանացի ֆիզիկոս Օտտօ Հաննը Ռութերդորֆի ուսանողը՝ ուղորդելով նեյտրոնները ուրանի ատոմների վրա, հույս ուներ ստանալ տրանսուրանի տարրեր: Հակառակ դրան, քիմիական փորձերից ստացավ բարիում:[36]Մեկ տարի անց Լիզ Մեյտները և իր զարմիկ Օտտօ ֆրիչը հաստատեցին, որ Հանսի ստացած արդյունքը, միջուկի տրոհման առաջին փորձն էր:[37] [38]1944-ին Հաննը արժանացավ Նոբելյան Մրցանակ քիմիայի բնագավառում:Չնայած Հաննի ջանքերին Մեյտների և Ֆրիչի ներդրումները չճանաչվեցին:[39]1950 թվականին զարգացավ արագացուցիչ մասնիկները և դեդեկտոր մասնիկները, որոնք թույլ տվեցին գիտնականններին ուսումնասիրելու ատոմների շարժման ազդեցությունը բարձր էներգիայի պայմաններում:[40]Նեյտրոններն ու պրոտոնները դարձան հադրոններ ավելի փոքր տարրեր` քվարկեր: Տարրական մասնիկների ընդունված մոդելը զարգացավ, որն էլ բացատրեց միջուկի հատկություները տարրական մասնիկների տեսանկյունից և այն ուժերը, որոնք ղեկավարում են նրանց փոխազդեցությունները:[41]
Տարրական մասնիկներ[խմբագրել | խմբագրել կոդը]
Չնայած ի սզբանե ատոմը համարվում էր անբաժանելի, ժամանակակից գիտությունը գտավ, որ այն կարող է բաժանվել տարբեր տարրական մասնիկների:Ատոմի հիմնական մասնիկներն են էլեկտրոնը, պրոտոնը, նեյտրոնը, երեքն էլ ֆերմիոններ են:Սակայն ջրածին -1 ատոմը ոչ մի նեյտրոն չունի,իսկ ջրածնի իոնը՝ ոչ մի էլեկտրոն:Էլեկտրոնն ինչ խոսք համեմատ այս տարրերի ավելի զանգվածով մեծ է ՝9.11×10−31 կգ, իր բացասական լիցքավորվածությամբ և չափով,որոնք այքան փոքր են որևէ սարքով չափելու համար:[42]Սովորական պայմաններում էլեկտրոնները կապվում են դրական լիցքավորված միջուկի հետ էլեկտրական լիցքերի կողմից առաջացած ձգողականության միջոցով:Եթե ատոմն ունի ավելի շատ կամ ավելի քիչ ատոմների քանակ, ապա համապատասխանաբար դառնում են դրական կամ բացասական լիցքավորված ամբողջություն, որն էլ հենց իոնն է:Էլեկտրոները հայտնի են դեռ 19–րդ դարի վերջից շնորհիվ Ջ.Ջ Թոմսոնի:Պրոտոնները ունեն դրական լիցք,[43] իսկ զանգվածը 1,836 անգամ մեծ է քան էլեկտրոնինը 1.6726×10−27 կգ-ով:Պրոտոնների թիվը կոչվում է ատոմային թիվ:Էռնեստ Ռութերֆորդը(1919)նկատեց, որ ազոտը ալֆա-մասնիկների պայթացման հետևանքով դառնում է ջրածնի միջուկ: 1920 թվականին նա ընդունեց, որ ջրածնի միջուկը դա առանձին մասնիկ է, որը անվանեցին պրոտոն:Նեյտրոնները չունեն էլեկտրական լիցքավորվածություն և ունեն էլեկտրոնի զանգվածից 1,839 անգամ ազատ զանգված կամ էլ 1.6929×10−27կգ զանգվածով երեք հիմնական մասնիկներից ամենածանրը, բայց այն կարող է կրճատվել միջուկային էներգիայի կողմից:Նեյտրոններն ու պրոտոնները միասնական կոչվում են նուկլեոններ , ունեն համեմատական չափեր 2.5×10−15 մ–ի կարգի, չնայած որ այս մասնիկների մակերեսը հստակ չէ:[44]Նեյտրոնը հայտնաբերվել է 1932 թվականին անգլիացի ֆիզիկոս Ջեյմս Չադվիկի կողմից: Ֆիզիկայի ստանդարտ մոդելում էլեկտրոնները իրականում տարրական մասնիկներն են առանց ներքին կառուցվածքի:Այնուամենայնիվ և պրոտոնները և նեյտրոնները բաղադրյալ մասնիկներ են, բաղկացած քվարկ կոչվող տարրական մասնկներց:Կան քվարկի երկու տեսակ, որոնցից յուրաքանչյուրն ունի իր հավելյալ էլեկտրական լիցքը:Պրոտոնները կազմված են երկու դեպի վեր / յուաքանչյուրը +2⁄3/ և մեկը դեպի վար −1⁄3 լիցքավորված −1⁄3): Նեյտրոնները բաղկացած են մեկ դեպի վեր քվարկից և երկու դեպի վար քվարկից:Այս տարբերությունը հաշվի է առնում զանգվածի և լիցքավորման տարբերությունը երկու մասնիկների միջև:[45] [46] Քվարկերը միմյանց կապված են ուժեղ փոխազդեցությամբ գլուոնների միջնորդվածությամբ : Պրոտոններն ու նեյտրոններն էլ իրենց հերթին միմյանց կապված են միջուկում միջուկային ուժի շնորհիվ, որը հզոր ուժի մնացորդն է և ունի տարբեր կարգի հատկություննր/մանրամասնի համար նայել միջուկի մասին հոդվածում/:[47] [48]
Միջուկ[խմբագրել | խմբագրել կոդը]
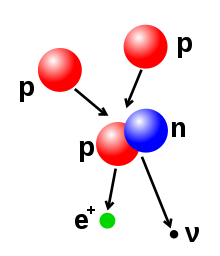

Ատոմի մեջ բոլոր իրար կապված պրոտոններն ու նեյտրոնները կազմում են շատ փոքր ատոմի միջուկը և կոչվում են նուկլեոննր:Միջուկի շառավիղը մոտավորապես հավասար է 1.07 3√A fm , որտեղ A –ն նուկլեոնների ընդհանուր քանակն է:[49] [50] Սա ավելի փոքր է, քան ատոմի շառավիղը 105 fm –ի կարգի: Նուկլեոնները միմյանց կապված են մնացորդային հզոր ուժի միջոցով:2.5 fm-ից փոքր տարածությունները այս ուժն ավելի հզոր է քան էլեկտրոստատիկ ուժը, որը պատճառ է հանդիսանում լիցքավորված պրոտոններին միմյանց մղելու:[51] Միևնույն տարրի ատոմները ունեն միևնույն քանակությամբ պրոտոններ ,որը անվանում են ատոմային թիվ:Մի մասնիկով կարող է փոխվել նեյտրոնների թիվը, որոշելով այդ մասնիկի իզոտոպը: Պրոտոների քանակի հարաբերությունը պրոտոնների թվին բնորոշում է միջուկի կայունությունը, որոշ իզոտոպներ ենթարկվում են ռադիոակտիվ քայքայման:[52]Պրոտոնը, էլեկտրոնը և նեյտրոնը դասվում են ֆերմիոնների շարքին:Ֆերմիոնները ենթարկվում են Պաուլի բացառման սկզբունքին , այնպիսին ինչպիսիք են բազում պրոտոնները, որոնք զբաղեցնում են քվանտային դիրք միաժամանակ: Այսպիսով միջուկի յուրաքանչյուր պրոտոն պետք է զբաղեցնի բոլոր մյուս պրոտոններից տարբերվող քվանտային վիճակ և այն վերաբերվում է միջուկի բոլոր նեյտրոններին և էլեկտրոնների խմբի բոլոր էլեկտրոններին: Այնուամենայնիվ պրոտոնն ու նեյտրոնը կարող են զբաղեցնել միևնույն քվանտային վիճակը:[53]Ցածր ատոմային թիվ ունեցող ատոմների համար, միջուկը, որն ունի ավելի շատ նեյտրոններ քան պրոտոններ, ձգտում է իջնել ավելի ցածր էներգետիկ վիճակի ռադիոակտիվ քայքայման միջոցով, այնպես որ նեյտրոն-պրոտոն հարաբերությունը մոտ է մեկի: Երբ ատոմային թիվը աճում է, պահանջվում է ավելի մեծ չափով նեյտրոններ, որպեսզի փոխհատուցվի պրոտոնների փոխադարձ միմյանց վանումը: Այսպիսով չկա կայուն միջուկ պրոտոնի և նեյրտոնի հավասար քանակով, ատոմային թիվը Z = 20 (կալիցիում calcium է, և երբ Z–ն աճում է, կայուն իզոտոպների նեյտրոն-պրոտոն հարաբերությունը բարձրանում է:Ամենաբարձր պրոտոն-նեյտրոն հարաբերությամբ կայուն իզոտոպը կապար-208- ն է:[54]Միջուկում եղած պրոտոնների և նեյտրոնների քանակը կարող է փոփոխվել, որը հզոր ուժի պատճառով կարող է պահանջել մեծ էներգիա:Միջուկի սինթեզն իրականանում է այն ժամանակ, երբ բազմաթիվ ատոմի մասնիկներ միանալով ստեղծում են ավելի ծանր միջուկ,այնպիսին ինչպիսին է երկու միջուկների բախումից առաջացած էներգիան: Օրինակի համար Արևի ընդերքում պրոտոնները պահանջում են 3–10 keV /կվ էներգիա/ որպեսզի հաղթահարեն կուլոմբյան արգելքը և պայթեն մեկ միջուկի մեջ:[55]Միջուկի բաժանումը լրիվ հակառակ գործողությունն է ,ստիպելով միջուկին բաժանվել երկու փոքր միջուկների, սովորաբար ռադիոակտիվ քայքայման միջոցով:Միջուկը փոփոխման կարող է ենթարկվել նաև ֆոտոններ կամ տարրական մասնիկների բարձր էներգիայի տակ պայթեցման միջոցով:Եթե սա փոխում է պրոտոնների թիվը միջուկում, ապա ատոմը փոխվում է մեկ այլ քիմիական էլեմենտի:[56] [57] Եթե սինթեզի ռեակցիայի հետևանքով միջուկների զանգվածը ավելի փոքր է քան առանձնացված մասնիկների զանվածների ընդհանուր քանակը, ապա այս երկու արժեքների միջև եղած տարբերությունը կարող են արտանետել այնպիսի օգտակար էներգիայի տեսակ, ինչպիսին գամմա ճառագայթն է կամ էլ բետտա մասնիկի կինետիկ էներգիան, ինչպես այն նկարագրված է Ալբերտ Էյնշտեյնի զանգված-էներգիայի համարժեքության բանաձևում , E = mc2 որտեղ m–ը կորած զանգվածն է, c–ն լույսի արագությունը: Այս պակասը նոր միջուկի պարտադիր էներգիայի մասն է կազմում և այն ոչ վերականգնելի էներգիայի կորուստ է, որն առաջացնում է միաձուլված մասնիկներից, որոնք մնում են միասին այն վիճակում որ պահանջում է այս էներգիան բաժանելու համար:[58]Երկու միջուկների միաձուլումը ստեղծում է նոր միջուկ ավելի ցածր ատոմային թվով ինչպիսին երկաթինն ու նիկելինն է և ընդհանուր միջուկային թիվը հասնում է մոտավորապես 60-ի, որը գերջերմային պրոցես է, որն արձակում է ավելի շատ էներգիա քան պահանջում է բոլորից միասին:[59]Սա էներգիա արտադրող պրոցես է որի միջուկների ձուլումից աստղերի մեջ առաջանում է ինքնահաստատման ռեակցիա:Ավելի ծանր միջուկի համար միջուկի պարտադիր էներգիան այս միջուկում սկսում է նվազել:Սա նշանակում է, որ ձուլման պրոցեսները, որի ժամանակ միջուկի արտադրած ատոմային թվերը 26-ից անցնում են, իսկ ատոմական զանգվածինը 60 է, որն էլ համարվում է էնդոտերմիկ/էնդոջերմային/ պրոցես:Սրանք ավելի մեծ միջուկներ են և չեն կարող առաջացնել էներգիա արտադրող ձուլման ռեակցիա, որ կարողանա պահպանել աստղի հիդրոստատիկ հավասարակշռությունը:[60]
Էլեկտրոնային ամպ[խմբագրել | խմբագրել կոդը]


Միջուկի էլեկտրոնները ձգում են պրոտոններին միջուկի էլեկտրոմագնիսական ուժի միջոցով: Այն կապում է ավելի փոքր միջուկներին շրջապատող էլեկտրոստատիկ պոտենցիալ ունեցող էլեկտրոններին, որը նշանակում է, որ կարիք կա էներգիայի հավելյալ աղբյուրի, որպեսզի էլեկտրոնը շարժվի: Որքան էլեկտրոնը մոտ է միջուկին, այնքան մեծ է ձգողականության ուժը: Այստեղից էլ այն էլեկտրոնները, որոնք մոտ են գտնվում պոտենցիալ միջուկին շարժման համար պահանջում են ավելի շատ էներգիա, քան նրանք, որոնք գտնվում են ավելի հեռու: Էլեկտրոններն էլ նման տարրերին ունեն նույն հատկություննրը` մասնիկ և ալիք:Էլեկտրոնային ամպը գտնվում է պոտենցիալ խոռոչի շրջանում, որտեղ յուրաքանչյուր էլեկտրոն ձևավորում է եռաչափ կայուն ալիքի տեսակ, ալիքանման ֆորման չի շարժվում հարաբերականորեն դեպի միջուկը: Այս վարքագիծը որոշակիացվում է ատոմային ուղեծրի կողմից, մաթեմատիկական գործառույթն այն բնորոշում է, որ հավանակունությունը, որ էլեկտրոնը կհայտնվի մասնավորապես այն տեղում, որտեղ չափվում է նրա դիրքը:[61]Այս ուղեծրերի միայն առանձին քվանտայնացված ցանց գոյություն ունի միջուկի շուրջը, քանի որ մեկ այլ հնարավոր ալիքային մասնիկներ արագորեն առանձնանում են և ստանում կայուն ձև:[62]Ուղեծրերը կարող են ունենալ մեկ կամ ավելի օղակային կառուցվածքներ կամ կապեր և նրանք տարբերվում են միմյանցից իրենց չափերով, ձևով և ուղղվածությամբ:[63] Պահանջվող էներգիայի քանակը վերացնում կամ ավելացնում է էլեկտրոն էներգիային կապող էլեկտրոնը շատ ավելի հեռու է միջուկներ կապող էներգիայից: Օրինակ, այն պահանջում է ընդամենը 13.6 eV, որպեսզի զրկի ջրածնի ատոմին [64]էլեկտրոնի հիմնական վիճակից, համեմատած 2.23 մլն. eV դեյտերիում(ծանր ջրածին) անջատելու համար:[65]Ատոմը էլեկտրականապես չեզոք են, եթե նրանք ունեն հավասար քանակությամբ պրոտոններ և էլեկտրոններ:Այն ատոմները, որոնք ունեն էլեկտրոնների կամ պակաս կամ ավելցուկ, կոչվում են իոններ:
Էլեկտրոնները, որոնք ամենահեռու են գտնվում միջուկից կարող են փոխակերպվել մոտ գտնվող ատոմների կամ բաժանվել ատոմների միջև:Այս մեխանիզմով ատոմները ի վիճակի են կապվել մոլեկուլների մեջ, իսկ այլ քիմիական միացություններ ինչպիսիք են իոնը և կովալենտը ստեղծում են բյուրեղների ցանց:[66]
Հատկություններ[խմբագրել | խմբագրել կոդը]
Միջուկի հատկություններ[խմբագրել | խմբագրել կոդը]
Հոդվածներ. Իզոտոպ, Կայուն իզոտոպ, նուկլիդների շարք, էլեմենտների շարք ըստ իզոտոպների Ըստ ընդունված ձևակերպման միջուկի պրոտոնների որոշակի քանակ պատկանում է նույն քիմիական էլեմենտին:Հավասար քանակությամբ պրոտոնները, բայց տարբեր քանակությամբ նեյտրոնները նույն էլեմենտի տարբեր իզոտոպներն են:Օրինակ ջրածնային ատոմներն ընդունում են միայն մեկ պրոտոն, բայց գոյություն ունեն իզոտոպների առանց նեյտրոնների / ջրածին-1 իր ամենասովորական ձևով, որը կոչվում է նաև պրոտիում/,մեկ նեյտրոն/դեուտերիւմ, ծանր ջրածին/, երկու նեյրոն /տրիտիում/ և ավելի քան երկու նեյտրոն:Երկու հայտնի էլեմենտները կազմում են ատոմների խումբ սկսած մեկ ջրածնի պրոտոնից մինչև 118 պրոտոնանոց ունունոկտիում:Բոլոր իզոտոպները, որոնց ատոմային թվերը անցնում են 82-ից ռադիոակտիվ են: Մոտավորապես 339 նուկլիդներ են իրականում պատահում երկրի վրա, որոնցից 254 –ը /մոտավոր 75%-ը/ չեն դիտվել որպես քայքայիչներ և չեն էլ պատկանում կայուն իզոտոպներին :Այնուամենայնիվ նրաց միայն 90 տեսակն է, որ ենթարկվում են ամեն տեսակ քայքայման, նույնիսկ տեսականորեն: Մյուս 164 տեսակը, որ մտնում է 254-ի մեջ նորից չեն դիտվում որպես քայքայման ենթակա, նույնիսկ եթե տեսականորեն էներգայի տեսանկյունից հնարավոր է:Սրանք նույնպես պայմանականորեն դասվում են կայունների շարքը:Մնացած 34 ռադիոակտիվ նուկլիդները ունեն ավելի քան 80 մլն տարի արևային համակարգի ստեղծումից սկսած և բավականին ավելի երկար է, քան ներկայումս:288 նուկլիդների հավաքածուն հայտնի է որպես նախածին նուկլիդներ:Վերջապես մնացած 51 կարճ կյանք ունեցող նուկլիդներ են ,որոնք հանդիպում են իրականում որպես նախածին նուկլիդների քայքայումից առաջացած դուստր արդյունքներ /ինչպես ռադիումն առաջանում է ուրանից/, կամ էլ որպես Երկիր մոլորակի վրա են բնական էներգետիկ պրոցեսներից առաջացած արդյունքները/նյութերը/ այնպիսին ինչպիսին են տիեզերական ճառագայթի պայթյունը/ օրինակ` բնածուխ carbon-14/:80 քիմիական էլեմենտների համար ամենաքիչը գոյություն ունի մեկ կայուն իզոտոպ:Որպես կանոն այս էլեմենտների յուրաքանչյուրի համար գոյություն ունի կայուն իզոտոպների ամբողջություն, միջինը 3.2 կայուն իզոտոպով:26 էլեմենտ ունեն միայն մեկ կայուն իզոտոպ ,մինչդեռ մեծ թվով կայուն իզոտոպների թիվը 10 են , օրինակ անագինը /tin/:43, 61,Էլեմենտ և բոլոր 83 կամ ավելի բարձր համարակալած էլեմենտները չունեն կայուն իզոտոպ:26 էլեմենտ ունեն միայն մեկ կայուն իզոտոպ ,մինչդեռ մեծ թվով կայուն իզոտոպների թիվը 10 են , օրինակ անագինը /tin/:43, 61,Էլեմենտ և բոլոր 83 կամ ավելի բարձր համարակալած էլեմենտները չունեն կայուն իզոտոպ:Պրոտոնների և նեյտրոնների հարաբերությունը ազդում է իզոտոպների կայունությունը , ինչպես նաև նեյտրոնների կամ պրոտոնների որոշ « կախարդական թվերի» ներկայությունից ,որոնք ներկայացնում են փակ կամ լիքը քվանտային թաղանթներ:Այս քվանտային թաղանթներին համապատասխանում են բարձր էներգետիկ մակարդակների ցանցին խխունջաձև միջուկով ,լիքը կաղապարով նման 50 պրոտոնով լցված անագի համար ,հաղորդում է անսովոր կայունություն նուկլիդին:254 հայտնի նուկլիդներից միայն 4 են,որ ունեն և կենտ թվով պրոտոններ և կենտ թվով նեյտրոններ ջրածին 2 hydrogen-2 (deuterium, lithium-6, boron-10 և nitrogen-14.hydrogen-2 (deuterium), լիտիումlithium-6, բոռ boron-10 and ազոտ nitrogen-14. Ինչպես նաև իրականում միայն հանդիպում է ռադիոակտիվ կենտ-կենտ նուկլիդները կեսկյանքի տևողություն ունեն միլիարդավոր տարիներ շարունակ.կալիում/potassium-40, վանադիում /vanadium-50/, լանտանում/ lanthanum-138/ and տանտալում/tantalum-180m/:Մեծամասամբ կենտ-կենտ միջուկը շատ անկայուն է համեմատ բետտայի քայքայման , որովհետև քայքայվող նյութերը զույդ-զույգ են , հետևաբար ավելի ուժեղ են կապված միջուկի զուգավորման արդյունքների հետևանքով:
Զանգված[խմբագրել | խմբագրել կոդը]
Ատոմի զանգվածի մեծ մասը կազմում է նրան ստեղծող պրոտոններն ու նեյտրոնները:Այս տարրերի` նուկլեոնների ընդհանուր քանակը տվյալ ատոմի համար կոչվում է զանգվածի թիվ:Զանգվածի թիվը պարզ ամբողջական թիվ է նուկլեոնների միավորներից կազմված:Վառ օրինակը ածխածին-12 է, որն ունի 12 նուկլեոն /6 պրոտոն և 6 նեյտրոն/: Ատոմի զանգվածն ընդհանռապես արտահայտվում է միասնական ատոմի զանգվածի միավորի միջոցով (u), որը կոչվում է նաև դալտոն(Da):Այս միավորը սահմանվում է որպես carbon-12-ի ազատ չեզոք ատոմի զանգվածի 12-րդ մասը որը մոտավորապես 1.66×10−27 կգ է:Ջրածին 1/Hydrogen-1,/ ջրածնի ամենաթեթև իզոտոպն է և ատոմական ամենափոքր զանգվածով, որի ատոմը կշռում է 1.007825 u.Այս արժեքի թիվը անվանում ենք ատոմի զանգված:Տվյալ ատոմի ատոմական զանգվածը մոտավորապես հավասար է /1%-ով/ զանգվածի թիվն անգամ ատոմական զանգվածի միավորի զանգվածը:Այնուամենայնիվ այս թիվը չի լինի ճշգրիտ ամբողջական թիվ, բացառությամբ ածխածնի /carbon-12 / պարագայում /նայել ստորև/:Ամենածանր կայուն ատոմը կապարն է /lead-208/ 207.9766521 u զանգվածով:Ավելի զանգվածային ատոմների հետ դժվար է աշխատել այդ իսկ պատճառով քիմիկոսները օգտագործում են գրամ –մոլեկուլ/մոլ/ միավորները:Ցանկացած էլեմենտի ատոմների մեկ մոլը ունի ատոմների միևնույն քանակը/մոտավորապես 6.022×1023/:Այս թիվն ընտրված է այն իմաստով, որ եթե որևէ էլեմենտի ատոմական զանգվածը 1u է , ապա այդ էլեմենտի մեկ մոլի զանգվածը մոտ է մեկ գրամի :Ելնելով միասնական ատոմական զանգվածի միավորի սահմանումից յուրաքանչյուր ածխածին- 12 ատոմ հենց 12 u է, այստեղից էլ ածխածին-12 մոլը կշռում է ճշգրիտ , 0.012 կգ:
Ձև և չափ[խմբագրել | խմբագրել կոդը]
Ատոմները չունեն հստակ սահման, այդ իսկ պատճառով նրա չափերը սովորաբար նկարագրվում են ատոմի շառավղի միջոցով:Այս չափումը թույլ է տալիս որոշել թե ինչ տարածության վրա է էլեկտրոնային ամպը գտնվում միջուկից:Այնուամենայնիվ ,սրանից կարելի է ենթադրել, որ ատոմը դուրս է գնդաձև վիճակից, որ հատուկ է միայն ատոմին անօդ /վակուում/ կամազատ տարածության մեջ:Ատոմի շառավիղը կարող է տատանվել տարածությունների առումով երկու միջուկի միջև, երբ երկու ատոմները կապվում են քիմիական կապով:Շառավիղը կարող է փոփոխվել կախված ատոմի տեղից, տրամագծից, քիմիական կապի տեսակից , ինչպես նաև հարևան ատոմների քանակից /համակարգող թիվ (coordination number, և քվանտային մեխանիկական հատկությունից:Էլեմենտների պարբերական աղյուսակում,ատոմի չափերը աճում են սյունակով դեպի վար, նվազում են ձախից աջ :Հետևաբար ամենափոքր ատոմը հելիումն է 32 pm շառավղով, մինչդեռ ամենամեծը ցելիումն է /caesium / 225 pm շառավղով:Երբ խոսքը վերաբերվում է արտաքին դաշտերին, ինչպիսին է էլեկտրական դաշտը ատոմի չափը կարող է շեղվել տրամագծային սիմետրիայից:Ձևափոխությունը կախված է մագնիտուտային դաշտից արտաքին էլեկտրոնների ուղեծրային տեսակից, ինչպես ցույց է տրված խմբային տեսական նկատառումներում:Տրամագծային փոփոխություններ կարող են արտահայտվել, օրինակ բյուրեղի մոտ, երբ բյուրեղյա էլեկտրական դաշտերը հանդիպում են ցածր սիմետրիկ կապերի վանդակում:Նշանակալի էլիպսոդիալ ձևափոխությունները վերջերս ապացուցեցին , հանդիպում են սուլֆատի իոնների համար պիրիտ տեսակի միացություններում: Ատոմի չափերը հազարավոր անգամներ փոքր են լույսի ալիքի երկարությունից , հետևաբար նրանք չեն կարող երևալ սովորական մանրադիտակի օգնությամբ, կարող են դիտարկվել միայն հատուկ սկանային խողովակակաձև մանրադիտակի օգնությամբ:Պատկերացնելու համար ատոմի չափը, այն համեմատվում է մարդու մազի լայնության հետ,որը հավասար է 1 մլն ածխածնի ատոմի:Ջրի մեկ կաթիլը պարունակում է 2 սիքստիլիոն (2×1021) ածխածնի ատոմ և կրկնակի քանակով ջրածնի ատոմ: 2×10−4 կգ զանգվածով ադամանդի մեկ կարատ պարունակում է 10 սիքստիլիոն(1022) ածխի ատոմ:Երբ խնձորը լիներ Երկիր մոլորակի չափ, ապա խնձորի յուրաքանչյուր ատոմ կլիներ մեկ խնձորի չափ:
Ռադիոակտիվ քայքայում[խմբագրել | խմբագրել կոդը]

Յուրաքանչյուր էլեմենտ ունի մեկ կամ ավելի իզոտոպներ , որոնք ունեն անկայուն միջուկ, որի հետևանքով տեղի է ունենում ռադիոակտիվ քայքայում, որի հետևանքով միջուկը արձակում է տարրեր կամ էլեկտրոմագնիսական ռադիացիա:Ռադիոակտիվությունը տեղի է ունենում այն ժամանակ միջուկի շառավիղը լայնանում է շառավղի հզոր ուժի համեմատ , որը գործում է միայն 1 fm հեռավորությամբ: Ամենատարածված ռադիոակտիվ քայքայումներ են. Ալֆայի քայքայումը տեղի է ունենում այն ժամանակ, երբ միջուկը արձակում է ալֆա մասնիկ, որի հելիումի միջուկը բաղկացած է երկու պրոտոններից և նեյտրոններից:Արդյունքում ստացվում է նոր էլեմենտ ցածր ատոմային թվով: Բետայի քայքայումը կարգավորվում է թույլ ուժի միջոցով, որի արդյունքում նեյտրոնը փոխակերպվում է պրոտոնի կամ էլ հակառակը:Վերջիններիս արտանետումները կոչվում են բետա մասնիկներ:Ճառագայթման այս տեսակում էլեկտրոնը ներծծվում է ավելի շուտ միջուկի կողմից, քան թե միջուկը կարտահանի պոզիտրոն:Նետրինը դեռ արտանետման ընթացքի մեջ է և պրոտոնը փոխվում է նեյտրոնի: Գամմա քաքայումը. Այս գործողությանը հետևում է միջուկի էներգիայի մակարդակի փոխվելը ավելի ցածր մակարդակի պատճառ դառնալով էլեկտրոմագնիսական ռադիացիայի արտանետման:Միջուկի գրգռված վիճակը, որի արդյունքում արտանետվում է գամմա ճառագայթը , սովորաբար հետևում է ալֆայի կամ բետտայի տարրեր:Այսպիսով գամմայի քաքայմանը հետևում է ալֆա կամ բետա ճառագայթները:Գամմայի արտանետման անալոգը թույլ է տալիս գրգռված միջուկին կորցնել էներգիա տարբեր ճանապարհով , կոչվում է ներքին փոխակերպում- այս գործողությունը, որի ժամանակ արտադրվում է բարձր արագությամբ էլեկտրոններ բետա ճառագայթները չեն, բարձր էներգիայի հետևանքով արտադրված ֆոտոնները գամմա ճառագայթներ չեն: Յուրաքանչյուր ռադիոակտիվ իզոտոպ ունի իր բնորոշ քայքայման շրջանը, կես-կյանք,որն իր անվանումը ստացել է ժամանակի այն քանակի համար, որի ընթացքում տեղի է ունենում քայքայումը:Սա քայքայման պրոցես է, որ համառորեն նվազեցնում է իզոտոպի մնացորդը՝ կես-կյանքը 50% -ով:Այստեղից էլ երկու կես –կյանք անցնելուց հետո ,մնում է միայն իզոտոպի 25%-ը և այսպես շարունակ:
Մագնիսական պահ[խմբագրել | խմբագրել կոդը]
Տարրական մասնիկներն ունեն ներքին քվանտային մեխանիկական հատկություն, որն անվանում են պտույտ:Այն նման է առարկայի անկյան շարժիչ ուժին, որը պտտվում է իր զանգվածի կենտրոնի շուրջ, սակայն եթե անկեղծ լինենք այս տարրերը նման են կետերի և չի կարելի ասել,որ նրանք պտտվում են:Պտույտը չափվում է պլանկի հաստատունի միավորներով, էլեկտրոններով, պրոտոններով և նեյտրոններով, որոնք բոլորն էլ ունեն ½ ħ, կամ "spin-½":Ատոմում միջուկի շուրջ պտտվող էլեկտրոնները ունեն ուղեծրի անկյան շարժիչ ուժ, որը գումարվում է իրենց պտույտին, մինչդեռ միջուկն էլ ինքնին ունի անկյան շարժիչ ուժ միջուկի պտույտի շնորհիվ:Մագնիսական դաշտն առաջանում է ատոմից, նրա մագնիսական պահը սահմանվում է անկյան շարժիչ ուժի տարբեր ձևերով , այնպես ինչպես պտուտակաձև լիցքավորված առարկան ստեղծում է մագնիսական դաշտ:Այնուամենայնիվ , առավել խոշոր ներուժ գալիս է պտույտից:Շնորհիվ իրենց բնույթի ,էլեկտրոնները ենթարկվում են Պաուլի բացառման սկզբունքին, որի համաձայն երկու էլեմենտներ չեն կարող գտնվել նույն քվանտային վիճակում, կապվել զույգերով միմյանց հետ , զույգի մի անդամը պտույտի դեպի վեր վիճակում , իսկ մյուսը հակառակ ուղղությամբ `դեպի վար:Այս երկու սպիրալները մեկը մյուսին դուրս են մղում կրճատելով մագնիսական երկբևեռ պահը այն հասցնելով 0-ի որոշ զույգ էլեկտրոնների ատոմներում: Ֆերոմագնիսական էլեմենտները այնպիսին ինչպիսին են երկաթը,կենտ թվով էլեկտրոնները տանում են դեպի չզույգավորված էլեկտրոն մագնիսական պահի ցանցը:Հարևան ատոմների ուղեծրերը մասամբ իրար ծածկում են և հասնում են ավելի ցածր էներգետիկ վիճակի , որը կոչվում է փոխազդեցության փոխանակում:Երբ ֆերոմագնիսական ատոմների մագնիսական պահերը երկարությամբ ձգված են, նյութը կարող է արտադրել չափելի դիտարկելի դաշտ:Պարամագնիսական նյութերը ունեն երկարությամբ ձգված մագնիսական պահերով ատոմներ պատահական ուղղություններով ,երբ չկա ոչ մի մագնիսական դաշտ , բայց անհատական ատոմների մագնիսական պահերը ներկա են դաշտում:Ատոմի միջուկը նույնպես կարող է ունենալ զուտ պտույտ:Սովորաբար այս միջուկները շարված են պատահական ուղղություններով ջերմային հավասարակշռության պատճառով:Այնուամենայնիվ որոշ էլեմենտներ ինչպիսին է xenon-129) , հնարավոր է բևեռացնել միջուկի պտույտի նշանակելի մասը ,այնպես որ նրանք շարված լինեն մի շարքով , իսկ այդ պայմանը կոչվում է հիպերբևեռացում :Սա ունի կարևոր կիրառություններ մագնիսական ռեզոնանսի պատկերման մեջ:
Էներգիայի մակարդակներ[խմբագրել | խմբագրել կոդը]


Ատոմում էլեկտրոնի պոտենցիալ էներգիան բացասական է, այն կախված է իր դիրքից երբ այն հասնում է նվազագույնի /բացարձակ արժեք/ միջուկում և անհետանում է, երբ տարածությունը միջուկից գնում է դեպի անվերջություն, կտրուկ ձևով հակառակ մասից դեպի տարածություն:Քվանտային մեխանիկայի մոդելում կապված էլեկտրոնը կարող է զբաղեցնել միայն վիճակներ կենտրոնացված դեպի միջուկը և յուրաքանչյուր վիճակ համապատասխանում է որոշակի էներգետիկ մակարդակի ./ նայել ժամանակակից անկախ Շրոդինգերի հավասարումը տեսական բացատրության համար/:Էներգիայի մակարդակը կարելի է չափել էլեկտրոնը ատոմից անջատելու անհրաժեշտ էներգիայի քանակով, և այն սովորաբար արտահայտվում է էլեկտրոն- վոլտ միավորի օգնությամբ (eV):Կապված էլեկտրոնի ամենացածր վիճակը կոչվում է հիմնական վիճակ, օրինակի համար ստացիոնար վիճակ ,երբ էլեկտրոնի անցումը ավելի բարձր մակարդակ արտահայտվում է գրգռված վիճակում:Էլեկտրոնների էներգիան աճում է ,երբ աճում է է n-ը ,որովհետև միջուկից ունեցած միջին տարածությունը մեծանում է:Էներգիայի կախվածությունը ℓ-ից միջուկների էլեկտրոստատիկ ներուժի արդյունք չէ, այլ էլեկտրոնների միջև եղած փոխազդեցության: Էլեկտրոնի անցումը երկու տարբեր վիճակների, օրինակ` հիմնական վիճակից դեպի գրգռված վիճակ /իոնիզացում/, կարող է արտանետել ֆոտոն էներգիան համապատասխանեցնելով այն մակարդաների պոտենցիալ էներգիայի տարբերությանը համաձայն Նիելս Բօհերի մոդելի, որը կարող է հաշվարկվել Շրոդինգեռի հավասարումով:Էլեկտրոնները կարող են ուղեծրերի միջև փոքրիկ մասնիկների նման:Օրինակ եթե միակ ֆոտոնը հարվածում է էլեկտրոններին միայն մեկ էլեկտրոն կարող է փոխել իր վիճակները ի պատասխան ֆոտոնի:/ նայել Էլեկտրոնի հատկությունները/: Արտանետված ֆոտոնի էներգիան համամասնական է իր հաճախականությանը , այսպիսով այս հատուկ էներգետիկ մակարդակները հայտնվում են որպես տարբեր կապեր էլեկտրոմագնիսական սպեկտրում:Յուրաքանչյուր էլեմենտ ունի բնորոշ իր սպեկտրը, որը կարող է կախված լինել միջուկի փոփոխությունից, էլեկտրոններով լիքը ենթաթաղանթներից, էլեկտրոնների միջև տեղ ունեցող փոխազդեցություններից և այլ գործոններից:Երբ շարունակական էներգիայի լուսարձակումը անցնում է գազի կամ պլազմայի միջով ,որոշ ֆոտոններ անհետանում են ատոմի կողմից, պատճառ հանդիսանալով,որ էլեկտրոնները փոխեն իրենց էներգիայի մակարդակը:Այն գրգռված էլեկտրոնները ,որոնք կապված են մնացել ատոմին տարերայնորեն ֆոտոնի նման էներգիան են արձակում ,շարժվելով պատահական ուղղությամբ և այս ձևով ետ ընկնելով էներգիայի ավելի ցածր մակարդակներ:Այսպիսով ատոմը ֆիլտրի դեր է տանում , էներգիայի արդյունքում ձևավորելով մի շարք վերացած կապեր:. ( նայել արտանետման գծեր ,ֆոտոններ,որոնք առաջանում են ատոմներից: Ատոմային սպեկտրալ գծերի ամրության և լայնության սպեկտրոսկոպիկ չափումները թույլ են տալիս որոշել նյութի ֆիզիկական հատկություներն ու բաղադրությունը: Սպեկտրալ գծերի ուշադիր զննումը ցույց է տալիս տարանջատման նուրբ կառուցվածքը:Այն տեղի է ունենում պտուտակաձև-ուղեծրի զույգավորվելուց, որը պտույտի և արտաքին էլեկտրոնի շարժման միջև եղած փոխազդեցությունն է: Ատոմը գտնվում է արտաքին մագնիսական դաշտում սպեկտրալ գծերը բաժանվում են երկու կամ երեք մասերի ,իսկ այդ երևույթը կոչվում է Զիիմանի արդյունք /Zeeman effect./: Այն տեղի է ունենում ատոմի մագնիսական պահի և մագնիսական դաշտի փոխազդեցության և նրա էլեկտրոնների հետևանքով Որոշ ատոմներ կարող են էլեկտրոնի բազմաթիվ փոխակերպումներ նույն էներգետիկ մակարդակոմ ,որն ի հայտ է գալիս որպես մեկ սպեկտրալ գիծ:Մագնիսական դաշտի փոխազդեցությունը ատոմի տեղափոխությունների հետ տանում է փոքր-ինչ տարբեր էներգետիկ մակարդակներ, արդյունքում ունենալով բազմաթիվ սպեկտրալ գծեր:Արտաքին էլեկտրական դաշտի ներկայությունը պատճառ կարող է հանդիսանալ սպեկտրալ գծերի տեղաշարժերի և բաժանման, փոխելով էլեկտրոնի էներգետիկ մակարդակները :Այս երևույթը կոչվում է Ստարկի արդյունք /Stark effect/: Եթե կապված էլեկտրոնը գտնվում է գրգռված վիճակում մաքուր էներգիայից փոխազդված ֆոտոնը կարող է պատճառ հանդիսանալ ֆոտոնի արտանետումների խթանի համապատասխանելով էներգիայի մակարդակին: Որպեսզի այն տեղի ունենա , էլեկտրոնը պետք է իջնի ավելի ցածր էներգետիկ վիճակի էներգետիկ տարբերությունը համապատասխանեցնելով փոխազդվող ֆոտոնի էներգիայի:Արտանետված ֆոտոնը և փոխազդվող ֆոտոնը շարժվում են զուգահեռաբար և համապատասխանում են փուլերին:Սա ասում է այն մասին,որ երկու ֆոտոնների ալիքաձև նմուշները միաժամանակ են գործում: Այս ֆիզիկակական հատկությունը օգտագործվեց լազերի ստեծման ժամանակ, որը կարող է լույսի էներգիա արձակել նեղ հաճախականույամբ:
Վալենտականություն և քիմիական կապի վարքագիծ[խմբագրել | խմբագրել կոդը]
Ատոմի էլեկտրոնային արտաքին թաղանթը իր առանձնացած վիճակում կոչվում է վալենտականության թաղանթ, իսկ այդ թաղանթի մեջ գտնվող էլեկտրոնները` վալենտականության էլեկտրոններ: Էլեկտրոնների վալենտականությունը սահմանում է քիմիական կապի վարքը մյուս ատոմների հետ:Ատոմները ձգտում են քիմիական ռեակցիայի մեջ մտնել միմյանց հետ նրանց արտաքին վալենտականության թաղանթը լցնելու կամ դատարկելու միջոցով:Օրինակ, միակ էլեկտրոնի անցումը ատոմների միջև կապերի համար օգտակար միացում է, որոնք ձևավորվում են ատոմների միջև ավելի քան մեկ էլեկտրոնով քան լիքը թաղանթով, իսկ մնացածները` մեկ կարճ լիքը թաղանթով էլեկտրոն, այս երևույթը հանդիպում է սոդայի քլորի sodium chloride միացության և այլ քիմիական իոնական աղերի մոտ:հան Այնուամենայնիվ շատ էլեմենտներ դրսևորում են բազմաթիվ վալենտականություններ կամ էլ միտումներ ունեն դրսեվորելու տարբեր վալենտականություն տարբեր միացություներում տարբեր թվերով էլեկտրոնների կիսվելուց: Այսպիսով քիմիական կապը էլեմենտների միջև ստանում է կիսվող էլեկտրոնների տարբեր ձևեր, որոնք ավելին են քան սովորական էլեկտրոնը կփոխանցեր:Դրանց վառ օրինակներն են ածխածինը և օրգանական միացությունները: Քիմիական էլեմենտները հաճախ են ցուցադրվում պարբերականության աղյուսակում ցույց տալով կրկնվող քիմիական հատկությունները և նույն վալենտական թիվ ունեցող էլեկտրոններով էլեմենտներ, որոնք գտնվում են աղյուսակի նույն սյունակում: Հորիզոնական շարքերը համապատասխանում են էլեկտրոնների քվանտային թաղանքի լցմանը:Աղյուսակի աջ կողմի հեռու գտնվողները ունեն իրենց ամբողջապես էլեկտրոններով լցված արտաքին թաղանթ, որոնք քիմիապես չեզոք էլեմենտներ են , դրանցից են ազնիվ գազերը /noble gases/:
Վիճակներ[խմբագրել | խմբագրել կոդը]
Նյութի տարբեր վիճակներում ատոմների քանակը կախված է ֆիզիկական պայմանններից, այնպիսին ինչպիսիք են ջերմությունը և ճնշումը: Պայմանների փոփոխության հետևանքով նյութերը կարող են գտնվել պինդ, հեղուկ և գազային վիճակներում և պլազմաներում: Կախված վիճակից, նյութը կարող է հայտնվել նաև տարբեր ալլոտրոպիկ վիճակներում:Սրա վառ ապացույցն է կարծր ածխածինը, որը կարող է լինել գրաֆիտի կամ ադամանդի տեսքով:Գազային ալլոտրոպներն են նաև մոլեկուլային թթվածինն ու օզոնը: Միանգամայն 0-աստիճանում կարող է ձևավորել Բոս-Էյնշտեյնի հաստատունը, որտեղ քվանտային մեխանիկական արդյունքները, որոնք սովորաբար ուսումնասիրված են միայն ատոմի չափի համար, տեսանելի են դառնում մանրադիտակի օգնությամբ: Այս գերսառը խումբը ատոմների, որոնք այնուհետ հանդես են գալիս որպես մեկ ատոմ , թույլ է տալիս քվանտային մեխանիկական վարքագծի հիմնովին ստուգում:
Ճանաչում[խմբագրել | խմբագրել կոդը]
Խողովակաձև մանրադիտակը թույլ է տալիս դիտարկելու մակերեսը ատոմական մակարդակում: Քվանտային երեևույթը թույլ է տալիս մասնիկներին հաղթահարելու արգելքները, որոնք իրականում անհաղթահերելի են:Էլեկտրոնները անցնում են անօդ տարածության միջով երկու հարթ մետաղական էլեկտրոդների միջև ,որը կլանում ՝է ատոմը , ապահովելով թունել -խողովակի հոսանքի խտությունը ,որոնք չափելի են :Նկարելով մեկ ատոմը ,թե նա ինչպես է /այն ընդունելով որպես ծայր /անցնում մյուսից թույլ տալիս վերջույթի տեղավորմանը հակառակ կայուն հոսանքի հետին մասի տեղադրմամբ:Հաշվարկը ցույց է տալիս, որ առանձին ատոմներ տեսանելի են մանրադիտակի միջոցով: Ատոմը կարելի է իոնացնել իր էլեկտրոններից մեկը հեռացնելով: Էլեկտրոնների լիցքավորումը պատճառ է հանդիսանում ատոմի հետագծի, երբ այն անցնում է մագնիսական դաշտով:Իոնի հետագծի շառավիղը մագնիսական դաշտով անցնելիս որոշվում է ատոմի զանգվածով:Զանգվածի սպեկտրոմետրը այս սկզբունքն օգտագործում է իոնների զանգվածի լիցքավորվածության հարաբերականությունը չափելու համար: Եթե նմուշը պարունակում է բազմաթիվ իզոտոպներ , զանգվածի սպեկտրոմետրը կարող է որոշել յուրաքանչյուր իոնի չափաբաժինը չափելով իոնների արձակած ճառագայթների ինտենսիվությունը: Ավելի տարածված մեթոդը էլեկտրոնի էներգիայի կորստի սպեկտրոսկոպիան է ,որ չափում է էլեկտրոնի ճառագայքի էներգիայի կորուստը էլեկտրոնային մանրադիտակի փոխհաղորդիչով , երբ այն փոխազդեցության մեջ է նմուշի մասնաբաժնի հետ: Ատոմի -փորձնական տոմոգրաֆիան ունի ենթանանոմետրի լուծում 3-D-ում և կարող է քիմիկապես որոշել առանձին ատոմները օգտագործելով ժամանակին թռիչքի սպեցտրոմետրիան: Գրգռված վիճակների սպեկտրը կարող է օգտագործվել վերլուծելու հեռավոր աստղերի ատոմային բաղադրությունը: Հատուկ լուսային ալիքները ,որոնք կան դիտարկված լույսի մեր ձևավորում են աստղեր, որոնք կարող են առանձնացվել և հարեն ազատ գազի ատոմների անցմանը: Այս գույները կարող են վերարտադրվել օգտագործելով գազի լիցքաթափման լամպը,որն ունի նույն էլեմենտը:Հելիումը հայտնաբերվել է նույն ճանապարհով Արևի սպեկտրում Երկրի վրա 105 - 109 ատոմներ/m3 հայտնաբերելուց 23 տարի առաջ:
Ծագում և ներկա վիճակ[խմբագրել | խմբագրել կոդը]
Ատոմները կազմում են ուսումնասիրելի տիեզերքի ընդհանուր էներգիայի խտության մոտավորապես 4% -ը, 0.25 ատոմների/m3 միջւն խտությամբ:Այնպիսին ինչպիսին Ծիր Կաթինն է the/ Milky Way/ , ատոմներն ունեն շատ բարձր կենտրոնացում, նյութի խտության միջաստղային միջավայրում 105 -ից109 ատոմներ/m3 դասավորվածությամբ : Թվում է, թե Արևը գտնվում է այդ տեղայնացված գնդի մեջ, բարձր իոնացված գազի միջավայրում ,այնպես որ արեգակնային միջավայրը միայն համարյա 103 ատոմ/m3 է:Աստղերը ձևավորվում են միջաստղային միջավայրի խիտ ամպերից և նրանց զարգացման պրոցեսները հետևանք են միջաստղային միջավայրի կայուն հարստացմանը ավելի զանգվածային էլեմենտներով քան ջրածինինն ու հելիումն է :Ծիր Կաթինի ատոմների 95% -ից ավել կենտրոնացված են աստղերի մեջ, իսկ ատոմների ընդհանուր զանգվածը կազմում է մոլորակի զանգվածի մոտավորապես 10%-ը:(Զանգվածի մնացած մասը մնում է որպես մութ հարց;
Կազմություն[խմբագրել | խմբագրել կոդը]
Կարծիք կա ,որ տիեզերքի վրա էլեկտրոնները գույություն ունեն դեռ Big Bang/մեծագույն պայթյուն/ հնագույն ժամանակներից:Ատոմի միջուկը կազմվում է նումլեոսինթեզի ռեակցիաների ընթացքում:Նուկլեոսինթեզի երեք րոպեյի ընթացքում արտադրվում է հելիում, լիթիում, և դետերիում տիեզերքում , ի միջիայլոց մի քիչ էլ բերիլիում և բորոն: Ատոմների սովորական և կայուն լինելը կախված է էներգիայից , որն էլ ցույց է տալիս ,որ ատոմը ունի ցածր էներգիա, որը կապված չէ միջուկի ու էլեկտրոնների համակարգից: Երբ ջերմաստիճանը շատ ավելի բարձր է քան իոնացման պոտենցիալինը , նյութը գտնվում է պլազմայի վիճակում – դրական լիցքերի իոնների գազով և էլեկտրոններով::Երբ ջերմաստիճանը իջնում է իոնացման պոտենցիալը , ատոմները դառնում են վիճակագրորեն բարենպաստ:Ատոմները լիցքավորված մասնիկների նկատմամբ դառնում են տիրապետող, 380,000 տարի Big Bang –ից հետո, երբ տիեզերքը բավականի սառեց, էլեկտրոնները կցվեցին միջուկին: Big Bang –ից սկսած, որը չարտադրեց ածխածին և ավելի ծանր էլելմենտներ, ատոմի միջուկը միավորված աստղերի մեջ, միջուկի տրոհման միջոցով արտադրելու համար հելիում և /ալֆա եռակի պրոցեսի միջոցով /, էլեմենտների հաջորդականությամբ ստեղծեց մինչև անգամ երկաթ, /նայել նուկլեոսինթեզը, մանրամասն պատկերացման համար: Իզոտոպները , ինպիսին լիթիում -6 է, ինչպես նաև բերիլիում և բորոնը առաջացել են տարածության մեջ տիեզերական ճառագայթների բաժանման հետևանքով:Այն տեղի է ունենում երբ բարձր էներգիան պրոտոնը հարվածում է ատոմի միջուկին և վանում բազմաթիվ նուկլեոնների:
Երկիր[խմբագրել | խմբագրել կոդը]
Ատոմների մեծ մասը, որ ստեղծել են Երկիրը և նրանց բնակիչներին, ներկա էին իրենց ներկա մշուշի ձևով,որոնք դուրս ժայթքեցին մոլեկուլային ամպի միջից կազմավորելու Արեգակնային համակարգը:Մնացածը արդյունք է ռադիոկտիվ քայքայման և նրան հարաբերող մասին, որը կարող է օգտագործվել որոշելու համար Երկիր մոլորակի տարիքը ռադիոմետրիկ չափման միջոցով:՝Հելիումի մեծ մասը գտնվում է երկրի ընդերքում (մոտավորապես 99% հելիումի գազային հորերը, ինչպես ցույց է տրված հելիում -3 –ի ավելի քիչ քանակը ալֆայի քայքայման արդյունքն է: Ատոմների քիչ հետքեր կան Երկրի վրա,որոնք չեն եղել վաղ ժամանակներում և որ էլ արդյունք են ռադիաոակտիվ քայքայման:Ածխածին -14 շարունակվում է առաջանալ մթնոլորտի տիեզերական ճառագայթումից:Որոշ ատոմներ արհեստականորեն առաջացել են կամայականորեն, միջուկային ռեակտորների արդյունքներ են, կամ էլ պայթյունների:Տրանսուրանիկ էլեմենտներից ատոմական թվերով 92-ից բարձր միայն պլուտոնն ու նեպտունն է, որ պատահում են Երկրի վրա:Տրանսուրանիկ էլեմենտները ունեն ռադիոակտիվ տեսանկյունից ավելի կարճ կյանք քան Երկրի ներկայիս տարիքն է :Պլուտոնի և նեպտունի բնական պահեստները արտադրվում են նեյտրոնի գրավվմամբ ուրանի հանքում: Չնայած գոյություն ունեն ազնիվ գազերի ազատ ատոմներ. թիվը փոքր է,ինչպիսին են արգոնը, նեոնը, հելիումը, մթնոլորտի 99%-ը մոլեկուլների ձևով, ներառյալ ածխածնի երկօքսիդի, երկատոմ թթվածնի և նիտրոգենի :Երկրի մակերեսի վրա ատոմների մի մեծ քանակություն միավորվում են կազմելու տարբեր միացություններ ներառյալ ջուրը, աղը, սիլիկատներ և օքսիդներ:Ատոմների միավորումից առաջանում են այնպիսի նյութեր ,որոնք կազմված չեն առանձին մոլեկուլներից , դրանց մեջ մտնում են բյուրեղները և հեղուկ կամ պինդ մետաղները:
Հազվագյուտ և տեսական ձևեր[խմբագրել | խմբագրել կոդը]
Գերծանր էլեմենտներ[խմբագրել | խմբագրել կոդը]
Մինչ իզոտոպները Կապար (82) ից ավելի բարձր ատոմական թվերով հայտնի են որպես ռադիոակտիվ, ՞՛կայուն կղզի island of stability" անվանումով 103-ի ատոմական թվի տակ գտնվող մի էլեմենտ առաջադրվեց:Այս գերծանր էլեմենտները կարող են ունենալ այնպիսի միջուկ ,որը հարաբերականորեն կայուն է ռադիոակտիվ քայքայման հանդեպ: Կայուն գերծանր ատոմ է համարվում ունբիհեքսիումը, որն ունի 126 պրոտոն և 184 նեյտրոն:
Էկզոտիկ նյութ[խմբագրել | խմբագրել կոդը]
Նյութի յուրաքանչյուր մասնիկ ունի համապատասխան հականյութ իր հակառակ էլեկտրական լիցքով: Այսպիսով պոզիտրոնը դա դրական լիցքավորված հակաէլեկտրոնն է իսկ հակապրոտոնը ՝ բացասական լիցքավորված պրոտոնը: Երբ նյութը հանդիպում է իր հակամարմնին, նրանք միմյանց վանում են:Այս պատճառով մարմնի և հակամարմնի մասնիկների միջև եղած անհավասարակշրությունը հազվադեպ է տիեզերքի վրա:Սկզբում անհավասարակշռությունը հասկանալի չէր, չնայած բարիոգենետիկայի ուսմունքը տալիս է բացատրություն, որի արդյունքում էլ ատոմների հակամարմինը հայտնաբերվեց բնության մեջ: 1996 թվականին ջրածնի հակամարմինը ՝ հակաջրածինը սինթեզվեց Ժնևի CERN-ի լաբորատորիայում: Ստեղծվեցին այլ էկզոտիկ ատոմներ,փոխարինելով պրոտոններից, նեյտրոններից կամ էլեկտրոններից մեկը այլ մասնիկներով ,որոնք ունեն նույն լիցքը:Օրինակ՝ մեկ էլեկտրոնը կարող է փոխարինվել ավելի ծավալուն մուոնով:Այս տեսակի ատոմները կարող են ծառայել հիմնական ֆիզիկայի փորձերի համար:
Նայել մասնիկների ցանկը հետևյալ կատեգորիայի տակ. Էկզոտիկ ատոմներ
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ Leigh, G. J., ed. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic ChemistryRecommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9. "An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements."
- ↑ "Radioactive Decays" https://en.wikipedia.org/wiki/Stanford_Linear_Accelerator_Center Stanford Linear Accelerator Center.15 June 2009. Archived from the original on 7 June 2009. Retrieved 2009-07-04.
- ↑ Liddell, Henry George; Scott, Robert. "A Greek-English Lexicon"Perseus Digital Library.
- ↑ Haubold, Hans; Mathai, A.M. (1998)."Microcosmos: From Leucippus to YukawaStructure of the Universe. Archived from the original on 2009-05-05. Retrieved 2008-01-17.
- ↑ ISBN 0-521-77351-2. OCLC 50441595
- ↑ Leon M. Lederman and Dick Teresi (1993, reprint in 2006).http://books.google.am/books?id=-v84Bp-LNNIC&printsec=frontcover&redir_esc=y#v=onepage&q&f=false The God Particle: If the Universe is the Answer, What is the Question?[]Boston: Houghton Mifflin Company. ISBN 0-618-71168-6. Lederman provides an excellent discussion of this point, and this debate.
- ↑ ^ Jump up to: a b Ponomarev 1993 pp. 14–15.
- ↑ Moran 2005,p. 146.
- ↑ Levere 2001, p. 7
- ↑ Pratt, Vernon (September 28, 2007). http://www.vernonpratt.com/conceptualisations/d06bl2_1mechanical.htmReason, nature and the human being in the West. Retrieved 2009-06-28.
- ↑ Siegfried 2002,pp. 42–55.
- ↑ Kemerling, Garth (August 8, 2002)."Corpuscularianism"Philosophical Dictionary. Retrieved 2009-06-17.
- ↑ "Lavoisier's Elements of Chemistry" https://en.wikipedia.org/wiki/Le_Moyne_College Le Moyne CollegeElements and Atoms.Department of Chemistry. Retrieved 2007-12-18.
- ↑ Wurtz 1881,pp. 1–2.
- ↑ Dalton 1808.
- ↑ ^ Roscoe 1895pp. 129
- ↑ Einstein, Albert (1905)."Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (PDF). https://en.wikipedia.org/wiki/Annalen_der_Physik . Annalen der Physik (in German) 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. Retrieved 2007-02-04
- ↑ Mazo 2002,pp. 1–7
- ↑ Lee, Y.K.; Hoon, K. (1995)."Brownian Motion" https://en.wikipedia.org/wiki/Imperial_College Imperial College. Archivedfrom the original on 18 December 2007. Retrieved 2007-12-18.
- ↑ Patterson, G. (2007). "Jean Perrin and the triumph of the atomic doctrine".Endeavour31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ↑ ^ "J.J. Thomson". https://en.wikipedia.org/wiki/Nobel_Foundation Nobel Foundation.1906. Retrieved 2007-12-20.
- ↑ Rutherford, E. (1911)"The Atomic Nucleus and Bohr's Early Model of the Atom", https://en.wikipedia.org/wiki/NASA https://en.wikipedia.org/wiki/NASA , https://en.wikipedia.org/wiki/Goddard_Space_Flight_Center Goddard Space Flight Center. Retrieved 2007-12-20
- ↑ https://en.wikipedia.org/wiki/Atom#cite_note-npc1921-29 ^ "Frederick Soddy, The Nobel Prize in Chemistry 1921" Retrieved 2008-01-18.
- ↑ Thomson, Joseph John (1913). "Rays of positive electricity" ,https://en.wikipedia.org/wiki/Proceedings_of_the_Royal_Society Proceedings of the Royal Society. A 89 (607): 1–20. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057
- ↑ Stern, David P. (May 16, 2005)."The Atomic Nucleus and Bohr's Early Model of the Atom"Retrieved 2007-12-20.
- ↑ Bohr, Niels (11 December 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture"Retrieved 2008-02-16.
- ↑ Pais 1986,pp. 228–230.
- ↑ Lewis, Gilbert N. (1916). "The Atom and the Molecule"Journal of the American Chemical Society 38 (4): 762–786. doi:10.1021/ja02261a002.
- ↑ ^ Scerri 2007pp. 205–226.
- ↑ Langmuir, Irving (1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society41 (6): 868–934. doi:10.1021/ja02227a002
- ↑ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physicshttp://dx.doi.org/10.1007%2FBF01882788
- ↑ Brown, Kevin (2007). "The Hydrogen Atom"MathPages. Retrieved 2007-12-21.
- ↑ Harrison, David M. (2000)."The Development of Quantum Mechanics" University of Toronto. Archived from the original on 25 December 2007. Retrieved 2007-12-21
- ↑ Aston, Francis W. (1920). "The constitution of atmospheric neon". Philosophical Magazine39 (6): 449–55. doi:10.1080/14786440408636058
- ↑ Chadwick, James (December 12, 1935)."Nobel Lecture: The Neutron and Its Properties". Nobel Foundation.Retrieved 2007-12-21.
- ↑ ^ "Otto Hahn, Lise Meitner and Fritz Strassmann"Chemical Achievers: The Human Face of the Chemical Sciences. Chemical Heritage Foundation. Archived from the original on 24 October 2009. Retrieved 2009-09-15.
- ↑ Meitner, Lise; Frisch, Otto Robert (1939). "Disintegration of uranium by neutrons: a new type of nuclear reaction". [Meitner, Lise; Frisch, Otto Robert (1939). "Disintegration of uranium by neutrons: a new type of nuclear reaction". Nature ]143 (3615): 239. Bibcode:1939Natur.143..239M. doi:10.1038/143239a0.
- ↑ Schroeder, M"Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages"(in German). Retrieved 2009-06-04.
- ↑ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997).Physics Today 50 (9): 26–32. Bibcode:1997PhT....50i..26C. doi:10.1063/1.881933
- ↑ Kullander, Sven (August 28, 2001)."Accelerators and Nobel Laureates" Nobel Foundation. Retrieved 2008-01-31.
- ↑ "The Nobel Prize in Physics 1990" Nobel Foundation. October 17, 1990. Retrieved 2008-01-31.
- ↑ Demtröder 2002 pp. 39–42.
- ↑ Woan 2000, p. 8
- ↑ MacGregor 1992,pp. 33–37.
- ↑ Particle Data Group (2002). "The Particle Adventure"Lawrence Berkeley Laboratory. Archived from the original on 4 January 2007. Retrieved 2007-01-03.
- ↑ Schombert, James (April 18, 2006)."Elementary Particles"University of Oregon. Retrieved 2007-01-03.
- ↑ Particle Data Group (2002). "The Particle Adventure"Lawrence Berkeley Laboratory. Archived from the original on 4 January 2007. Retrieved 2007-01-03.
- ↑ Schombert, James (April 18, 2006)."Elementary Particles"University of Oregon. Retrieved 2007-01-03.
- ↑ "The Particle Adventure"Lawrence Berkeley Laboratory. Archived from the original on 4 January 2007. Retrieved 2007-01-03.
- ↑ Schombert, James (April 18, 2006)."Elementary Particles"University of Oregon. Retrieved 2007-01-03.
- ↑ Pfeffer 2000pp. 330–336.
- ↑ Wenner, Jennifer M. (October 10, 2007)."How Does Radioactive Decay Work?"Carleton College. Retrieved 2008-01-09.
- ↑ Raymond, David (April 7, 2006). "Nuclear Binding Energies"New Mexico Tech. Archived from the original on December 11, 2006. Retrieved 2007-01-03.
- ↑ Raymond, David (April 7, 2006)"Nuclear Binding Energies"New Mexico Tech. Archived from the original on December 11, 2006. Retrieved 2007-01-03.
- ↑ "Overcoming the Coulomb BarrierCase Western Reserve University. Retrieved 2008-02-13.
- ↑ Staff (March 30, 2007).. "ABC's of Nuclear ScienceLawrence Berkeley National Laboratory. Archived from the original on 5
- ↑ Makhijani, Arjun; Saleska, Scott (March 2, 2001). ""Basics of Nuclear Physics and Fission"nstitute for Energy and Environmental Research. Archived from the original on 16 January 2007. Retrieved 2007-01-03.
- ↑ Shultis & Faw 2002pp. 10–17.
- ↑ Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy".American Journal of Physics 63 (7)653–658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828
- ↑ Raymond, David (April 7, 2006). "Nuclear Binding Energies"New Mexico Tech. Archived from the original on December 11, 2006. Retrieved 2007-01-03.
- ↑ Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding".Science 157(3784): 13–24. Bibcode:1967Sci...157...13M. doi:10.1126/science.157.3784.13. PMID 5338306
- ↑ Brucat, Philip J. (2008)."The Quantum Atom"University of Florida. Archived from the original on 7 December 2006. Retrieved 2007-01-04.
- ↑ Manthey, David (2001)"Atomic Orbitals"Orbital Central. Archived from the original on 10 January 2008. Retrieved 2008-01-21.
- ↑ Herter, Terry (2006).. "Lecture 8: The Hydrogen Atom" Cornell University. Retrieved 2008-02-14.
- ↑ Cornell University. Retrieved 2008-02-14.Physical Review 7(2): 282–285. Bibcode:1950PhRv...79..282B. doi:10.1103/PhysRev.79.282
- ↑ ^ Smirnov 2003 pp. 249–272.
Ծանոթագրություններ գրքերից[խմբագրել | խմբագրել կոդը]
- L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. ISBN 0-12-436603-1. OCLC 16212955.
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 0-7503-0481-2. OCLC 47150433.
- Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 0-7506-7463-6. OCLC 162592180.
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer. ISBN 3-540-20631-0. OCLC 181435713.
- Feynman, Richard (1995). Six Easy Pieces. The Penguin Group. ISBN 978-0-14-027666-4. OCLC 40499574.
- Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. ISBN 0-486-65957-7. OCLC 18834711.
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- Goodstein, David L. (2002). States of Matter. Courier Dover Publications. ISBN 0-13-843557-X.
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 0-521-77351-2. OCLC 50441595.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 0-415-17995-5. OCLC 44541769.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. ISBN 0-387-23284-2. OCLC 228384008.
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 0-7486-0954-7.
- Lequeux, James (2005). The Interstellar Medium. Springer. ISBN 3-540-21326-0. OCLC 133157789.
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
- Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G., ed. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF). vol. 2. John Wiley & Sons. pp. 412–26. ISBN 0-471-13946-7. Retrieved 2008-01-09.
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 1-58115-203-5.
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 0-19-521833-7. OCLC 223372888.
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0-306-46562-0. OCLC 228374906.
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 0-19-851567-7. OCLC 48753074.
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505.
- Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0-674-01495-2.
- Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. ISBN 0-313-31664-3. OCLC 50164580.
- Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 0-13-054091-9. OCLC 47925884.
- Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. ISBN 0-19-851971-0.
- Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 0-8014-0333-2. OCLC 17518275.
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 1-86094-250-4. OCLC 45900880.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0-7503-0251-8. OCLC 26853108.
- Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry. Century science series. New York: Macmillan. Retrieved 2011-04-03.
- Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. ISBN 0-19-530573-6.
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 0-8247-0834-2. OCLC 123346507.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0-87169-924-9. OCLC 186607849.
- Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 0-7641-2146-4. OCLC 51543743.
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 0-387-95550-X.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. pp. 213–214. ISBN 0-7432-4379-X.
- Various (2002). Lide, David R., ed. Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 0-8493-0486-5. OCLC 179976746. Archived from the original on 23 May 2008. Retrieved 2008-05-23.
- Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 0-521-57507-9. OCLC 224032426.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X.
- Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 0-306-46403-9. OCLC 44110319.
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th ed.). Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. Archived from the original on 4 March 2008. Retrieved 2008-02-05.
Արտաքին հղումներ[խմբագրել | խմբագրել կոդը]
Ատոմը (հին հունարեն ἄτομος — անտրոհելի) էլեկտրականապես չեզոք նյութի մասնիկ է, որը կազմված է դրական լիցք ունեցուղ միջուկից և բացասական էլեկտրոնային ամպից։ Քիմիական տարրի նվազագույն մասնիկն է՝ հանդիսանում է նրա քիմիական հատկությունների կրողը։[1] Էլեկտրոնային ամպը միջուկի շուրջ պահվում է էլեկտրամագնիսական ուժերի հաշվին։ Տարբեր տեսակի և թվով ատոմները կապվելով միջատոմային կապերով, կազմում են մոլեկուլ։
Ատոմի միջուկը կազմված է դրական լիցքով պրոտոններից և չեզոք նեյտրոններից (միակ բացառությունն է, ջրածնի ատոմը, որը նեյտրոններ չպարունակող միակ կայուն միջուկն է)։ Եթե պրոտոնների քանակը միջուկում, համապատասխանում է էլեկտրոնների քանակին, ապա ատոմը էլեկտրականապես չեզոք է։ Հակառակ դեպքում, ատոմը ունի որոշակի դրական կամ բացասական լիցք և կոչվում է իոն։ Ատոմները դասակարգվում են, ըստ միջուկում պրոտոնների և նեյտրոնների թվի։ Պրոտոնների թվով որոշվում է ատոմի պատկանելիությունը քիմիական տարրին, իսկ նեյտրոնների թվով, քիմիական տարրի իզոտոպին։[2]
Ժամանակակից ատոմի մոդելը նկարագրել է Էռնեստ Ռեզերֆորդը։
Հասկացության ձևավորում[խմբագրել | խմբագրել կոդը]
Ատոմի մասին հասկացությունները՝ որպես մատերիայի անբաժանելի և ամենափոքր մասնիկ, առաջին անգամ սահմանվել է հին հնդիկ և հույն փիլիսոփաների կողմից (ատոմիզմ)։ 17-րդ և 18-րդ դարերում քիմիկոսներին հաջողվեց փորձով ապացուցել այդ վարկածը՝ ցույց տալով, որ որոշ նյութեր չեն կարող ենթարկվել հետագա քայքայումների ավելի փոքր բաղկացուցիչ տարրերի քիմիական մեթոդների միջոցով։ Սակայն 19-րդ դարի վերջին և 20-րդ դարի սկզբին ֆիզիկոսները հայտնաբերեցին սուբատոմական մասնիկներ և առաջարկեցին ատոմի կառուցվածքը։ Դրանից հետո պարզ դարձավ, որ ատոմն ինքնին անբաժանելի չէ։
Քիմիկոսների միջազգային կոնֆերանսին, որը տեղի է ունեցել 1860 թվականին Գերմանիայի Կարլսրուե քաղաքում, ընդունվեցին մոլեկուլի և ատոմի կառուցվածքի մասին հասկացությունների սահմանումներ։ Ատոմը քիմիական տարրի այն փոքրագույն մասնիկն է, որը մտնում է պարզ և բարդ նյութերի բաղադրության մեջ։
Նիլս Կոկը (ծնվել է 1924 թվականի հունվարի 29-ին , մահացել ՝ 2011 թվականի , օգոստոսի 14-ին) Վիրաբուժության պրոֆեսոր, դասավանդել և գործել է Շվեդիայի Կոպենհագենի համալսարանում: Նա նշանավոր է իր հետազոտությունների, փորձարկումների և կոլորեկտալ վիրաբուժական տեխնիկաների համար: Նրա հետազոտությունների բեկումնային արդյունքը եղավ այն, որ նա զարգացրեց մի պարկ, /որը կոչվում է Կոկի պարկ/ որն օգտագործվում է այն մարդկանց համար, որոնք պահանջում էին սովորական ստօմա:
Անձնական կյանք և կրթություն[խմբագրել | խմբագրել կոդը]
Կոկը ծնվել է Յակոբստադում, Ֆինլանդիայում 1924 թվականին: Զինվորական ծառայության անցնելով Ֆիննական բանակում II Համաշխարհային պատերազմի ժամանակ, նա հաճախում է Հելսինկիի համալսարանի բժշկական ֆակուլտետը և այն ավարտում է 1951 թվականին:[3] Նա այստեղ անմիջապես սկսում է իր վիրաբուժական գործունեությունը: Հետագայում նա հինգտարի իր վիրաբուժական դասընթացներն են անցկացնում Շվեդիայի Գոթենբուրգի համալսարանում, իսկ 1959 թվականին նա ստանում է պրոֆեսորի կոչում և հետևաբար զբաղեցնում վիրաբուժության պրոֆեսորի օգնականի պաշտոնը:[4] He later became chairman of the medical department of Sahlgren Hospital.[3] In 1974, Kock became a full professor at Gothenburg.[5]
Գործունեություն[խմբագրել | խմբագրել կոդը]
Նա իր աշխատանքային գործունեության ընթացքում հրատարակում է մոտավորապես 300 աշխատություն:[3]
1960-ական թվականներին փորձարկումներ է կատարում կատուների և շների վրա, այն նպատակով, որ զարգացնի միզապարկի պարունակությունը, որը օգտագործվում էր իլեոստոմիայի վիրաբուժական գործողությունից ստացված բարակ աղիներից ստեղծված պահեստային մասը/ ռեզեռվուար/: 1969 թվականին, նա հրատարակում է իր աշխատությունը, որտեղ նա մանրամասն գրում է այն տեխնիկայի մասին, որի միջոցով նա ստեղծել է ներ-որովայնային ռեզերվուար, առաջարկելով այլընտրանք պայմանական իլեոստօմի համար ,որը պահանջում էր օգտագործել արտաքինից կախված պարկանման սարքավորումներ ավելցուկ հավաքելու համար:իլեոստոմիան դա գործընթաց է, որի ժամանակ մարդիկ տառապում են որվայնի ոչ նորմալ գործունեությունից, ինչպիսին են կոլիտները, պոլիպները, և վերջին փուլում Կրոհնի հիվանդությունը, խմբված են ստոմայում արտաթորանքի պատճառներով:[6] Նա իր աշխատությունը եզրափակում է իլեոստոմայի պարունակության գործընթացի ներքին զարգացմամբ, որը հայտնի է դառնում Կոկի պարկ անունով, որն առաջին անգամ գործարկվել է 1969 թվականին:[7][8] Առաջին անգամ էր, որ հիվանդը, որը տառապելով այս հիվանդությամբ, կարող էր ամբողջությամբ վերահսկել որովայնային թափոնների քանակը:[9][10]
Կոկի պարկի գործընթաց[խմբագրել | խմբագրել կոդը]
Կոկի պարկի գործընթացը բարելավում է հիվանդի կյանքը, հատկապես վիրաբուժության արդյունքը լինում է լավ գործող պարկ: Առաջին կոկի պարկերը չստեղծվեցին որևէ փականային մեխանիզմով:Գործընթացը պահանջում էր հետագա զարգացում, որը Կոկն իրագործեց իր հետագա փործարկումների ժամանակ 1970-ական և 1980-ական թվականներին: Վաղ փորձերը ցույց են տվել, որ այդ պրոցեդուրան ընդունած հիվանդներից 50%-ը չեն կարողանում զսպել կեղտի արտադրությունը: 1972 թվականին նա զարգացրեց ծծող փականի գաղափարը այս խնդիրների մի մասը վերացնելու համար:Ծծող փականն առաջանում էր հենց իսկ աղիքային հյուսվածքից:[11]
Կոկի պրոցեդուրան անընդունակ էր պահելու դադարկող փականը սովորական դիրքում, նույնիսկ ծծող փականի ներառման դեպքում: Կորուստը 25-40% էր: 1970-ական թվականներին Կոկի կատարած աշխատանքները մեծամասամբ կենտրոնացած էին փականի աշխատանքը կայունացնելու վրա: Խնդիրը այնուամենայնիվ լուծում ստացավ դոկտոր Վիլիամ Բարնետտի կողմից:
Հետագա գործունեություն և մահ[խմբագրել | խմբագրել կոդը]
1985 թվականից հետոԿոկի հիմնական աշխատանքը եղավ զարգացնել միզապարկի պարունակությունը, որը խթան հանդիսացավ Կոկի պարկի աշխատանքի տեխնիկայի զարգացմանը:[12]
շկական հՀետագայում Նա սկսեց դասախոսել աշխարհի բոլոր անկյուններում, որպեսզի սովորեցնի և զարգացնի իր ուրոստօմը վիրաբուժության տեխնիկան, հատկապես այն երկրներում, որտեղ հատկապես տարածված է շիստոսոմոզ երիկամային հիվանդությունը:Նա երկար տարիներ համագործակցում է եգիպտացի պրոֆեսոր Մոհամեդ գհոնեիմի հետ:[13] from the medical department of the University of Mansoura (which at the time was a branch of Cairo University). He focused on perfecting his procedure and educating others in the use of his life-improving surgical techniques.[4]
Նա թոշակի է անցնում Համալսարանակն հիվանդանոցում աշխատելուց 1990 թվականին:
Կոկը մահանում է 2011 թվականի օգոստոսի 24-ին, Շվեդիասյի իր Գոտենբուրգի տանըat his residence in Gothenburg, Sweden.[4]
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
- ↑ Սովետական մեծ հանրագիտարան
- ↑ Leigh, G. J., ed. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry - Recommendations 1990. Oxford: Blackwell Scientific Publications. էջ 35. ISBN 0-08-022369-9. «An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.»
- ↑ 3,0 3,1 3,2 Nils G. Kock; Classic Article; forward by Corman, Marvin L., M.D.; March 1994; Springer (web); Volume 37, Issue 3; excerpt from "Diseases of the Colon & Rectum"; Chapter: Intra-abdominal 'Reservoir' in Patients With Permanent Ileostomy; Pp. 278–279.
- ↑ 4,0 4,1 4,2 A Tribute to Nils G. Kock, 1924–2011; Canadien Journal of Surgery; June 2012; doi: 10.1503/cjs.001212PMC; [reprint from US National Library of Medicine; National Institutes of Health]; 55(3); pp. 153–154; retrieved March 2014.
- ↑ Annals of the Royal College of Surgeons of England; PDF format; Harding Rains, A.J.; 1979; [accessed online]; Dorriston Ltd.; London; accessed March 2014.
- ↑ http://www.cancer.org/treatment/treatmentsandsideeffects/physicalsideeffects/ostomies/ileostomyguide/index Ileostomy: A Guide]; Index and pages; American Cancer Society on line; (PDF available for download); retrieved March 2014.
- ↑ Kock Pouch Procedure Revisited at the Quality of Life Association Symposium; September 23, 2009; PR Web; Los Angeles, CA; Quote: "This year, 2009, is an anniversary celebration – the 40th anniversary of Dr. Nils Kock performing the first Kock pouch continent ileostomy in 1969..."; retrieved March 2014.
- ↑ Fecal & Urinary Diversions: Management Principles; Colwell, Janice; 2004; Elsevier Health Sciences; pp. 9–10.
- ↑ Aging and the Continent Ostamate; Schiller, Don J., MD, FACS; PDF format; accessed online March 7, 2014.
- ↑ Lepisto AH, Jarvinen HJ; "Durability of Kock Continent Ileostomy;" Dis Colon Rectum; 2003; 46(7): 925-928.
- ↑ The Kock Pouch Complication: The Slipped Valve; Kock Pouch website; retrieved March 2014.
- ↑ Ghoneim MA, Adhmallah AK, Awaad HK, et al.; "Cystectomy & Diversion for Carcinoma of the Bilharzial Bladder;" 1988; Progressive Clinic Biological Research; 260:315–9; PMID: 3129731 [PubMed - indexed for MEDLINE].
- ↑ Mohamed Ahmed Ghoneim; Medical Fact page; Mansoura University website; accessed March 2014.
