Արոմատիկություն
Արոմատիկություն տերմինը առաջարկվել է Կեկուլեի կողմից բենզոլի և նրա ածանցյալների դասակարգման համար և պայմանավորված է որոշ ներկայացուցիչների բուրավետությամբ։ Կառուցվածքային տեսության զարգացումը հնարավորություն տվեց բացատրել արոմատիկ միացությունների քիմիական կայունությունը նրանց յուրահատուկ կառուցվածքով։ Քննարկենք բենզոլի կառուցվածքը։ Բենզոլի մոլեկուլում ցիկլ կազմող ածխածնի վեց ատոմները գտնվում են sp2 հիբրիդացման վիճակում և առաջացնում են 12 σ-կապերի (C-C,C-H)։ Բոլոր σ-կապերը գտնվում են նույն հարթության վրա։ Վեց ածխածինների pz-օրբիտալները դասավորվում են σ-կապերի հարթությանը ուղղահայաց և վերածածկվում են միմյանց հետ կողմնային հատվածներում։π-էլեկտրոնային խտությունը սիմետրիկ ձևով տարածվում է σ-կապերի հարթության երկու կողմերում(վերևում և ներքևում),այսինքն ապատեղայնացված է։ Այսպիսի համակարգը փակ զուգորդված համակարգ է և կոչվում է արոմատիկ։


Բենզոլի զուգորդման էներգիան կազմում է 227,8 կՋ/մոլ։ Դրանով է բացատրվում բենզոլի բարձր թերմոդինամիկական կայունությունը։
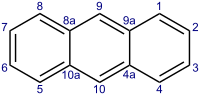
Կոնդեսացված զուգորդված համակարգերի (նավթալին, անտրացեն, ֆենանտրեն) թերմոդինամիկական կայունությունը ավելի ցածր է, քան բենզոլինը, ինչը պայմանավորված է կոնդեսացված արեններում էլեկտրոնային խտության ոչ լրիվ հավասար բաշխումով։
-
Անտրացեն
-
Ֆենանտրեն
Արոմատիկության չափանիշները[խմբագրել | խմբագրել կոդը]
Ըստ Հյուկելի, համակարգը համարվում է արոմատիկ, եթե՝
- 1.մոլեկուլը ունի ցիկլիկ կառուցվածք,
- 2.ցիկլի բոլոր ատոմները գտնվում են sp2 հիբրիդացման վիճակում և բոլոր ցիկլերը հարթ են,
- 3.ապատեղայնացված π-էլեկտրոնային համակարգի առաջացմանը մասնակցում են (4n+2) թվով էլեկտրոններ, որտեղ n=0,1,2,3,...։
Արոմատիկ միացություններ են ցիկլոպրոպենիլ-կատիոնը (2 π-էլեկտրոն,n=0),բենզոլը (6 π էլեկտրոն,n=1),նավթալինը (n=2)`
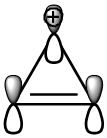
Ցիկլոօկտատետրաենը (π-էլեկտրոնների թիվը-8) արոմատիկ միացություն չէ, քանի որ չի համապատասխանում արոմատիկության չափանիշներին։
Կոնդեսացված բենզոլային համակարգերը համապատասխանում են արոմատիկության չափանիշներին-նավթալին (10 π-էլեկտրոն,n=2),անտացենը և ֆենանտրենը (14 π-էլեկտրոն,n=3)։
Հետերոցիկլիկ արոմատիկ միացություններ[խմբագրել | խմբագրել կոդը]
Այս միացությունները բացի ածխածնի ատոմներից, պարունակում են նաև այլ տարրեր,ազոտ,ծծումբ և թթվածին։ Հինգանդամանի հետերոցիկլիկ միացություններում (պիրոլ, թիոֆեն, ֆուրան) արոմատիկ համակարգը առաջանում է հինգ p-օրբիտալների վրա գտնվող վեց էլեկտրոնների մասնակցությամբ՝ ածխածնի չորս ատոմների մեկական էլեկտրոնների և մեկ հետերոատոմի չբաշխված էլեկտրոնային զույգի՝ էլեկտրոնային սեքստետի առաջացումով։ Այդպիսի համակարգերը կոչվում են էլեկտրոնավելցուկային, քանի որ 6 էլեկտրոնները հավասարաչափ պատկանում են 5 ատոմների, իսկ պիրոլի ազոտը կոչվում է «պիրոլային ազոտ»


Քանի որ ազոտի չբաշխված էլեկտրոնային զույգը մասնակցում է արոմատիկ սեքստետի առաջացմանը և չի կարող միացնել պրոտոն, պիրոլը հիմնային հատկություններ չի ցուցաբերում։ Ընդհակառակը, պիրոլը, ըստ կառուցվածքի լինելով ամին, ցուցաբերում է թույլ թթվային հատկություններ։ Նման միացությունները տալիս են էլեկտրաֆիլ տեղակալման և միացման ռեակցիաներ։ Զուգորդման էներգիան աճում է, իսկ ռեակցիոնունակությունը ընկնում է հետևյալ շարքում՝
Պիրոլ > ֆուրան > թիոֆեն >> բենզոլ
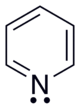
Վեցանդամանի հետերոցիկլերը կարող են պարունակել մեկից ավելի հետերոատոմ։ Մեկ հետերոատոմով ցիկլերից առավել կարևոր նշանակություն ունեն պիրիդինը և կոնդեսացված ցիկլեր խինոլինը և ակրիդինը՝


Պիրիդինի մոլեկուլում ազոտի ատոմը գտնվում է sp2 հիբրիդային վիճակում, արոմատիկ սեքստետի առաջացմանը տրամադրում է մեկ էլեկտրոն։ Հետևաբար պիրիդինի արոմատիկ համակարգը առաջանում է sp2 հիբրիդացման վիճակում գտնվող վեց ատոմների σ-կապերի առաջացմանը չմասնակցող pz-օրբիտալների վրա գտնվող մեկական էլեկտրոններից (բենզոլի նման)։ Ի տարբերություն պիրոլի, պիրիդինի ազոտի չբաշխված էլեկտրոնային զույգը չի մասնակցում զուգորդմանը, և շնորհիվ ազոտի բարձր էլեկտրաբացասականության էլեկտրոնային խտությունը շեղված է դեպի ազոտի ատոմը։ Նման համակարգերը հանդիսանում են էլեկտրոնդեֆիցիտային (էլեկտրոնպակասորդային),իսկ ազոտը կոչվում է «պիրիդինային ազոտ»։ Պիրիդինը ավելի թույլ հիմք է, քան տրիմեթիլամինը, սակայն կարող է փոխազդել հանքային թթուների հետ աղերի առաջացումով[1]։
Տես նաև[խմբագրել | խմբագրել կոդը]
Ծանոթագրություններ[խմբագրել | խմբագրել կոդը]
Գրականություն[խմբագրել | խմբագրել կոդը]
- Vorlesungsskript Արխիվացված 2011-11-29 Wayback Machine (pdf)
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Արոմատիկություն» հոդվածին։ |
| ||||||